水产品种类对过敏原原肌球蛋白胃肠消化性能的影响
李娅茹,栾宏伟,李文娇,卢 瑛,
(1.上海海洋大学食品学院,上海 201306;2.上海海洋大学,上海水产品加工及贮藏工程技术研究中心,上海 201306;3.上海海洋大学,农业农村部水产品贮藏保鲜质量安全风险评估实验室,上海 201306)
甲壳类和贝类产品因其独特的口感和特殊的营养成分,已成为人们餐桌上的常见菜肴。然而,近年来因摄入这类食品而引起过敏的报道频繁出现[1]。大约85%的海鲜过敏反应是由甲壳类或贝类引起的[2]。多达90%的海鲜过敏患者将终生受过敏问题困扰,并可能由于皮肤接触或吸入烹饪或加工过程中产生的气溶蛋白而发生[3]。原肌球蛋白(TM)是一种肌动蛋白相关蛋白,是肌肉和非肌肉细胞的动力学的关键调控因子[4],也是不同的甲壳动物和软体动物的一种常见和主要的过敏原[5]。其分子量在35~38 kDa左右,具有异常稳定的α螺旋结构,即使在长期加热后,它仍能保持免疫球蛋白E(Ig E)的结合能力[6−7]。
日常生活中,水煮是水产品最常见的烹饪手段之一,人们认为该烹饪方法方便简单,在杀灭某些水产品所携带细菌的同时,更好地保持水产品的特有风味。产生食物过敏的先决条件之一是过敏原必须对胃肠道酶的消化具有抵抗力[8]。因此,过敏原被胃肠道(Gastrointestinal,GI)消化后,其在消化过程中的稳定性被认为是决定食物蛋白过敏性的重要因素[9−10]。研究人员发现,蛋白酶处理是减少TM 的Ig E 结合的有效方法[11−13]。胃蛋白酶具有广泛的特异性,可以优先裂解疏水和芳香族氨基酸残基(如苯丙氨酸、酪氨酸和色氨酸)之间的肽键[14]。肠道中的胰蛋白酶可裂解碱性氨基酸(精氨酸和赖氨酸)的羧基侧的肽键[15−16],胰凝乳蛋白酶将氨基酸的羰基裂解成芳香族肽键,如苯丙氨酸、酪氨酸和色氨酸[17]。根据粮农组织/世卫组织的报告,蛋白酶消化产生的片段和不能被酶消化的蛋白质,当其分子量大于 3.5 kDa 时,也可能在人体中引起过敏反应。
尽管已经有很多研究报道了甲壳类动物过敏原的模拟胃消化特性[18−19],并报道其是IgE 介导的过敏反应的最常见原因之一[20],但未见关于甲壳类动物和贝类的水煮肌肉的过敏原特征和不同来源的过敏原的胃肠消化性能的比较研究。因此,本研究选择不同甲壳类(Litopenaeus vannamei、Penaeus monodon、Eriocheir sinensis)和贝类(Ruditapes philippinarum、Sinonovacula constricta)的水煮肌肉作为体外模拟胃肠道消化的对象,通过调查和比较不同种类水产品过敏原TM 在体外模拟消化过程中的免疫学活性变化,探究过敏原TM 的抗消化性能,为今后开发低过敏性水产品提供科学依据。
1 材料与方法
1.1 材料与仪器
甲壳类、贝类水产品:南美白对虾(Litopenaeus vannamei)、斑节对虾(Penaeus monodon)、中华绒螯蟹(Eriocheir sinensis)、花蛤(Ruditapes philippinarum)和缢蛏(Sinonovacula constricta) 购买于浦东新区菜市场,直接用于实验或者置于-20 ℃冰箱冷冻保存;甲壳类和贝类主要过敏原原肌球蛋白的单克隆抗体(MAb)2A7H6、CE7B2 前期研究中制备的单抗;BSA 标准品 购自美国Pierce 公司;HRP-兔抗鼠IgG 抗体 购自美国Invitrogen 公司;DAB 显色液、TEMED(0761)、胰蛋白酶(T1426-50MG)、脂肪酶(L3126-100G)、胃蛋白酶(P7000-100G) 购自Sigma 公司;非预染Marker、预染Marker 购自Fermentas 公司;转膜专用吸水纸 购自Whatman公司;BCA 蛋白定量检测试剂盒、0.22 μm 滤膜 购自生物工程(上海)有限公司;0.22 μm PVDF 膜 购自美国Millipore 公司;其余试剂 均购自国药集团化学试剂有限公司。
Biotek Synergy 2 多功能酶标仪 美国伯腾仪器有限公司;BIO-RAD 蛋白质电泳仪(mini protean 4) 美国Bio-Rad 公司;AE-8135 半干式转膜仪日本ATTO 公司;powerlook 2100XL-USB 凝胶扫描仪 UMAX 公司;X-Cite 荧光显微镜 Excelitas公司;Z36HK 高速冷冻离心机 德国Hermle 公司;Elixtm 纯水系统 美国Millipore 公司。
1.2 实验方法
1.2.1 甲壳类、贝类蛋白抽提液的制备 参考黄天娇等[21]的方法并稍作改进,取5 种水产品,洗净后去壳,各称取5 g 肌肉与25 mL 的20 mmol/L PBST 混合,匀浆,4 ℃、10000 r/min 离心10 min,取上清制备为水产品抽提液,备用;同等条件下浸提匀浆后的肌肉样本沸水煮10 min,离心后取上清制备为水煮抽提液,备用。蛋白含量测定方法参考BCA 蛋白定量试剂盒说明书[22]。
1.2.2 免疫活性分析
1.2.2.1 电泳和免疫印迹 聚丙烯酰胺凝胶电泳(SDS-PAGE)根据Laemmli 等[23]方法稍作修改,即配制分离胶(12%)和浓缩胶(5%),上样量10 μL,电源电压120 V,电泳结束后用考马斯亮蓝染色液染色,然后脱色至蛋白条带清晰。
免疫印记(Western blot)根据Zhang 等[24]方法稍作修改。SDS-PAGE 胶在200 mA 下转膜30 min,然后将PVDF 膜用含0.5%吐温-20 的PBS(PBST)溶液洗涤3 次后加5%脱脂奶粉,37 ℃反应1 h 后,PBST 洗涤3 次后加入2A7H6 单克隆抗体[25],37 ℃、50 r/min 摇床振荡反应1 h 后洗涤。加入HRP-标记的兔抗鼠IgG 二抗(1:2500),37 ℃、50 r/min 摇床反应1 h 后洗涤。用DAB 显色液显色,晾干后拍照保存。
1.2.2.2 间接ELISA 法 采用间接ELISA 法分析样品的免疫活性。首先,将样品用包被液进行稀释后包被于96 孔酶标板,4 ℃静置过夜。PBST 洗涤3 次后加入5% 脱脂奶粉,37 ℃反应1 h。洗涤后加入单克隆抗体CE7B2,37 ℃ 孵育1 h,洗涤。再加入HRP-兔抗鼠IgG(1:2500),37 ℃孵育1 h。洗涤后,加入OPD 显色液,室温避光放置20 min。最后加入终止液。迅速用酶标仪检测酶标板的OD490值[26−27]。
1.2.3 体外模拟胃、肠消化
1.2.3.1 模拟胃液消化 模拟胃液(simulated gastric fluid,SGF)配制主要参考美国药典的配方[28],按照2000 U/mL 的胃蛋白酶活性单位配制(pH 为1.30)。取5 种水产品,洗净后沸水煮 10 min,置于冰上冷却后去壳,取肌肉组织搅拌10 s,备用;取5 支玻璃试管,各加入2 g 水煮肌肉和预热好的10 mL SGF,混匀后50 r/min 振荡消化,分别在反应0、1、2、5、10、30、60、120 min 时取样1 mL,沸水浴10 min 灭活蛋白酶,冷却,4 ℃离心的上清即为水煮肌肉的SGF消化产物[29−32],消化产物作为ELISA 样品进行免疫活性分析。
1.2.3.2 模拟肠液消化 模拟肠液(simulated intestinal fluid,SIF)配制主要参考美国药典的配方[28],按照1685 U/mL 的胰蛋白酶和2200 U/mL 的脂肪酶活性单位配制(pH 为8.1)。取5 种水产品,洗净后沸水煮10 min,置于冰上冷却后去壳,取肌肉组织搅拌10 s,备用;取5 支玻璃试管,各加入2 g 水煮肌肉和预热好的10 mL SIF,混匀后振荡消化,在反应0、1、5、10、30、60、120、240 min 后取样1 mL,沸水浴10 min 灭活蛋白酶,冷却,4 ℃离心后上清即为水煮肌肉的SIF 消化产物[29−32],消化产物作为ELISA样品进行免疫活性分析。
1.2.4 不同水产品水煮肌肉的肌原纤维分析 肌肉样本的提取主要参考周然等[33]的方法,并略有改进。取5 种甲壳类、贝类水产品,称取5 g,加入30 mL制备液,匀浆30 s。1000 r/min,离心15 min,弃去上清,取沉淀。向沉淀中加入30 mL 制备液,用玻璃棒搅拌并振荡均匀。再次离心15 min,弃去上清液,取沉淀。重复离心3 次,收集沉淀;将沉淀用30 mL 制备液溶解,获得样本悬浊液。参照周然等[33]的方法,取所得悬浊液,利用X-Cite 荧光显微镜放大10×10 倍观察,并利用显微镜计算机软件测量肌原纤维长度,计算平均值。每个平行样提取200 根肌肉纤维。随后,对肌肉纤维长度进行统计分析。
1.3 数据处理
每个样品进行3 次平行试验,数据使用SPSS 19.0 进行ANOVA 分析,P<0.05 表示差异显著;由OriginPro 9.1 64Bit 进行图形制作。
2 结果与分析
2.1 煮沸处理对水产品主要过敏原原肌球蛋白的影响
对煮沸前后的肌肉抽提液进行电泳和免疫印迹试验,分析其蛋白组成变化,结果如图1 所示。电泳图中可观察到大量不同分子量的蛋白质条带(图1a);所有样品在40 kDa 附近都有明显的条带,结合免疫印迹结果可知,该条带对TM 的特异性单抗2A7H6有特异性反应,表明该处为TM 条带。甲壳类和贝类的条带有明显差异。而煮沸去除不耐热蛋白后,25~35 kDa、45~116 kDa 分子量区间的蛋白条带大部分消失;35~45 kDa 分子量区间条带明显,说明它们均具有耐热性。两种虾类在14.4~25 kDa 区间明显的条带,其可能为肌球蛋白轻链,具有耐热性。花蛤在40 kDa 附近的条带较浅,表明其含量较低。而中华绒螯蟹在40 kDa 附近的条带高于虾和贝类,这与Liu 等[34−35]的研究一致。
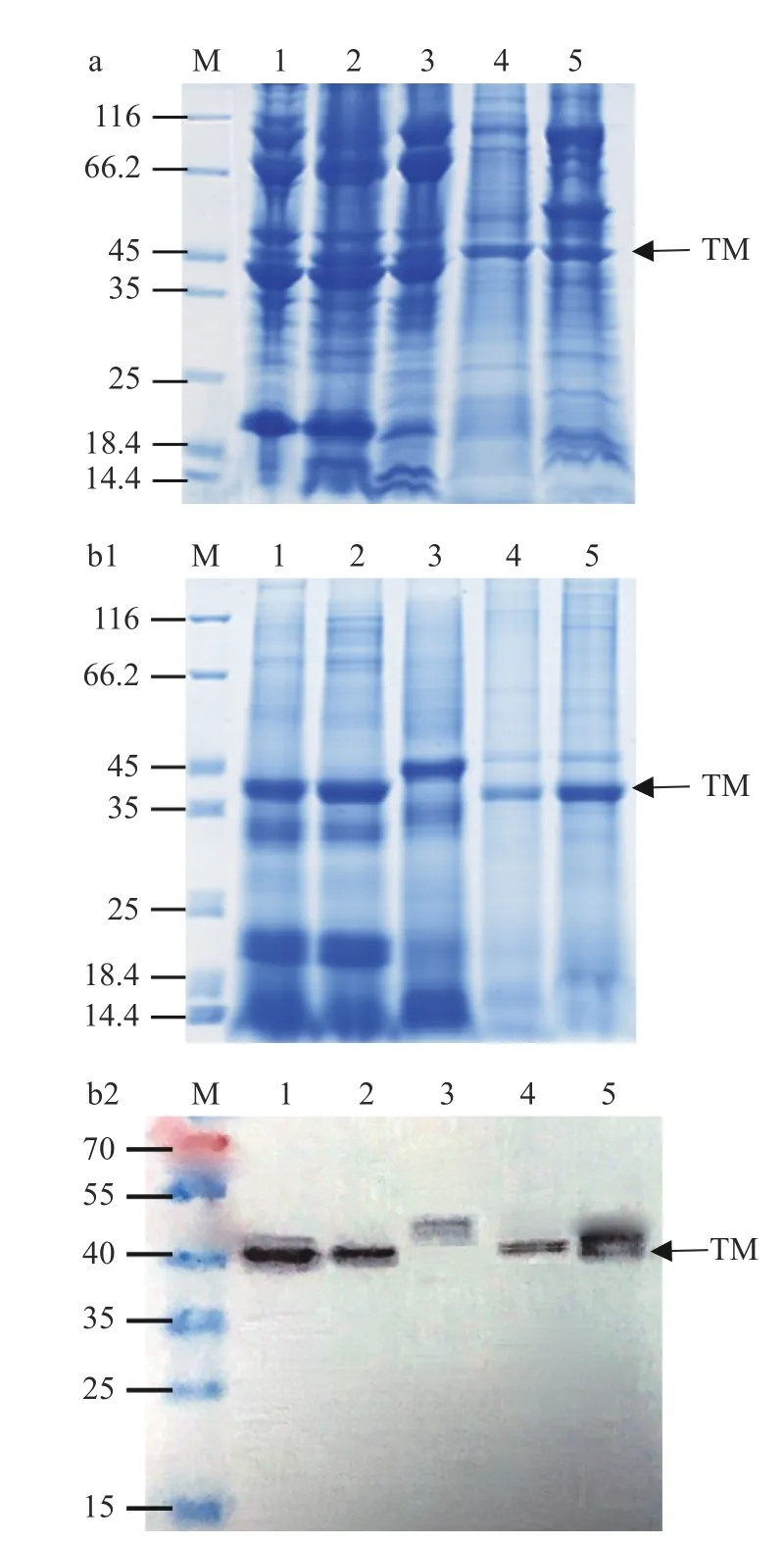
图1 煮沸处理对水产品主要过敏原原肌球蛋白的影响Fig.1 The effect of boiling treatment on the TM of aquatic products
五种水产品抽提液与CE7B2 抗体的ELISA 结果如图2。CE7B2 抗体可与贝类和甲壳类动物过敏原TM 的IgE 位点进行特异性结合[24]。样品经加热后,免疫活性均略有降低。花蛤、缢蛏过敏原TM 过敏原性分别降低6.0%和4.2%,而南美白对虾、斑节对虾、中华绒螯蟹分别为2.9%、2.1%和1.6%,说明贝类经水煮后过敏原性的丢失高于甲壳类水产品。
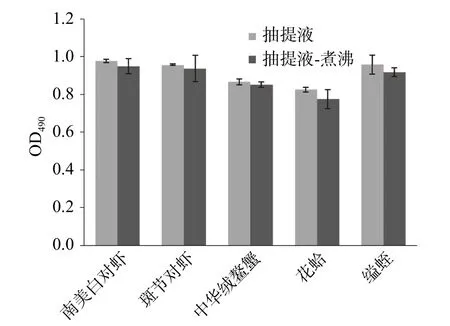
图2 五种水产品抽提液和CE7B2 抗体的ELISA 结果Fig.2 ELISA result for 5 shellfish extract proteins with McAb CE7B2
综上,水煮可以使非耐热蛋白消失;而经ELISA验证发现,水煮对水产品TM 过敏原性的破坏程度不大,损失均低于10%。且煮沸后的抽提液中杂蛋白含量明显减少,更适合选取其作为胃肠消化的对照样本。
2.2 水产品种类对TM 的消化性能影响作用
2.2.1 模拟胃液消化 5 种水产品的SGF 消化情况见图3 和图4。随着消化时间的增加,TM 条带逐渐消失,1 min 内产生了大量的小分子(4.1~14.4 kDa)(图3),表明TM 在胃蛋白酶的作用下,蛋白降解,生成了一些小分子肽等物质。甲壳类样品的TM 条带(~36 kDa)在30 min 后明显变浅,但在 120 min 时仍存在(图3a~3c);其中中华绒螯蟹的TM 条带在30 min 时几乎肉眼不可见,与其他两种虾类相比,其TM 蛋白的降解速度更快(图3c)。花蛤与缢蛏两种贝类肌肉中的TM 条带在1 min 时明显变浅(图3d~3e),并产生了大量0~18.4 kDa 的低分子量条带,这些条带直到消化结束仍然存在,可能为具有免疫活性的肽段。

图3 水煮肌肉的消化产物模拟胃液电泳图Fig.3 SDS-PAGE results for boiled muscle after SGF digestion
利用TM 的特异性单抗2A7H6,通过间接ELISA分析5 种水产品的免疫学活性结果如图4 所示。由图可知,五种水煮样品的免疫活性随着SGF 消化时间的增加均有不同程度的降低。在10 min 时,斑节对虾的免疫活性下降率低于其他4 种水产品;1 h 后五种水产品的免疫活性下降率呈现平衡趋势,但是2 种贝类的免疫活性降低率>80%,明显高于甲壳类。定量结果显示,甲壳类水煮肌肉中TM 的免疫活性下降率为64.7%~67.7%,而贝类TM 的免疫活性降低率高达86.5%~86.8%。这些结果与SDS-PAGE的结果一致,表明水产品的种类对TM 的胃消化率有较大影响。
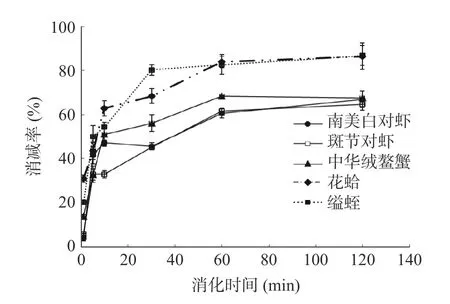
图4 水煮肌肉的模拟胃液消化产物免疫活性Fig.4 ELISA results for boiled muscle after SGF digestion
2.3 水产品水煮肌肉的模拟肠液消化
本研究进一步探讨了不同水产品的模拟肠道消化情况(图5 和图6)。SDS-PAGE 结果发现,甲壳类样品蛋白在不到1 min 的时间内被消化,南美白对虾样品出现许多小分子条带(4.1~14.4 kDa)(图5a),这些条带在120 min 后仍然存在,而斑节对虾和中华绒螯蟹产生的小分子蛋白较少(图5b~5c);两种贝类的水煮肌肉样品消化时间更短,且均产生了一些新的蛋白条带(图5d~5e)。
ELISA 结果(图6)显示,在模拟消化SIF 过程中,五种水产品的TM 免疫活性在1 h 内明显降低(>50%)。SIF 消化4 h 后,甲壳类水煮肌肉TM 的免疫活性损失为89.0%~91.5%,而贝类TM 的活性损失可达90.8%~92.2%,两者相差不大。比较水产品的SGF 和SIF 的消化产物,发现所有样品在SIF中的消化速度都比较快。由此推测,肠道是TM 活性丧失的主要场所。
2.4 不同水产品水煮肌肉的肌原纤维结构分析
为了探究TM 的胃肠道抗消化能力是否与肌纤维结构有关,本研究进一步对五种水产品的肌原纤维进行了对比分析(表1)。由表可知,五种水产品的肌原纤维粗细和长短均不相同,甲壳类的肌原纤维(156.4~185.8 μm)明显长于贝类(125.0~134.6 μm)。肌原纤维长度高于500 μm 的比例均很低(<5%);但是甲壳类的肌纤维在100 μm 以上的比例高于贝类,贝类的肌纤维长度大部分在100 μm 以下。此外,虾、蟹(甲壳类)的肌原纤维较粗,而花蛤、缢蛏(贝类)的肌原纤维较细,甲壳类肌纤维的宽度约为贝类肌纤维的3 倍。
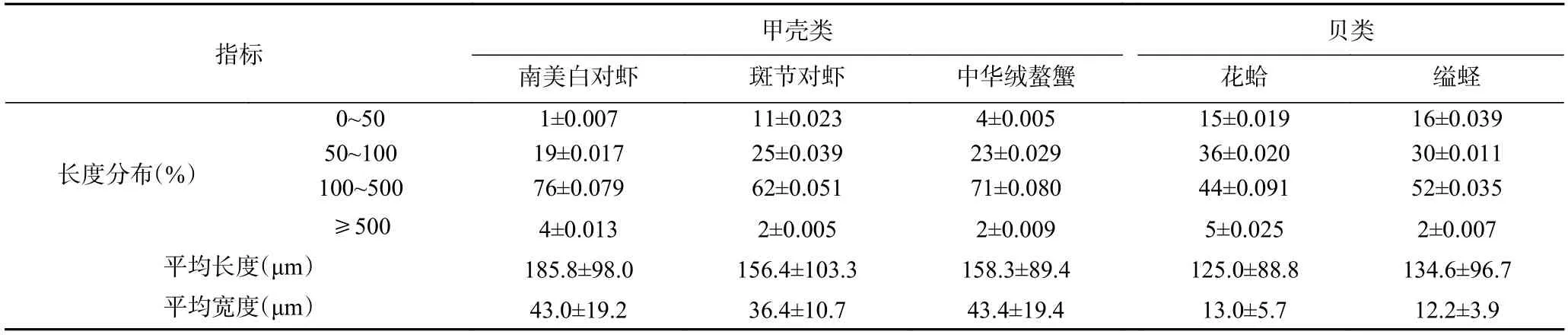
表1 水产品肌原纤维在不同长度的分布情况Table 1 Distribution of myofibrils in different lengths of aquatic products
3 讨论
煮熟的海产品经过人口腔咀嚼和胃和肠的消化后,其营养成分才能被人体吸收。甲壳类和贝类产品的TM 具有热稳定性,它可以在胃肠消化过程中被降解为各种大小的肽。故食物过敏原只有具备足够的胃肠道稳定性,才能到达肠道粘膜,从进而发生吸收和致敏作用[36]。而未完全降解的过敏原表位肽或过敏原进入人体后会与血清中的IgE 结合,使人体产生过敏反应[37]。因此,致敏蛋白在胃肠道中对水解酶消化的抵抗力受到广泛关注。
模拟胃肠消化结果显示,TM 的消化率和免疫活性的变化主要发生在肠消化阶段。在单一的SGF和SIF 消化阶段,SDS-PAGE 中的TM 条带明显减弱并消失(图3 和图5)。SGF 消化中,水煮肌的TM条带逐渐变浅,且TM 略微向低分子量迁移,说明TM 在蛋白酶的作用下开始降解,这一结果同王学丽等[38]的研究结果一致。图4 和图6 说明TM 酶解产物对抗体有特异性反应,特异性反应条带显示降解片段仍有免疫活性,这说明其具有一定的耐消化性。TM 在消化道中的降解模式与Liu 等[35]和Wu[18]等的研究结果相似。然而,Liu 等[34]认为,虾类肌纤维蛋白中的TM 比其他非过敏性蛋白消失得相对更慢。本研究结果可观察到TM 的消化速率与非致敏蛋白相差不大。这可能与被测试样品的性质以及消化条件有关,如酶的比例、食物颗粒大小或食物种类的差异等[39−40]。
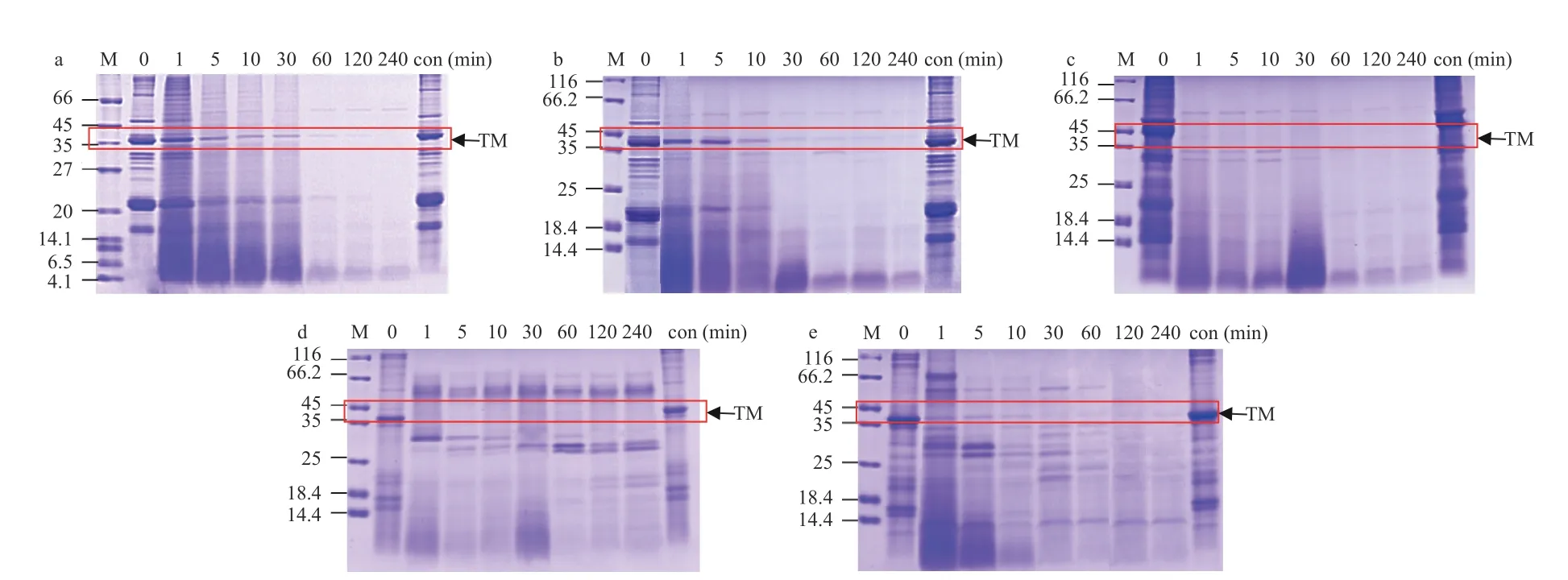
图5 水煮肌肉的消化产物模拟肠液电泳图Fig.5 SDS-PAGE results for boiled muscle after SIF digestion
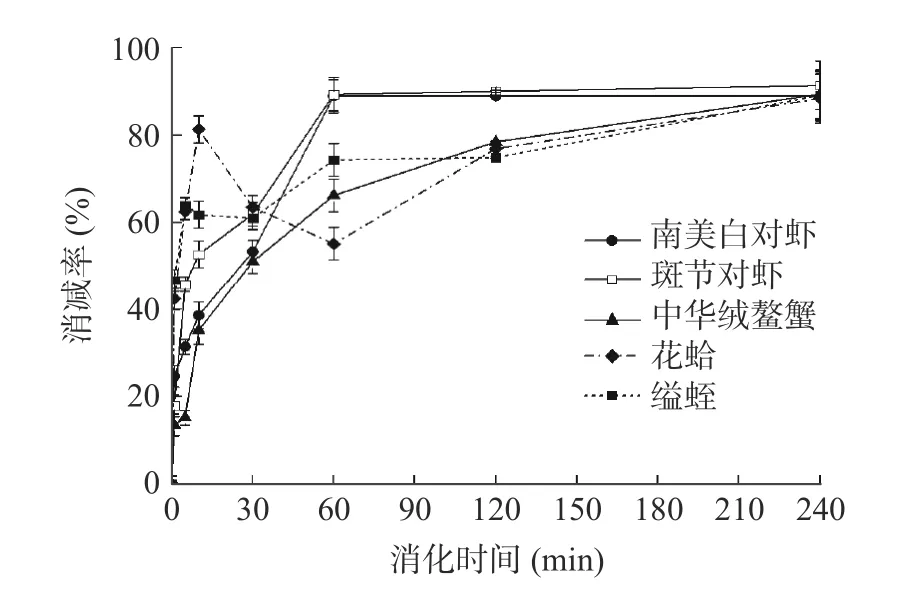
图6 水煮肌肉的模拟肠液消化消化产物免疫活性Fig.6 ELISA results for boiled muscle after SIF digestion
在SGF 和SIF 反应中,样品均在消化1 min 后产生了大量的小分子,这可能是由于完整的蛋白质被消化成不同大小的肽段,空间结构被破坏所致[41]。且贝类的消化速度比甲壳类快,这可能是因为甲壳类肌纤维的宽度明显比贝类宽[42−43]。在SGF 反应中,三个甲壳类样品中,螃蟹的消化效果最明显,其次是南美白对虾;在SIF 反应中,其他四个样品的消化效果均优于南美白对虾。这表明,水产品的种类对免疫活性和过敏性有较为明显的影响。人体摄入的蛋白质通常是经过加工的食物成分之一。加工过程可以使食物基质中的蛋白质变性并改变其空间结构。消化酶的消化作用会进一步影响过敏原的空间结构。本研究发现,即便是经过胃肠消化后,样品仍具有一定的免疫活性。这可能是因为有少数线性表位可以在加工和消化后完全或部分保留致敏性[44]。
食品加工可以通过改变过敏原的结构特性来影响过敏原的稳定性和其他物理化学特性。周然等[33]研究发现,鱼肉的肌纤维在储存过程中变短,这说明肌纤维能在一定程度上反映水产品肌肉组织的内部结构。陈铮等[45]研究了热处理过程中牡蛎闭壳肌肌原纤维蛋白的浊度、溶解度、表面疏水性、α-螺旋含量和总巯基含量的变化,发现随着温度的升高,牡蛎闭壳肌肌原纤维蛋白的浊度整体呈增大趋势,α-螺旋含量、总巯基含量逐渐降低,这表明肌原纤维蛋白的结构变化对理化性质影响显著。综上所述,水产品的肌原纤维蛋白在不同的环境和加工条件下,因其结构变化表现出不同的理化特性和食用品质。本研究中,由于原肌球蛋白是肌原纤维结构中的一部分,其在蛋白酶中的消化性与其暴露程度会受到肌原纤维蛋白的结构变化影响,因此,认为甲壳类和贝类肌肉组织结构的差异可能是造成甲壳类和贝类消化率和免疫活性存在差异的原因之一。
4 结论
本文选取五种水产品作为研究对象,系统性地调查了TM 在体外胃肠消化中免疫活性和过敏原性的变化情况。研究发现,肠道是TM 免疫活性损失的主要场所;在模拟胃肠道消化中,甲壳类TM 的免疫活性消减率均低于贝类,说明水产品的种类会影响TM 的胃肠道消化能力,甲壳类和贝类肌肉组织结构的差异可能是造成甲壳类和贝类消化率和免疫活性差异的原因之一。此外,经过胃肠道模拟消化后,仍然存在一些低分子量的致敏片段,今后有必要深入研究残留片段的抗原表位,以解析过敏原TM的抗消化机制。本研究可对今后过敏原的消减技术和低过敏性食品的开发提供科学依据。

