发酵法制备芸豆渣可溶性膳食纤维及其抗运动性疲劳作用研究
白海军,王 颖
(1.黑龙江八一农垦大学体育教研部,黑龙江大庆 163319;2.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;3.国家杂粮工程技术研究中心,黑龙江大庆 163319;4.粮食副产物加工与利用教育部工程研究中心,黑龙江大庆 163319;5.黑龙江省农产品加工与质量安全重点实验室,黑龙江大庆 163319)
芸豆豆渣属于营养丰富且附加值高的杂豆天然加工副产物,其中,膳食纤维约占总含量的51%~58%,蛋白质约为16.87%~22%,脂肪含量占15%~20%,以及少量的维生素等化合物。其大部分用于饲料、食品及功能性成分前体物[1],如若不被及时开发和利用,便会造成资源浪费和经济损失,因此,近年来逐渐成为学者们研究的热点。芸豆豆渣中富含丰富的膳食纤维,具有一定的抗氧化性[2],在机体内可产生自由基,进而达到预防癌症、抗衰老等功效[3],是一种天然新型保健食品原料来源。通常,豆渣中的膳食纤维可通过物理分离法、化学分离法、酶提取法和复合提取法等获得[4−7]。为获得多量优质的膳食纤维,广大的研究者采用物理方法、化学方法、生物方法和复合手段等改变膳食纤维固有的结构和性能从而获得期望的理化及功能特性[8−10]。其中,发酵法改性的优势在于成本低、安全高效,微生物在发酵过程中产生大量酸性代谢产物,使处于酸性条件下的膳食纤维的糖苷键断裂,产生新的还原性末端[11]。酵母菌和乳酸菌等微生物可通过发酵产生谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)等过氧化酶类物质清除活性氧,同时真菌自身含有的细胞壁多糖能够清除如超氧阴离子自由基等活性氧,使得植物发酵液具有抗氧化性。芸豆食用及药用价值高[12],原料选择芸豆渣膳食纤维发酵液既可最大程度保留植物原料的营养成分,又可通过有益微生物的代谢产生功能性小分子活性物质,赋予其多项生理功能[13]。
运动性疲劳的产生因素是多方面的,其机理缘于自由基和其他氧化物积累量过多[14]。随着运动时间的延长,运动性疲劳感亦会逐渐增加,进而使机体运动能力降低,相关方面的研究一直都是体育科研人员孜孜追求的课题。部分研究证实,提高抗氧化剂的摄入,可清除体内多余的自由基提高体内抗氧化能力,进而缓解运动性疲劳。井宏颖等[15]通过体内抗氧化实验,证实地黄饮子通过增加SOD 活性,提高小鼠抗氧化能力,可在一定程度上缓解运动性疲劳。也有研究表明[16],白藜芦醇是一种天然抗氧化剂,在体内和体外都具有的抗氧化和抗炎特性,能够有效地缓解运动疲劳。
目前,针对芸豆渣膳食纤维的研究多集中于提取工艺优化、部分功能特性等方面,而关于其抗疲劳性的研究颇少。本研究以芸豆渣膳食纤维为原料,经过复合菌种发酵进行改性,建立运动性疲劳大鼠模型,并通过负重力竭游泳实验和测定相关生化指标,研究改性后的芸豆渣膳食纤维对缓解运动性疲劳的影响,旨在为丰富抗疲劳类功能性产品的种类和安全、绿色可持续发展利益最大化提供理论依据,也为制定全面多样化的运动训练饮食计划提供参考。
1 材料与方法
1.1 材料与仪器
4~6 周龄SPF 级雄性Wistar 大鼠50 只,初始体质量(220±20)g 辽宁长生生物技术股份有限公司,清洁级许可证号:SCXK(辽)2015-0001,饲养于SPF 级动物房,12 h/12 h 模拟循环光照,环境温度(23±2)℃,相对湿度50%±10%。大鼠自由饮水及采食。
芸豆渣、奶白花芸豆 国家杂粮工程技术研究中心;碱性蛋白酶(200000 U/g)、耐高温a-淀粉酶(20000 U/mL) 上海源叶生物有限公司;生化指标检测试剂盒 苏州卡尔文生物技术有限公司;其他试剂均为分析纯;植物乳杆菌(Lactobacillus plantarum)、嗜酸链球菌(Streptococcus acidophilus)、双歧杆菌(Bifidobacterium)、鼠李糖乳杆菌(Lactobacillus rhamnosus) 实验组前期筛选。
AR2140 电子天平 常州励岸宝机械设备科技有限公司;DL-360B 型超声波清洗机、FD-1A-50 型冷冻干燥机、LMQ.C-50E 型高压灭菌锅 上海之信仪器有限公司;YC-04B 型多功能粉碎机 广州金本机械设备有限公司;RM2016 轮转式切片机 德国Leica 公司。
1.2 实验方法
1.2.1 发酵改性芸豆豆渣膳食纤维提取 采用超声辅酶法提取,具体工艺流程如下:芸豆豆渣→脱脂→接菌发酵→热水漂洗→烘干→粉碎→超声辅酶脱蛋白、脱淀粉→灭酶→离心→滤液→浓缩→醇沉→发酵改性可溶性芸豆渣膳食纤维→脱水、干燥→超微粉碎→发酵改性可溶性芸豆渣膳食纤维粉。
操作要点:a.预处理:烘干豆渣,粉碎约30 s后过40 目筛备用。b.脱脂:豆渣与石油醚按料液比1:6 g/mL 混匀,搅拌脱脂6 h,共脱脂两次。c.接菌发酵:植物乳杆菌、嗜酸链球菌、双歧杆菌(1:1:1),料液比为1:20 g/mL,接菌量3.5%、发酵温度37.2 ℃、发酵时间24 h、调节pH 至6。d.超声辅酶脱蛋白、脱淀粉:准确称取10 g 豆渣粉,按料液比1:10 g/mL加入蒸馏水,调节pH 至8,加入1%碱性蛋白酶;调节pH 至5.5,加入0.2%的耐高温α-淀粉酶,超声辅助下(超声功率500 W,时间15 min,温度50 ℃)酶解蛋白质和淀粉。e.灭酶:121 ℃,15 min。f.分离芸豆渣可溶性膳食纤维(soluble dietary fiber:SDF):用蒸馏水冲洗滤渣,40 ℃滤液旋蒸浓缩至30 mL,1:5 体积的乙醇醇沉10 h 后抽滤,清洗膳食纤维至中性后,冷冻干燥12 h 获SDF,超微粉碎过80 目筛,备用。
1.2.2 芸豆渣SDF 发酵前后理化性质测定
1.2.2.1 水溶性膳食纤维含量 酶重量法,参照依据GB 5009.88-2014。
1.2.2.2 持水力测定 分别称取0.5 g 发酵前后SDF 样品于离心管中m1,加入定量蒸馏水,匀速搅拌20 min 后静置30 min,4000 r/min,10 min,除去上清液,称残渣质量m2,按照公式(1)计算持水力[4]。
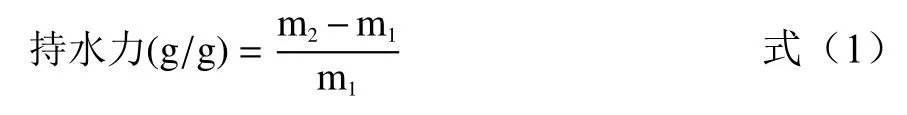
式中:m1为样品的质量(g);m2为残渣质量(g)。
1.2.2.3 膨胀力测定 分别称取1.0 g 发酵前后SDF样品于20 mL 量筒中记录其初始体积,加入蒸馏水,振荡均匀,室温下静置24 h 后观察量筒中物料的自由膨胀体积,按照公式(2)计算膨胀力[17]。
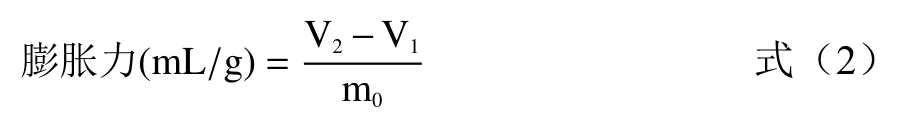
式中:m0为样品的干质量(g),V1为样品初始体积(mL);V2为膨胀后的体积(mL)。
1.2.2.4 持油力测定 分别称取0.5 g 发酵前后SDF样品于50 mL 离心管中m1,加入20 mL 食用油,搅拌30 min 后静置12 h,4000 r/min,10 min,除去上清液,称残渣质量m2,并按照公式(3)计算[5]。
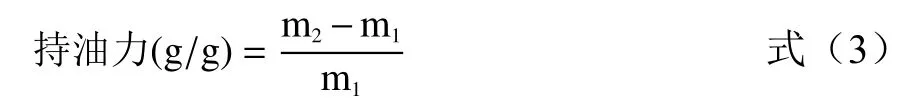
式中:m1为样品的质量(g);m2为残渣质量(g)。
1.2.3 动物实验
1.2.3.1 大鼠模型建立 参照其它研究建模方法[18−19],将健康的50 只大鼠随机分为5 组,分别为空白对照组(EBS)、模型组(MBS)及发酵改性芸豆渣SDF 低、中、高剂量组(KBS-L、KBS-M、KBSH),每组10 只,每天进行灌胃,累计灌胃30 d,具体喂药操作剂量如表1。除空白对照组之外,其余组大鼠进行适应性游泳训练,水温为(25±2)℃,每周训练周期为7 d,游泳6 d,休息1 d,累计4 周。第1 周大鼠无负重游泳训练,时间为每天20 min,待第1 周大鼠熟悉游泳环境,第2 周、3 周无负重游泳训练分别为30、40 min,第4 周开始负重自身体重3%铅块游泳到力竭,训练30 min。大鼠力竭标准的状态是,动作迟缓、大鼠口鼻沉入水中时间大于10 s,然后,迅速捞起。
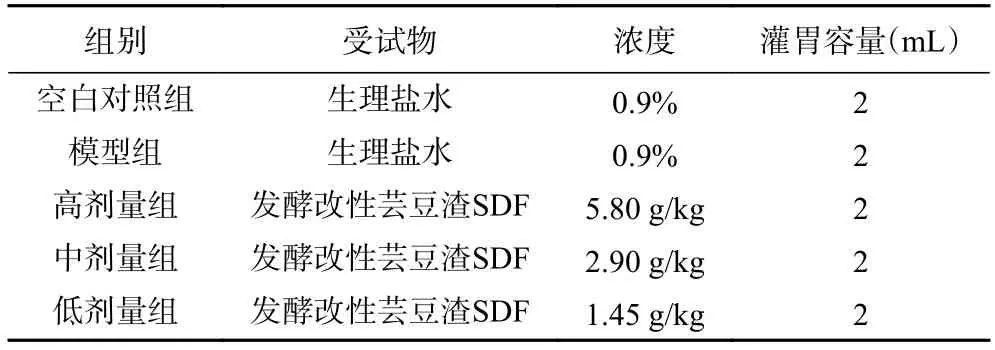
表1 实验动物灌胃药剂分配Table 1 Distribution of drugs by gavage in experimental animals
1.2.3.2 负重力游泳实验 将训练4 周后的大鼠进行实验,空白组大鼠置于相同温度浅水中,不进行游泳;同时,记录并比较实验组大鼠负重力竭的游泳时间,即开始游泳时间至力竭时间。
1.2.3.3 部分生理指标测定 负重力游泳实验结束后立刻将大鼠处死,立即眼眶取血,3000 r/min,离心15 min,将上清血清置于−80 ℃保存备用。利用试剂盒检测大鼠血清超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、乳酸脱氢酶(LDH);使用试剂盒测定大鼠肝脏中的肝糖原和后腿部骨骼肌的肌糖原。
1.3 数据处理
实验数据采用SPSS 20.0 统计学软件分析处理,每组实验指标测定均重复3 次,实验数据以(均值±标准差)表示,组间两两差异比较进行t检验,多组间比较采用单因素方差分析,P<0.05、P<0.01 分别表示结果有显著性差异和极显著性差异。
2 结果与分析
2.1 改性芸豆渣SDF 理化性质的变化
由表2 可以看出经过复合菌发酵改性后的奶白花芸豆豆渣SDF 含量为18.32%,比发酵前提高了12.38%。复合菌种在芸豆可溶性膳食纤维发酵过程中不但可以减少蛋白质和淀粉等大分子物质的含量,也可分泌纤维素酶将不溶性膳食纤维(IDF)分解为SDF,使得SDF 的含量显著提高(P<0.05)。同时,从表中数据得知,芸豆SDF 经微生物发酵后,持水力、膨胀力、持油力均显著提高(P<0.05)。其中,持水力提高了1.43 倍,数值为4.97 g/g;膨胀力为3.83 mL/g、持油力为1.24 g/g,分别提高了80.66%和58.97%。植物乳杆菌、双歧杆菌等有益发酵细菌使得SDF 的结构糖苷键降解,结合位点和接触面增多,故而结构由紧密变成松散,提高其与水、油的相互作用[20]。由此可知,复合细菌菌种发酵可以改善芸豆SDF 的理化性质。
表2 芸豆豆渣发酵前后SDF 理化性质的变化(± n,n=3)Table 2 Changes in physicochemical quality of SDF of bean dregs before and after fermentation (±n,n=3)

表2 芸豆豆渣发酵前后SDF 理化性质的变化(± n,n=3)Table 2 Changes in physicochemical quality of SDF of bean dregs before and after fermentation (±n,n=3)
注:同列不同小写字母代表差异显著(P<0.05)。
2.2 改性芸豆渣SDF 对大鼠体重、游泳力竭时间的影响
如表3 所示,4 周后疲劳型大鼠建模成功后,模型组与空白对照组的大鼠体重差异较显著(P<0.05)。KBS-H 与模型组相比,常态体质量差异不显著(P>0.05);KBS-M、KBS-L 与模型组相比,体重差异显著(P<0.05),具有统计学意义。与空白组相比,模型组和受试组体重略有下降,表明大鼠力竭实验消耗部分能量,体现在体重减轻,说明运动性疲劳大鼠建模成功。通过大鼠的游泳力竭时间可以看出,模型组的运动时间极显著低于空白组(P<0.01);与模型组相比,发酵改性芸豆渣SDF 高、中、低剂量组游泳力竭时间极显著延长(P<0.01),表明发酵改性后的芸豆膳食纤维具有抗运动性疲劳能力。
表3 芸豆豆渣发酵改性SDF 对大鼠体重、游泳力竭时间的影响( ±n,n=3)Table 3 Effects of SDF of soybean dregon body weight and swimming exhaustion time of rats before and after fermentation(±n,n=3)
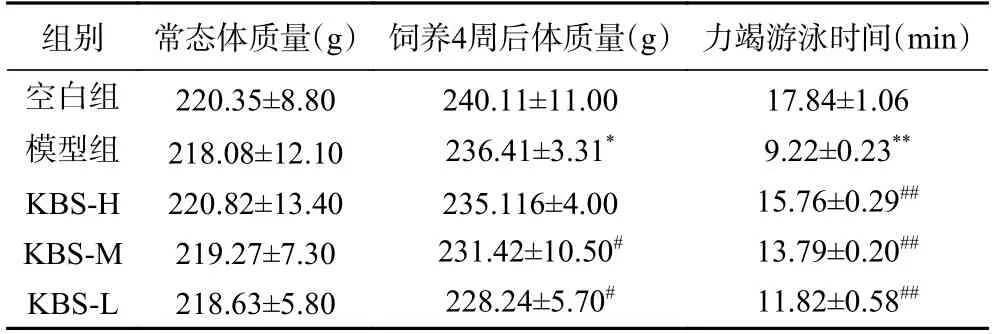
表3 芸豆豆渣发酵改性SDF 对大鼠体重、游泳力竭时间的影响( ±n,n=3)Table 3 Effects of SDF of soybean dregon body weight and swimming exhaustion time of rats before and after fermentation(±n,n=3)
注:与空白组相比*P<0.05,**P<0.01;与模型组相比#P<0.05,##P<0.01。表4~表5同。
2.3 改性芸豆渣SDF 对大鼠SOD、GSH-PX、MDA、LDH 活性影响
运动疲劳使得体内无氧呼吸强度增加、自由基积聚、抗氧能力减弱,人体的内环境稳定性受到影响[21]。与空白组相比,本实验中模型组、剂量组中MDA、SOD、LDH 含量具有极显著差异(P<0.01);GSH-Px 含量具有显著差异(P<0.05),说明大鼠建模成功。超氧化物歧化酶、谷胱甘肽过氧化物酶可清除体内自由基,提高二者活性,有助于人体抗氧化性提高[22]。模型组中SOD 与空白组差异极显著,GSH-Px 差异显著(P<0.01,P<0.05),表明运动后大鼠的两种酶活力下降。高、中、低剂量组的SOD 活性较于模型组分别提高了25.58%、12.95%、6.17%,其中高剂量组有极显著差异(P<0.01);高、中、低剂量组的GSH-PX 活性与模型组相较各提高25.25%、18.79%、10.65%,且差异显著(P<0.05,P<0.01),同时,KBS-H 的GSH-Px 含量高于模型组,以上结果表明改性后的芸豆SDF 能诱导这两种酶活性增强,从而保护机体免受氧化损伤。这表明改性芸豆渣膳食纤维能够提高大鼠的抗疲劳能力,可以修复运动损伤。
MDA 含量是反映机体抗氧化潜在能力的重要参数,可以反映机体脂质过氧化速率和强度,也能间接反映组织过氧化损伤程度,数值越小氧化程度越小[23]。在本实验中,从表4 可以看出,与模型组相比,高、中、低剂量组MDA 均极显著减少(P<0.01),其中,高剂量组的膳食纤维抗运动性疲劳效果更明显。身体中骨骼肌、肾脏LDH 的含量较高[24],运动时,血液糖酵解致使肌肉中积累大量乳酸,乳酸脱氢酶含量提升会降低乳酸含量。本研究中,较模型组而言,低、中、高剂量组LDH 含量均减少,其中高剂量组显著降低(P<0.05),这表明膳食纤维可降低乳酸产生含量进而抑制乳酸脱氢酶活性,延缓疲劳产生。
表4 各组大鼠MDA、SOD、GSH-Px、LDH 比较(± n,n=3)Table 4 Comparison of MDA,SOD,GSH-Px and LDH in each group rats (±n,n=3)
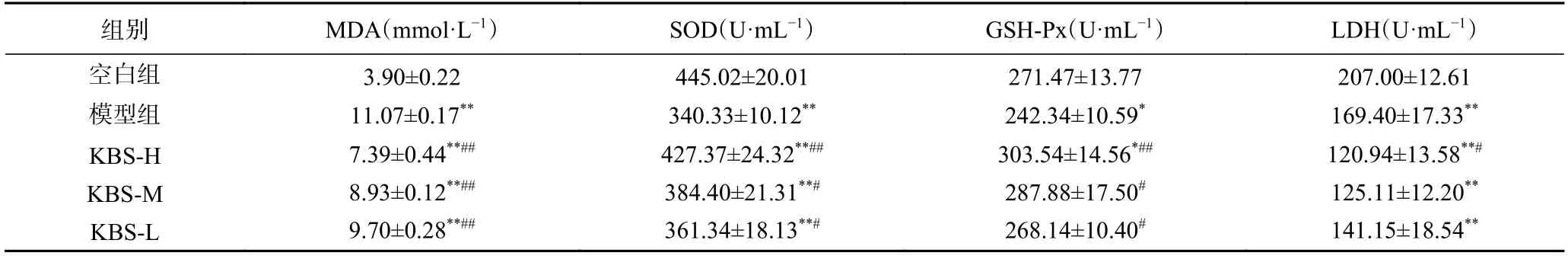
表4 各组大鼠MDA、SOD、GSH-Px、LDH 比较(± n,n=3)Table 4 Comparison of MDA,SOD,GSH-Px and LDH in each group rats (±n,n=3)
2.4 改性芸豆渣SDF 对大鼠肝糖原及肌糖原的影响
剧烈运动时,骨骼肌内的葡萄糖和肝脏内的糖原作用于肌肉和全身为机体提供能量,故而肌糖原与肝糖原变化情况可衡量运动的疲劳程度[25]。改性后的芸豆渣SDF 对大鼠肌糖原和肝糖原的影响如表5所示。与空白组相较,模型组的肝糖原和肌糖原值差异极显著(P<0.01),这表明运动性疲劳会导致小鼠肝糖原与肌糖原含量显著降低。高剂量芸豆渣膳食纤维组较模型组相比肝糖原、肌糖原极显著提高(P<0.01),中剂量组显著提高(P<0.05);同时,高剂量组与空白组相比差异显著(P<0.05)。通过上述结果,说明改性后的芸豆渣膳食纤维可以增加大鼠肝糖原和肌糖原的储存能力,进而增强持续性运动的耐受力。
表5 大鼠肝糖原及肌糖原(± n,n=3)Table 5 Hepatic glycogen in muscle and muscle glycogen in liver of rats (±n,n=3)
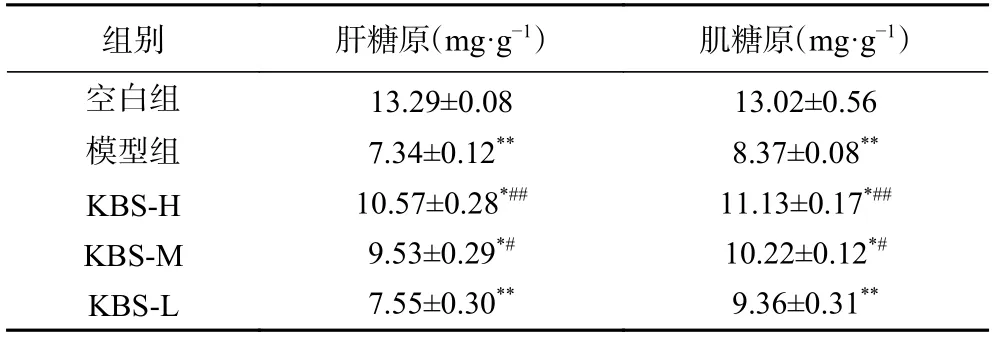
表5 大鼠肝糖原及肌糖原(± n,n=3)Table 5 Hepatic glycogen in muscle and muscle glycogen in liver of rats (±n,n=3)
3 讨论与结论
本研究中芸豆膳食纤维经过复合菌发酵改性后测定其理化值可以明确,发酵可提高膳食纤维的物化特性和得率,使得其对水和油的吸附、保留能力增强,这与涂宗财等[26]的研究结论基本一致。发酵改性促进芸豆膳食纤维提高水溶性和稳定性,这为后续开发相关抗疲劳功能性产品解决关键性技术问题。随着“全民健康,全民运动”的发展理念深入人心,有关缓解运动性疲劳的研究机理十分契合。
当人体能量和氧气供应不足或不及时时,造成运动性疲劳,氧化反应增强,因此需要提高抗氧化剂的摄入,加强还原反应,进而清除或抑制自由基,修复氧化损伤[27]。大鼠血清中的指标MDA、SOD、GSH-Px 反映抗氧化和清除自由基的能力,可用于评估疲劳和健康状况[28]。本实验大鼠体内相关指标的检测结果表明改性后的芸豆渣膳食纤维具有较好的抗氧化功效;与模型组相比较,摄入的膳食纤维越多,大鼠抗氧化能力越强。研究者对富硒大豆肽抗疲劳性进行研究,抗氧化性指标SOD 酶、GSH-Px 酶活性相较于模型组显著提高,MDA 含量显著降低(P<0.05),这与本文天然性植物膳食摄入的抗氧化性结果相一致[29]。有研究表明芸豆具有抗氧化性,并且经过发酵改性后,抗氧化性优于发酵前[30]。本研究中经过发酵后的芸豆膳食纤维的SOD 和GSH-Px 酶活力均提高25%左右,同时高剂量组能够缓解力竭大鼠疲劳性,这可能与发酵改性有关,增加相应酶活性。高鹏[31]的研究证实了甜菜渣膳食纤维能够降低蒙古马运动期间的疲劳程度,提高运动性能。集中于对膳食纤维影响运动机制的研究相对较少,后续的研究可进一步针对此方面开展。
人体摄入能量后,将葡萄糖转化为糖原储存在体内,为人体供能。剧烈运动时需要分解大量肝糖原和肌糖原提供能量。相关研究证实,醇类物质[28]、蛋白质和多肽[32−34]、中药中的活性成分[35]等可以通过提高肝糖原、肌糖原的含量,维持血糖平衡,改善运动性疲劳。本文中发酵改性后芸豆膳食纤维提高了模型大鼠肝糖原和肌糖原,这与其他研究结果一致,表明其摄入体内有助于肌糖原和肝糖原的储备,增强机体对运动负荷耐受能力的功效与抗疲劳能力。
综上所述,经过发酵法改性后的芸豆豆渣可溶性膳食纤维可以提高运动性大鼠的抗氧化损伤和肌肉组织代谢能力,缓解并改善运动性疲劳,可作为无毒害和副作用的新型抗氧化和抗疲劳原料,添加到运动员功能性产品中,对开发抗疲劳性产品具有重要意义。

