斜纹夜蛾取食Cry1Ca蛋白后中肠组织病理变化
姚 雪,刘 臣,段云鹏,魏纪珍*,梁革梅
(1.河南农业大学植物保护学院,郑州 450002;2.中国农业科学院植物保护研究所/植物病虫害生物学国家重点实验室,北京 100193)
转一种苏云金芽胞杆菌(Bacillusthuringiensis,Bt)蛋白或多种Bt蛋白的作物不但有效地控制了害虫的暴发,也带来了极大的经济效益和环境效益[1-4]。因此,到2019年,Bt作物已经在全球29个国家被批准种植,其年种植面积也超过了1.904亿hm2[5]。然而,大面积的种植Bt作物,也使得昆虫在巨大的选择压力下,抗性水平显著增加,甚至威胁到转Bt作物的种植和Bt的长期使用[6]。
目前,延缓抗性的一个重要策略是多基因策略,即在作物中表达多个不同作用靶标的抗虫Bt基因[7]。目前应用最广的是在作物中同时表达Cry1A和Cry2A用于防治棉铃虫Helicoverpaarmigera(Hübner)等重要农业害虫。Cry1Ca也是Cry1家族的Bt蛋白,前期的研究表明Cry1C特异性受体与Cry1A类没有或存在较低的竞争结合[8-10]。并且Cry1Ca能用于防治对Cry1A类蛋白产生抗性的害虫[11-13]。除此之外,Cry1Ca蛋白对鳞翅目害虫的杀虫活性与其他Bt蛋白存在明显差异,该蛋白应用到转多Bt基因作物中能在很大程度上扩大杀虫谱[14]。事实上,Cry1Ca已被尝试转入到作物中用于防治害虫和延缓抗性[15-18]。
转Cry1A蛋白的棉花有效地遏制了棉铃虫的猖獗,但是其他鳞翅目害虫,如甜菜夜蛾Spodopteraexigua和斜纹夜蛾Spodopteralitura等仍然不能被有效控制。其中,斜纹夜蛾是一种为害严重的,世界性的农业害虫,它寄主植物广泛,生殖力强,而且具有很强的迁飞习性,给农业生产带来了巨大的危害[19]。目前对斜纹夜蛾的防治主要是化学防治,长期化学农药的使用,已使斜纹夜蛾对传统的化学杀虫剂产生了很高的抗性,包括有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药;甚至对一些新型杀虫剂如多杀菌素、吲哚沙卡、氯虫腈和阿维菌素等也产生了抗性[20-25]。我们的前期研究表明,Cry1Ca 对斜纹夜蛾具有很好的防治效果[14],然而目前Cry1Ca 在斜纹夜蛾中的毒理作用和作用机制还缺乏相应的研究。
昆虫幼虫取食 Bt蛋白后会对中肠组织造成严重的损伤,如亚洲玉米螟Ostriniafurnacalis和粘虫Mythimnaseparata取食Cry1F蛋白后,中肠细胞微绒毛肿胀、脱落;细胞核变形,质膜和核膜界限不清晰;染色质发生固缩、贴近核膜;线粒体拉伸变形、数量减少,严重的发生空泡化;内质网肿胀与断裂、数量减少[26]。本研究通过斜纹夜蛾幼虫取食Cry1Ca蛋白、解剖其中肠制备组织切片、通过透射电镜观察斜纹夜蛾取食Cry1Ca不同时间后中肠细胞组织的生理病变过程,为进一步研究Cry1Ca杀虫蛋白的作用机理提供理论参考。
1 材料与方法
1.1 供试虫源和Cry1Ca蛋白
斜纹夜蛾采集于湖北省武汉市,之后在实验室人工气候箱内用人工饲料饲喂,温度为(26±1)℃、相对湿度为(60±10)%、光周期为16L:8D。
Cry1Ca毒蛋白由中国农业科学院植物保护研究所抗虫生物技术组馈赠,纯化浓缩后的蛋白图谱见文献[14]。
1.2 中肠组织取样
将4龄斜纹夜蛾幼虫接于24孔养虫盒内,饥饿处理24 h,对照转移到正常的饲料上饲养,试验组转移到含0.44 μg/g(该剂量为初孵幼虫LC95的浓度)的Cry1Ca蛋白饲料上饲养,取食2 h、6 h、12 h、24 h和36 h后分别解剖幼虫中肠,对照和Cry1Ca处理各24头,重复3次。
1.3 中肠组织超薄切片制作和电镜观察
采用双固定法制备玻片。解剖后的中肠先用3%戊二醛前固定,后用1%锇酸对中肠样品进行后固定。经过0.1 mol/L的磷酸缓冲液脱水、置换、渗透、包埋、聚合、超薄切片、切片染色后,具体玻片的制备参考文章[27,28]。利用日产Hitachi-500透射电子显微镜,80 kV加速电压下拍照观察。
2 结果与分析
2.1 斜纹夜蛾中肠杯状细胞微绒毛变化
斜纹夜蛾中肠正常的杯状细胞微绒毛排列密致整齐,数量众多(图1A);取食Cry1Ca 2 h后,杯状细胞微绒毛出现严重脱落(图1B),6 h后,杯状细胞微绒毛明显发生肿胀和扭曲(图1C);12~36 h,微绒毛变形、断裂和脱落情况逐步加剧(图1D,1E,1F),36 h时杯状细胞的微绒毛几乎脱落完毕(图1F)。

图1 取食含Cry1Ca蛋白的人工饲料不同时间后斜纹夜蛾中肠组织中杯状细胞变化Fig.1 Histopahtological changes of S.litura midgut goblet cells after feeding on artificial diets incorporated with Cry1Ca toxins
2.2 斜纹夜蛾中肠柱状细胞微绒毛变化
斜纹夜蛾中肠正常的柱状细胞的微绒毛细长、排列整齐,数量众多(图2A);取食Cry1Ca 2 h后,柱状细胞的微绒毛数量开始变少,断裂情况严重(图2B);6 h后,微绒毛已经基本被全部破坏(图2C),柱状细胞微绒毛也明显表现出肿胀和扭曲(图2D,2F);随时间延长,脱落情况进一步加剧,到24和36 h时完全脱落(图2E,2F)。

图2 取食含Cry1Ca蛋白的人工饲料不同时间后斜纹夜蛾中肠组织中柱状细胞变化Fig.2 Histopahtological changes of S.litura midgut columnar cells after feeding on artificial diets incorporated with Cry1Ca toxin
2.3 斜纹夜蛾中肠细胞细胞核变化
斜纹夜蛾中肠细胞正常的细胞核是圆形的、饱满、圆润、核膜完整、边界清晰可见,染色质分布均匀(图3A);取食Cry1Ca 2 h后,细胞核略有变形,呈现椭圆形(图3B);6 h 后,细胞核变形加剧,圆润的细胞核呈现皱缩,染色质聚集一侧(图3C);12 h和24 h后,细胞核继续变形或畸形(图3D,3E),染色质进一步聚集;36 h时,核膜破坏,边界模糊,细胞质流出(图3F)。
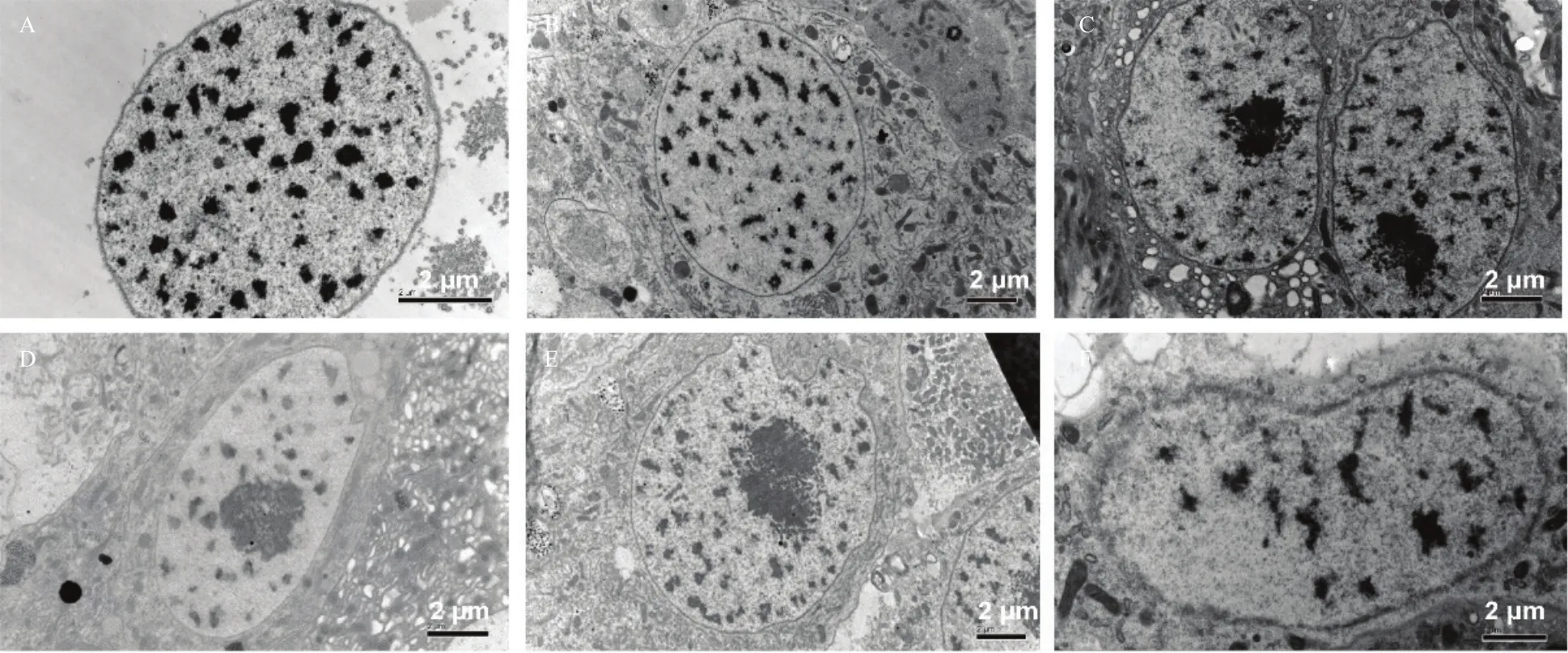
图3 取食含Cry1Ca蛋白的人工饲料不同时间后斜纹夜蛾中肠组织中细胞核变化Fig.3 Histopahtological changes of S.litura midgut cell nucleus after feeding on artificial diets incorporated with Cry1Ca toxin
2.4 斜纹夜蛾中肠细胞线粒体变化
斜纹夜蛾中肠细胞正常的线粒体为椭圆形或纺锤形,内脊清晰(图4A);取食Cry1Ca 2 h后,线粒体内脊开始模糊(图4B);6 h后,线粒体内脊更加模糊、变形、发生空泡化(图4C);12 h、24 h和36 h后,细胞线粒体继续拉长变形,空泡化加剧,数量减少(图4D,4E,4F)。

图4 取食含Cry1Ca蛋白的人工饲料不同时间后斜纹夜蛾中肠组织中细胞线粒体变化Fig.4 Histopahtological changes of S.litura midgut mitochondria after feeding on artificial diets incorporated with Cry1Ca toxin
2.5 斜纹夜蛾中肠细胞内质网变化
斜纹夜蛾中肠细胞正常的内质网发达,呈线状整齐排布于细胞质中(图5A);取食Cry1Ca 2 h后,内质网排列逐渐杂乱无章、肿胀变形,随时间的推移病状加剧;密集的内质网在6 h后开始变得稀疏,24 h和36 h后基本完全消解(图5B~5F)。

图5 取食含Cry1Ca蛋白的人工饲料不同时间后斜纹夜蛾中肠组织中内质网变化Fig.5 Histopahtological changes of S.litura midgut endoplasmic reticulum after feeding on artificial diets incorporated with Cry1Ca toxin
3 讨论
通过不同时间点取样观察斜纹夜蛾取食Cry1Ca后的中肠组织病变情况,我们发现中肠组织的病变情况与取食其他Bt蛋白后的症状类似[14,27-30],都会出现中肠细胞微绒毛的肿胀、扭曲、断裂和脱落(图1,2),细胞核会出现拉长或畸形、核膜模糊、染色质不均匀和聚集(图3),线粒体变形、发生空泡化、内脊模糊不清并随时间推移症状加重(图4);内质网变得杂乱无章、肿胀变形和数量减少(图5)。在中肠组织中,昆虫中肠柱状细胞的质膜的充分折叠大大增加了细胞吸收和分泌的面积,进而达到对营养物质充分消化吸收的目的;杯状细胞具有调节血淋巴和肠腔中K+和H+平衡的作用。分析Bt的作用模型表明昆虫取食Cry1类蛋白后,在中肠碱性环境中Bt原蛋白被蛋白酶活化成为65 kDa左右有杀虫活性的活化片段,这些活化的Bt片段与中肠受体结合,经过构象变化,插入于中肠上皮细胞膜内,进而形成细胞孔洞,导致细胞膨胀,渗透压失衡,最终造成昆虫死亡[31],这些中肠病变可能是与受体的结合或者穿孔作用引起的。本研究结果说明,Cry1Ca与其他Bt蛋白引起的中肠病变过程相似,推测其与其他Bt蛋白在中肠内的生理作用机制类似。
然而,不同Bt蛋白作用靶标害虫后,造成中肠病理变化的时间具有差异,Cry1Ac(0.5 μg/g)作用2 h后,棉铃虫中肠已发生明显的病理变化,且随着时间推后,影响越剧烈;Vip3Aa(50 μg/g)对棉铃虫的作用则较慢,在取食12 h后才可以观察到有明显的组织病理变化[28],尽管Vip3Aa的浓度高于Cry1Ac浓度的100倍,但是Cry1Ac的作用速度要更快,这一结果与Cry1Ac对棉铃虫的毒力高于Vip3Aa对棉铃虫毒力是一致的[14,32]。类似的,使用较低浓度的Cry1Ac(0.97 μg/g)对棉铃虫的作用速度快于较高浓度的 Cry2Ab(8 μg/g)对棉铃虫的作用速度[28],这与Cry1Ac对棉铃虫的毒力高于Cry2Ab对棉铃虫的毒力也是一致的[33]。这些结果表明病变速率的快慢一方面跟剂量有关,但是更多地反映出毒力的高低。4龄亚洲玉米螟和粘虫取食Cry1F蛋白(初孵幼虫LC90的剂量)48 h后中肠组织发生明显的病变[26]。本研究中,斜纹夜蛾4龄幼虫取食Cry1Ca(初孵幼虫LC95的浓度)后2 h中肠各组织就开始出现病理变化,这与Cry1Ca对斜纹夜蛾较高的杀虫活性一致[14]。斜纹夜蛾目前是农业生产上的重要害虫,对棉花、玉米、大豆、多种蔬菜等造成严重为害[19]。前期报道的Cry1Ca特异性受体与Cry1A不存在竞争结合[8-10],Cry1Ca能用于防治对Cry1A类蛋白产生抗性的害虫[11-13]。这里我们发现Cry1Ca作用于斜纹夜蛾的中肠组织在2 h就能有明显的病变暗示着其较高的毒力效果,综上研究表明Cry1Ca是多基因策略转基因作物的重要潜力杀虫蛋白。
然而,在其他农业害虫中的研究报道结果表明,对Cry1C产生抗性的小菜蛾品系对Cry1Aa、Cry1Ab、Cry1Ac、Cry1F和Cry1J也产生了抗性[34],对Cry1Ab产生了抗性的甜菜夜蛾品系同时对Cry1Ca 也产生了抗性[35]。同时,甜菜夜蛾的钙黏蛋白被鉴定为Cry1Ca和Cry1Ac的共同受体[36-38]。这些研究给我们也提出了预警,对于Cry1Ca在斜纹夜蛾中的受体和作用机理需要进行深入的研究,以便于制定合理有效的抗性治理措施。
致谢:试验得到中国农业科学院原子能研究所郝宏京老师和王莹老师的帮助,特此表示感谢!

