小脑经颅直流电刺激技术提升运动表现的应用
亓丰学, 苗雨, 张娜, 刘卉
(1.北京体育大学运动与脑科学实验室, 北京 100084; 2.北京体育大学中国运动与健康研究院, 北京 100084)
小脑位于枕叶下方、脑干背侧,即颅后窝内[1],与大脑、间脑和脑干共同构成人脑,其体积约为人脑的10%,但神经元多达690亿个,占人脑总神经元的80%[2]。研究显示,小脑中的网络数量是大脑网络的2倍[3],密集的神经元和组织网络为小脑参与和执行身体活动提供支持,不仅接收来自大脑、脊髓和感觉系统的信息,同时对信息进行整合,输出到相应的皮层[4],参与维持身体平衡、调节肌肉张力和协调肌肉的随意运动等。此外,小脑还参与非运动功能的表达[5],如认知和情感等[6]。研究表明,小脑齿状核的信息输出很大一部分投射到前额叶和后顶叶皮层等大脑皮层的非运动区域,与大脑形成紧密的运动与非运动功能神经网络[7-9]。小脑复杂的解剖结构和功能特点为调控运动和非运动功能提供了新思路。但是,如何调控小脑能更有效提升运动表现缺乏系统的研究。
经颅直流电刺激(transcranial direct current stimulation, tDCS)是一种非侵入性的脑刺激技术,通过电极将微弱的直流电作用于脑皮层,调节皮层的兴奋性和可塑性[10],为深入了解小脑功能及其在调控运动和非运动方面的作用提供了新工具。近年来,应用tDCS刺激小脑提升脑功能的研究逐渐增多,特别在神经科学、神经病学以及康复领域得到广泛关注。但tDCS干预小脑是否能有效提升人类的运动表现,选择怎样的tDCS刺激参数、时间和脑区位置能有效提升运动表现尚不清楚。现梳理tDCS刺激脑皮层的神经生理机制,总结tDCS刺激小脑的电极放置位置与方法,并综述小脑tDCS技术对改善运动表现的影响及神经机制研究。
1 经颅直流电刺激的作用机制
tDCS具有极性依靠的特点,正极tDCS刺激神经细胞胞体和/或树突诱发神经元放电增强,静息膜电位降低,产生去极化,提升大脑皮层兴奋性[11]如图1(a)所示。负极tDCS刺激神经细胞胞体和/或树突诱发神经元放电减弱,静息膜电位升高,导致超极化,抑制大脑皮层兴奋性[12-13],如图1(b)所示。

图1 tDCS作用机制Fig.1 tDCS action mechanism
tDCS对大脑皮层兴奋性的后效应依赖N-methyl-D-aspartate(NMDA)受体调节,谷氨酸受去极化的影响,浓度提升,激活NMDA受体和钙离子通道,提升神经细胞内钙离子浓度,导致长时程增强(long term potentiation, LTP)[14]。谷氨酸受超极化的影响,浓度降低,抑制NMDA受体和钙离子通道,神经细胞内钙离子浓度降低,导致长时程抑制(long term depression, LTD)[15-17]。LTP和LTD是学习、记忆过程中重要的神经生理学机制,可促进或抑制突触间连接[15]。研究发现,tDCS的刺激强度和刺激时长对突触可塑性有不同的影响,1~2 mA tDCS正极刺激可诱发运动皮层兴奋性持续90 min[18-19]。1 mA tDCS负极刺激可抑制运动皮层兴奋性长达60 min[20],3 mA tDCS负极刺激抑制运动皮层兴奋性可达90 min[16]。近20年的临床研究表明,tDCS具有无痛、局灶性、无创性和可逆性的特点,能够有效改善人类的运动表现[21]、感觉功能[22]和认知功能[23-25]。但是,如何进一步延长微弱电流刺激后的脑皮层兴奋性或抑制性的效果,仍需进一步的研究。
2 经颅直流电刺激小脑的电极放置
根据研究目的和电场强度的不同[26],国际上通常把tDCS刺激双侧小脑的电极(通常为1~2 mA)安放于枕骨隆突中央下方1~2 cm处[27-29],刺激单侧小脑的电极通常安放于枕骨隆突一侧3 cm处[30],参考电极通常放置于颊肌[31]、前额/眼眶上区域[27]、三角肌[32]或乳突[33-34],tDCS刺激小脑的电极安放位置参考如图2所示。
3 经颅直流电刺激小脑对人类运动表现的影响
运动表现是运动员在比赛或训练中以及普通人群在身体锻炼中运动能力的集中体现。研究表明,小脑、初级运动皮层M1以及二者的神经网络连接对提高运动表现有重要作用,是调节运动过程的重要网络[35]。长期的运动干预可以改变运动员脑网络的功能可塑性[36]。随着非侵入性脑刺激技术以及神经影像技术的发展,tDCS技术逐渐应用于小脑皮层改善人类的运动表现,如平衡能力、运动适应、动作技能学习以及肌肉力量等。
3.1 改善身体姿势控制
姿势控制能力是一种自适应的感觉控制系统,视觉、本体感觉和前庭觉[37]在脊髓、前庭核、脑干、小脑、丘脑和运动皮层等多级神经中枢进行整合加工[38],以获得对当前姿势状态最准确的感知。其中,小脑是整合与姿势控制相关信息的重要脑区。
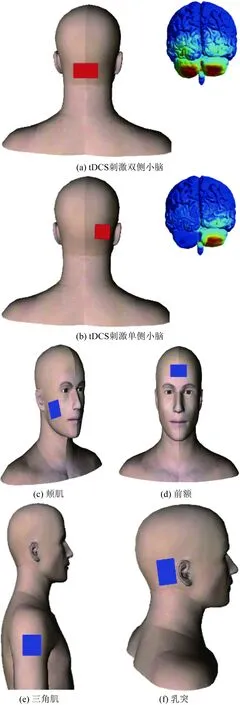
图2 tDCS刺激小脑的电极安放位置参考Fig.2 References of set-ups to apply tDCS over the cerebellum
随年龄增长,老年人的感觉系统灵活性减弱,导致摔倒风险增加。Ehsani等[39]让健康老年人接受单次1.5 mA tDCS正极刺激小脑20 min后即刻,站在固定或转动的平衡测试仪上,发现静态和动态姿势摇摆明显减少,48 h后的随访发现,Berg平衡量表的评分也明显增高,单次刺激改善老年人的平衡能力持续48 h。可能的原因是tDCS正极刺激小脑激活浦肯野细胞活性,改善小脑蚓部区或白质束的功能,抑制小脑深部核神经元产生适当的运动输出,进而抑制了损害姿势平衡的活动[40]。tDCS正极刺激小脑促进小脑和其他脑区的连接,增加小脑控制M1、前庭系统、中脑和其他脑区的功能。Baharlouei等[41]用2 mA tDCS正极刺激小脑,发现老年人在接受单次刺激后控制静态和动态姿势的能力得到改善,且老年人在进行平衡测试时接受简单认知任务,同样改善了静态平衡能力。有研究表明,小脑白质束将小脑和其他脑区连接,使得tDCS刺激小脑在认知任务方面具有潜在的益处[42]。因此,当老年人的认知系统和姿势控制系统同时激活,更有利于平衡能力的改善。
Poortvliet等[27]在对年轻人的姿势控制实验任务中增加难度,1 mA tDCS正极刺激小脑20 min后,受试者接受15 s的被动跟腱震动任务干扰他们的站姿,观察其姿势控制扰乱后的恢复能力。研究发现,恢复过程中压力中心(center of pressure, COP)的位移减少,改善了健康成年人的自适应姿势控制能力。然而,Forerster等[43]用1 mA tDCS的正极(13 min)和负极(9 min)分别干预健康受试者的右侧小脑,结果显示tDCS负极刺激损害了健康个体的静态平衡能力,但正极刺激小脑没有影响静态平衡能力。可能的原因是1 mA的tDCS正极刺激强度未能有效激活健康成年人神经元的兴奋性和强化各个感觉系统的神经联系。
此外,Inukai等[44]研究2 mA tDCS负极刺激小脑20 min对健康成年人的静态平衡表现的影响,发现身体摇摆总轨迹长度以及单位时间的轨迹长度降低,平衡能力改善。1个月后,同一批受试者再次接受同样强度的tDCS负极刺激,参考电极由前额改为右侧颊肌,同样改善静态平衡能力[44]。浦肯野细胞是小脑皮层唯一能够传出冲动的神经元,这些细胞的轴突释放的γ-氨基丁酸神经递质能抑制小脑深部核神经元,从而增强M1的兴奋性,导致平衡能力的提升,即“小脑-大脑抑制”[45]。
平衡能力降低以及行走障碍是导致脑卒中、帕金森、小脑共济失调甚至脑瘫等疾病患者摔倒的重要原因。小脑参与步态的前馈控制使机体避开障碍物以适应新环境,并通过小脑-丘脑-皮层通路的激活状态提高机体的平衡适应能力[46]。Picelli等[47]让脑卒中患者在机器人的辅助下进行步态训练时接受2 mA 负极tDCS干预健侧的小脑半球结合负极经皮脊髓直流电刺激20 min,连续干预10 d,患者的行走能力得到改善。大脑半球竞争模型表明健康人大脑半球间存在经胼胝体抑制[48],脑卒中后通过抑制健侧脑区异常的神经元兴奋性来帮助恢复患者的平衡功能。因此,tDCS负极干预健侧小脑半球可改善受损脑区功能恢复[49]。Rezaee等[50]研究发现2 mA tDCS正极刺激小脑齿状核和小脑控制下肢的区域(小叶VII-IX)结合虚拟现实(virtual reality, VR)视觉反馈系统干预慢性脑卒中患者15 min,可以改善患者站立平衡能力。VR视觉反馈系统可导致机体在维持平衡过程中产生操作性条件反射,且tDCS刺激小脑的辅助治疗可减少反应时间,从而提高姿势控制能力。Grecco等[51]用1 mA tDCS正极刺激共济失调性脑瘫儿童小脑20 min结合运动跑台进行姿势训练2周(共10次),2周训练后闭眼时COP振荡明显减少,脑瘫儿童的身体平衡能力改善,这种积极效应在一个月后仍获得保留。这说明tDCS正极刺激小脑结合跑台训练可以增加外周神经的信息传递,并增强参与运动的脑区连通性。可见,小脑在自适应学习过程中起重要作用,高强度运动训练(如跑台训练)结合正极tDCS刺激小脑可促进新运动模式的学习,进而对平衡和步态等活动产生积极影响。
综上,tDCS刺激小脑能够改善健康群体和神经病损患者的平衡能力。tDCS正极刺激小脑能够促进小脑和其他脑区的连接,增加小脑控制M1、前庭系统、中脑和其他脑区的功能,激活浦肯野细胞活性,改善小脑蚓部区或白质束的功能,抑制小脑深部核神经元放电。tDCS负极刺激小脑皮层,γ-氨基丁酸浓度升高,抑制小脑深部核神经元放电,从而提升M1的兴奋性。此外,健康成年人相较于老年人或神经病损患者的姿势控制能力没有衰退或受到损害,可能需要更优化的刺激模式提升身体姿势控制能力。因此,根据受试者对姿势控制的不同需求选择合理的刺激强度和刺激时间调控脑部神经元的兴奋性,提升身体平衡能力。
3.2 提高运动适应性
运动适应基于运动技能学习和感觉反馈,通过反复试验调整运动以适应新需求和不断减少错误,在变化的环境中完善预期目标的运动模式。运动适应是一个复杂的过程,涉及多个脑区间的相互作用,它可以校准大脑对身体移动的规划和考虑与新任务需求相关的成本[52]。
Galea等[53]用2 mA tDCS正极分别刺激右侧小脑和M1,通过受试者多次重复在计算机屏幕上快速、准确捕捉射击目标的方式评估视觉适应能力,结果显示tDCS刺激小脑后受试者能更快速适应视动转换和减少运动错误。Weightman等[54]研究表明年轻人用2D机器人操作系统(需要上臂伸展运动)适应一个60°视动转换来完成任务,发现2 mA tDCS正极刺激右侧小脑可以提高受试者的适应能力。因为上臂伸展的精细动作依赖于小脑,所以激活小脑神经细胞的活性有效提高了上臂的运动适应能力。眼动适应是一种由小脑介导的运动适应类型,当视线落在目标位置时,眼动系统检测错误,更新运动指令,在前一次的基础上调整振幅,订正视线位置。Avila等[55]对受试者进行眼动适应实验,发现1.5 mA正极tDCS刺激右侧小脑15 min,增强了跳动视力的适应能力。Mitroi等[56]在延迟眨眼条件反射的实验中研究发现1.5 mA或2 mA tDCS刺激小脑20 min,均会增强年轻健康受试者眨眼调节能力。tDCS可能改变了小脑中γ-氨基丁酸、谷氨酸、脑源性神经营养因子等神经递质的神经传递,促进眨眼调节能力。
综上所述,tDCS刺激小脑能改善受试者的运动适应能力。tDCS可作为一种神经调节技术调节小脑动眼神经冲动输出,促进任务相关的特定小脑区域神经活动。未来需要更多元的样本结合不同刺激模式进行研究,揭示tDCS刺激小脑改善运动适应的生物学机制,更好地理解人类运动学习过程中小脑在脑网络中的作用。
3.3 提升运动学习能力
运动学习是通过感觉器官,从多种信息源摄取所学动作技术的信息进行加工处理[57],形成动作表象,建立动作程序,并根据程序完成动作的过程。学习过程需接受反馈信息,通过减少错误,完成运动学习过程。已有研究表明,tDCS可增加小脑皮层神经细胞激活,影响NMDA受体的多态性,促进皮层脊髓可塑性和运动学习能力[58-59]。
Cantarero等[60]用2 mA tDCS的正极刺激右侧小脑,受试者连续3 d进行线上或线下的顺序视觉等距捏力任务练习,结果显示练习的错误率降低,运动技能习得能力较伪刺激组明显改善,且在线学习组(tDCS刺激期间完成学习任务)的效果优于离线模式(tDCS非刺激期间完成学习任务)。但是,在线和离线组的技能掌握水平在一周后不存在差异,在线学习并未获得额外的习得效果。Ehsani等[61]用2 mA tDCS正极刺激小脑20 min,使受试者在线完成序列反应时任务(serial reaction time task, SRTT),并分别在刺激结束后35 min和48 h评估短期和长期的学习效果。结果表明,SRTT任务的错误率明显减少,在线学习同样增强短期运动学习表现,并将其积极效应维持48 h。Jackson等[62]增加了学习任务的难度,让受试者向远处(6 m外)目标进行投掷练习,并尽可能缩短落地点至目标中心的距离。研究发现,投掷训练时结合2 mA tDCS正极刺激右侧小脑20 min,能有效减少投掷误差的幅度,提高复杂任务中运动技能的习得。正极tDCS刺激小脑可增加神经元放电速率,增强神经元间突触连接,从而影响神经网络,巩固序列学习任务[63]。日常活动不同于固定任务,具有较强的多变性,未来需要进一步应用复杂的任务研究理解运动控制和学习。通过调控小脑神经活动能减少运动学习时错误的发生,同时小脑通过参与由小脑和基底神经节介导的其他学习机制(如奖赏机制)强化运动学习[64],促进学习能力的提高。
但是,Beyer等[65]用2 mA正极tDCS刺激右侧小脑20 min后进行离线运动学习(不在刺激期间完成学习任务),结果显示学习的效率没有提高。Verhage等[66]用1.5 mA正极tDCS刺激健康受试者的小脑20 min,同时进行内隐分类学习任务,结果显示未改善学习能力。Jongkees等[67]研究发现1 mA tDCS正极刺激小脑20 min结合序列反应时任务抑制运动学习能力达24 h。tDCS刺激小脑可能具有任务依赖性。虽然干预小脑有助于运动技能的习得,但是其对视觉运动扰动适应、联想学习以及眨眼条件等方面的学习更敏感。
综上,tDCS刺激小脑能够改善人类的运动学习能力,在线学习效果优于离线模式,且表现出较为明显的任务依赖特征。此外,运动学习过程依赖于小脑外侧和M1共同的神经网络活动[68],未来的研究可以进一步探索两者之间的神经网络连接。tDCS刺激小脑结合任务学习训练是否能改善老年人和神经病损患者的运动能力,是否能提高运动员尤其是竞技能力提升空间受限的高水平运动员的运动技能学习有待进一步研究。
3.4 提升肌肉力量表现
力量素质是人体神经肌肉系统在工作时克服或对抗阻力的能力。肌肉力量不仅有助于完成日常生活中的各种任务,如走、跑、跳、投等,而且还可以预测运动员的运动表现或动作效能。肢体进行随意运动时,小脑接收大脑皮层发出的运动指令和获取肌肉执行运动指令的信息后,小脑皮层的浦肯野氏细胞发出神经冲动,调控小脑齿状核的齿状细胞活动,经齿状核-丘脑皮层束反馈到运动皮层,通过易化或抑制作用调控运动皮层的神经活动,从而精确控制肌肉力量[69]。
目前的研究较多验证了tDCS刺激背外侧前额叶皮层[70]、M1[71]和颞叶皮层[72]等能有效提升肌肉力量,并将该技术应用到运动训练中。Kenville等[73]首次将tDCS刺激小脑用于提升肌肉力量,25名健康受试者在接受tDCS刺激期间,三次用力推固定的杠铃杆(杠铃杆质量极大,无法被推动),每次持续3~5 s,评估受试者的最大等长收缩力量(maximal isometric voluntary contraction, MIVC)。结果显示,2 mA tDCS正极刺激小脑20 min,可以增强杠铃深蹲运动中肌肉MIVC[73]。虽然这表明肌肉力量可以通过tDCS刺激小脑调节,但是目前研究结果无法证明小脑与肌肉力量的提高直接相关。tDCS刺激小脑可能增加小脑与其他脑区的连接,肌肉力量的短期增长可能归因于多个脑区的神经兴奋性增加。
综上,tDCS刺激小脑对提高肌肉力量表现有积极效应。然而,由于该领域尚未开展大范围的研究,先前实验的积极效应未在其他研究中被论证,无法确定tDCS刺激小脑可以直接增加肌肉力量。因为肌力的增加离不开脑网络的协调控制,所以未来研究需要结合神经影像学技术,分析tDCS刺激期间肌力变化的神经生理学机制。未来应该结合不同的研究方法探索tDCS刺激小脑对肌肉力量的影响,为进一步提高运动表现提供理论依据。
4 结论与展望
tDCS刺激小脑能改善人体姿势控制能力、提升运动适应能力、加快动作技能的学习和提高肌肉力量表现等。tDCS刺激小脑作为一种潜在的神经病损疾病治疗技术和运动功能提升的干预方法,未来需要解决以下问题。
(1)进一步揭示tDCS刺激小脑改善运动表现的神经生理机制。未来需要通过神经影像学技术,如功能磁共振成像(functional magnetic resonance imaging, FMRI)和弥散张量成像(diffusion tensor imaging, DTI)探索齿状核-丘脑-皮层通路介导运动表现的机制。
(2)明确tDCS干预小脑的最佳刺激参数(如刺激强度、刺激时间和刺激时间间隔等)。目前,tDCS刺激小脑的参数更多基于健康成人群体和病人群体的刺激模式,未来需要针对不同年龄段、不同群体(如运动员和青少年病人)探索在不同任务活动状态下更适宜有效的刺激参数。
(3)探索与真实场景结合的实验范式,增强实验结果的实效性。目前与提升运动表现相关的研究主要基于特定的实验场景,未来如何将小脑tDCS技术应用于真实场景的运动训练中,帮助运动员突破现有的运动能力需要进一步探索。
(4)进一步验证tDCS对改善肌肉力量表现的有效性。目前尚未开展大范围的研究探索tDCS对改善肌肉力量表现的效果,无法确定tDCS刺激小脑是否可以直接增加肌肉力量。未来研究需要结合神经影像学技术,探究tDCS刺激小脑对肌肉力量的影响,分析tDCS刺激小脑期间肌力变化的神经生理学机制。
(5)探索新技术延长tDCS刺激小脑后的积极效应。目前tDCS刺激小脑的后效应仅持续1 h左右,未来需要进一步研发新的无创脑刺激技术延长刺激后效应,发挥无创脑刺激技术的效益。

