阿奇霉素分散片质量评价研究*
苑思坤,刘 亚,陈维一,郭 宏,刘惠军,杨 飞,邹佳洁,梁倩立
(1. 河北省保定市食品药品检验所,河北 保定 071000; 2. 保定市体育运动学校,河北 保定 071000)
阿奇霉素为半合成的十五元环大环内酯类抗菌药物,是以红霉素为原料,经过肟化、贝克曼重排、还原和甲基化反应合成得到的一种广谱抗菌药物[1-2]。其临床主要用于治疗敏感菌所致呼吸道、皮肤软组织感染,以及衣原体所致传播性疾病[3],对小儿支原体肺炎也有较好疗效[4]。其分散片可提高药物的生物利用度[5]。目前,阿奇霉素分散片已列入河北省基本药物管理的非基本药物目录。本次评价性抽验为省级专项检查,分别从河北省各市、县、乡三级行政辖区采集样品,有目的性地涵盖了生产企业、流通企业、使用单位等各个环节,共抽取样品43批次,涉及22个生产企业,共计22个批准文号,具有较好的代表性。本研究中通过分析阿奇霉素分散片的法定标准检验结果,对其检验标准及检验数据进行了全面质量评价,并参考相关标准与文献[6-12],建立了新的有关物质检验方法,为进一步完善、提高质量标准,更好地保证药品质量提供了参考。现报道如下。
1 仪器与试药
1.1 仪器
1260 型高效液相色谱仪(美国Agilent 公司),包括G1315D 型二极管阵列检测器、EZChrom Elite 色谱工作站;e2695 型高效液相色谱仪(美国Waters 公司),包括2998 型光电二极管阵列检测器、Empower 色谱工作站;CAP225D型电子分析天平(精度为十万分之一),PB-10型酸度计,购于德国赛多利斯公司;RCZ-8M 型溶出试验仪,ZB - 1E 型智能崩解仪,购于天大天发公司;KQ5200 型超声波清洗仪(昆山市超声仪器有限公司,功率为200 W,频率为40 kHz)。
1.2 试药
阿奇霉素分散片(生产企业编号为S1 - S22,抽验样品43 批次,规格为每粒含阿奇霉素0.25 g);阿奇霉素对照品(纯度为94.4%,批号为130593-201303),阿奇霉素系统适用性试验对照品(批号为130609 -201706),购自中国食品药品检定研究院;甲醇、乙腈为色谱纯,磷酸氢二钠、磷酸氢二钾、磷酸二氢铵及其他试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 法定检验标准检验
2.1.1 法定检验项目
阿奇霉素分散片现行法定检验标准为2010 年版《中国药典(二部)》,2015 年版与2020 年版《中国药典》均未收载,检验标准多年未更新。现行法定标准包括1)性状:白色或类白色片;2)鉴别:①为薄层色谱鉴别,②为高效液相色谱鉴别,在含量测定项下记录的色谱图中,供试品溶液主峰保留时间应与对照品溶液一致,以上①②2 项可选做1 项,本研究中选做鉴别②试验;3)检查:包括有关物质、重量差异、溶出度、分散均匀性、含量测定。其中,含量测定采用高效液相色谱法,按外标法[13]计算。
2.1.2 检验结果
1)总体情况
本次评价性抽验中,共抽取阿奇霉素分散片43 批次,检验43批次,合格43批次,合格率为100.00%。
2)性状
均符合法定标准规定。
3)鉴别
高效液相色谱法检验结果显示,供试品溶液色谱峰的保留时间与对照品溶液一致,均符合法定标准规定。
4)检查
有关物质:标准规定,阿奇霉素B、阿奇霉素Gx、红霉素A偕亚胺醚、其他单个杂质及各杂质峰面积的和均应在规定限值范围内。43 批次样品中,仅有2 批次样品检出阿奇霉素B 峰,含量分别为0.3%与0.1%(限值为2.0%),其余批次均未检出;30 批次检出阿奇霉素Gx峰,最大含量为0.1%(限值为1.0%),其余批次均未检出;40 批次检出红霉素A 偕亚胺醚峰,最大含量为0.1%(限值为1.0%),其余批次均未检出;43 批次中其他单个杂质最小含量为0.2%,最大含量为0.6%(限值为1.0%);总杂质最小含量为0.2%,最大含量为0.8%(限值为4.0%)。43 批次样品中有关物质检验结果均符合法定标准规定。
重量差异:标准规定,20 片重量均在重量差异限度范围内,或超出装量差异限度的不得多于2 片,并不得有1 片超出限度1 倍。43 批次中,有41 批次均在限度范围内(占95.35%),有2 批次中有1 片超出限度但未超过1 倍(占4.65%),无2 片超出限度且不超出限度1 倍的批次。
溶出度:标准规定,限度为标示量的75%。43 批次样品均符合规定。检验结果见图1。

图1 阿奇霉素分散片溶出度检验结果分布Fig.1 Dissolution distribution of Azithromycin Dispersible Tablets
分散均匀性:标准规定,6片在3 min内全部崩解,并通过筛网。43批次均符合规定,其中7批次在1~2 min全部崩解,占16.28%;26 批次在2~3 min 全部崩解,占60.47%。
含量测定:标准规定,含阿奇霉素(C38H72N2O12)应为标示量的90.0%~110.0%。43 批次的阿奇霉素含量为91.1%~101.9%,平均含量为95.8%,近似服从正态分布。各生产企业阿奇霉素分散片中阿奇霉素的平均含量见表1。

表1 各生产企业阿奇霉素分散片中阿奇霉素平均含量(%)Tab.1 Average contents of azithromycin in Azithromycin Dispersible Tablets from different manufacturers(%)
2.2 探索性研究
2.2.1 标准检验方法
2010 年版《中国药典(二部)》中阿奇霉素分散片有关物质项下关于阿奇霉素B 的规定为相对保留时间约为1.53 处的色谱峰,43 批次样品中仅有2 批次样品在此保留时间处检出阿奇霉素B 色谱峰,其余41 批次样品均检出疑似峰,但疑似峰的相对保留时间在阿奇霉素主峰的相对保留时间±5%范围内,绝大多数超出了10%,故按2010 年版《中国药典(二部)》阿奇霉素分散片有关物质标准判定,此疑似峰不属于阿奇霉素B,判定为未检出(见图2)。采用二极管阵列检测器对疑似峰进行光谱分析,疑似峰与阿奇霉素B峰的光谱图基本一致(见图3),表明采用现行药品标准测定阿奇霉素分散片有关物质时,阿奇霉素B存在漏判。

1. 保留时间±5%范围 2. 疑似阿奇霉素B峰图2 阿奇霉素分散片有关物质检查色谱图1.Range of retention time(±5%) 2.Suspected peak of azithromycin BFig.2 Chromatograms of detection for relevant substances in Azithromycin Dispersible Tablets
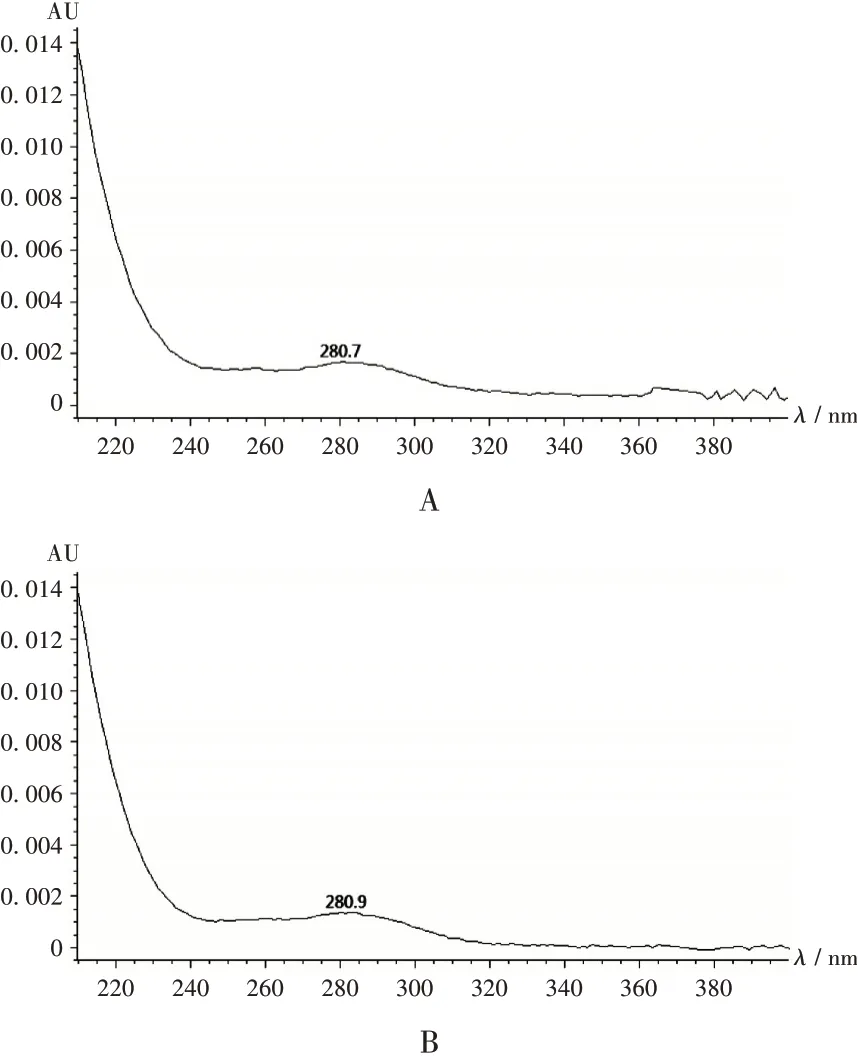
A. 阿奇霉素B B. 疑似峰图3 光谱扫描图A.Azithromycin B B.Suspected peakFig.3 Spectral scanning images
考虑到色谱柱可能是影响样品保留时间的重要因素,故考察了6 种不同品牌及规格的色谱柱,采用2010年版《中国药典(二部)》有关物质项下的色谱条件进行检测,结果采用3 种柱长为200 mm 的色谱柱,3 次检验中有2 次主峰保留时间超出范围;采用3 种柱长为250 mm 的色谱柱,3 次检验中主峰保留时间均在范围内。详见表2。

表2 阿奇霉素主峰在不同品牌及规格色谱柱的保留时间Tab.2 Retention time of the main peak of azithromycin by chromatographic columns with different brands and specifications
结果表明,色谱柱长度是影响保留时间的主要因素,而不同厂家、型号的色谱柱也对保留时间有一定影响,现行法定标准中定位阿奇霉素B为主峰相对保留时间为1.53 处的色谱峰,6 种不同色谱柱中有2 种保留时间均超出了范围,导致漏判。表明现行质量标准的耐用性有欠缺。
2.2.2 新方法的建立
1)色谱条件与系统适用性试验
色谱柱:Waters Sunfire C18柱(250 mm × 4.6 mm,5 μm);流动相:A为磷酸盐缓冲液(取0.05 mol/L磷酸氢二钾溶液,用30%磷酸溶液调pH至8.0)-乙腈(45∶55,V/V),B 为甲醇,采用梯度洗脱程序(见表3)对阿奇霉素分散片的有关物质进行分离;流速:1.0 mL/min;柱温:30 ℃;检测波长:210 mn;进样量:50 μL。在此色谱条件下,阿奇霉素主峰与各主要杂质峰分离效果良好,各峰分离度均大于1.5,理论板数均不低于2 000。

表3 梯度洗脱程序(%)Tab.3 Gradient elution process(%)
2)溶液制备
稀释液:以磷酸二氢铵溶液(取磷酸二氢铵1.72 g,精密称定,加水溶解并稀释至1 000 mL,用氨试液调pH至10.0±0.10)-甲醇-乙腈(7∶6∶6,V/V/V)作为稀释液。
系统适用性试验溶液:取阿奇霉素系统适用性试验对照品(含杂质R,Q,J,S,I,A,H,B)适量,精密称定,加稀释液溶解并稀释成每1 mL约含10 mg的溶液。
供试品溶液:取样品细粉适量,精密称定,加稀释液溶解并定量稀释成每1 mL约含10 mg的溶液。
对照品溶液:精密量取供试品溶液1 mL,置200 mL容量瓶中,用稀释液稀释并定容,摇匀,即得。
3)方法学考察
专属性试验:(1)辅料干扰试验。按企业提供的阿奇霉素分散片处方工艺配制空白辅料,按上述色谱条件进样测定,记录色谱图。结果空白辅料不干扰阿奇霉素及杂质的测定。详见图4 A。(2)分离效果试验。精密量取溶液制备项下系统适用性试验溶液(含杂质R,Q,J,S,I,A,H,B)与供试品溶液各1 mL,混匀,注入高效液相色谱仪。结果阿奇霉素主峰与各主要杂质峰间分离效果良好,各峰分离度均大于1.5。详见图4 B。
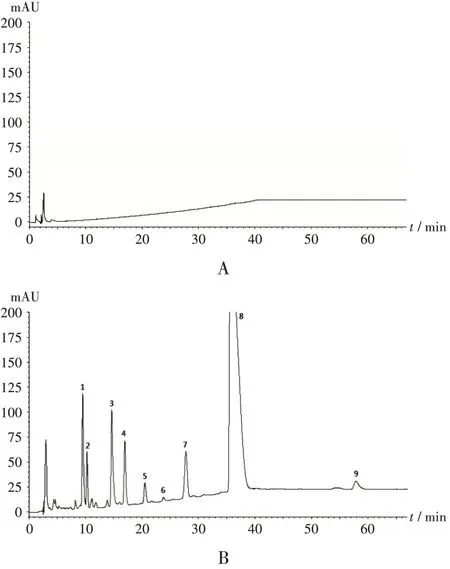
1. 杂质R(红霉素A 9,11-亚胺醚) 2. 杂质Q(红霉素A 6,9-亚胺醚) 3. 杂质J(3-O-去克拉定糖基阿奇霉素)4. 杂质I(3'-N-去甲基阿奇霉素) 5. 杂质S(红霉素A-E-肟) 6. 杂质A(氮红霉素A) 7. 杂质H 8. 阿奇霉素 9. 杂质B(阿奇霉素B)A. 辅料干扰试验 B. 分离效果试验图4 专属性试验高效液相色谱图1.Impurity R(erythromycin A 9,11-iminoether) 2.Impurity Q(erythromycin A 6,9-iminoether) 3.Impurity J(desosaminylazithromycin) 4.Impurity I(N-demethylazithromycin) 5.Impurity S(erythromycin A-E-oxime) 6.Impurity A(Azaerthromycin A) 7.Impurity H 8.Azithromycin 9.Impurity B(azithromycin B)A.Excipients interference test B.Separation effect testFig.4 HPLC chromatograms of the specificity test
线性关系考察:取阿奇霉素对照品适量,加稀释液溶解并稀释成每1 mL 含0.1 mg 的溶液。精密量取此溶液1,2,5,10,15,20 mL,分别置50 mL容量瓶中,加稀释液稀释并定容,摇匀,每1 mL 溶液含阿奇霉素2.003,4.006,10.014,20.028,30.042,40.056 μg,相当于杂质的量为0.2%,0.4%,1.0%,2.0%,3.0%,4.0%。分别取50 μL 进样测定,记录峰面积,以质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y=2 905.3X-6 405.1(R2=0.999 1,n=6)。结果表明,阿奇霉素质量浓度在2.003~40.056 μg/ mL 范围内与峰面积线性关系良好。
检测限与定量限确定:用逐级稀释法,以阿奇霉素峰计,以信噪比(S/N)为3∶1 时的质量浓度为检测限,以S/N为10∶1 时的质量浓度为定量限。结果检测限为0.12 μg/mL,定量限为0.40 μg/mL。
稳定性试验:精密量取供试品溶液适量,分别于放置0,2,4,6,8 h 时按上述色谱条件进样测定,记录峰面积。结果阿奇霉素B 峰面积的RSD为1.23%(n=5),且其他杂质含量未显著增加,表明供试品溶液在8 h 内稳定性良好。
重复性试验:精密称取同一样品,依法制备供试品溶液,平行5份,再按上述色谱条件进样测定。结果阿奇霉素B峰面积的RSD为1.37%(n=5),表明方法重复性良好。
耐用性试验:取系统适用性试验溶液50 μL,色谱柱采用Agilent 5 TC - C18(2)柱(250 mm × 4.6 mm,5 μm)和Shiseido Capcell PAK C18柱(250 mm×4.6 mm,5 μm),按上述色谱条件分别注入Agilent 1260 型及Waters e2695型高效液相色谱仪,记录色谱图。结果阿奇霉素主峰、各主要杂质峰间分离效果良好,分离度均大于1.5。取溶液制备项下供试品溶液及对照品溶液各50 μL,分别进样测定,每台仪器各进样1次。结果阿奇霉素B峰面积的RSD为1.79%(n=2),表明方法耐用性良好。
4)样品中阿奇霉素含量测定
取43批样品各适量,依法制备供试品溶液,进样测定。结果按新建立的方法检验,43 批次样品中均检出阿奇霉素B,无漏判情况,检测结果均在规定限值范围(限值为2.0%)内,但有2 批次样品接近限值(1.9%,1.8%)。详见表4。

表4 43批次样品中阿奇霉素B含量检测结果(%)Tab.4 Results of content detection of azithromycin B in 43 batches of samples(%)
3 讨论
抽验结果表明,河北省不同层面(市、县、乡)、不同环节(生产、流通、使用)、不同保存条件(温度、湿度)的阿奇霉素分散片的质量无明显差异。
不同厂家的生产工艺在合理性、可控性和稳定性方面存在一定差异,如个别厂家的同批药品重量差异较大,在检验中发现有2批次样品重量差异项虽符合规定,但均有1 片超出限度(但不超过1 倍),说明其生产工艺稳定性相对较差;有1批次样品阿奇霉素含量接近标准规定的低限值,1 批接近高限值,总体占比为4.65%。可见,生产企业应严格把握好原料药的质量关,精准控制原料药投量。
阿奇霉素分散片现行国家标准中,有关物质项下关于阿奇霉素B 的定位为相对保留时间约为1.53 处的色谱峰,43批次样品仅有2批次在定位位置检出了阿奇霉素B 峰,出现了漏判。本研究中考察了6 种不同品牌(2种规格)的色谱柱,结果采用3种200 mm柱长的色谱柱进行检验时,3 次检验中有2 次阿奇霉素B 的保留时间超出范围;采用3 种250 mm 柱长的色谱柱进行检验时,3 次检验阿奇霉素B 的保留时间均在范围内,表明色谱柱为影响色谱峰保留时间及阿奇霉素B 检出的重要因素,而柱长是影响检验结果的关键因素。
本研究中建立的新的有关物质测定方法采用了特定杂质峰对照保留时间定位的方法,结果43 批次样品中均检出了阿奇霉素B,极大地提高了检出率,保证了药品质量。但有2 批次样品阿奇霉素B 偏高(1.9%,1.8%),接近限值(2.0%),生产厂家应引起重视,加强基础研究和生产管理。
综上所述,本研究中建立的方法操作简便、专属性强,线性关系考察和重复性试验结果,以及确定的检测限均满足规定要求,可作为阿奇霉素分散片有关物质的检验方法。

