FACS AriaⅢ细胞分选参数选择及条件优化
沈链链, 刘艳青, 管强东
(南京医科大学 公共卫生学院, 江苏 南京 211166)
流式细胞分选(Fluorescence-activated cell sorting,FACS)是一项应用于生物医学领域的细胞分离与纯化技术[1]。目前常规细胞分选除了流式细胞分选技术外,还有密度梯度离心法和免疫磁珠分离法。相对于其他两种技术,流式细胞分选技术具有高通量、分选速度快、分选细胞纯度高活性好等技术优势[2-4]。随着细胞生物学和生物医学工程技术的发展,流式细胞仪已成为科研领域和临床诊断中不可缺少的设备[5]。在PubMed上使用“Fluorescence-activated cell sorting”作为关键词检索文献,有关流式细胞分选方面的文献与日俱增,如图1所示,由此可见流式细胞分选仪得到了越来越多使用和研究。
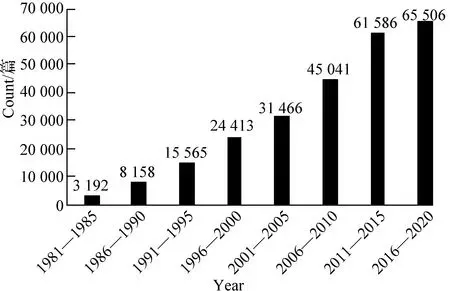
图1 PubMed上检索“Fluorescence-activated cell sorting”文献统计Fig.1 Search for “Fluorescence-activated cell sorting” literature statistics on PubMed
流式细胞分选仪在实际运行中受到多种因素的制约,如仪器性能、操作手法和细胞状态[1, 6],并且分选的每个步骤和仪器参数的设置都会对细胞的活性、纯度以及分选速度产生较大影响[7]。目前有研究报道不同型号的喷嘴以及分选模式均会对细胞的纯度及活性有较大的影响[2, 8-9]。分选主要分为试管式分选和96孔板分选,对于试管式分选来说,得率、纯度和活性这3个主要评价指标很难同时兼顾,应根据后续实验的要求采用不同的分选方案。对于96孔板分选来说,单细胞入孔率和克隆形成率是2个重要评价指标,已有研究表明不同分选条件对单细胞入孔率和克隆形成率有较大影响[8],同一条件下对于不同样本的单细胞入孔率和克隆形成率也有较大差异[10],应采用合适的分选方案才能同时保证单细胞入孔率和克隆形成率。
样本的制备(主要是细胞浓度及状态、活性),流式细胞仪参数、喷嘴尺寸的选择是保障高分选效率和高分选纯度的重要因素,但这需要丰富的经验和一定的技巧,而目前相关报道很少,只有一些理论或经验之谈,缺乏系统的研究。因此,有必要结合实际情况系统地研究各个环节对分选产生的影响,结合实验数据针对不同的样本及需求制定符合实际工作且高效个性化的分选方案,为后续工作提供高质量符合要求的细胞。胃癌细胞BGC-823是一种低分化的并且被广泛使用的贴壁上皮样细胞,其大小适中、状态稳定、可传代次数好。因此文章以BGC-823细胞为例,探索流式细胞分选的参数选择和条件优化。
1 材料与方法
1.1 材 料
FACS AriaⅢ流式细胞分选仪,Accudrop微球和鞘液(均为美国Becton Dickinson公司);荧光倒置显微镜(日本Nikon公司);胰酶、培养基以及细胞培养所需材料(均为美国Thermo Fisher公司)。
1.2 方 法
1.2.1 样品制备
稳定转染绿色荧光蛋白(GFP)的BGC-823细胞用胰酶消化,离心后用无血清培养基将细胞浓度分别调整为1×106,5×106,1×107个/mL,用筛孔尺寸为50 μm的滤网过滤于流式管中。
1.2.2 仪器调试
打开仪器开关以及电脑软件,安装提前超声处理过的85 μm或100 μm喷嘴,点击Stream启动主液流,液流稳定后调节振幅Ampl和频率Freq,使液流断点处于窗口中上部,并使Gap值趋于稳定。点击Sweet Spot键,使液流稳定在设定状态。配制Accudrop微球,点击Auto Delay自动调试液滴延迟时间,侧液流液滴比例99%以上为最佳。
1.2.3 96孔板单细胞分选
在Device Setup界面选择96孔板,并点击Go to Home键使载物台移动到默认位置,加装96孔板,调节左侧液流使其从防溅孔中心穿过并落在A1孔盖板中心位置,若未落在A1孔中心,则对载物台位置进行调节。为了精确定位,还需将细胞预分选到孔板盖上,选取96孔板每一排的前中后3个孔,每个孔分选50个细胞,分选完后观察盖板上的液滴是否在每个孔的中心位置,若不在则需要微调载物台位置。位置调节完后,取下盖板,每个孔预先加入150 μL培养液,用single cell模式每个孔分选1个细胞。用同样方法对85 μm和100 μm喷嘴,以及不同浓度1×106,5×106,1×107个/mL的细胞进行分选。分选完成后,立刻盖上盖板,4 h后,在荧光显微镜下观察微孔中细胞群落中绿色荧光较亮的单个细胞的孔数,再放入培养箱,培养7 d后观察克隆形成的情况。
1.2.4 试管式分选
安装试管分选架,在流式管中提前加入1 mL培养液,调节侧液流电压使侧液流正好落在流式管中液面的中心位置。先用85 μm和100 μm两种不同喷嘴进行分选,后对1×106,5×106,1×107个/mL 3种浓度以及用4-way purity,purity,yield,initial和fine tune 5种模式进行分选。每一次分选均分出1×105个细胞,记录分选时间,分选完后按照检测设门的条件回测细胞纯度(记录5 000个细胞),将剩余细胞均匀地铺在60 mm的培养皿中放入培养箱,培养7 d后荧光显微镜观察细胞生长情况。
1.3 统计学处理
采用SPSS 21.0软件进行统计学分析。数据用均数±标准差(x±s)表示,两两比较采用t检验,多组间比较采用方差分析,P<0.05 为差异有统计学意义。
2 结果与讨论
2.1 喷嘴的选择
不同直径的喷嘴对96孔板分选的单细胞入孔率和克隆形成率都有一定影响,以及对试管式分选的纯度和活性也有影响。不同喷嘴分选后结果见表1,分选培养后细胞状态如图2所示。用85 μm喷嘴进行96孔板分选时平均单细胞入孔率为(72.9±1.8)%,平均克隆形成率为(46.2±3.9)%,进行试管式分选后平均纯度为(71.3±1.8)%,培养7 d后细胞形态完整,有克隆形成,荧光相对较弱;用100 μm喷嘴进行96孔板分选时平均单细胞入孔率为(74.6±1.6)%,平均克隆形成率为(54.0±1.8)%,进行试管式分选后平均纯度为(81.1±1.7)%,培养7 d后细胞状态较好,细胞数量较多,荧光较强。统计数据为3次独立重复实验的平均值±标准误差。
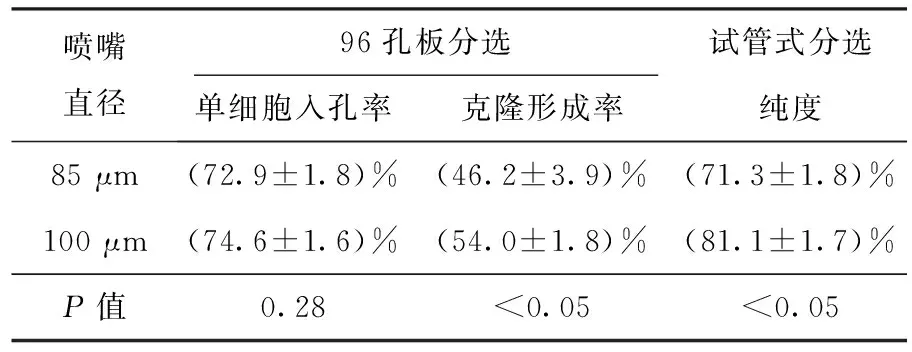
表1 不同喷嘴分选后结果比较Table 1 Comparison of the results of different nozzles after sorting

(a) 85 μm
(b) 100 μm图2 85 μm喷嘴和100 μm喷嘴试管式分选培养后细胞状态Fig.2 Cell states after different nozzle test-tube sorting and culture with 85 μm and 100 μm nozzle
2.2 细胞浓度的选择
不同浓度的细胞对分选的效率和纯度有一定的影响。对浓度为1×106个/mL细胞进行96孔板分选时,平均单细胞入孔率为(74.6±2.6)%,平均克隆形成率为(56.3±2.1)%,进行试管式分选后平均纯度为(82.4±1.2)%,分选时间为(24.7±1.3) min,培养7 d后细胞状态较好,克隆形成较多,荧光较强;对浓度为5×106个/mL细胞进行96孔板分选时平均单细胞入孔率为(74.6±1.6)%,平均克隆形成率为(54.0±1.8)%,进行试管式分选后平均纯度为(81.1±1.7)%,分选时间为(5.0±0.5) min,培养7 d后细胞状态较好,克隆形成较多,荧光较强;对浓度为1×107个/mL细胞进行96孔板分选时平均单细胞入孔率为(70.5±2.2)%,平均克隆形成率为(52.7±1.8)%,进行试管式分选后平均纯度为(77.6±1.7)%,分选时间为(3.3±0.2) min,培养7 d后细胞状态较好,有克隆形成,荧光较弱。统计数据为3次独立重复实验的平均值±标准误差,见表2和图3。
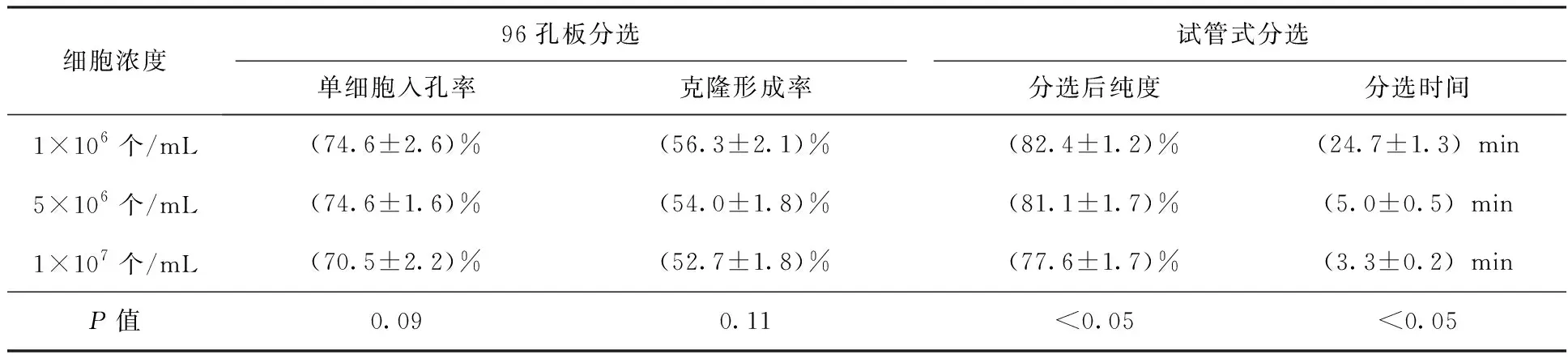
表2 不同浓度细胞分选后结果比较Table 2 Comparison of the results of different concentrations of cells after sorting

(a) 1×106个/mL

(b) 5×106个/mL
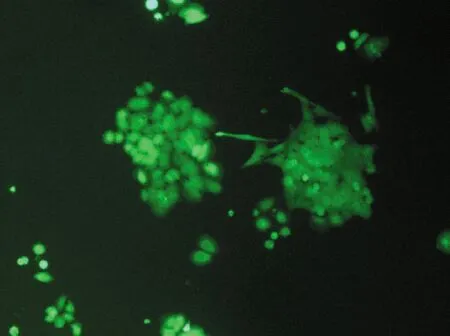
(c) 1×107个/mL图3 不同浓度细胞试管式分选培养后的细胞状态Fig.3 Cell states at different concentrations after test-tube sorting and culture
2.3 试管式分选模式的选择
不同的分选模式影响分选效率和分选纯度。用4-way purity,purity,yield,initial和fine tune 5种模式进行分选后平均纯度分别为(81.1±1.7)%,(80.4±1.1)%,(77.3±2.5)%,(76.4±1.0)%,(80.6±1.4)%。培养7 d后,4-way purity,purity和fine tune 3种模式细胞状态较好,克隆形成较多,荧光较强;yield和initial 2种的模式细胞形态完整,有克隆形成,但荧光较弱。统计数据为3次独立重复实验的平均值±标准误差,见表3和图4。

表3 不同分选模式细胞分选后结果比较Table 3 Comparison of the results of different sorting modes after cell sorting
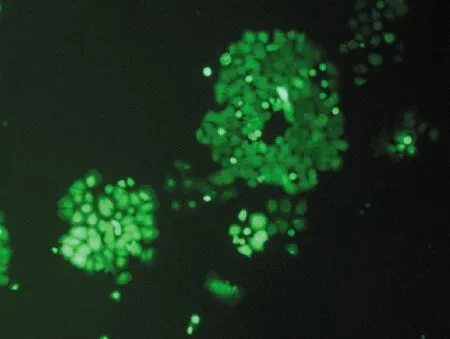
(a) 4-way purity
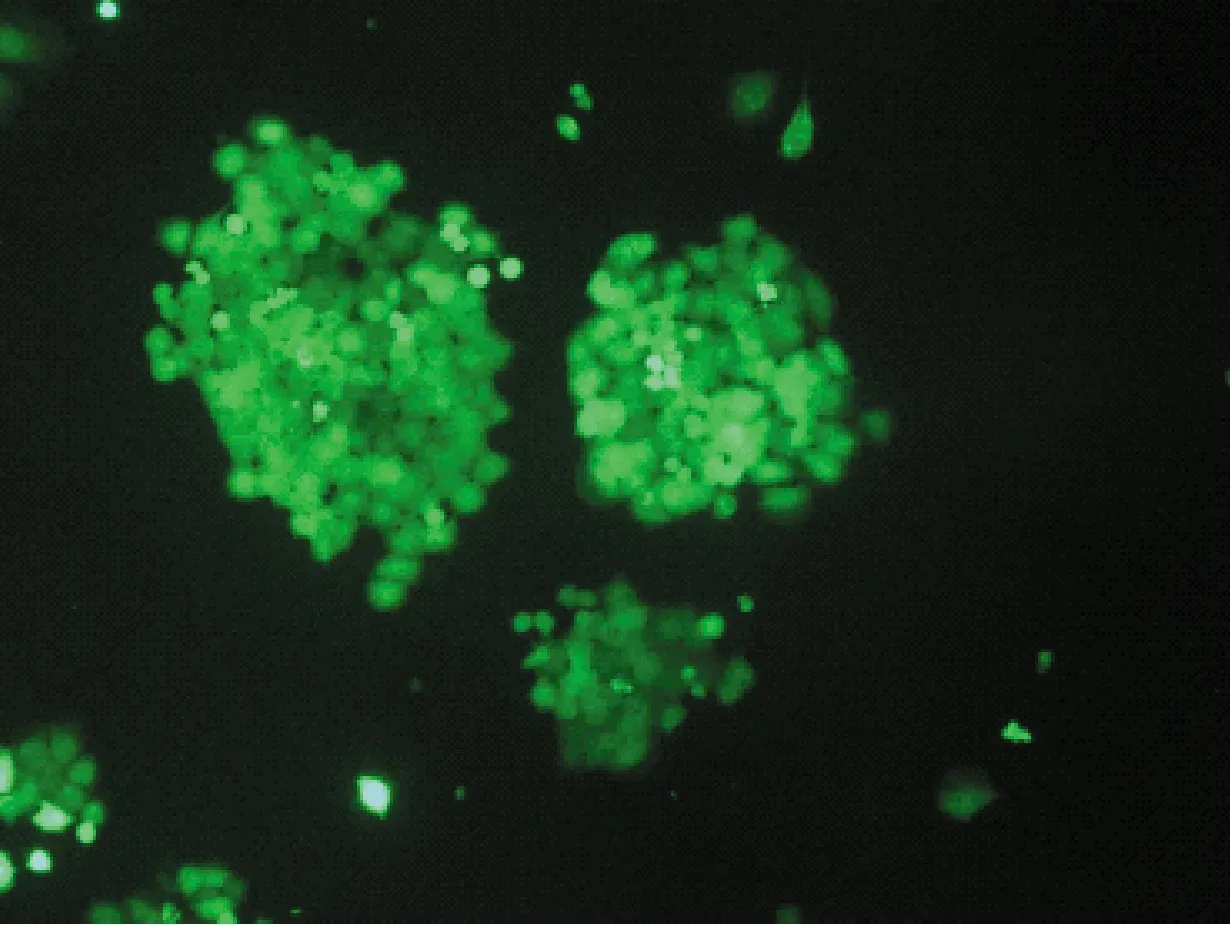
(b) Purity
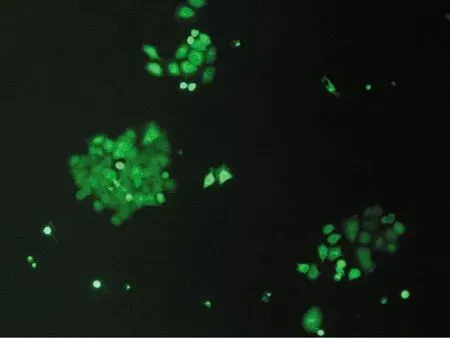
(c) Yield
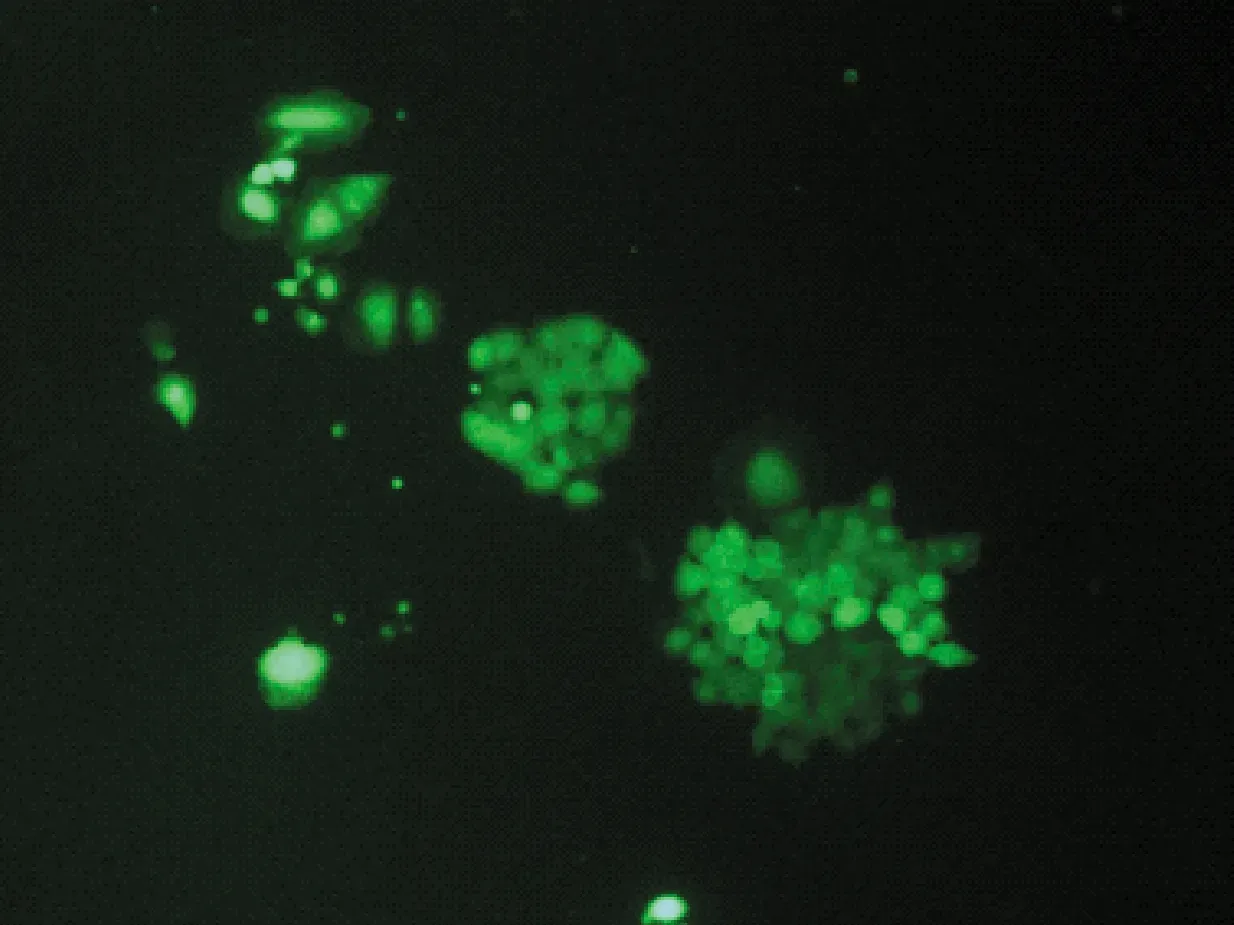
(d) Initial
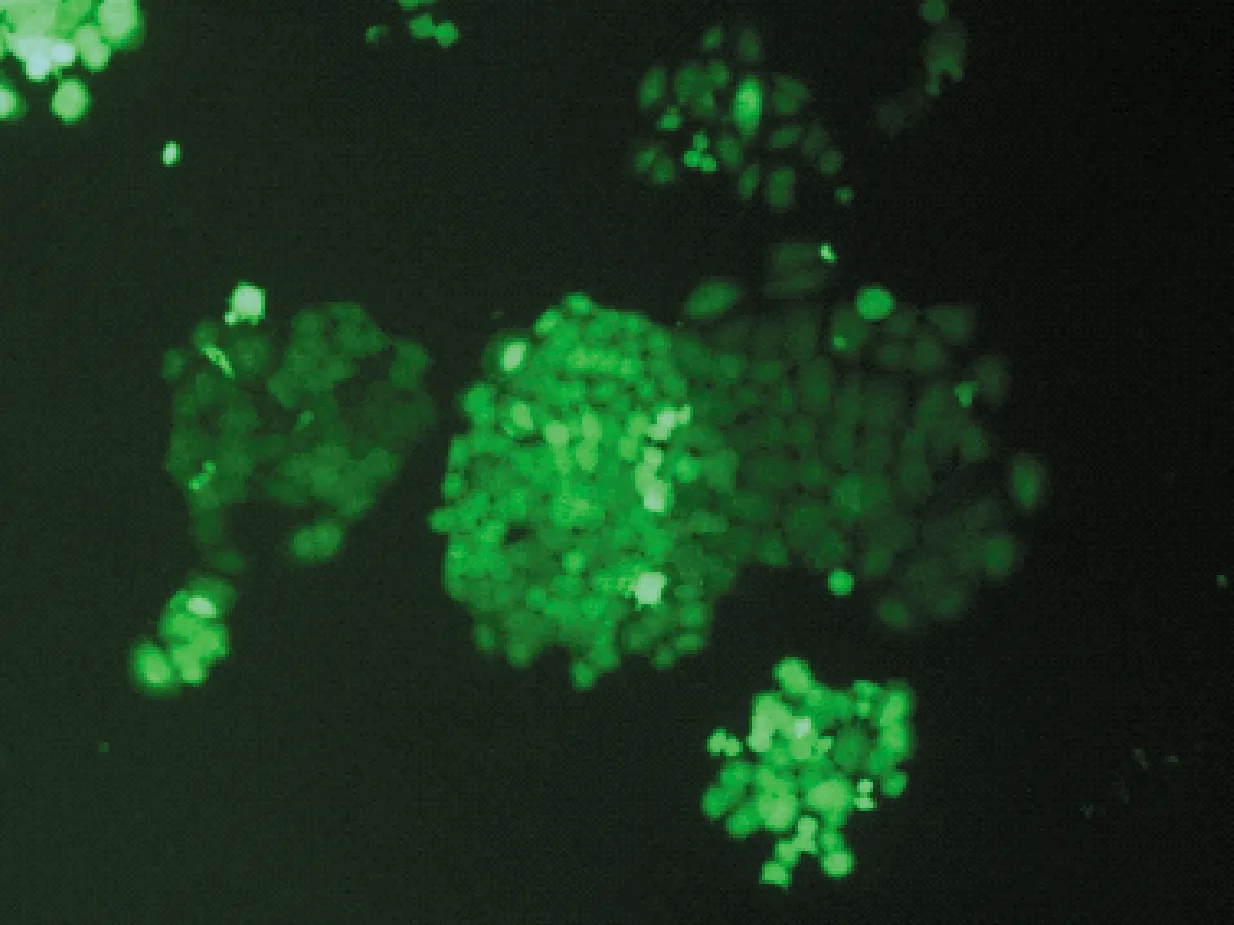
(e) Fine tune图4 不同分选模式试管式分选培养后细胞状态Fig.4 Cell states in different sorting mode after test-tube sorting and culture
3 讨 论
流式细胞分选技术以高通量、耗时短、多参数、无污染等优势被广泛用于细胞的分选和纯化,其分选后的细胞能继续培养或者直接用于移植、提取核酸、原位杂交、单细胞PCR扩增等[9, 11-13]。流式细胞分选仪是通过振荡的喷嘴将液流分裂成均匀的小液滴,原则上每个液滴只包含一个细胞,通过仪器的多参数设置,包含目的细胞的液滴可被充以正负电荷,当液滴流经电压偏转板时发生偏转落入微孔板或收集管中[5, 14]。
流式细胞分选的结果受多种因素的影响,如仪器的状态、样品的状态、喷嘴的选择和分选模式的选择。仪器状态对分选结果影响较大的主要有液流的连续性和稳定性以及液滴延迟的调节。液流的不稳定以及调节不当会使仪器无法正确抓取目标细胞,从而降低分选效果。为保证液流的连续性和稳定性应做到以下几点:每次开机前,首先要检查鞘液过滤器,若过滤器中有气泡应先排除气泡,若过滤器堵塞要及时更换;其次要对喷嘴进行超声清洗防止喷嘴小孔堵塞,安装喷嘴时保证O型密封圈的密封性,不要大幅度上下移动;清洁电压偏转板确保无盐结晶残留;观察流动室有无气泡,若有气泡可以反复开关液流启动按钮排除气泡;根据不同的喷嘴设定准确适当的振幅Ampl和频率Freq值;开启液流后要使液流稳定30 min,排除环境因素导致的液流不稳定。液滴延迟是细胞从被检测到被分选所经过的时间差,要实现精确的分选,则必须得到准确的液滴延迟值。虽然FACS AriaⅢ流式细胞分选仪具备自动调试液滴延迟的功能,但在调试前应使4路模拟分选液流能被激光均等照亮,否则会使分液流和中心液流照度不同,从而影响液滴延迟的设置[1]。
喷嘴的选择是分选的基础,一般要求喷嘴的直径为样本细胞直径至少3倍以上,小喷嘴对应的流速和振荡频率较大,形成的液滴小而多,可能存在液滴对细胞包裹不全的情况,导致分选后细胞受损甚至形成细胞碎片;大喷嘴形成的液滴较大,分选时形成的鞘液压力更低,但是会存在一个液滴包裹多个细胞的情况,在某些分选模式下会影响细胞的回收率。综合考虑之下,85 μm和100 μm喷嘴使用较多,研究中探讨这两种喷嘴对BGC-823细胞分选的影响。85 μm和100 μm喷嘴单细胞入孔率都在70%以上且没有差异,但是85 μm喷嘴克隆形成率只有46.2%,相对较低。这可能和鞘液的压力有关,85 μm喷嘴的鞘液压力为0.31 MPa,而100 μm喷嘴的鞘液压力只有0.17 MPa,大的鞘液压力影响了细胞活性从而会导致克隆形成率的下降。用85 μm喷嘴进行试管式分选后的细胞纯度只有71.3%,相对100 μm喷嘴的81.1%较低。大的鞘液压力不仅会使细胞活性降低甚至会使部分细胞受损从而形成细胞碎片导致分选后纯度降低。
样本的制备(主要是细胞浓度及状态、活性)对细胞分选的结果也起着关键性作用。有研究发现浓度越小的细胞悬液,其液流越稳定,并且单位时间内有更少的细胞被检测,提高了细胞检测的灵敏度,从而提高了分选的效率和纯度[8, 15]。研究探讨1×106,5×106,1×107个/mL 3种浓度对BGC-823细胞试管式分选和微孔板分选的影响。3种浓度对微孔板分选结果影响不大,单细胞入孔率都在70%以上,克隆形成率都在50%以上,这可能与分选模式有关,微孔板分选一般选用single cell模式,这种模式可以准确分选计数并且能更好地分选只包含单个目标细胞的液滴。但对试管式分选来说分选后细胞纯度存在差异,细胞浓度越高分选后细胞的纯度越低,高浓度的细胞液流越不稳定,并且细胞越容易聚集从而进一步影响分选结果。然而并不是细胞浓度越低越好,对于1×106个/mL和5×106个/mL这2种浓度的细胞来说,分选后细胞纯度差别并不大,但是分选所用时间相差很大,1×106个/mL浓度的细胞分选需要24.7 min,而5×106个/mL浓度细胞分选只要5.0 min,综合考虑选用5×106个/mL浓度细胞进行分选能在保证纯度的前提下大大提高了分选效率。除细胞浓度外,细胞的状态和活性对分选结果也有一定影响,分选对样本的要求是高活性、低杂质、少聚集的单细胞悬液。因此最好选用新复苏的、处于对数生长期并且活性好的细胞。在黏附细胞的单细胞样本准备时,需要用胰酶消化使细胞黏附降低从而分离,在此消化过程中时间过长或过短都会影响细胞样品的质量,对于容易聚集的黏附力强的细胞,可以适当加入EDTA来有效防止细胞的聚集。
FACS AriaⅢ流式细胞分选仪具有6种分选模式,分别是single cell,4-way purity,purity,yield,initial和fine tune,每种模式对应着不同的算法。single cell模式能准确分选计数,适用于微孔板分选。purity和4-way-purity模式是保证纯度的模式,他们只对包含目的细胞的液滴进行分选,而对掺有非目的细胞的液滴不进行分选,这可能导致细胞回收率的下降。purity常用于2路分选;4-way-purity常用于4路分选,能避免中间2路纯度受影响;yield模式更注重于细胞的回收率,会使非目标细胞误选,导致分选的纯度较低;initial模式为drop delay设定粗调模式;fine tune为drop delay设定细调模式。本研究中4-way purity,purity和fine tune这3种模式细胞分选后纯度较高,而yield和initial模式细胞分选后纯度相对较低。分选模式根据分选的目的来定,一般高富集实验要求高纯度的,多选用4-way purity或purity模式,对于后续实验对纯度要求不高并且细胞数较少的情况下,为保证细胞回收率可以选择yield模式。
4 结 论
对于和BGC-823细胞大小类似的贴壁肿瘤细胞而言,96孔板分选可采用100 μm喷嘴和5×106个/mL细胞浓度能获得更高的单细胞入孔率和克隆形成率;而对于试管式分选采用100 μm喷嘴、5×106个/mL细胞浓度和4-way purity模式将获得更高的分选后细胞纯度。研究以BGC-823细胞分选条件的优化为例,为FACS Aria Ⅲ流式细胞分选仪细胞分选参数的选择以及条件的优化提供了一定的参考,为后续工作开展及顺利进行做充分保障。

