基于“证据推理”建构沉淀溶解平衡的深度认识路径
王玲 邢东阳 曾仲献 李金燕


摘要:从广东学业水平选择性考试(化学)题目涉及的问题切入,针对人教版“沉淀溶解平衡”单元教材编排内容的预留空间,借助数字化电导率传感器实验平台建构沉淀溶解平衡的存在及影响因素的直观证据,通过驱动性问题的设计与证据推理,帮助学生发现沉淀溶解平衡的特殊性并建构沉淀溶解平衡移动的思维模型,展示难溶盐溶解度的测定方法。通过实验探究,将具体知识的学习、观念的建构和问题的解决有机结合起来,深度发展学生的微粒观、平衡观、定量观和证据推理等核心素养。
关键词:电导率传感器;沉淀溶解平衡;难溶盐溶解度的测定
文章编号:1008-0546(2022)07-0073-04中图分类号:G632.41文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.07.018
一、问题的提出
2021年广东学业水平选择性考试(化学)17题考查通过测定一定温度下饱和 AgCl 溶液的电导率,探究温度对AgCl溶解度的影响。试题以信息的形式给出:“电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。”考查学生在陌生情境中基于控制變量的实验设计能力、信息领悟能力、利用信息与实验现象合理推理关联,探究目的与探究结论之间的逻辑关系能力等。该试题属于原创性试题,它巧妙地将大学物理化学中的难溶盐溶解度的测定方法融入试题,但试题设问点考查的内容完全符合高中化学学业水平选择性考试要求;但本题中涉及一个相对陌生的物理量“电导率”,还涉及温度对AgCl 溶解度的影响,其实质就是对 AgCl 沉淀溶解平衡的影响,现阶段高中教材“沉淀溶解平衡”单元内容对难溶物的溶解度的介绍仅停留在“很小”层面,虽然教材77页表3-3中直接列出几种难溶电解质20℃时的溶解度来体现“很小”,但教材中没有介绍难溶物的溶解度是如何测出来的,也没有直观的实验素材佐证“很小”的存在;另外该单元的教材中没有直接提到沉淀溶解平衡的外界影响因素,这样的内容编排给教学实施过程留下了很大的思考与探索空间。沉淀溶解平衡是对平衡理论的丰富与完善,但沉淀溶解平衡的移动与溶液中的其他平衡又有不同之处,不能完全依靠“勒夏特列原理模型”进行分析。该试题的出现为一线教师的教学思考和研究方向提供了重要的指引,基于此,本文将利用数字化电导率传感实验平台,显性建构沉淀溶解平衡的存在及特殊性的认识素材,半定量反映沉淀溶解平衡的外界影响因素,展示难溶物溶解度的测定方法;通过实验探究,将具体知识的学习、观念的建构和问题的解决有机结合起来,深度探讨沉淀溶解平衡理论,发展学生的微粒观、平衡观、定量观和证据推理能力等核心素养。
二、实验探究与证据推理
1.基于电导率传感器建构沉淀溶解平衡认知过程
难溶物的溶解量“很小”,在教学中如果没有直观的实验素材佐证,学生的认知观念仅能停留在机械的记忆层面,也不利于微粒观的建构。在教学中借助数字化电导率传感器实验平台,设计如下实验1,证明难溶物少量溶解的存在,同时证明溶解平衡的存在及溶解平衡移动的特殊性。
实验1:在常温下,测定100 mL 蒸馏水的电导率,然后向其中加入少量AgCl 固体;观察电导率的变化,当电导率不变时,再向其中加入10 mL蒸馏水,观察电导率的变化;继续向其中加入10 mL蒸馏水,再次观察电导率的变化。实验装置及实验结果如图1、图2所示。
在教学中根据图2实验结果我们可以带领学生讨论以下问题。
①将AgCl溶于水后,溶液电导率增大,说明什么?
②一段时间后,电导率为什么保持不变?
③在 c 点加入10 mL蒸馏水,电导率为什么先减小后增大?一段时间后,为什么又保持不变?电导率保持不变时,AgCl 的溶解停止了吗?
④在 e 点再加入10 mL蒸馏水,为什么会重复出现上述现象?
⑤认真观察c点、e点、g点的电导率值是否相等,为什么?
在实验与解决这些问题的过程中,学生的认知是根据真实的实验现象,进行合理的推理,感受到微观粒子在溶液中的运动变化而建构出沉淀溶解平衡的基本原理,发展并完善学生对平衡理论的认知结构,提升学生的微粒观与逻辑推理能力。学生观察到 c 点、e 点、g 点的电导率值基本相等,说明此时溶液中 AgCl 的浓度相等,这一现象表明在温度一定时,加水稀释沉淀溶解平衡向沉淀溶解的方向移动,而且只要有固体存在,最终AgCl 的平衡浓度将等于起始平衡浓度,这一结论与“勒夏特列原理”中的“减弱但不能消除”有矛盾之处,这正是沉淀溶解平衡的特殊性——沉淀溶解平衡一定是指定条件下的饱和溶液,也就是说沉淀溶解平衡移动的方向一定是向着建立饱和溶液的方向。本质因素是沉淀溶解平衡属于异相平衡,固体的量不影响平衡。
2.基于电导率传感器建构沉淀溶解平衡的影响因素
溶液中的平衡体系,一般探究温度和浓度两个因素对平衡的影响。但对于沉淀溶解平衡来说,学生受最初接触难溶物认知概念的影响,习惯提出“哪些沉淀能溶于酸,哪些沉淀不能溶于酸?”这样的问题。显然学生的认识水平是浅层次的记忆而不是通过分析沉淀溶解平衡移动的因素把握沉淀“溶”与“不溶”本质规律的深度学习。基于此,本文研究了温度、酸度、浓度(同离子效应)三个因素对沉淀溶解平衡的影响。
根据试题已知25℃,Ksp (AgCl)=1.8×10-10,则饱和溶液中 c(Ag+) =c(Cl-) ≈1.34×10-5mol/L,纯水中 c( H+) =c(OH-) ≈1.0×10-7mol/L,因此溶剂水的电离对难溶盐电导率的影响不能忽略,用电导率传感器可以测出 AgCl 饱和溶液的电导率κ值,AgCl 溶液实际的κ(AgCl)=κ(AgCl 溶液)-κ(H2O)[1]。
(1)实验内容
实验2:AgCl 固体的制取
分别取20 mL 0.1 mol/L NaCl 和 AgNO3溶液将其混合,生成 AgCl 白色沉淀,充分搅拌后采用倾泻法过滤,用蒸馏水洗涤、过滤直至洗出液用0.1 mol/L AgNO3溶液检测不出 Cl-为止,将 AgCl 固体浸泡在少量蒸馏水中待用。
实验3:探究温度对AgCl溶解度的影响
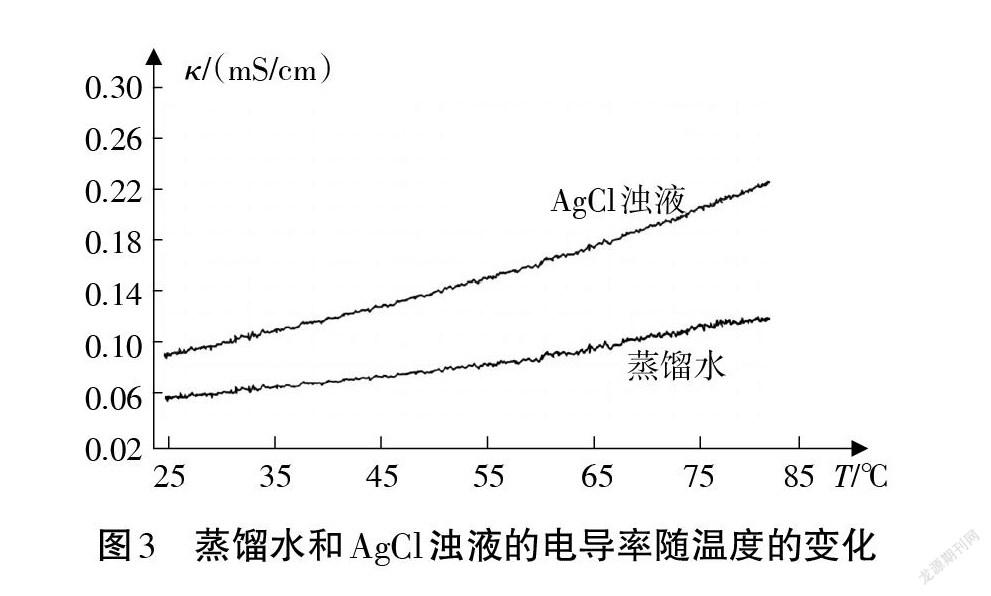
分别取40 mL蒸馏水和AgCl浊液于两个50 mL烧杯中,用图1实验装置双通道同时分别测定不同温度下蒸馏水和AgCl浊液的电导率,温度范围为25-84℃ (温度高于84℃时,因液体接近沸腾,气泡的产生会干扰传感器的灵敏度)。实验结果如图3所示。
在教学中根据图3我们可以带领学生讨论以下问题:
①温度对AgCl 的沉淀溶解平衡有无影响?如果有,是如何影响的?说明理由。
②温度为什么会影响沉淀溶解平衡?
温度影响沉淀溶解平衡,其本质原因是温度升高,微观粒子的热运动加剧,导致溶质分子(或离子)间间隙变大,相当于降低了溶质分子(或离子)的有效浓度,沉淀溶解平衡向沉淀溶解的方向移动,固体溶解度变大。
实验4:探究酸度对AgCl溶解度的影响
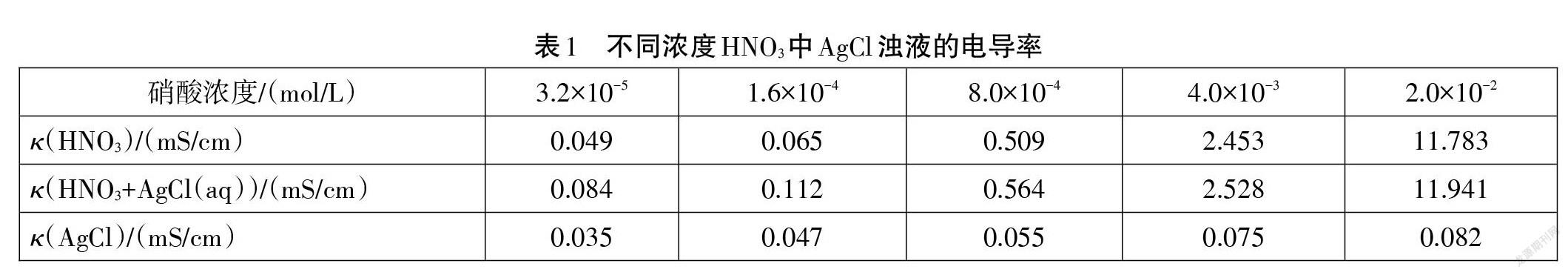
在50 mL 烧杯中加入40 mL 浓度分别为 3.2×10-5 mol/L、1.6×10-4 mol/L、8.0×10-4 mol/L、4.0×10-3 mol/L、2.0×10-2 mol/L 的 HNO3,然后用移液枪分别滴入1 mL AgCl浊液,控制温度30℃,按照图1实验装置进行实验。实验结果记录于表1 中。
在教学中根据表1实验结果我们可以带领学生讨论以下问题。
①硝酸对AgCl 的溶解度有影响吗?如果有,是如何影响的?
②为什么硝酸会影响AgCl溶解度?硝酸与AgCl 能反应吗?
硝酸与AgCl不发生化学反应,就中学的知识范畴来讲,应该不影响AgCl 的沉淀溶解平衡,但实验结果与学生的认识发生冲突,这是为什么呢?《无机化学》上册难溶电解质理论介绍向AgCl饱和溶液中加入易溶强电解质后,溶液中各种离子的总浓度增大,增强了离子间的静电作用,在Ag+的周围有更多的阴离子(主要是 NO3(-)),形成了所谓的“离子氛”;在 Cl-的周围有更多的阳离子(主要是 K+),也形成了“离子氛”,使 Ag+和 Cl-受到较强的牵制作用,降低了它們的有效浓度,因而在单位时间内与沉淀表面碰撞次数减少,沉淀过程变慢,难溶电解质的溶解过程暂时超过了沉淀过程,平衡向沉淀溶解的方向移动;当建立起新的平衡时,难溶电解质的溶解度就增大了[2],这就是盐效应的作用机理。当然AgCl在硝酸中的溶解度增大也可能是硝酸氧化了Cl-,减小了溶液中Cl-的浓度,导致溶解平衡向溶解的方向移动。
实验5:探究不同浓度NaCl溶液对AgCl溶解度的影响
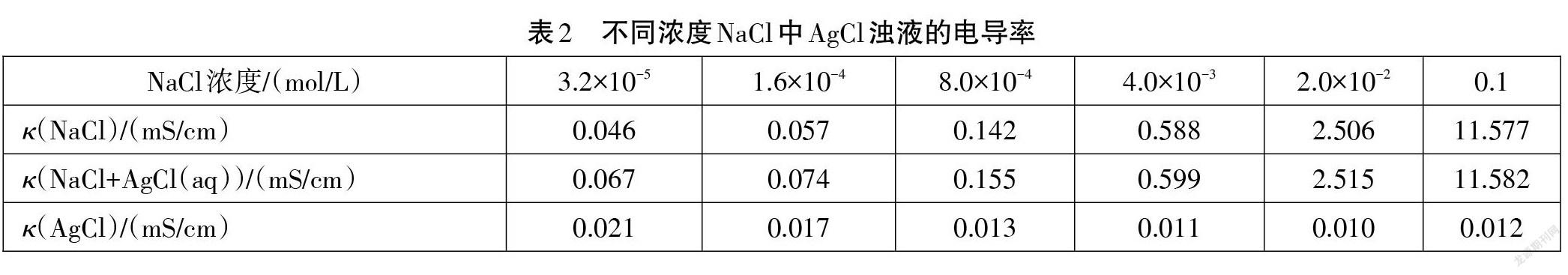
在50 mL 烧杯中加入40 mL 浓度分别为 3.2×10-5 mol/L、1.6×10-4 mol/L、8.0×10-4 mol/L、4.0×10-3 mol/L、2.0×10-2 mol/L、0.1 mol/L 的 NaCl 溶液,然后用移液枪分别滴入1 mL AgCl浊液,控制温度30℃,按照图1实验装置进行实验。实验结果记录于表2中。
在教学中根据表2实验结果我们可以带领学生讨论以下问题。
①NaCl 对 AgCl 的溶解度有影响吗?如果有,是如何影响的?
②为什么AgCl 的溶解度随NaCl溶液浓度增大出现先减小后略增大的现象?
温度一定时,向 AgCl 浊液中加入 NaCl 溶液,因增大溶液中 Cl-的浓度,相对于溶质AgCl来说,c(Cl-) 的值大于饱和浓度,沉淀溶解平衡向析出沉淀的方向移动,即同离子效应;但根据实验4 的探究结论, NaCl 属于易溶强电解质,对 AgCl 的溶解平衡也存在盐效应,会使 AgCl 的溶解度增大;除此之外当溶液中 Cl-的浓度增大到一定程度时会发生配位反应[2]: AgCl(s)+Cl-(aq)AgCl2(-)(aq),增大AgCl 的溶解度;根据实验结果可以推出,当NaCl溶液的浓度较小时,同离子效应起决定作用,AgCl 的溶解度随 NaCl 溶液的浓度的增大而减小;但随着 NaCl 溶液的浓度的增大,盐效应和配位溶解效应也逐渐体现出来,当 NaCl 溶液的浓度达到0.02 mol/L 以后,AgCl 浊液的导电率反而增大,表明AgCl 的溶解度增大,证明配位溶解效应起了决定作用;一般说来,在难溶电解质的溶度积很小时,盐效应的影响很小,可以忽略不计。
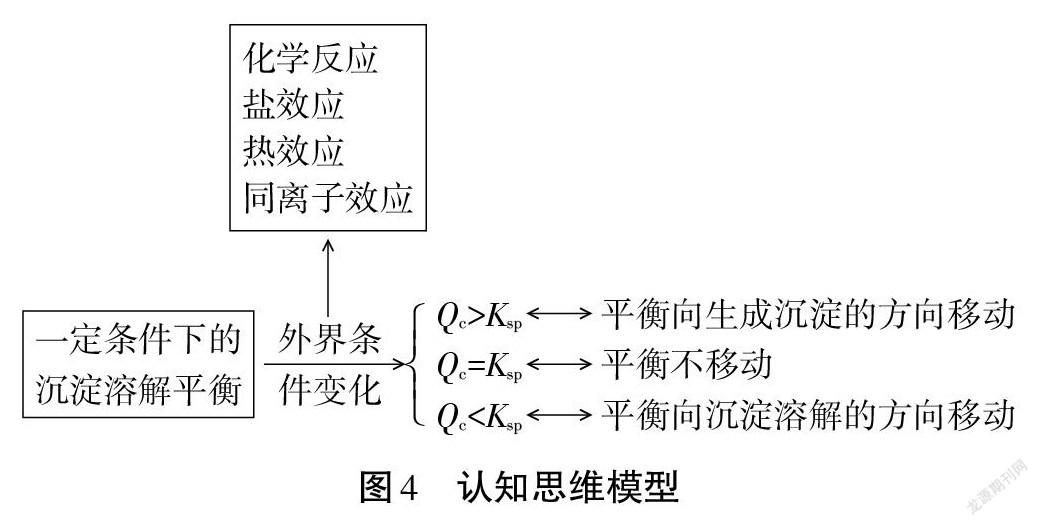
通过对沉淀溶解平衡影响因素的实验探究与问题分析,建构学生对沉淀溶解平衡影响因素的认知思维模型如图4。
三、研究反思
1.重视开展“素养为本”的教学,是《普通高中化学课程标准(2017年版2020年修订)》的基本理念。本研究借助数字化实验,从定性与定量两个角度对难溶物溶解平衡的存在、溶解平衡的特殊性以及溶解平衡的影响因素进行探究,通过设置驱动性问题与问题解决,实现对实验现象的证据收集与推理,从而建立观点、结论和证据之间的逻辑关系,促使深度学习的生成,让素养教学落地生根,该研究可为“沉淀溶解平衡”单元教学设计提供参考。
2.高考评价体系将“引领教学”纳入核心功能,实现“以考促教、以考促学”的目的,促进立德树人根本任务的落实。高考对教学有很大的引领作用。本试题通过大学教材才出现的“电导率”为因变量,探究熟悉物质AgCl 的陌生性质——温度对AgCl溶解度的影响,开阔了教师的视野,同时也激发教师的研究欲望:为什么选择难溶物AgCl 为溶解度随温度变化的研究对象?为什么选择“电导率”为因变量?易溶盐的溶解度测定一线教师较为熟悉,是通过结晶法,而难溶盐溶解度因为“很小”,用常量结晶法是难以测出溶解度随温度的变化情况,更不用说测其溶解度的具体值,因此需要灵敏度更高的实验平台才达到实验目的。本研究可以拓展教师的认知水平,增进教师对“沉淀溶解平衡”单元知识的认识与理解,促进教师专业成长,推动教学的演化进步。
参考文献
[1] 周勇,李章文,李伟.电导法测定碘化铅的溶度积[J]. 化学教育,2013,34(12):74-75,80.
[2] 孟长功.无机化学(第6版)[M]. 北京:高等教育出版社,2018.

