环境中多卤代咔唑的赋存及分析方法研究进展
周珊珊,楼晓峰
(浙江工业大学 环境学院,浙江 杭州 310014)
咔唑(Carbazole,简称为CZ)及其衍生物分子内的电子转移较强并且其共轭体系较大,是一类重要的含氮芳杂环的化合物,被广泛应用于染料、光电材料、合成树脂、农药和医药等领域[1-2]。多卤代咔唑(PHCZ)是指咔唑环上的氢原子被卤素原子(Cl,Br或I)取代的一类化合物,其化学结构与多氯二苯并呋喃相似[3]。1984年,Kuehl等[4]在美国纽约Buffalo River沉积物中首次测得了PHCZ残留。在随后的几十年中,陆续在沉积物、土壤、空气和水体等环境介质中检测到PHCZ,引起人们的广泛关注。
1 多卤代咔唑的特性
目前,研究者根据模型估算及实验室研究分析了PHCZ的持久性、生物积累性和毒性。Mumbo等[5]通过模型计算了CZ和PHCZ的土壤半衰期、生物富集系数(Biological concentration factor,简称为BCF)、对水生生物的长期无影响质量浓度(No observed effect concentration,简称为NOEC)和土壤吸附系数koc,见表1。根据美国环境保护署(USEPA)规定:化合物在土壤中的半衰期大于60 d表示其具有中等持久性,大于180 d表示其则具有高度持久性;BCF≥1 000表示其具有中生物积累性,BCF≥5 000表示其具有高生物积累性;NOEC为0.1~10 mg/L表示其对水生生物具有中等慢性毒性,NOEC<0.1 mg/L表示其对水生生物具有强慢性毒性。1,3,6,8-CCZ和1,3,6,8-BCZ的土壤半衰期为360 d,说明其具有高度持久性,其余几种咔唑为75~120 d,说明其具有中等持久性;1,3,6,8-BCZ的BCF值最大(15 000),说明其具有高度生物积累性,1,3,6-CCZ、1,3,6,8-CCZ和1,3,6-BCZ的BCF值为1 000~5 000,说明其具有中等生物积累性,其余几种咔唑生物积累性较弱;1,3,6-CCZ、1,3,6,8-CCZ、3,6-BCZ、1,3,6-BCZ和1,3,6,8-BCZ的NOEC<0.1 mg/L,说明其具有强水生生物慢性毒性,其余几种咔唑为中等水生生物慢性毒性。
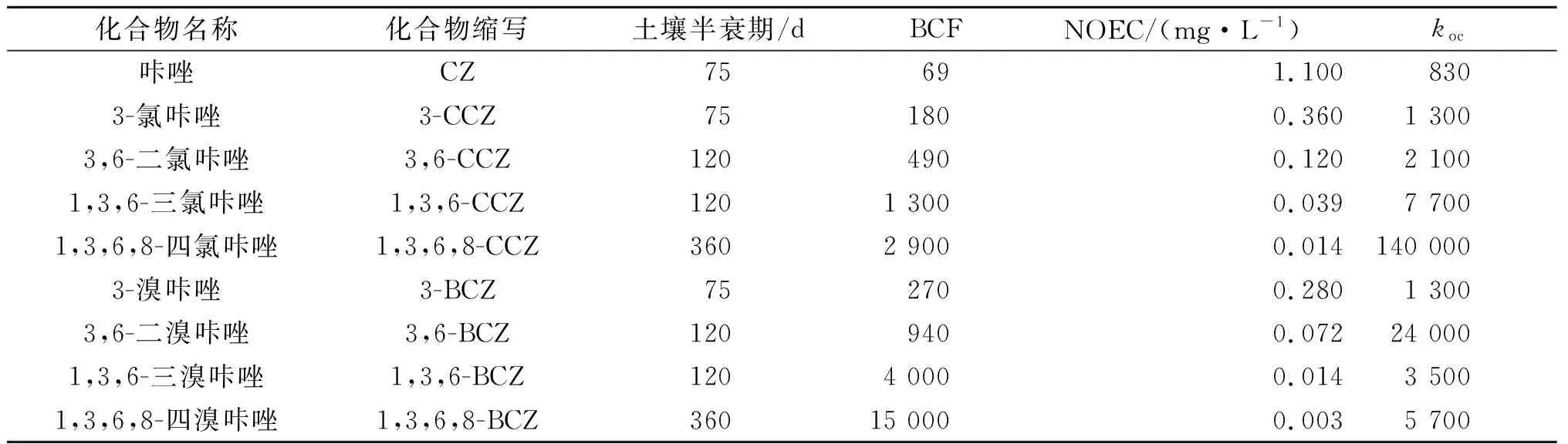
表1 几种常见PHCZ的理化性质Table 1 Physiochemical properties of the frequently detected polyhalogenated carbazoles
PHCZ不仅与多氯二苯并呋喃(Polychlorinated dibenzofuran,简称为PCDF)结构相似,还具有类二噁英毒性。Mumbo等[5]研究表明:3-CCZ、3,6-CCZ和3,6-BCZ对大鼠肝癌细胞(H4IIA)经乙氧基间苯二酚-O-脱乙基酶(Ethoxyresorufin-O-deethylase,简称为EROD)诱导的活性作用明显,证明了这3 种PHCZ具有类二噁英毒性。Fang等[6]通过对斑马鱼胚胎的PHCZ暴露研究,发现纳摩尔级别的2,7-BCZ和2,3,6,7-CCZ对斑马鱼有明显的发育毒性,其表型与二噁英引起的心脏毒性相似,同时微摩尔级别的2,7-BCZ和2,3,6,7-CCZ能够诱导细胞色素P4501A(CYP1A)表达,进一步证明了其具有类二噁英毒性。Ji等[7]利用斑马鱼胚胎评估了2,7-BCZ、3,6-BCZ和3,6-CCZ的环境风险,研究表明2,7-BCZ具有更强的毒性和心脏致畸作用,并表现出部分与芳香烃受体(Aryl hydrocarbon receptor,简称为AhR)激活一致的发育毒性。Ji等[8]利用转基因斑马鱼研究18 种PHCZ的AhR激动剂效应,发现大多数PHCZ都能引起二噁英AhR激动剂效应,改变AhR下游基因的表达水平,并且和2,3,7,8-四氯二苯并对二噁英(2,3,7,8-TCDD)一样,能与AhR相互作用。
PHCZ类物质的环境持久性、生物可积累性及类二噁英毒性提示PHCZ是一种潜在的持久性有机污染物。咔唑及卤代咔唑通式为
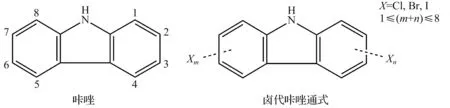
2 环境中多卤代咔唑的来源
目前,环境中PHCZ的来源尚不明确,可能来自自然源,也可能来自人为源[9]。
2.1 人 为 源
卤代靛蓝染料可能是PHCZ的人为来源之一。Kuehl等[4]采集了美国纽约Buffalo River染料厂的沉淀物,检测到了1,3,6,8-BCZ,其质量分数为25 ng/g(以干质量计,以下同),而在远离染料厂的沉积物中1,3,6,8-BCZ的质量分数都低于1 ng/g。Parette等[10]认为1,3,6,8-BCZ和1,8-B-3,6-CCZ等可能是在生产卤代靛蓝染料时产生的副产物,在废物排放或产品的使用过程中进入环境。此外,Parette等[10]还认为在生产7,7’-二溴-5,5’-二氯靛蓝染料过程中有可能形成1,8-B-3,6-CCZ,因为1,8-B-3,6-CCZ的卤素取代模式与7,7’-二溴-5,5’-二氯靛蓝中的卤素取代模式完全一致。Parette等[10]还推测:含对氯苯胺结构的除草剂,如灭草隆和绿谷隆,在施用后能降解产生对氯苯胺,对氯苯胺进一步转化后生成3-CCZ和3,6-CCZ。
2.2 自 然 源
2.1节人为源可以合理解释一部分PHCZ在环境中的残留,但不能解释在所有环境中检测到PHCZ的原因。例如,Mumbo等[5]在德国Oberbayern无历史污染记录的土壤中检测到了CZ、3-CCZ、3,6-CCZ和一种三氯咔唑,这无法用人为源来解释。Zhu等[11]在分析美国Lake Michigan柱状沉积物时发现在1860—1900年柱状样中残留的1,3,6,8-BCZ质量分数为20 ng/g,但1900年之前工业生产溴代咔唑的可能性很小,因此他们认为1,3,6,8-BCZ存在自然源。以上事实都表明环境中的PHCZ存在自然源。
已有研究表明氯过氧化氢酶(Chloroperoxidase,简称为CPO)可在自然环境中催化咔唑发生卤化反应生成PHCZ[12-13]。Mumbo等[12]研究发现从C.fumago提取的CPO能够催化氯、溴离子与CZ反应,生成多种氯或溴代咔唑,包括1~4位取代的氯或溴代咔唑,这给CPO催化生成PHCZ的可能自然源提供了证据。此外,陈艳秋[13]在实验室通过模拟自然环境,过氧化氢、氯和溴离子共同参与,经CPO催化,最终检测到了40 种PHCZ,包括Cl-,Cl2-,Cl3-,Cl4-,Br-,Br2-,Br3-,Br4-,ClBr-,ClBr2-,ClBr3-,Cl2Br-,Cl3Br-,Cl2Br2-取代的PHCZ。
3 多卤代咔唑的在环境中的分布
3.1 多卤代咔唑在沉积物中的分布
现有的对PHCZ在环境中的分布研究绝大多数基于沉积物。沉积物是许多有机污染物迁移、转化和环境退化的重要场所。并且当水环境中的有机污染物质量浓度降低时,沉积物中吸附的有机污染物可以重新被释放到水环境中,造成二次污染等[14-17]。部分区域沉积物中PHCZ的相关研究如表2所示。
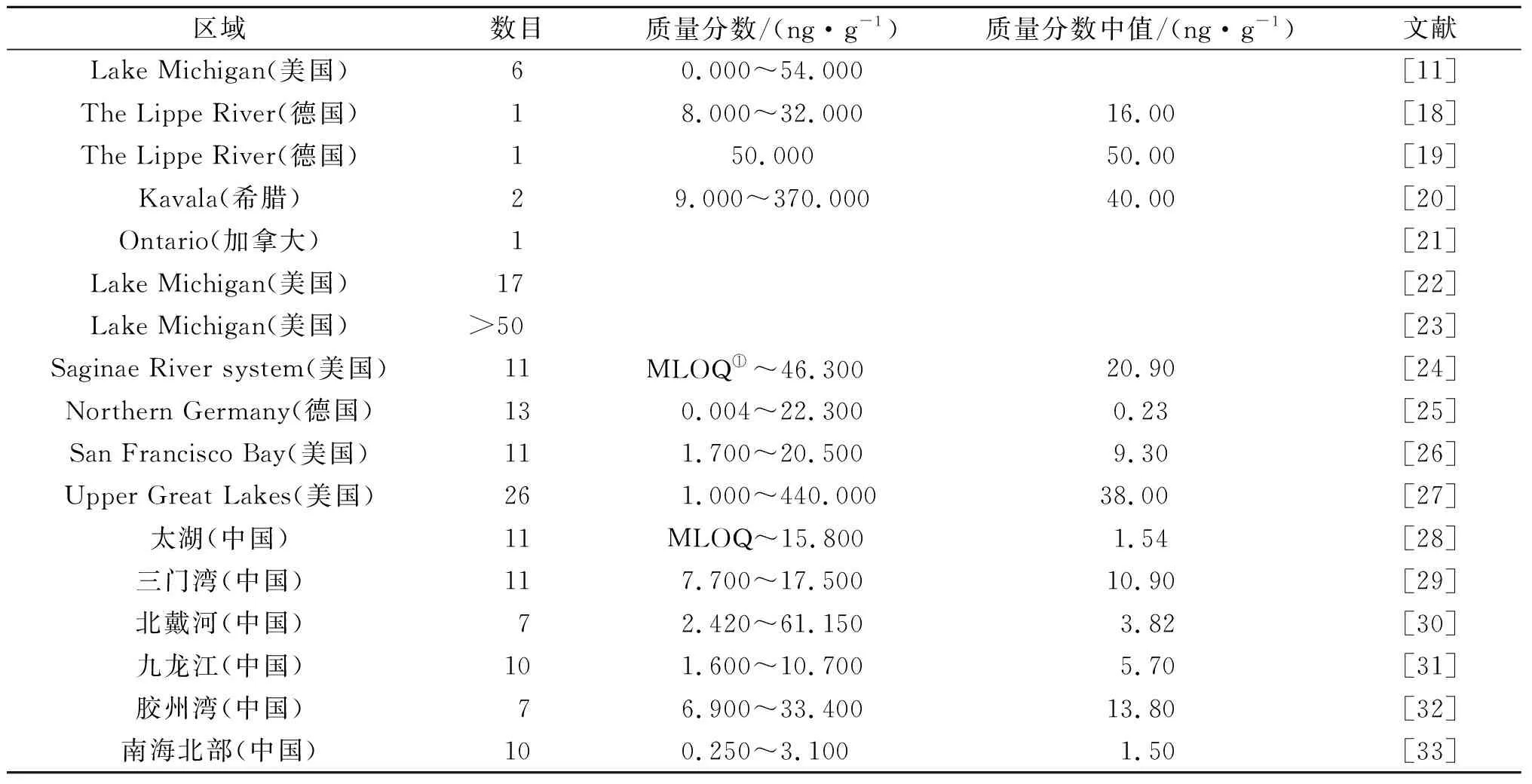
表2 部分区域沉积物中的PHCZTable 2 Previous studies on PHCZ in sediment samples from some areas
环境中的PHCZ在沉积物中首次被发现,随后在不同国家的海洋、河流和湖泊等区域的沉积物中陆续被检测到。1984年,Kuehl等[4]在分析美国纽约Buffalo River沉积物时首次发现了1,3,6,8-CCZ和一种五氯咔唑,1,3,6,8-CCZ的质量分数为0.3~25.0 ng/g。Zhu等[11]采集了美国Lake Michigan的两个柱状沉积物,检测到了1,3,6,8-BCZ和几种结构未确定的三溴、四溴和五溴取代咔唑,1,3,6,8-BCZ的质量分数为54 ng/g;Zhu等[11]还发现1,3,6,8-BCZ的质量浓度在1920—1935年达到顶峰,随后一段时间直至21世纪初,急剧下降。2004年,Heim等[18]采集了德国Lippe River河岸湿地的柱状沉积物,仅在上层沉积物(2~22 cm)中检测到36-CCZ,其残留质量分数为8~32 ng/g,认为36-CCZ可能来源于人为污染。2011年,Grigoriadou等[20]采用气相色谱-串联质谱(GC-MS)非目标筛选分析方法,在希腊Kavala高度工业化沿海地区沉积物(包括海洋和河流沉积物)中检测到了36-CCZ和一种二溴咔唑,质量分数分别高达370 ng/g和93 ng/g。2014年,Pena-Abaurrea等[21]首次报道在加拿大Southern Ontario沉积物中发现了混合卤素取代的PHCZ和1,8-B-3,6-CCZ。同年,Guo等[22]在Lake Michigan柱状沉积物中检测到了17 种PHCZ,包括8 种纯溴取代咔唑和7 种混合卤素取代的卤代咔唑,3,6-BCZ质量分数为1~41 ng/g,1,3,6,8-BCZ质量分数为7~65 ng/g。2015年,Peng等[23]在美国Lake Michigan沉积物中检测到了超过50 种不同氯、溴和碘原子数的卤代咔唑。
随着人们对PHCZ的日益关注,商业上已经有PHCZ的成套参考标准,能够实现对多种PHCZ的准确定量分析。2016年,Chen等[25]调查了未被污染的德国北部河口海洋表层沉积物中CZ、BenzoCZ和13 种PHCZ等的分布情况,结果显示:沉积物中PHCZ的残留量多在pg/g级别,以CZ和BenzoCZ为主(中值分别为565,369 pg/g);其次为3,6-CCZ(中值196 pg/g),所有样品中均有3,6-CCZ检出;再次是3-CCZ,其检出率为78.4%。2017年,Guo等[27]调查了美国五大湖(Lake Michigan,Lake Superior,Lake Huron等)沉积物中26 种PHCZ的分布情况,表层沉积物中26 种PHCZ的总质量分数为1~440 ng/g,中值为38 ng/g,此外,Guo等[27]还估算了五大湖中PHCZ的总积累量超过3 000 t,比多氯联苯和十溴联苯醚的总量(约200 t)大1 个数量级。
之前对沉积物中PHCZ的研究多集中在北美和欧洲[9],近几年来才有关于我国水体沉积物中PHCZ的报道。2017年,Wu等[28]分析了我国太湖沉积物中11 种PHCZ的分布情况,11 种PHCZ的总质量分数为MLOQ~15.8 ng/g,中值为1.54 ng/g,沉积物中以3,6-CCZ和3,6-BCZ为主,且只有一个采样点没有PHCZ检出,这是第一次在亚洲水体环境中调查PHCZ。2019年,Qiu等[29]调查了中国东海三门湾表层沉积物的11 种PHCZ及CZ的分布情况,11 种PHCZ总质量分数为7.7~17.5 ng/g,中值为10.9 ng/g,组成分布显示3,6-CCZ占主要,与CZ的质量分数相当;三门湾中PHCZ的质量分数与同一地点POPs的质量分数相当,其中多氯联苯PCBs为9.3~19.6 ng/g,有机氯农药OCPs为3.0~7.4 ng/g,双对氯苯基三氯乙烷DDTs为0.7~3.0 ng/g和六氯环己烷HCHs为0.4~1.0 ng/g。2019年,Zhang等[30]检测了北戴河湿地新河口潮间带中表层沉积物中7 种PHCZ的质量分数,7 种PHCZ的总质量分数为2.42~61.15 ng/g,中值为3.82 ng/g,沉积物中3-BCZ和3,6-BCZ占主要(占比分别为30.92%,25.52%);通过相关公式估算得到新河口潮间带沉积物中PHCZ总存量为902.28 kg,其中3-BCZ为279.23 kg,3,6-BCZ为229.95 kg。Zhou等[31]利用超高效液相色谱-串联质谱联用仪(UPLC-MS/MS)建立了沉积物中PHCZ的检测方法,并测定了福建九龙江表层沉积物中CZ及10 种PHCZ的质量分数,10 种PHCZ的总质量分数为1.6~10.7 ng/g,中值为5.7 ng/g;除3-BCZ外,1,3,6,8-BCZ、1,8-B-3,6-CCZ、CZ和其他PHCZ在所有样品中均被检测到。2021年,Zhou等[33]报道了中国南海北部28 个表层沉积物及3 个柱状沉积物中CZ及10 种PHCZ的分布,表层沉积物中PHCZ总质量分数为0.25~3.10 ng/g,中值为1.5 ng/g,3 个柱状沉积物中PHCZ总质量分数分别为0.63~1.14,1.90~2.52,0.54~2.36 ng/g,3,6-CCZ和1,3,6,8-BCZ为主要同系物,占比在40%以上。
大部分研究都发现3,6-CCZ在沉积物PHCZ检测中占比最高,检出最为频繁,其次为3,6-BCZ。环境样品中对位取代物质占比高可能是由于对位相较于邻位的高电荷密度以及NH2部分中孤对电子增强了对位取代产物的稳定性[12]。3,6-CCZ和3,6-BCZ在各区域中占比较高,可能符合咔唑的亲电性芳基取代模式,即咔唑相对于氮原子的邻位和对位更易于被卤素取代[34]。其他PHCZ在不同区域检出频率各有差异,这可能反映了PHCZ的不同来源或人类影响和自然过程的复杂性。
3.2 多卤代咔唑在土壤中的分布
土壤是联系无机环境和有机生物界的枢纽,土壤中的有机质可以吸附并固定持久性有机污染物[35],是环境中有机污染物的天然汇。有机污染物被植物吸收积累,再通过食物链传递,不仅对生态系统造成严重损害,而且会对人体健康造成严重伤害[36-37]。部分区域土壤中PHCZ的相关研究如表3所示。
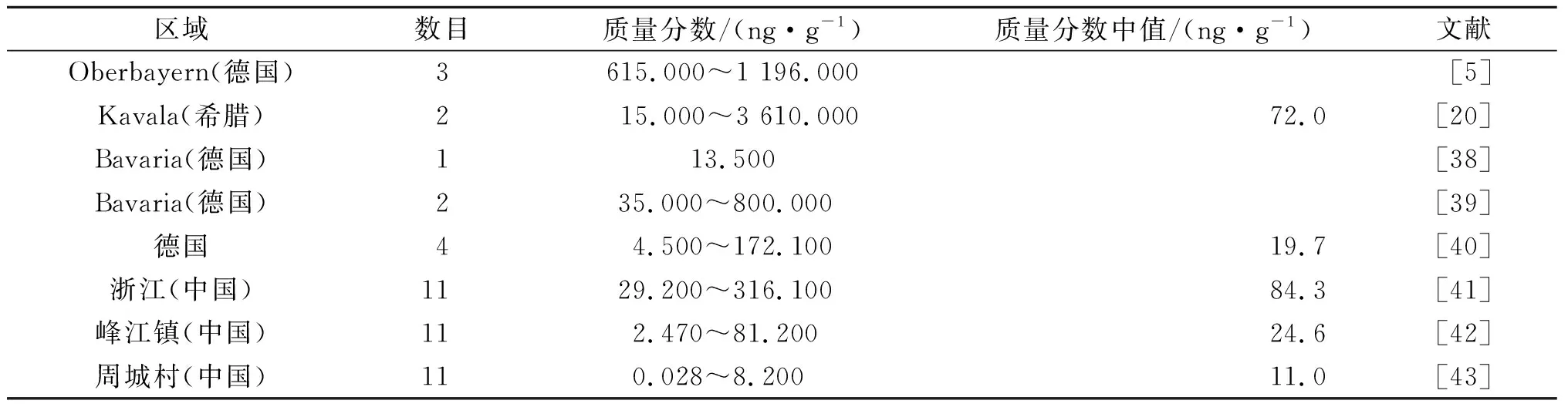
表3 部分区域土壤中的PHCZTable 3 Previous studies on PHCZ in soil samples from some areas
2005年,Reischl等[38]首次报道在德国Bavaria土壤中发现了3,6-CCZ,其质量分数为13.5 ng/g,并且显示3,6-CCZ的最高质量浓度不是在有机质层,而是在土壤腐殖质层和沉淀层之间。Mumbo等[5]在德国Oberbayern一个没有污染历史记录的地区检测到3-CCZ,3,6-CCZ和一种三氯咔唑,其中3-CCZ和3,6-CCZ的质量分数分别为9~29 ng/g和606~1 167 ng/g,3,6-CCZ比CZ和3-CCZ分别约高100 倍和40 倍。2011年,Grigoriadou等[20]在希腊Kavala土壤中检测到3-CCZ和3,6-CCZ,质量分数分别为5~110 ng/g和14~3 500 ng/g。2011年,Tröbs等[39]在希腊Kavala同一地区土壤中检测到35 ng/g的3-CCZ和800 ng/g的3,6-CCZ。2016年,Mumbo等[40]在德国不同地区森林土壤中检测到CZ、3-CCZ、3,6-CCZ、3-BCZ和3,6-BCZ,其质量分数分别为0.6~267.6,0.1~9.1,0.4~67.6,0.2~7.2,0.2~19.8 ng/g,这是首次在土壤中检测到了溴代咔唑。2018年,潘永强[41]分析了浙江省55 个表层土壤样品中CZ和11 种PHCZ的残留量,包括3-CCZ、3,6-CCZ、1,3,6,8-CCZ、2,3,6,7-CCZ、3-BCZ、2,7-BCZ、3,6-BCZ、1,3,6-BCZ、1,3,6,8-BCZ、1-B-3,6-CCZ和1,8-B-3,6-CCZ,除2,7-BCZ外,其余PHCZ的检出率均超过80%,PHCZ的总质量分数为29.2~316.1 ng/g,平均值为84.3 ng/g。2019年,Zhou等[42]建立一种高效可靠的GC-HRMS分析方法,检测中国台州峰江镇土壤中的上述11 种PHCZ,几乎所有样品中都有PHCZ检出,11 种PHCZ的总质量分数为2.47~81.2 ng/g,中值为24.6 ng/g。土壤中PHCZ的组成与沉积物类似,也是3,6-CCZ的检出最频繁,且占比最高。
3.3 多卤代咔唑在大气中的分布
2017年,Fromme等[44]分析了采自德国Munich的14 所学校、13 所日托中心和13 所住宅的灰尘样本以及5 个室内空气样本的CZ和14 种PHCZ的质量浓度水平,其中CZ、BenzoCZ、3-CCZ、3,6-CCZ、2,7-BCZ、1,3,6-BCZ和3,6-ICZ的检出率为99%~100%,其余卤代咔唑的检出率为40%~80%,在所有检出的卤代咔唑中,3,6-CCZ、1,3,6-BCZ和2,7-BCZ所占比重最高,其质量分数中值分别为13.3,6.2,1.2 ng/g。Fromme等[44]通过日托中心的数据量化评估了儿童对CZ、3,6-CCZ和1,3,6-BCZ的每日摄入量(以体重计,下同)分别为0.03,0.04,0.02 ng/kg。
3.4 多卤代咔唑在水中的分布
2019年,Wang等[45]分析了采自中国武汉市10 个饮用水处理厂供水区的10 份自来水样本中的11 种PHCZ的质量浓度,发现10 份自来水样本中有9 份检测到CZ和PHCZ,11 种PHCZ的总质量浓度为MLOQ~51.9 ng/L,随着氯化水中溴化物质量浓度增加,PHCZ的种类从只含氯取代的咔唑逐渐转化为溴氯混合取代和纯溴取代咔唑,并会促进总PHCZ的形成。2020年,Wang等[46]分析了57 个采自武汉市10 个城市居住区的饮用水样本以及18 个农村住宅区井饮用水样本中11 种PHCZ的质量浓度,结果显示:75 份饮用水样本中有73 份检测到PHCZ,11 种PHCZ的总质量浓度为MLOQ~53.48 ng/L,中值质量浓度(8.19 ng/L)与PCBs(20.3 ng/L)和全氟化合物(PFASs,10.3 ng/L)相当,比饮用水中的多氯二苯并二噁英/呋喃(PCDD/Fs,0.000 6 ng/L)高4 个数量级;农村地区中PHCZ总质量浓度(5.7~5.8 ng/L)远低于大多数城市区域(23.1~48.3 ng/L);煮沸后饮用水中PHCZ的质量浓度没有下降,据估算,婴儿通过饮用水摄取的PHCZs日摄入量(以体重计)最高达0.38 pg/kg,大约是成年人的4.5倍,相当于欧洲联盟食品科学委员会(Scientific committee on food of the European union,简称为EU SCF)规定的国际可接受日摄入量(以体重计)限值(2 pg/kg)和粮农组织/世卫组织食品添加剂联合专家委员会(Joint FAO/WHO expert committee on food additives,简称为JECFA)规定的日摄入量(以体重计)限值(1~4 pg/kg)的1/200~1/3,但超过了欧洲食品安全局(European food safety authority,简称为EFCA)建议的可耐受摄入量(以体重计)上限(0.25 pg/kg)。
4 不同环境样品中多卤代咔唑的分析方法
4.1 沉积物/土壤中多卤代咔唑的分析方法
沉积物或土壤中PHCZ的分析方法基本采用索提或加速溶剂萃取技术配合气相色谱-串联质谱(GC-MS)或超高效液相色谱-串联质谱(UPLC-MS)。
4.1.1 索 提
Zhu等[11]采用V(丙酮)∶V(正己烷)=1∶1的混合溶液对沉积物索提24 h,采用硅胶层析柱净化,用8 mLV(二氯甲烷)∶V(正己烷)=1∶4的混合溶液及8 mLV(二氯甲烷)∶V(正己烷)=2∶3的混合溶液洗脱,采用GC-MS分析,发现1,3,6,8-BCZ的回收率达到80%~99%。Zhou等[42]用甲苯对土壤索提16~24 h后,先经凝胶渗透层析柱再经弗罗里硅土层析柱净化,采用GC-HRMS-EI检测,仪器检出限为0.101~0.283 pg/μL,PHCZ的方法检出限(3 倍信噪比)为0.698~2.37 pg/g(以干质量计),加标回收率为84.3%~110%,示踪标回收率为88.5%~113%,RSD<14.2%。
4.1.2 加速溶剂萃取
Wu等[26]采用加速溶剂萃取技术萃取沉积物,萃取剂为纯二氯甲烷,经凝胶渗透色谱纯化后通过硅胶固相萃取柱(Solid phase extraction,简称SPE)及聚酯SPE柱净化,并用V(正己烷)∶V(二氯甲烷)=6∶4的混合溶液和纯二氯甲烷洗脱,采用GC-MS-EI/ECNI分析,发现PHCZ的加标回收率为94%~104%,RSD<14.6%,沉积物基质效应为96%~105%,方法定量限为0.11~0.53 ng/g(以干质量计)。Guo等[27]使用加速溶剂萃取系统萃取沉积物的PHCZ,萃取剂为V(正己烷)∶V(丙酮)=1∶1 的混合溶液,经硅胶/氧化铝层析柱分馏净化并用100 mLV(正己烷)∶V(二氯甲烷)=4∶1的混合溶液、100 mL纯二氯甲烷和100 mL甲醇洗脱,采用GC-MS-EI/ECNI分析,示踪标回收率为84%~116%,PHCZ平均回收率为55%~123%,仪器检出限(3倍信噪比)为0.001 7~0.074 1 ng/g(以干质量计)。Zhou等[31]采用加速溶剂萃取以纯二氯甲烷为萃取剂处理沉积物,经弗罗里硅土SPE柱净化,并用6 mLV(正己烷)∶V(二氯甲烷)=6∶4的混合溶液和7 mL纯二氯甲烷淋洗,用玻璃注射器通过0.22 μm聚四氟乙烯(PTFE)滤膜后,再用UPLC-MS/MS分析测定,检测结果显示:11 种PHCZ的方法检出限(3倍信噪比)和方法定量限(10倍信噪比)分别为3.0×10-3~0.22 ng/g和1.0×10-2~0.75 ng/g(以干质量计);沉积物中2.0 ng/g和10 ng/g的加标回收率分别为64.8%~91.8%和70.9%~124.7%,RSD<13.2%;除36-BCZ具有63.3%的正基质效应外,沉积物基质对其他PHCZ普遍表现为低或中负基质效应。
索提萃取虽然效率较高,设备便宜且操作简单,但提取时间较长,通常需要20 h以上,且溶剂消耗量大;加速溶剂萃取的有机溶剂使用量少,萃取效率高、速度快,且自动程度高,在萃取固体样品时就能分离固体样品和萃取液,不需要进行后续离心、过滤等操作[9],目前对沉积物/土壤中PHCZ的萃取多采用加速溶剂萃取技术;柱层析净化法需手动填料,操作过程繁琐且溶剂使用量大,逐渐被操作简便、重现性好和溶剂用量少等的净化方法替代,如SPE技术。
4.2 生物样品中多卤代咔唑的分析方法
Wu等[47]采用加速溶剂萃取技术萃取鱼类样品中的PHCZ,首先采用凝胶渗透色谱纯化,接着用硅胶SPE柱净化,然后用11 mLV(正己烷)∶V(二氯甲烷)=6∶4的混合溶液洗脱,最后采用GC-MS-EI/ECNI分析,PHCZ同系物加标回收率为(81.1±8.4)%和(106.9±7.7)%,示踪标回收率为(101.6±15.4)%和(88.4±13.7)%,仪器检出限(5倍信噪比)为0.02~0.26 ng/mL,方法定量限为0.6~1.1 ng/g(以干质量计)。周佳怡[48]针对蚯蚓中的PHCZ建立了一套QuEChERS前处理方法,采用GC-MS-EI/ECNI分析,PHCZ的加标回收率为71.21%~105.04%,RSD<10.46%,方法检出限和方法定量限分别为0.049~0.39 ng/g和0.16~1.32 ng/g(均以脂质量计)。
4.3 大气中多卤代咔唑的分析方法
Fromme等[44]采集了室内空气中粉尘样本,采用索提方法萃取样品,以二氯甲烷为萃取剂萃取18 h,经硅胶柱净化后分别用20 mL正己烷和V(丙酮)∶V(二氯甲烷)=1∶1的混合溶液洗脱,采用GC-MS/MS分析,大部分PHCZ加标回收率均大于70%,仪器检出限为1~4 pg,粉尘样品的方法检出限为0.004~0.7 ng/g(以干质量计),空气样品的方法检出限为0.04~1.55 pg/m3。
4.4 水体中多卤代咔唑的分析方法
Wang等[46]分析了居民区饮用水样本,采用固相萃取法,水样以2 mL/min流速通过聚苯乙烯二乙烯苯(Poly-sery PSD)SPE柱,再用8 mLV(正己烷)∶V(乙酸乙酯)=1∶1的混合溶液洗脱,采用GC-MS-EI分析测定,PHCZ的加标回收率为92.7%~104.9%,RSD<6.2%,方法定量限为0.15~0.46 ng/L。
5 结 论
综上,PHCZ在环境中的含量呈上升趋势。虽然目前已经对PHCZ的特性、来源、环境分布和分析方法等方面进行了一定程度的研究,但和其他有机污染物相比,人们对PHCZ的认识水平依旧非常有限。因此,积极开展环境中PHCZ的环境监测,对PHCZ的污染现状、来源和发展趋势等进行探索并开发更加高效、灵敏和可靠的预处理与分析技术将是今后的研究重点。

