脂质体外消化过程中氧化评价模型与检测方法研究进展
张铭凯,李晓雯,孟 晨,陈亚淑,陈洪建,邓乾春*
(1.武汉轻工大学 食品科学与工程学院,湖北 武汉 430048;2.中国农业科学院 油料作物研究所,湖北 武汉 430062;3.湖北工业大学 生物工程与食品学院,湖北 武汉 430068)
作为人体三大必需营养素之一,脂质提供了机体运作所需要的能量以及必需脂肪酸等生物活性物质[1]。95%的脂质在食品中以甘油三酯的形式存在,甘油三酯中不同的脂肪酸组成让脂质呈现不同的特性。
脂质作为日常食品的重要组成部分,不仅在提取、加工、运输过程中容易发生氧化,当脂质进入人体消化道时,体内复杂的环境存在众多因素促使脂质发生氧化,形成脂质氢过氧化物、挥发性不饱和醛等氧化产物[2]。这些氧化产物的生成不仅降低了脂质的营养价值[3],过量摄入还会增加患心血管疾病、糖尿病、肿瘤等多种疾病的风险[4]。然而,由于食物基质与胃肠道环境的复杂性,脂质在消化中的氧化程度受到消化道内的多种环境因素影响,共同消化的食品组分也会改变脂质的氧化速率,导致脂质在消化中的氧化状态难以监控。
为了更好地研究脂质在人体内消化过程中的酶解、氧化情况,体外消化模型是最常用的方法。目前静态、半动态和动态消化模型在脂质消化吸收方面已得到广泛应用。同时,为了评估脂质在消化后的状态,对脂质氧化产物的检测方法也随着研究人员的开发不断更新,准确性、特异性、灵敏度等特性都在不断提高。作者通过总结体外消化模型和脂质氧化产物检测方法在脂质氧化机理研究中的发展以及应用现状,以求为今后的相关研究提供理论基础。
1 消化过程中脂质氧化的研究现状
1.1 脂质消化过程及其对脂质氧化的影响
脂类进入人体消化道会经过乳化、水解、吸收3个阶段。在口腔中,咀嚼作用使食物分解成较小的颗粒,让脂质在胃部更快地接触脂肪酶从而分解、乳化。而最主要的脂质消化吸收阶段在小肠,通过肠道内的促消化因子让脂质分解形成乳糜微粒,从而被肠道吸收。
1.1.1 口腔消化阶段虽然脂质在口腔中停留时间不长,但口腔仍能对不同状态食物中的脂质造成不同程度的影响。液体、固体两种状态的食物在口腔消化阶段的分解效果不同,从而影响到包含在其中的脂质的消化效果。液体通常在口腔中停留时间很短,但其所含的脂质会和唾液中的矿物质、黏蛋白、酶等物质相互作用而使脂质的性质发生变化[3]。黏蛋白能够包裹或者吸附脂质液滴,矿物质离子可以通过离子结合效应和静电屏蔽效应让脂质液滴聚集。而半固体或固体的食物在口腔中停留时间相对更久,咀嚼使得固体食物被机械分解成小颗粒,增加脂质、蛋白质等营养物质与胃肠道接触的面积。在口腔消化阶段,脂质与促氧化因子的接触较少,脂质的乳化作用也还没有开始,脂质的氧化程度较低。
1.1.2 胃消化阶段在脂质消化过程中,胃部的作用主要是对脂质进行初步乳化和储存[5]。脂质的乳化作用在胃中开始,通过胃的机械力和胃中的强酸、消化酶等介质帮助处于不同食物基质中的脂质释放出来,产生一定量的油水界面从而乳化脂质。脂质在胃肠道中被逐步分解成甘油二酰基、甘油单酰基、磷脂、甾醇、游离脂肪酸等形式[6],这些分解产物中的少部分会通过被动扩散被胃黏膜吸收[7]。在这个过程中,无论在胃中的脂质性质如何,其甘油三酯中的sn-3位都能被胃脂肪酶特异性水解[8]。经过初步乳化的脂质所形成的1,2-二酰基甘油和游离脂肪酸等物质能进一步促进脂肪酶和甘油三酯的结合,使得脂质液滴的粒径大小被改变,同时对胃中脂肪酶的活性产生影响。通过胃部的消化作用,食品中脂质的界面性质和结构组成发生改变,再通过胃的排空作用将食糜运输到肠道。
由于脂质液滴粒径大小不同,脂质在正常成年人胃中分解程度差异较大(一般在5%~37%),其对胃中氧气、金属离子等促氧化因子敏感性也不同。通过胃部的消化作用,部分脂质被分解成更易发生氧化反应的游离脂肪酸形式,在胃中氧气、其他食品组分等多重因素的影响下生成氢过氧化物等氧化产物(见图1)[9]。在给哥廷根小型猪喂食含有葵花籽油的高脂高蛋白饲料之后,Gobert等在不同时间段对猪胃部消化液进行取样,对比发现进食后期消化液中硫代巴比妥酸反应物(TBARS)含量明显高于前期,说明在胃中脂质氧化程度明显增加[10]。并且胃内部环境含有多种促氧化因素,尤其是金属离子。Larsson等在体外模拟消化实验中加入血红蛋白模拟胃部含铁离子环境,发现在胃消化阶段结束后,消化液TBARS值上升,并且通过不同状态(37℃环境、有无脂肪酶)的对比实验发现TBARS值增加的程度明显减弱,说明胃部本身的促氧化环境是脂质氧化的主导因素[11]。同时,在胃消化阶段,氢过氧化物的含量远大于TBARS含量,而肠道消化阶段后TBARS值再次升高,表明脂质在胃消化阶段中的氧化反应主要形成的是初步氧化产物。
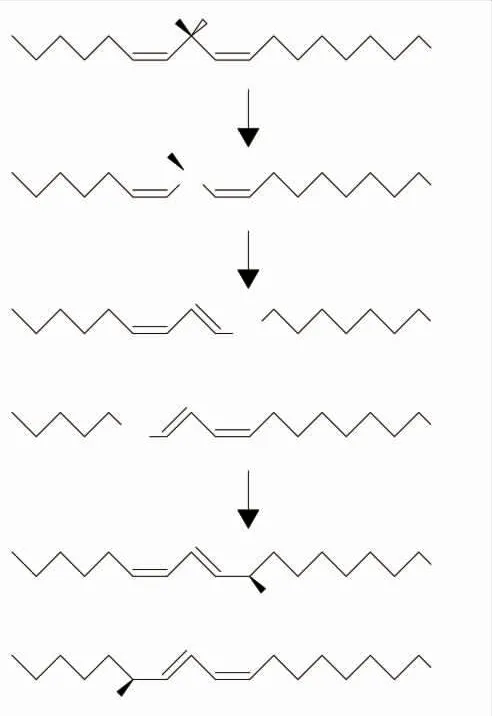
图1 以亚油酸为例的氢过氧化物形成流程图Fig.1 Hydroperoxide formation flow chart with linoleic acid as an example
1.1.3 肠消化阶段对比脂质在胃部的消化,小肠部分对脂质的消化吸收贡献更大。脂质在小肠中经胰脂肪酶、羧基酯脂肪酶、胆盐刺激脂肪酶等共同作用下发生脂质水解反应,其中胰脂肪酶对甘油三酯水解作用占到甘油三酯在人体总水解程度的45%~70%[12]。当脂质进入十二指肠的时候,小肠会迅速分泌胆汁和胰液,其中大量的胆汁盐、磷脂酰胆碱、游离胆固醇等会与脂质混合。此时,低浓度的胆汁盐能够促进胰脂肪酶水解脂质,但高浓度的胆汁盐会抑制胰脂肪酶的活性。同时辅脂酶能够调控胰脂肪酶的水解速率,胰脂肪酶必须在辅脂酶的帮助下才能从甘油三酯中水解出脂肪酸。有了胰脂肪酶、胆汁盐、辅脂酶等调控因子的存在,才能保证脂质高效稳定地被水解。通过胰脂肪酶的作用,脂质会被水解成2-单酰基甘油和脂肪酸,这些脂质水解产物会在胆汁盐的存在下自发合成乳糜微粒,同时磷脂和2-单酰基甘油会促进乳糜微粒的合成,提升脂质的吸收速率[13]。脂质在肠道内分解后生成的游离脂肪酸、胆固醇、卵磷脂等物质会被小肠上皮细胞吸收。其中短、中链脂肪酸会直接进入血液循环,长链脂肪酸会在吸收后重新被合成为甘油三酯,通过与胆固醇、蛋白质等物质结合形成乳糜微粒,最终进入血液循环,运输到人体各个器官中提供能量[14]。
脂质经过胃部初步分解、乳化后更容易和肠道内的消化酶以及促氧化因子作用,也就更容易发生氧化反应。肠道内的胰脂肪酶会优先水解粒径很小的乳化油脂,阻碍油脂液滴发生像胃部环境中的聚集现象,从而使得肠道消化中的脂质氧化反应速率比胃部消化阶段更快。通过在恒温摇床上模拟肠道消化新鲜的鱼肝油,Larsson等发现模拟肠道消化后的消化液中TBARS含量显著上升[15]。
目前,单独对肠道中脂质分解、氧化机理的研究并不多。这是因为肠道中对脂质氧化状态造成影响的因素相对于口腔、胃部更复杂,并且更难以检测各个因素具体的影响效果[16]。为了充分了解脂质在消化中的氧化状态变化及其对人体的影响,越来越多的学者开展对脂质消化过程的研究。考虑到体内消化实验的道德伦理约束以及高成本的耗材,搭建或使用体外消化模型研究脂质消化过程中的氧化成为主要评价方法之一。
1.2 消化过程中脂质氧化的静态消化模型研究现状
体外消化模型是近二十年的研究热点[17],与体内消化相比,体外消化能够降低研究成本、节省时间和人工、同时提高实验的重现性[18]。目前,静态体外消化方法是人体消化脂质过程研究中应用最广泛的方法。
静态INFOGEST模型[19]在2014年发表,众多研究人员以此模型研究脂质的消化、氧化过程。由于不同参数的静态消化模型对于脂质消化过程的呈现性有着明显差异,INFOGEST模型将静态体外消化模型的参数标准化,使得使用此模型的各种实验有了对比性。之后,在2019年研究者接着发表了优化后的静态INFOGEST 2.0模型(见图2)[20]。对比2014版的INFOGEST模型,最大的变化在于利用了兔胃脂肪酶(RGE)来模拟人胃脂肪酶。人胃脂肪酶对脂质消化的促进作用能改变脂质在胃中以及进入肠道时的状态,影响后续肠道内消化酶对脂质的作用效果[21],以及脂质的氧化稳定性。RGE与人胃脂肪酶的序列同源性达到了85%[22],且与人胃脂肪酶有类似的pH敏感性。
INFOGEST 2.0模型完善了静态体外消化模型的口、胃、肠消化液参数以及确切的组分混合配比和添加流程,学者可根据自己的需求在不同的消化阶段取样进行分析研究。利用添加了消化酶的静态模型,更利于食物中脂质、蛋白质等成分在胃肠道中释放出来,从而观测不同消化阶段中食品组分对脂质氧化状态的影响。Steppeler等以牛肉、猪肉、鸡肉、鲑鱼肉等血红素含量不同的肉为原料,利用INFOGEST消化模型进行体外模拟消化实验来探讨摄入的肉(牛、羊、猪肉等)与结肠直肠癌风险的相关性[23]。同样,INFOGEST模型也可以作为基础模型来对比人体和其他动物的消化过程,从而探究不同因素对脂质氧化的影响。Tullberg等为了探究鱼肝油在消化过程中的脂质氧化产物(HNE、MDA等)形成情况,以INFOGEST模型为原型设定了运用猪消化道中酶、胆盐和人体肠液的3种不同静态消化模型,发现在3种模型的消化过程中胃部的MDA、HNE含量均有增加且在肠消化阶段后这些产物的含量再次上升,并且添加人体肠液的实验组消化液中氧化产物含量多于其他模型[24]。以上结合静态消化模型探究多种因素对不同类型的脂质氧化影响的实验数据,对未来学者设计实验研究消化中脂质氧化的机理有着重要指导作用。

图2 INFOGEST 2.0模型模拟消化流程Fig.2 INFOGEST 2.0 model simulates the digestion process
目前多数脂质消化研究将静态体外消化作为结果评估的重要环节之一,但静态消化本身无法避免地需要在恒温水浴锅或者恒温摇床中进行手动操作,从而形成误差。并且,静态INFOGEST模型仅适用于胃、肠端点取样,也无法模拟脂质摄入时消化酶浓度动态变化、pH变化、机械剪切作用、胃肠道排空作用等动态因素。尤其是静态模型无法模拟pH以及消化酶含量的动态变化,使得胃肠道中多数促氧化因子对脂质氧化状态的影响无法真实还原。这样的局限性让静态体外消化模型不能很准确地模拟复杂的体内消化条件。为了能更深入了解脂质在消化中的状态变化,动态体外模拟消化技术必不可少。
1.3 消化过程中脂质氧化的半动态和动态消化模型研究现状
消化模型若涉及模型参数实时变化、消化道机械力模拟等动态模拟技术,常常被分为半动态消化模型和动态消化模型。表1列出了近年来运用了半动态、动态消化模型研究脂质消化相关课题的实例。
体外消化脂质过程中共消化食物组分的差异、模拟消化酶的不同来源、胃部本身的剪切及排空过程等多种因素均影响脂质的氧化程度、乳糜微粒形成和脂肪酸的释放,应用半动态消化模型能够研究脂质消化过程中脂质反应的一些前提条件。半动态消化模型是介于简单的静态消化模型和复杂的动态消化模型之间的一种模型,通常研究口腔、胃和小肠的单一消化阶段,通过加入注射泵、pH-stat、恒温搅拌/振荡器等设备模拟消化道中酶的释放、pH动态变化等特性[25]。尤其是pH-stat方法,能够将滴定仪器与计算机联合使用,自动化控制消化模型中的pH。同时,pH-stat方法简单、实用,能够实时观察消化道pH梯度曲线。有研究者运用类似半动态模拟胃部消化模型研究不同食品基质对胃部消化时的脂质、蛋白质水解程度的影响[26]。然而此研究中仅模拟胃部消化过程,忽略了口腔消化中黏蛋白、酶、消化液等对食物中脂质消化状态的影响。随后,该研究者在全脂牛奶的模拟消化过程中,采用了静态模拟口腔消化后的样品作为半动态模拟胃部消化的初始样品,更加贴近真实的消化流程[27]。胃部消化过程中,由于pH降低会影响胃部脂肪酶、蛋白酶等活性,进而改变脂质分解的脂肪酸进入小肠的时间,延迟胃的排空作用[28],从而影响脂质消化及氧化的进程。可以通过在胃消化的不同时间段运用注射器抽取消化模型容器中的样品,以模拟胃消化脂质时的排空行为[29]。同时,半动态消化模型中动态变化的酶含量更利于观察消化道中的消化酶对脂质分解及氧化进程的影响[30]。
基于以上研究,同时参考INFOGEST静态消化模型,有研究者设计了一种模拟成人上消化道的半动态INFOGEST体外消化标准模型,大大提高了运用半动态消化模型进行脂质消化实验的重现性[31]。模型中加入pH逐渐降低、胃液分泌和胃排空等胃部消化阶段中的动态行为,填补了INFOGEST模型在模拟消化过程中的动力学数据。半动态消化模型改善了静态模型只能从胃肠道端点取样的特点,能更好地研究脂质分解、氧化以及吸收过程。其相对简单的实验流程便于学者根据自身实验目的对半动态消化模型进行优化。但目前大多数半动态消化模型选用的简单的圆柱形容器,无法模拟胃内真实的J型结构和机械剪切作用。同时,除开胃部蠕动的机械作用,半动态消化模型对其他胃动力行为的模拟通常是运用磁力搅拌、恒温振荡器等设备,可能会破坏食品的结构从而与体内真实消化情况产生偏差[32]。为了更全面、成体系地研究脂质的消化、氧化过程,复杂且全面的动态消化模型会是首选。
动态消化模型与静态消化模型、半动态消化模型相比,能够更准确模拟胃肠道的蠕动与排空、食糜的运输、pH与酶浓度的动态变化等动态特征,同时也能连接不同的消化阶段,为脂质消化、吸收等机制的研究提供更有意义的数据[33-34]。通常动态消化模型被分为单隔室和多隔室两种模型。单隔室动态消化模型一般是模拟胃部消化,比如人体胃模拟器(HGS)。设计HGS的目的主要是为了模拟消化时胃窦的蠕动,其胃室是由乳胶制成的倒圆锥形容器,内部有一个网袋来模拟胃筛分作用[35],分别由两个机械泵负责模拟胃液的运输和胃排空效应,同时设定滚轮的压缩幅度来还原胃部的蠕动作用[36]。乳状液对消化环境的剪切作用以及pH变化很敏感,胃部的筛分、蠕动以及排空作用能很大程度影响乳液中脂质与脂肪酶、活性氧等物质的接触时间与面积。同时,HGS中动态变化的参数会使乳液在消化中的絮凝现象更严重也更贴合真实消化过程,较大程度的絮凝会延缓脂质进入肠道的时间,从而调控脂质在肠道消化中的氧化、吸收效果。Ye等采用HGS模型对比有无热处理对乳状液在体外模拟消化中絮凝状态的影响,与半动态消化模型所提供的数据相比,HGS模型的实验结果更真实地体现了乳状液在胃部的形态变化情况,为后续研究脂质在消化道的氧化、吸收过程建立了理论基础[37]。脂质在胃肠道消化过程中,胃中的剪切作用能够增加脂质同胃部促氧化因子(低pH、活性氮族、羟基等)的接触面积(尤其是固体食品中的脂质),增加脂质氧化的概率,影响脂质在胃肠道中的氧化稳定性。HGS的应用能够更真实地模拟脂质在胃消化过程中的氧化环境。类似HGS的单隔室体外消化模型,为了发挥耗时短、重现性强等优势,需要更集中于还原单个消化阶段才能更有针对性地应用于脂质消化实验。
大部分脂质水解发生在小肠消化过程中,游离脂肪酸相对甘油三酯更容易发生氧化反应,并且脂质在胃部发生氧化反应生成的氧化产物会降低脂质在小肠阶段的氧化稳定性,因此小肠阶段的消化、氧化不容忽视,能够体现人体消化道连续消化过程的多隔室动态消化模型自然更适合研究脂质在消化中的分解、氧化等反应。最常用的连续动态消化模型是TNO胃肠模型(TIM-1)。TIM-1是一个4隔室(胃、十二指肠、空肠、回肠)消化模型,每个隔室的消化条件,如消化液分泌速率、pH和酶浓度改变速率等参数都是通过软件分别控制蠕动泵来调节,整个系统也是处于37℃的水中,通过蠕动泵调节各隔室之间食糜和消化液的运输,通过泵的周期挤压来模拟胃肠道的蠕动效果,同时隔室以膜透析食物来模拟小肠的吸收。此模型的设计目的是为了模拟系统的人体胃肠道消化过程以及探索各种食品组分的生物可及性[38]。TIM-1是TIM模型中最常用的配置。随着时代发展,推出了TIM-1的简化版Tiny-TIM模型、针对研究大肠消化的TIM-2模型以及针对研究胃中食物均质和排空作用的TIMagc模型。从表1可以看出,有很多学者利用此模型研究脂质消化、氧化过程。脂质吸收过程会一直持续到回肠,TIM-1模型的多隔室设计利于研究者对肠道消化中脂质状态变化进行整体观察。同时,TIM-1模型连续、多隔室的特点更利于表现出共消化食品组分以及胃肠道中促氧化因子对脂质氧化状态的影响。基于以上特点,Maestre等以TIM-1为消化模型观测了葡萄籽多酚对肠道中脂质氧化的限制作用以及高脂肪含量的鱼肉在消化中脂质氧化的情况[39]。作为TIM-1模型的简化版,Tiny-TIM则是针对TIM-1模型流量有限制的专项优化模型,在不舍弃模拟消化阶段连贯性的同时提高了消化物的通量,也减少了实验耗时。利用Tiny-TIM模型,Larsson等先后研究了脂肪含量以及血红蛋白对体外消化中脂质氧化的影响和鱼肝油在体外模拟消化中的氧化程度变化[40-41]。可以看出,TIM系列体外动态消化模型各有自身的侧重点,利于学者针对不同探究目的选择不同模型。不仅仅是TIM模型,所有的静态、半动态以及动态消化模型都还在不断优化中,从而使目的不同的体外消化实验能够更加真实、准确地模拟人体中脂质的消化、氧化过程。
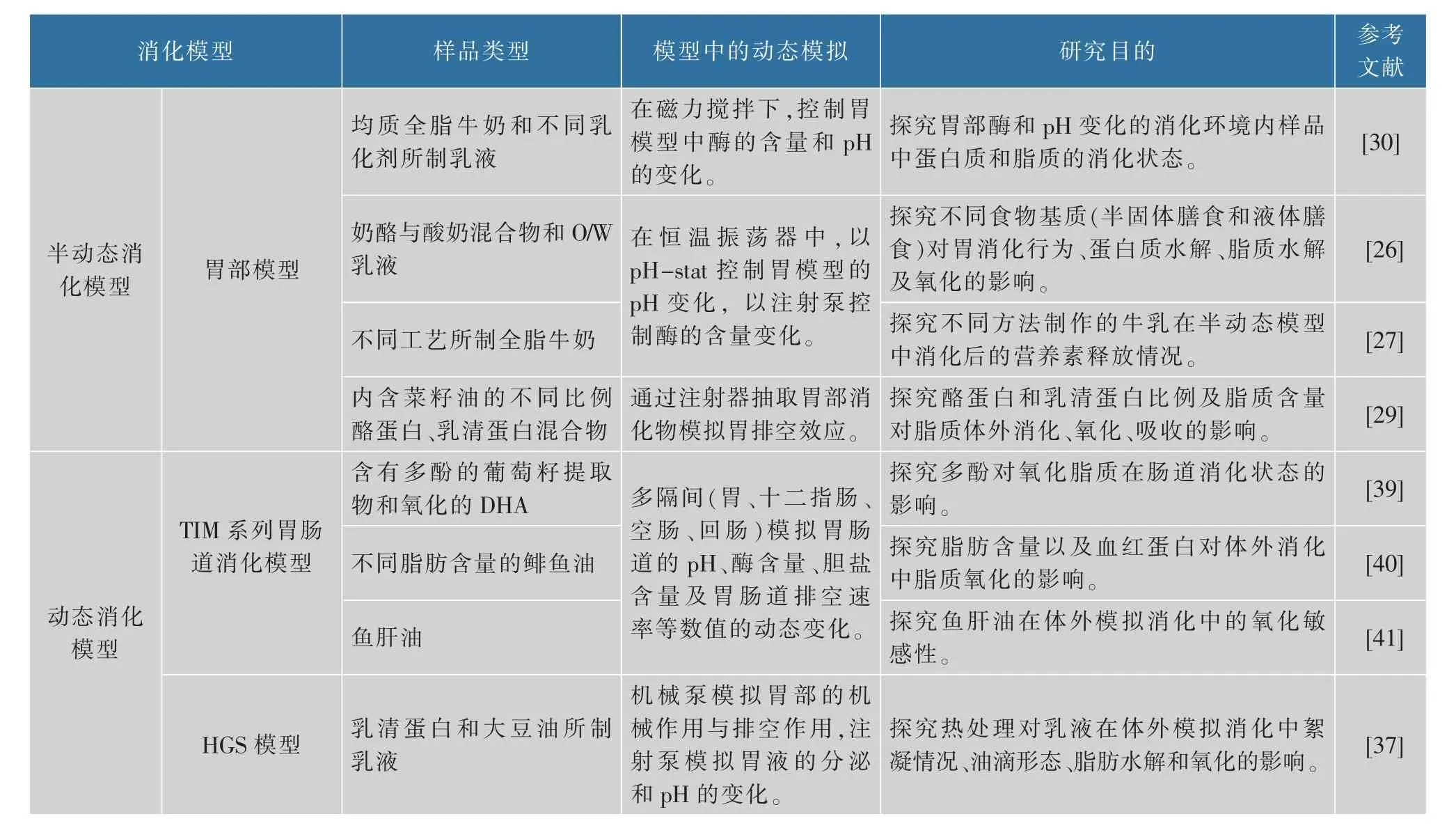
表1 半动态和动态体外消化模型研究脂质消化的实例Table 1 Examples of semi-dynamic and dynamic in vitro digestion models for studying lipid digestion
2 脂质消化后的氧化状态评价
2.1 常用脂质氧化产物检测方法
多年来,研究人员探索出众多检测脂质氧化状态的方法(见表2)。例如,以过氧化值为目标值的碘量滴定法、检测过氧化氢的二甲酚橙测定法(FOX测定法)和硫氰酸铁法、以紫外分光光度法测定含有共轭二烯(CD)/共轭三烯(CT)样品的吸光度和TBARS法等。由于快捷方便、成本低等特点,这些方法至今仍是最常用的检测方法。但消化后的食品各组分状态造成体系复杂,导致以上对单一目标物检测的方法准确性和特异性都有待考量[42]。

表2 脂质氧化产物的常用检测方法Table 2 Common detection methods of oxidation products of lipids
以测定MDA含量的TBARS法为例,这种方法简单而且重复性高,广泛应用于猪肉、牛羊肉、香肠等食物中的脂质氧化产物检测。但由于在TBARS法中所检测的MDA-TBA2和硫代巴比妥酸(TBA)与糖、多肽等其他化合物结合形成的物质具有相同的波长,或者食品基质中含有吸收此波长的物质,都会使得TBARS法测定值不准[43]。基于TBARS法,栾君等通过UPLC-FLD法和UPLC-DAD法对MDA-TBA2进行定量分析,并且可以将结果和原TBARS法对比来优化UPLC方法[44]。在HNE的检测中,分光光度法和LC-MS技术是很常见的检测方法。为了提高这些方法的精密度和准确性,可以在样品中加入醛反应探针,利用醛的固有反应让样品中的醛转化成更稳定的状态。在这些方法中,常用2,4-二硝基苯肼(DNPH)作为醛反应探针[45-47]与HNE反应生成二硝基苯腙化合物,利于通过高效液相色谱技术检测其含量。之后,Wang等选取了2-肼喹啉(HQ)代替DNPH和HNE进行反应,新的衍生物能提高LC-MS/MS方法对HNE含量检测的准确性和稳定性[48]。
大多数的分析方法运用了高效液相色谱、质谱、气相色谱以及多种分析方法联用等技术,这些技术在不同程度上改善了传统方法特异性差的缺点,但需要大量的溶剂。同时,方法中的众多衍生化实验步骤使得实验误差增大。考虑到这些情况,气相/固相微萃取法和核磁共振波谱法(1H-NMR)开始被研究人员运用在脂质氧化产物检测中。气体扩散微萃取(GDME)方法利用气相中的分析物通过多孔膜扩散和微萃取的原理[49],尤其适用于挥发性和半挥发性脂质氧化产物的检测[50-51]。随后,该研究者结合了分散液相微萃取(DLLME)和GDME技术,利用DLLME能够减少溶剂消耗和GDME能同时衍生与萃取等特点,建立了新型的GDME-DLLME方法,能同时在脂质中提取MDA、甲醛、乙醛、丙醛、戊醛和丙烯醛这6种脂质氧化产物并进行衍生化[65]。相比于降低消耗和误差的微萃取方法,1H-NMR方法能在样品无化学反应修饰的情况下同时检测CD、氢过氧化物、不饱和醛等多种脂质氧化产物。并且,由于1H-NMR技术能够检测出脂质中不同组分所占的比例,通过观测酰基、脂肪酸等物质的比例变化就可以定性、定量的检测氧化产物以及具有抗氧化活性的亲脂性化合物[52]。但由于1H-NMR方法的灵敏度较低,研究消化过程中的脂质氧化状态常用的是气相/固相微萃取方法。除了1H-NMR、GDME等检测方法外,电子自旋共振波谱(ESR)等高灵敏度检测方法也被用于脂质在胃肠道消化过程中氧化自由基的检测。通过反磁性分子及电子标记物的添加,电子捕获剂同乳糜两相中生成的氧化自由基及电子标记物同中间层的胆盐等相互作用,来反应胃肠道消化中氧化自由基在乳糜中的分布及空间结构变化,精确定位胃肠道中脂质氧化反应位点。相比于前文提到的常用方法,ESR能够避免大量试剂的消耗以及衍生化反应带来的误差。
2.2 特征脂质氧化产物的研究现状
同时,探索新的特征脂质氧化产物也是提升脂质氧化状态检测准确度的重要研究方向。海洋脂质相比于其他食用脂质,有着更高含量的不饱和脂肪酸,同时也更容易发生氧化。由于更复杂的脂质结构,海洋脂质的氧化反应是一种复杂的连锁反应,其产物难以监测。4-氧-2-壬烯醛(ONE)在海洋脂质氧化产物中更具有特征性,Tullberg等在进行体外消化中海洋脂质氧化状态的研究时选择了ONE作为新的海洋脂质氧化标志物,提高了检测海洋脂质氧化程度的特异性和准确性,减少杂质对检测结果的影响[53]。在探究脂质氧化产物时,大多数学者的目光都放在氢过氧化物、α,β-不饱和醛等物质上,Grüneis等则提出需要关注环氧化物在脂质氧化反应中的生成[54]。环氧化物在氧化产物中的含量超过了氢过氧化物且其与DNA、蛋白质的反应比不饱和醛更加活跃[55]。同时,由于环氧化物不一定含有共轭二烯结构也无法采用过氧化物滴定法测定含量,很容易在脂质氧化产物检测的研究中被忽视。目前可以使用GC-MS以及LC-MS等技术对环氧化物进行检测,但这些方法耗时长且需要衍生化,未来需要开发更快速有效的方法对其含量进行测定。
3 展 望
由于摄入脂质的氧化对机体健康的影响不易察觉以及经济成本上的考量,脂质氧化研究大部分都聚焦在食用脂质的加工、运输和储存等方面。随着食用脂质的多样化发展以及对脂质氧化产物危害性的认识,学者们对于胃肠道中脂质氧化的探究将会不断加深。体外消化模型在脂质体内氧化研究领域中的应用很广泛,众多学者根据自己的实验目的选择适合的体外消化模型进行研究。随着脂质体外消化模型的更新与优化,数据可靠性、准确性也在不断提升。然而,因为技术的限制,体外消化模型还无法完全模拟脂质在胃肠道中的消化、氧化过程,更加精准的体外消化模型亟待开发。同时,体外模拟消化需要结合多种脂质氧化状态评价方法,高灵敏度、特异性、高效的胃肠道脂质氧化产物检测方法的更新、优化也是目前脂质氧化研究的重要内容。因此,对脂质在人体消化过程的研究需要结合体外消化模型、氧化产物检测方法以及脂质代谢、吸收模型等研究手段,进行系统、深入的研究,这对于提升脂质质量、创制安全健康的功能脂质、促进脂质产业升级均有重要意义。

