抗非小细胞肺癌药物山奈酚纳米脂质靶向递药载体的处方前研究
马玉霏 刘金丽 王晓雪 侯甲福 佟雷







[摘要] 目的 制備抗非小细胞肺癌药物山奈酚纳米结构脂质载体,并对多种测定包封率的方法进行筛选。 方法 于2020年9月~2021年9月进行实验,采用熔融超声法将山奈酚制成纳米结构脂质载体,通过紫外分光光度法测定药物含量并进行方法学考察,通过测定溶解度和油水分配系数研究山奈酚的基本理化性质,分别选用超速离心法、超滤离心法、透析法、反透析法、鱼精蛋白沉淀法及葡萄糖凝胶过滤法测定包封率。 结果 山奈酚在2.2~11.0 μg/ml浓度范围内线性关系良好(r2=0.9994),精密度、重复性、回收率及稳定性试验的RSD值均小于2%。溶解度和油水分配系数的测定结果均表明山奈酚为脂溶性药物。6种方法测得的平均包封率分别为25.77%、73.44%、57.35%、84.20%、89.61%、43.99%。 结论 反透析法和鱼精蛋白沉淀法测定的结果较为高效准确,适用于山奈酚纳米结构脂质载体包封率的测定。
[关键词] 山奈酚;纳米脂质载体;包封率;抗非小细胞肺癌;靶向递药
[中图分类号] R979.1 [文献标识码] A [文章编号] 1673-9701(2022)17-0031-04
Preformulation study of the kaempferol-loaded nanostructured lipid targeted drug delivery carrier, An anti-non-small cell lung cancer drug
MA Yufei1 LIU Jinli2 WANG Xiaoxue1 HOU Jiafu1 TONG Lei1
1.School of Pharmacy,Mudanjiang Medical University, Mudanjiang 157011,China;2.Department of Infection, Hongqi Hospital Affiliated to Mudanjiang Medical University,Mudanjiang 157011, China
[Abstract] Objective To prepare the kaempferol-loaded nanostructured lipid carrier, an anti-non-small cell lung cancer drug, and to screen a variety of methods for determining the entrapment efficiency. Methods The experiment was carried out from September 2020 to September 2021. Kaempferol was made into a nanostructured lipid carrier by the ultrasonic melt method.The drug content was determined by UV spectrophotometry and the methodological validation was conducted.The basic physical and chemical properties of kaempferol were studied by measuring solubility and oil-water partition coefficient. The entrapment efficiency was determined by ultracentrifugation, ultrafiltration centrifugation, dialysis, reverse dialysis, protamine precipitation and glucose gel filtration, respectively. Results There was a good linear relationship over the concentration range of 2.2-11.0 μg/ml for kaempferol(r2=0.9994),and the RSD values of precision, repeatability, recovery and stability test were less than 2%.The measurement results of solubility and oil-water partition coefficient showed that kaempferol was a lipid-soluble drug. The average entrapment efficiencies measured by the six methods were 25.77%,73.44%,57.35%, 84.20%,89.61% and 43.99%, respectively. Conclusion The results measured by reverse dialysis and protamine precipitation are relatively efficient and accurate, and the two methods are suitable for the determination of the entrapment efficiency of the kaempferol-loaded nanostructured lipid carrier.
[Key words] Kaempferol; Nanostructured lipid carrier; Encapsulation efficiency; Anti-non-small cell lung cancer; Targeted drug delivery
肺癌患者病死率占恶性肿瘤病死率的首位[1],而非小细胞肺癌(non-small cell lung cancer,NSCLC)在肺癌中约占80%[2],平均生存率低于5年。山奈酚(kaemperol,KA)是一种黄酮类化合物,不仅拥有抗菌抗炎、抗氧化、降血糖等作用[3~5],研究表明KA对于NSCLC细胞的生长具有抑制作用,但KA自身水溶性差,限制进一步应用[6-8]。纳米结构脂质载体(nanostructure lipid carrier,NLC)是第三代纳米载体,能有效增加药物的溶解度、提高药物的稳定性,进而促进药物的吸收[9]。本实验采用熔融超声法将山奈酚制成纳米结构脂质载体(KA-NLC),并对超速离心法、超滤离心法、透析法、反透析法、鱼精蛋白沉淀法及葡萄糖凝胶过滤法测定包封率的结果进行比较,为该药物制剂的处方优化及深入研究奠定基础。
1 材料与方法
1.1 仪器
HMS-18数字型加热磁力搅拌器(上海泰坦科技股份有限公司);UV-1800紫外可见分光光度计(日本岛津公司);JY92-II超声波细胞粉碎机(宁波新芝生物科技股份有限公司);3K15台式高速冷冻离心机(德国希格玛有限公司)。
1.2 材料
山奈酚(阿达玛斯试剂有限公司);油酸(阿达玛斯试剂有限公司);单硬脂酸甘油酯(阿达玛斯试剂有限公司);泊洛沙姆(南京威尔化工有限公司)。
1.3 方法
1.3.1 KA-NLC的制备 KA和脂质混合加热作为油相,泊洛沙姆水溶液加热作为水相,将水相缓慢加至油相中,搅拌得到初乳,超声分散后冷却得KA-NLC。油相中不加入KA,其余同上,即得空白NLC。
1.3.2 紫外分光光度法测定药物含量 (1)测定波长的选择:采取铝盐显色法,KA溶液在200~400 nm波长内进行扫描,考察紫外吸收情况,空白NLC操作同上[10]。(2)标准曲线的绘制:配制终浓度为2.2、4.4、6.6、8.8、11.0 μg/ml的KA溶液,在(1)条件下进行测定。以KA浓度C为横坐标,吸光度值A为纵坐标绘制标准曲线。(3)精密度试验:配制浓度为1、4、10 μg/ml的KA溶液,1 d内测定6次得日内精密度;连续测定5 d得日间精密度,分别计算RSD。(4)重复性试验:同时配制5份浓度为5 μg/ml的KA溶液进行测定,计算RSD。(5)回收率试验:将KA溶液加至空白NLC溶液中,甲醇稀释至KA终浓度为0.5、5、10 μg/ml进行测定,回收率(%)=实际浓度/理论浓度×100%。(6)稳定性试验:室温条件下分别于0、6、12、18、24 h测定KA溶液药物含量。(7)载药粒子的含量测定:KA-NLC经甲醇破乳后采用微孔滤膜(0.22 μm)进行过滤,于(1)条件下进行测定。
1.3.3 KA基本理化性质的研究(1)溶解度测定:分别用超纯水、磷酸盐缓冲液(pH 7.4 PBS)及含0.5%、2%、5%吐温80与磷酸盐缓冲液混合溶液(Tween 80 -pH 7.4 PBS)溶解KA,恒温水浴搅拌,使固体药物始终存在于溶液中。72 h后吸取上清液,计算KA表观溶解度。(2)油水分配系数测定:采用水饱和的正辛醇溶解KA,涡旋至KA完全溶解,恒温条件下搅拌72 h,两相分层后分别测定药物含量。计算公式如下:P=CA-CB/CA(P:油水分配系数;CA:水相中药物初始浓度;CB:平衡后水相中药物浓度)。
1.3.4 包封率的测定 计算公式如下:包封率(%)=(1■)×100%(W1:游离药物量;W2:总药物量)。取适量KA-NLC通过1.3.2项下(1)方法记录吸光度值,计算总药物量W2。(1)超速离心法:取KA-NLC于离心管中,以15 000 r/min的速度离心2 h,取上清液测定药物含量。(2)超滤离心法:取KA-NLC于超滤离心管内管中,以5000 r/min的速度离心30 min,吸取外管中滤液测定药物含量。(3)透析法:取KA-NLC于透析袋内,PBS缓冲液作为透析介质,以800 r/min的速度搅拌,定时取1 ml透析介质进行含量测定,并补充同体积透析介质,待药物浓度稳定计算包封率。(4)反透析法:含有乙醇溶液的透析袋放入KA-NLC中,以800 r/min的速度搅拌,定时从透析袋中取出1 ml进行含量测定,待药物浓度稳定计算包封率。(5)鱼精蛋白沉淀法:KA-NLC中加入同体积的鱼精蛋白(10 g/L),混匀后静置5 min,加入超纯水再次混匀后,以8000 r/min的速度离心30 min,取上清液测定药物含量。(6)葡萄糖凝胶过滤法:葡萄糖凝胶G-50溶胀后注入凝胶柱,超纯水洗脱3次,注入KA-NLC溶液继续洗脱,每2毫升收集一管测定吸光度;另取KA溶液同上操作。以管数为横坐标,吸光度(A)为纵坐标绘制两种溶液的洗脱曲线。取KA-NLC按以上方法分离并收集游离药物,进行含量测定。
2 结果
2.1 紫外分光光度法测定药物含量
2.1.1 测定波长的选择 KA溶液在265 nm处有最大吸收峰,且制剂辅料在此处无吸收峰,最终检测波长定为265 nm。
2.1.2 标准曲线的绘制 山奈酚的线性方程为A=0.1243C-0.0096(r2=0.9994,n=6),在2.2~11.0 μg/ml的浓度范围内线性关系良好。
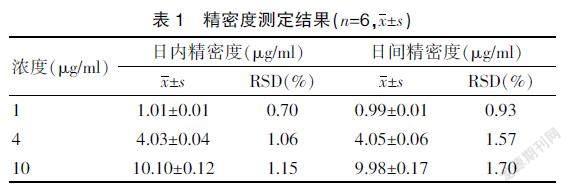
2.1.3 精密度试验 3种浓度的溶液日内RSD和日间RSD均小于2%,表明所用儀器精密度良好。见表1。
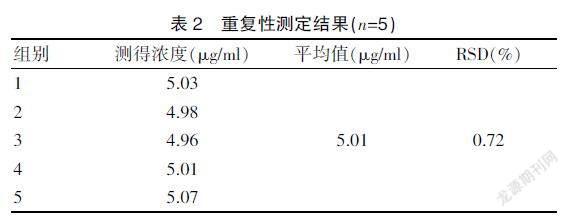
2.1.4 重复性试验 重复性试验RSD为0.72%(n=5),证明此方法重复性较好。见表2。
2.1.5 回收率试验 3种浓度的溶液RSD均小于2%,符合方法学要求。见表3。
2.1.6 稳定性试验 稳定性RSD为1.49%,表明溶液在24 h内稳定。见表4。
2.2 KA基本理化性质的研究
2.2.1 溶解度测定 KA在超纯水和PBS缓冲液中的溶解度极低,随着Tween 80用量的增加,KA溶解度也随之增加,说明KA为水难溶性药物。见表5。
2.2.2 油水分配系数测定 结果表明,KA的油水分配系数LogP为(2.16±0.09),药典规定logP>0.5时为脂溶性药物,由此证明KA脂溶性较强,将其制备成KA-NLC具有一定意义。见表6。
2.3 包封率的测定
2.3.1 超速离心法 3批样品包封率均小于30%,该方法通常需要几万转的转速[11],本实验所用离心机无法达到条件,不能有效分离游离药物,故不选用该方法测定KA-NLC包封率。见表7。
2.3.2 超滤离心法 3批样品RSD为6.16%,可能在超滤过程中超滤膜截留大分子溶质增加了膜附近渗透压,使得游离药物的透过率减小,导致结果重复性较差,故不选用该方法测定KA-NLC包封率[12]。见表8。
2.3.3 透析法 平均包封率为57.35%。由于KA在PBS中溶解性较差,易堵塞透析袋微孔导致游离药物无法正常析出,使所测包封率偏低,故不适于KA-NLC包封率的测定[13]。见表9。
2.3.4 反透析法 平均包封率为84.20%,RSD为1.08%。由于减少透析介质的用量,避免对游离药物的稀释,所测结果较好,较适用于KA-NLC包封率的测定。见表10。
2.3.5 鱼精蛋白沉淀法 平均包封率为89.61%,RSD为0.81%。鱼精蛋白呈正电[14]。本实验的KA-NLC呈负电,二者形成的聚合物在离心后能完全沉淀,故该方法适于测定KA-NLC包封率。见表11。
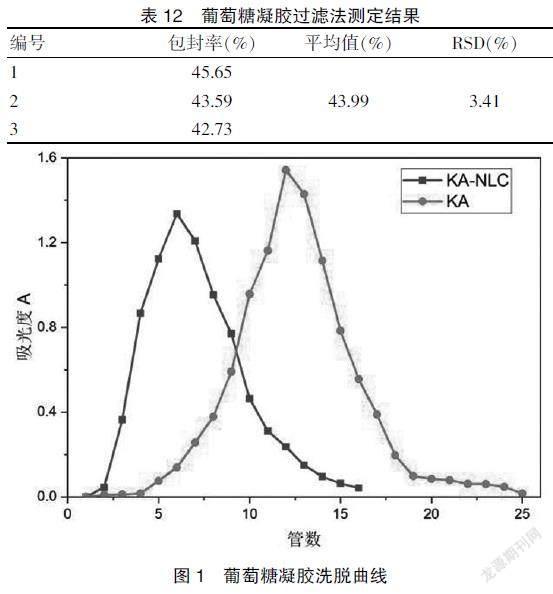
2.3.6 葡萄糖凝胶过滤法 平均包封率为43.99%。该方法是按分子量大小的顺序进行洗脱,从而实现载体与药物的分离,但较适用于分离水溶性药物[15]。见表12。图1的洗脱曲线也显示,该方法不能有效分离KA-NLC与游离药物,故不选用此方法测定包封率。
3 讨论
NSCLC在肺癌中最为常见,其临床治疗和预后均较差[16]。KA具有多种药理作用,在肿瘤方面的应用尤为突出,但KA为脂溶性药物,口服生物利用度较低,限制其实际应用。NLC能够有效提高难溶性药物的递送效率,脂质的混合使用使载体能够容纳更多药物。本研究通过熔融-超声法成功制备了KA-NLC,改善KA水溶性差的缺陷,为进一步研究提供一定的实验依据。
本实验分别通过超速离心法、超滤离心法、透析法、反透析法、鱼精蛋白沉淀法及葡萄糖凝胶过滤法测定所制KA-NLC的包封率。结果表明超速离心法虽操作简单,但离心时间过长易摩擦产热,需要在低温条件下进行,因此对设备条件要求较高,且本实验所制KA-NLC粒径较小,该方法不能完全分离药物与载体,导致测定的游离药物含量偏高。超滤离心法便捷快速,但超滤膜对药物的吸附作用可引起药物浓度发生变化,导致所测结果重复性较差。透析法虽对仪器要求简单,但脂溶性药物不易溶解于透析介质而聚集在透析袋上,导致所测结果偏差较大。反透析法可减少透析介质的使用,避免破坏载体与游离药物的动态平衡,减少药物泄露的可能,使测定结果更为准确。鱼精蛋白沉淀法通过电荷吸附与载体形成大颗粒沉淀,将药物与载体分离的同时也不破坏载体的结构,操作简便且重复性好。葡萄糖凝胶过滤法无法有效分离脂溶性药物,且分离过程中需要大量的洗脱液,可能会造成载体的渗漏,同时洗脱液的流速、上样量及载体粒径等均存在一定影响,导致所测结果重复性较差。通过比较以上结果,最终选择反透析法和鱼精蛋白沉淀法测定KA-NLC的包封率,为脂溶性药物的纳米结构脂质载体包封率的测定提供一定的参考依据。
综上所述,反透析法和鱼精蛋白沉淀法测定的结果较为高效准确,适用于山奈酚纳米结构脂质载体的包封率的测定。
[参考文献]
[1] 郑荣寿,孙可欣,张思维,等.2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志, 2019(1):19-28.
[2] Lau S,Batra U,Mok T,et al.Dacomitinib in the management of advanced non-small-cell lung cancer[J].Drugs,2019,79(1):823-831.
[3] 李珂如,胡光强,吴安国,等.山奈酚及其衍生物在神经系统疾病中的药理作用研究进展[J].西南医科大学学报,2021,44(4):412-416.
[4] Zheng L,Chen L,Li J,et al. Two kaempferol glycosides separated from camellia oleifera meal by high-speed countercurrent chromatography and their possible application for antioxidation[J].Journal of Food Science,2019,84(10):2805-2811.
[5] Kitakaze T,Jiang H,Nomura T,et al. Kaempferol promotes glucose uptake in myotubes through a JAK2-dependent pathway[J].Journal of Agricultural and Food Chemistry,2020,68(47):13720-13729.
[6] Fouzder C,Mukhuty A,Kundu R. Kaempferol inhibits Nrf2 signalling pathway via downregulation of Nrf2 mRNA and induces apoptosis in NSCLC cells[J].Archives of Biochemistry and Biophysics,2021,697(6):108 700.
[7] Hiroyuki S,Asami T,Satoshi E,et al. Kaempherol and luteolin decrease claudin-2 expression mediated by inhibition of STAT3 in lung adenocarcinoma A549 cells[J].Nutrients,2017,9(6):597.
[8] 杨生辉,黄琰菁,莫安薇,等.山奈酚通过调控miR21抑制非小细胞肺癌A549细胞增殖的研究[J].中國现代应用药学,2020,37(13):1557-1562.

