不同基质水产苗种中己烯雌酚酶联免疫分析法的建立
梁娟 魏海英 于盟盟 张倩玉 牟丹丹 赵涛涛

摘要:为建立水产苗种中己烯雌酚(Diethylstibestrol,DES)残留量的定性、定量检测的酶联免疫(ELISA)法,采用乙酸乙酯作为提取剂,超声振荡提取替代涡旋振荡提取、纯水对正己烷进行饱和等措施对前处理过程进行优化,同时考察了基质效应对检测结果的影响。DES在0.150~9.00 ng·mL的加标水平范围内,曲线相关系数R=0.997,方法定量限为0.075 μg·kg;中国对虾苗种、三疣梭子蟹苗种、刺参苗种、牙鲆苗种在0.075、0.150、0.750 μg·kg加标水平下,平均回收率测定范围为74.3%~96.7%,精密度范围为3.7%~7.6%。试验结果表明,该法灵敏度更高、特异性强、快速简便,适用于不同基质水产苗种中DES残留量的定性和定量分析。
关键词:水产苗种;己烯雌酚;残留量;不同基质;酶联免疫法
己烯雌酚(DES)是一種人工合成的雌激素,具有调节生物机体代谢、生长、发育及生殖等作用,能促进蛋白质的合成代谢,导致氨基酸合成蛋白质的速度加快而使体重增加[1],曾被水产育苗和养殖技术人员作为提高产量的“法宝”,带来巨大的经济效益,在医学上也被广泛应用于妇科病的预防和治疗[2]。DES在生态环境中降解缓慢,通过食物链进入人体,会诱发少儿发育早熟、生殖器病变,引起后代多种泌尿生殖系统异常[3],甚至对人体产生致畸、致癌、致突变等危害[4],即使排出体外也会在土壤和水源中富集,造成生态环境污染恶性循环。许多国家已明令禁止将DES用于动物养殖。早在1971年,美国就已颁布禁止使用DES的相关法令,随后1978年欧盟也颁发相关禁止法令,2012年国际癌症研究机构将DES列为Ⅰ类人类致癌物[5];2002年《中华人民共和国农业部公告第193号》明确将DES及代谢物列为食品动物中禁用的兽药,2020年《中华人民共和国农业农村部公告 第250号》也明确规定,DES及其盐和酯在所有动物源性食品中不得检出。但由于缺乏科学管理和经济利益的驱使,DES的违规使用现象屡禁不止。
在水产品质量安全监督工作中,大型仪器分析方法灵敏度高、准确性好,常作为药物残留检测的确认方法。然而,水产苗种的繁育季节性强、周期短,抽检样品用大型精密仪器进行检测,由于检测技术复杂、前处理过程耗时长、检测结果滞后等原因,阳性样品检测结果上报给渔业主管部门时,苗种已被销售,不但贻误最佳执法时机,而且容易使阳性苗种流向养殖环节,从源头上造成水产品质量安全的隐患。因此,在水产苗种的实际检测工作中,建立灵敏度高、特异性强、快速简便、健康安全的方法,为渔业质量安全主管部门的管理工作提供及时的技术支撑,提高执法工作的实效性具有非常重要的现实意义。
目前DES的检测方法主要有气相色谱法(GC)[3]、气相色谱-质谱法(GC-MS)[6]、气相色谱-串联质谱法(GC-MS/MS)[7]、高效液相色谱法(HPLC)[8-9]、液相色谱—质谱联用法(LC-MS/MS)[10]、高效液相色谱—串联质谱法(HPLC-MS/MS)[11]、超高效液相色谱-串联质谱法(UPLC-MS/MS)[12]、液相色谱-高分辨质谱法(LC-HRMS)[13]等大型精密仪器分析法,ELISA法测定水产品及动物性食品中DES残留量也有SC/T 3020-2004《水产品中己烯雌酚残留量的测定 酶联免疫法》[14]和农业部1163号公告-1-2009《动物性食品中己烯雌酚残留检测酶联免疫吸附测定》[15]等相应的标准。近几年来,DES的分析检测方法在不断地完善,进一步优化预处理技术,提高仪器灵敏度,建立更高效、更安全、更环保和更便捷的ELISA检测方法是发展的趋势[16],也是食品安全检测领域中最具有发展前景和产业化的检测技术[17]。本文对美国柏尔生物技术公司提供的试剂盒使用方法采用超声振荡提取替代涡旋振荡提取、纯水对正己烷进行饱和等优化改进措施,以期建立对不同基质水产苗种中DES残留量进行定性、定量测定的ELISA分析方法,为渔业质量安全主管部门的监管工作提供及时、准确的技术保障。
1材料与方法
1.1仪器和试剂
MK3微孔板酶标仪[赛默飞世尔科技(中国)有限公司];微量移液器、多道微量移液器(赛默飞世尔科技有限公司);PL202-L电子精密天平(梅特勒托利多仪器上海有限公司);KQ-5200DE超声波清洗器(昆山超声仪器有限公司);DC-24水浴氮吹仪(上海安谱实验科技股份有限公司);10D经济型纯水仪(上海摩勒科学仪器有限公司);DNP-9002BS-III电热恒温培养箱(上海新苗医疗器械制造有限公司);96孔DES检测试剂盒(美国柏尔生物技术公司);乙酸乙酯、无水CaCl2、甲醇(AR,上海国药集团化学试剂有限公司);正己烷(AR,天津科密欧试剂有限公司)。
1.2样品
中国对虾、三疣梭子蟹、刺参、牙鲆等苗种样品分别由国家北方虾蟹产业技术体系日照站、山东省现代农业刺参产业技术体系日照综合试验站和山东省现代农业鱼类产业技术体系日照东港综合试验站提供。
1.3方法
1.3.1试剂配制
1.3.1.1HRP-Conjugated Antibody 2#溶液配制取100 μl 100×HRP酶标二抗(HRP-Conjugated Antibody 2)加入到9.9 mL二抗稀释液(Antibody Diluent2 )中,按1∶99比例将100×HRP-Conjugated Antibody 2稀释为10 mL的1×HRP-Conjugated Antibody 2。
1.3.1.2Wash Solution洗液配制取10 mL的20×浓缩洗液(Wash Solution)加入到190 mL纯水中,按1∶19比例配制1×Wash Solution。
1.3.1.3PBS溶液配制取1 mL的10×缓冲液(PBS)加入到9 mL双蒸馏水中,按1∶19比例配制成10 mL的1×PBS。
1.3.1.4PBS-甲醇溶液配制取3 mL的1×PBS加入2 mL甲醇,按3∶2比例配制1×PBS-甲醇溶液。
1.3.2样品处理挑出样品中饵料等杂质,用去离子水清洗、沥干,搅碎成糜状,充分混合均匀;准确称取样品(3.00±0.01)g置于25 mL聚丙烯离心管中,加入9 mL乙酸乙酯和0.3 g CaCl2,超声振荡20 min,(22.5±2.5)℃ 4 000 r/min离心5 min;移取6 mL上清液,置于10 mL聚丙烯离心管中,(50~60)℃水浴氮气吹干;加入2.00 mL饱和正己烷溶解残留物,再加入1.00 mL的1×PBS/甲醇,超声振荡15 min;(22.5±2.5)℃ 4 000 r/min离心10 min,弃去上层饱和正己烷層,下层溶液供酶标板进行检测。
1.3.3孵育过程移取标准溶液或样品上机液50 μL,置于对应的孔中;再依次加入100 μL DES一抗(Diethylstilbestrol Antibody 1#),轻敲微孔板边缘混匀1 min,用盖板膜盖板后,(22.5±2.5)℃避光孵育30 min;小心揭开盖板膜,将孔内液体甩干,每孔及时加入洗涤液250 μL,轻敲微孔板边缘混匀1 min,将孔内液体甩干,重复洗板步骤3次,每次间隔10 s,最后一次洗板后,应使板尽量甩干并在吸水纸上倒扣、排干(排干后若有气泡,先用洗耳球吹破,再拍干);再按以上顺序将每酶标板孔加入150 μL的1×HRP-Conjugated Antibody 2#,轻敲微孔板边缘混匀1 min,用盖板膜盖板后,(22.5±2.5)℃避光孵育30 min;按照上述洗板方法再次洗板;每酶标板孔加入100 μL的底物(TMB Substrate),轻轻振荡混匀1 min,用盖板膜盖板后,(22.5±2.5)℃避光孵育15~20 min;每酶标板孔加入100 μL的终止液(Stop Buffer)终止显色反应,轻敲微孔板边缘混匀1 min,稳定1 min后,上机测定(上机前30~40 min打开酶标仪,使仪器状态稳定,并将测试波长设定为450 nm)。
2结果与分析
2.1提取溶剂的选择
DES为一类脂溶性化合物,易在动物的脂肪及组织中残留[3]。在前处理过程中,根据样品的不同性质,一般用叔丁基甲基醚、乙腈、乙酸乙酯、甲醇、乙醇等有机溶剂对待测组分进行提取。近年来,已有研究表明叔丁基甲基醚能引起头痛、头晕、恶心等症状,具有致突变性及致癌作用[18],美国 EPA 已将其列入致癌物质名单中[19];乙腈、甲醇、乙醇与水的互溶性较强,会将水产品中部分水溶性蛋白提取出来,带来更多杂质,使提取液浑浊,不利于后续净化[20];乙酸乙酯极性与DES极性相近,用乙酸乙酯提取的样品回收率趋于稳定状态,为净化工序提供有力保障,回收率高,效果理想,是DES最佳提取溶液[21-22]。因此,本方法选用乙酸乙酯作为提取溶剂。
2.2振荡提取的选择
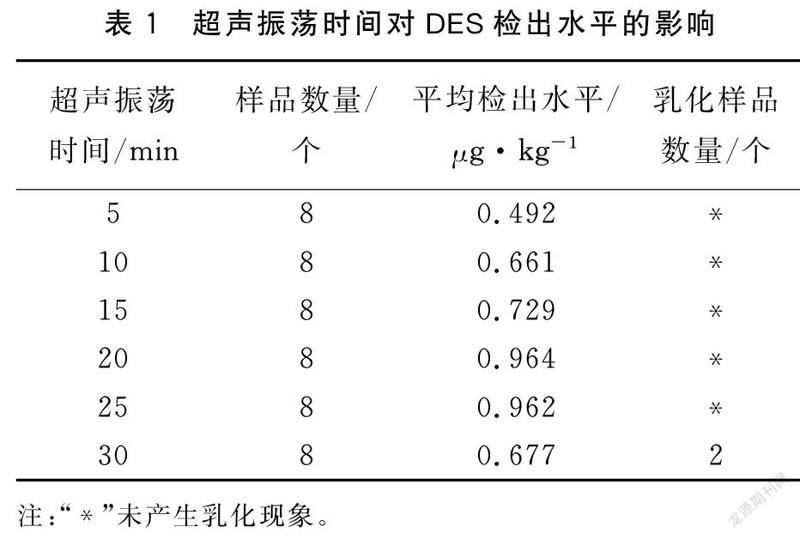
徐英江等[16]研究发现,对动物源性样品中DES提取,采用超声振荡提取可以使溶剂快速地进入到固体物质中或与液体物质尽快混合,具有缩短提取时间,有效提高萃取率,节约成本等优点;陈溪等[23]对化妆品中DES等7种雌激素采用超声振荡提取,经凝胶渗透净化色谱(GPC)净化,回收率为69.4%~108.7%;刘美华等[24]用离子液体和分散剂对废水样品中DES等组分进行超声辅助萃取,提高了回收率。综上所述,采用超声振荡的方式对目标组分进行提取已成为一种常态。故本方法将涡旋振荡提取优化为超声振荡提取。但是,超声提取时间过短容易混合不匀,提取不充分,造成假阴性;超声提取时间过长会溶解出更多的杂质成分造成乳化现象,把握好超声振荡时间是操作的关键。
选取中国对虾苗种、三疣梭子蟹苗种、刺参苗种、牙鲆苗种4种不同基质的DES阴性样品,每种基质样品称取12份,均添加为1.00 μg·kg加标水平,每2份为一组,设6个平行组。固定超声频率为40 kHz,分别超声振荡5、10、15、20、25、30 min,以考察超声振荡时间对DES检出水平和提取液乳化现象的影响(表1)。试验结果显示,超声时间在5~25 min范围内,样品提取液状态良好,未出现混浊和乳化现象,超声超过25 min时,样品提取液开始出现混浊和乳化现象;样品平均检出水平在5~20 min范围内随着时间的延长而提高,在20 min时达到最大值,在20~25 min范围内基本不变,超声时间为30 min时,平均检出水平明显降低,这可能是多次用正己烷去乳化层导致DES损失所致。由此可见,超声振荡适用于DES的提取,且最佳超声提取时间为20 min。
2.3加标回收率与精密度(RSD)
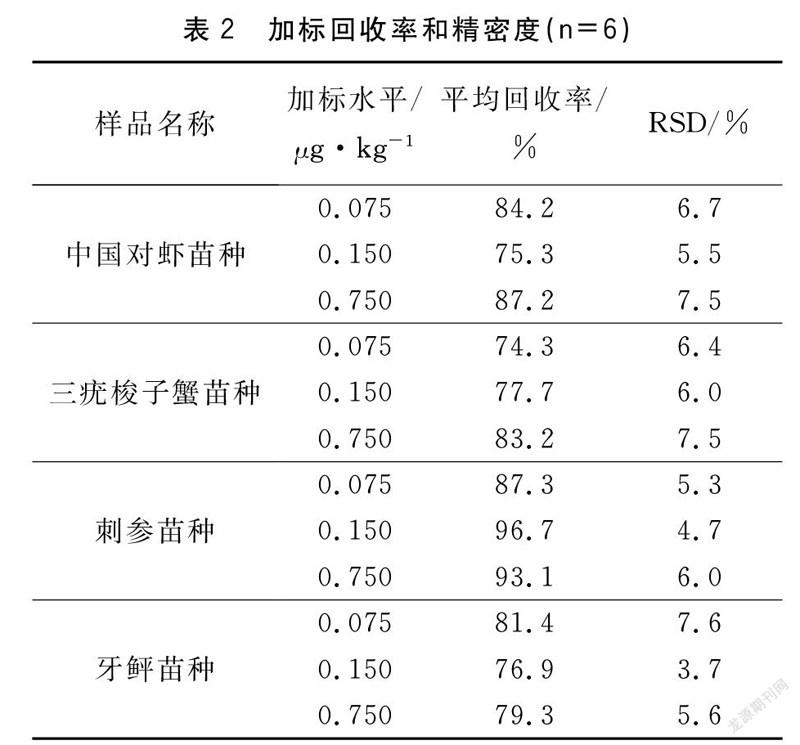
GB/T 27404-2008《实验室质量控制规范 食品理化检测》[25]规定,对食品中禁用药物,回收率应在方法检测下限、两倍方法检测下限和十倍方法检测下限进行加标回收率试验。同大型仪器分析法的自动进样方式不同,ELISA法是手动进样,如何正确操作微量移液器是减少偶然误差、增加微量进样稳定性、确保精密度、提高加标回收率的关键,梁娟等[26]认为“吸二打一”的操作手法是有效解决这一问题的关键。本文选取4种不同基质的DES阴性样品,分别作0.075、0.150和0.750 μg·kg三个加标水平进行检测,每个加标水平设6组重复,计算平均回收率和RSD。三个加标水平回收率均在74.3%~96.7%之间,RSD测定范围为3.7%~7.6%(表2)。由此可见,本文所建立的方法具有良好的准确度和RSD,可以对样品中DES残留量进行定性、定量测定。
2.4线性范围及定量限
针对鱼、虾等水产品中可食部分,美国柏尔生物技术公司试剂盒定量检测下限为0.075 0 μg·kg,本试验通过对前处理过程进行优化改进,中国对虾、三疣梭子蟹、刺参、牙鲆等四种不同基质苗种在0.075 0 μg·kg加标水平下,加标回收率和精密度均达到GB/T 27404-2008《实验室质量控制规范 食品理化检测》[25]的质量控制规定(表3)。与《农业部1163号公告-9-2009 水产品中己烯雌酚残留检测 气相色谱-质谱法》[27]中规定的GC-MS法相比,ELISA法定量限较低、灵敏度较高(表3),DES在0.150~9.00 ng·mL的水平范围内,标准曲线线性关系良好R2=0.997。
2.5基质效应的考察
不同种类的样品之间性质差异很大,会产生不同的基质效应,样品基质对反应的干扰是影响ELISA法检测结果准确性的一个重要因素。样品或样品提取液中的化学物质,如杂蛋白、脂肪、色素等,可能会影响抗体与DES的结合,降低方法灵敏度和稳定性,甚至导致假阳性[28]。根据农业部1192号公告-1-2009《水产苗种违禁药物抽检技术规范》[29]中规定,苗种样品的制备不应只取可食部分,而是整条/只搅碎混合均匀。可能是蟹壳、鱼骨、虾壳等杂质的影响,造成样品空白的检出水平偏高,导致中国对虾、三疣梭子蟹、牙鲆等苗种的基质效应比较明显,加标回收率相对刺参苗种较低,但四种不同基质样品的三个加标水平回收率均在74.3%~96.7%之间,精密度测定范围为3.7%~7.6%(表3),符合水产品质量安全主管部门的规定。由此可见,本方法适用于不同基质水产苗种中DES的测定。
2.6正己烷的优化结果
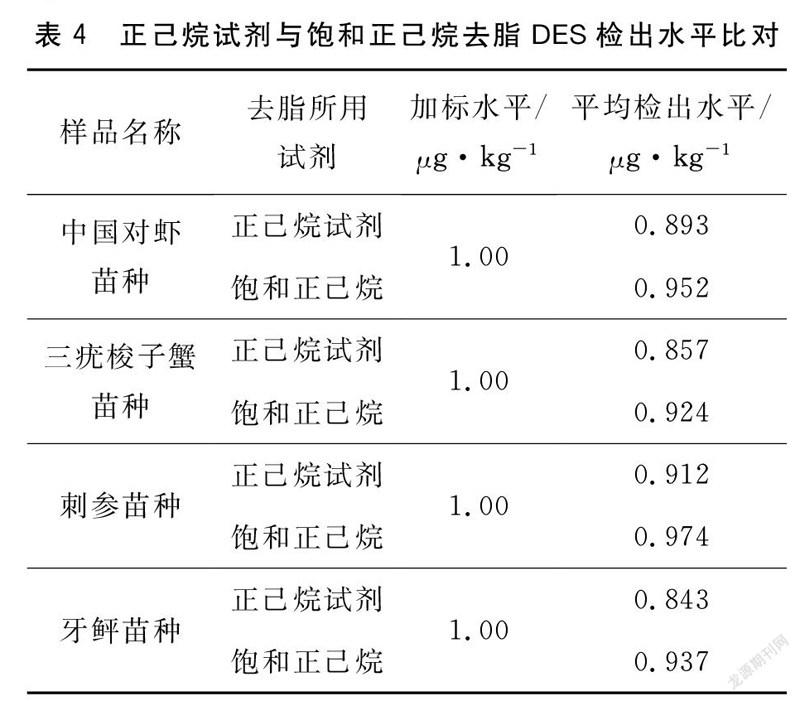
DES具有很强的亲脂性,水产苗种样品基质复杂、脂肪含量高,提取液极易产生浑浊或乳化现象,不利于DES的提取和凈化,容易在测定过程中产生ME,因此有必要在前处理过程中用正己烷对样品提取液进行净化,以将溶液中的杂质、脂肪去除。当乳化现象比较严重,乳化层不能一次去除时,需要增加正己烷去脂的次数。但是,用正己烷去脂净化的同时会导致样品提取液损失一部分DES,使得目标组分检出水平降低,容易导致样品的假阴性。将正己烷用纯水进行饱和,可以减少DES的损失,提高检测结果的准确性。
本文用DES阴性样品作1.00 μg·kg加标水平,分别用正己烷试剂和饱和正己烷进行去脂,每种去脂方式设3组重复,分别计算平均检出水平。结果显示,用饱和正己烷去脂的样品检出浓度较高(表4),由此可见用纯水对正己烷试剂进行饱和的必要性。
2.7温度对测定值的影响
ELISA法测定温度应严格控制在(22.5±2.5)℃,温度过高或过低,都不利于抗原抗体有效结合,降低灵敏度和方法稳定性。当0浓度标准点的吸光度值(B0)低于0.6时,表示试剂可能变质[28,30]。但是,不同批次的试剂盒可能显示不同的B0值,相对吸光度值具有很好的稳定性。梁康建等[28]通过试剂盒稳定性实验得知,50%抑制DES浓度的吸光度值(B)与0浓度标准点的吸光度比值高于0.7(即B/B0>0.7)时,即可判定ELISA试剂盒已失效。试剂盒应在2~8 ℃温度下储存,在37 ℃温度下放置1 d,相当于在4 ℃温度下放置45 d,使试剂盒保质期缩短。
3结论与讨论
ELISA法的缺点是影响因素较多,易出现大量假阳性结果,抗体批次不同,测定结果也会出现差异。但大型仪器分析方法对仪器设备要求较高,样品前处理过程复杂,难以实现大量样品现场快速检测。与大型仪器分析方法相比,ELISA法具备灵敏快捷、精密度高、分析成本低、操作步骤简单、有机试剂使用量少、对人体伤害和环境污染危险性小等优势。通过多年实际检测结果得知,用本方法检出的阳性样品,后续又用GC-MS法对其结果进行确证,检测结果一致。由此可见,本方法可用于实际样品检测,能够较好地满足水产苗种质量安全监管部门的需要,是目前水产苗种质量安全检测工作中值得推广的方法。参考文献:
[1] HU Q,GUAN X Q,SONG L L,et al.Inhibition of pancreatic lipase by environmental xenoestrogens [J].Ecotoxicology and Environmental Safety,2020,192:110305.
[2] 王瑜,任舒悦,姜会聪,等.上转换发光免疫层析试纸条快速定量检测己烯雌酚[J].分析化学,2017,45(1):35-41.
[3] 冒玉娟,王婧,刘佳敏,等.己烯雌酚残留检测研究进展[J].畜牧与饲料科学,2019,40(5):28-32.
[4] MITRA M S,PHILIP B K.Diethylstilbestrol[M]//Encyclopedia of Toxicology.Amsterdam:Elsevier,2014:143-145.
[5] 安卫娟,钟敏,张庆华,等.响应面分析法优化沙雷氏菌(Serratia sp.)AXJ-M对己烯雌酚的降解[J].微生物学通报,2021,48(11):4006-4018.
[6] 王宇,孔祥瑞,李成久.气相色谱—质谱法测定水产品中己烯雌酚的不确定度分析评定[J].水产科学,2016,35(3):284-288.
[7] 陈星星,黄振华,周朝生,等.水产品中药物残留仪器分析技术的研究进展[J].浙江农业科学,2019,60(7):1241-1243+1258.
[8] 邓爱妮,陶艳玲,张昱,等.固相微萃取高效液相色谱法测定食品中己烯雌酚[J].化学研究与应用,2011,23(5):639-643.
[9] 吴红军,成强,臧素娟,等.高效液相色谱法测定水产品中己烯雌酚的残留量[J].安徽农业科学,2014,42(14):4447-4448.
[10] 彭婷婷,徐晓萍,朱晓蕾,等.液相-质谱联用法检测食品中己烯雌酚的研究[J].化工时刊,2020,34(9):20-22.
[11] ZHAO Y,BAI X L,SONG T,et al.Determination of environmental estrogens and bisphenol A in water samples byultra-high performance liquid chromatography coupled to Q-exactive high resolution mass spectrometry after magnetic solid-phase extraction[J].Microchemical Journal,2019,151:104212.
[12] 曹晓琴,方振峰,张涛,等.UPLC-MS/MS同时测定14种药食同源动物性食品中4种甾体激素[J].食品工业,2021,42(5):422-426.
[13] KAUFMANN A,BUTCHER P,MADEN K,et al.High-resolution mass spectrometry-based multi-residue method covering relevant steroids,stilbenes and resorcylic acid lactones in a variety of animal-based matrices[J].Analytica Chimica Acta,2019,1054:59-73.
[14] 中华人民共和国农业部.水产品中己烯雌酚残留量的测定 酶联免疫法:SC/T 3020-2004[S].北京:中国农业出版社,2004:1-7.
[15] 中华人民共和国农业部.动物性食品中己烯雌酚残留检测:酶联免疫吸附测定法:农业部1163号公告-1-2009[S].北京:中国农业出版社,2009:1-3.
[16] 徐英江,黄会,田秀慧,等.己烯雌酚和双烯雌酚对生物的影响及分析方法研究进展[J].中国渔业质量与标准,2014,4(5):40-48.
[17] 李宁,霍峰,董艳峰,等.饲料中己烯雌酚ELISA检测方法的建立[J].黑龙江畜牧兽医,2016(17):284-286.
[18] 梁增强,杨菁.甲基叔丁基醚环境污染特性及修复技术研究进展[J].环境与发展,2020,32(1):9-10.
[19] 陳井影,赵晓松,王玉军.甲基叔丁基醚(MTBE)研究新进展[J].吉林农业大学学报,2004(2):182-186.
[20] 马丽莎,戴晓欣,谢文平,等.QuEChERS/GC-MS法同时测定鱼、虾中的雌二醇与己烯雌酚残留[J].分析测试学报,2015,34(1):62-66+72.
[21] 蒋翠红.气质检测水产品中己烯雌酚含量的研究[J].食品安全导刊,2016(12):91.
[22] 黄雪玲,戚隽渊,魏厚道,等.固相萃取-高效液相色谱法同时测定水产品中的己烯雌酚和甲基睾丸酮[J].江苏农业科学,2015,43(5):285-287.
[23] 陈溪,沈葆真,张晓林,等.凝胶渗透净化色谱-液相色谱串联质谱法测定化妆品中7种雌性激素[J].日用化学工业,2013,43(5):393-396.
[24] 刘美华,邱彬,陈国南,等.超声辅助离子液体分散液相微萃取-高效液相色谱法测定废水中雌激素的研究[J].分析测试技术与仪器,2009,15(3):151-157.
[25] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.实验室质量控制规范 食品理化检测:GB/T 27404-2008[S].北京:中国标准出版社,2008:26-27.
[26] 梁娟,于盟盟,韩梅,等.ELISA法检测水产品中硝基呋喃代谢物残留见解[J].河北渔业,2014(4):45-47.
[27] 中华人民共和国农业部.水产品中己烯雌酚残留检测:气相色谱-质谱法:农业部1163号公告-9-2009[S].北京:中国农业出版社,2009:1-5.
[28] 梁康建,白瑞樱,宋利君,等.己烯雌酚残留检测ELISA试剂盒的研制及应用[J].食品科技,2011,36(9):347-352.
[29] 中华人民共和国农业部.水产苗种违禁药物抽检技术规范:农业部1192号公告-1-2009[S].北京:中国农业出版社,2009:1-3.
[30] 孙俐,高晓敏.酶联免疫法测定肉及肉制品中己烯雌酚残留量[J].食品研究与开发,2010,31(1):122-125.Establishment of enzyme linked immunosorbent assay
for diethylstilbestrol in aquatic seedlings with different substrates
LIANG Juan WEI Haiying,YU Mengmeng,Zhang Qianyu,MU Dandan,ZHAO Taotao
(Rizhao Marine and Fishery Research Institute,Rizhao 276826,China)
Abstract:In order to establish an enzyme-linked immunosorbent assay (ELISA) method for the qualitative and quantitative detection of diethylstilbestrol (DES) residues in aquatic seedlings,the pretreatment process was optimized by using ethyl acetate as extractant,ultrasonic oscillation extraction instead of vortex oscillation extraction,and n-hexane saturation with pure water.At the same time,the influence of matrix effect on the detection results was investigated.Diethylstilbestrol had good linear in the range of 0.150~9.00 ng·mL-1,with the correlation coefficients R2=0.997,and the detection limit was 0.075 μg·kg-1; The average recoveries ranged from 74.3%~96.7% at the spiked level of 0075,0.150 and 0.750 μg·kg-1 in the seedlings of Penaeus chinensis,Portunus trituberculatus,Stichopus japonicus and Paralichthys olivaceus.The relative standard deviations was 3.7%~7.6%.The results showed that this method was accurate,rapid and cheap,which would be suitable for qualitative and quantitative analysis of diethylstilbestrol residues in aquatic seedlings with different substrates.
Key words:aquatic seedlings; diethylstilbestrol; residue; different substrates; ELISA

