丹酚酸B抑制MyD88/NF-κB/NLRP3通路对肺炎链球菌肺炎幼鼠的保护作用及机制
郑丽丽,康文芹,牛莎
(焦作市人民医院儿科一区,河南 焦作 454000)
肺炎链球菌是一种寄居于人体上呼吸道的球状革兰阳性菌,是引起儿童呼吸道感染致肺炎的常见病原菌[1]。目前,对肺炎链球菌肺炎的临床治疗以抗生素为主,但是,随着抗生素的广泛应用,肺炎链球的耐药性逐年升高,导致治疗效果不理想,死亡率升高[2-3]。因此,研究新型治疗肺炎链球菌肺炎的药物具有重要意义。中药在防治肺炎上具有独特的优势,丹参为唇形科植物丹参的干燥根和根茎,具有活血化瘀、抗炎和清热解毒等药理作用[4],据报道,丹参对肺炎患儿的肺功能具有一定的改善作用[5]。丹酚酸B在丹参中含量丰富,是丹参药理活性最强的成分。本研究拟通过建立肺炎链球菌肺炎幼鼠模型,研究丹酚酸B对肺炎链球菌肺炎幼鼠的保护作用及其机制,为临床治疗肺炎链球菌肺炎提供实验参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 90只3周龄SPF级雄性SD大鼠购自北京维通利华实验动物技术公司,体质量50~60 g,生产许可证号:SCXK(京)2016-0011。适应性饲养7 d后开始实验。
1.1.2 实验药品和仪器 丹酚酸B(质量分数98%,批号:200719D)购自南京道斯夫生物科技有限公司;肺炎链球菌标准菌株(批号:ATCC49619)购自上海硕欣生物科技有限公司;苏木素伊红染色剂(批号:G1120)购自北京索莱宝生物科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒、兔抗大鼠髓样分化因子88(myeloid differentiation factor 88,MyD88)、核因子κB p65(nuclear factorκB p65,NF-κB p65)、p-NF-κB p65、Nod样受体蛋白 3(Nod-like receptor pyrin domain containing 3,NLRP3)、GAPDH抗体和羊抗兔IgG二抗购自英国ABCam公司(批号:ab236712;ab234570;ab219413;ab239882;ab183559;ab270449;ab8245;ab150077);BCA试剂盒(批号:P001S)购自上海碧云天生物技术有限公司;flexiVent型动物肺功能仪购自加拿大SCIREQ公司;HD-310型生物组织自动脱水机、HistoCore_Arcadia型包埋机、RM2016型石蜡切片机均购自德国徕卡公司;Biotek Synergy 2 H1 HT型酶标仪购自美国BioTek公司。
1.2 方法
1.2.1 建模与给药 幼鼠分为对照组、模型组、丹酚酸B低、中、高剂量组,每组18只。经鼻腔滴入肺炎链球菌菌液100 μL(菌量3×107CFU/mL)建立肺炎链球菌肺炎幼鼠模型[6](对照组幼鼠经鼻腔滴入等量生理盐水)。给予菌液后,丹酚酸B低剂量组死亡2只幼鼠,模型组和丹酚酸B中、高剂量组各死亡1只幼鼠。造模后1 d,丹酚酸B低、中、高剂量组幼鼠分别灌胃10、20、40 mg/kg的丹酚酸B[7],每日1次,连续7 d,对照组和模型组灌胃等量生理盐水。至干预结束时,模型组共死亡3只幼鼠,干预期间丹酚酸B各剂量组无幼鼠死亡。观察幼鼠一般情况。
1.2.2 幼鼠肺功能指标检测 末次干预后2 h,腹腔麻醉,颈部备皮,暴露气管,进行气管插管,采用肺功能仪检测用力肺活量(forced vital capacity,FVC)和呼气峰流速(peak expiratory flow,PEF)。
1.2.3 样本取材 肺功能检测完成后,开胸取肺组织,各组随机取5只幼鼠肺组织固定于4%(φ)多聚甲醛溶液中,再从各组取5只幼鼠肺组织加生理盐水制成匀浆,4℃离心(3 000 r/min,10 min,r=8 cm),取上清液保存于-20℃;取各组剩余幼鼠肺组织液氮保存,待进行RT-qPCR检测和Western blot检测。
1.2.4 HE染色观察肺组织病理学变化 肺组织在4%多聚甲醛溶液中固定24 h,脱水后石蜡包埋切片,厚度5 μm,苏木素染色5 min,流水冲洗,1%盐酸酒精分化10 s,1%氨水返蓝后流水冲洗,伊红染液染色3 min,流水冲洗,脱水,透明,封片,光学显微镜观察各组幼鼠肺组织病理学变化。
1.2.5 ELISA法检测肺组织TNF-α和IL-6水平 取肺组织匀浆上清液,酶标板标准品孔加梯度稀释的标准品,样品孔加上清液及其稀释液,37℃孵育30 min,加酶标试剂(空白孔除外),37℃孵育1 h后加显色液显色20 min,标准品孔出现颜色变化时加终止液,以空白孔调零,450 nm波长测吸光度值(A),使用CurveExpert软件根据标准品浓度与吸光度值绘制标准曲线,计算TNF-α和IL-6含量。
1.2.6 RT-qPCR检测肺组织MyD88、NF-κB p65和NLRP3 mRNA表达水平 取部分液氮保存肺组织,Trizol法提取总RNA,检测RNA浓度及纯度。利用反转录试剂盒合成cDNA。反应条件为预变性95℃ 5 min,变性95℃ 10 s,56℃ 10 s循环40次。引物序列GAPDH:上游(5′-TGACCTCAACTACATGGTCTACA-3′),下游(5′-CTTCCCATTCTCGGCCTTG-3′);MyD88:上游(5′-AAGGTGTCGTCGCATGGTG-3′),下游(5′-TTGGTGCAAGGGTTGGTATAGT-3′);NF-κB p65:上游(5′-ACGATCTGTTTCCCCTCATC-3′),下游(5′-TGCTTCTCTCCCCAGGAATA-3′);NLRP3:上游(5′-GTGTTGTCAGGATCTCGCATTG-3′),下游(5′-AGCAGCACAGTGAAGTAAGGCC-3′)。以GAPDH为内参,2-△△Ct法计算目的基因表达水平。
1.2.7 Western blot检测肺组织 MyD88、p-NF-κB p65、NF-κB p65和NLRP3蛋白表达水平 取200 mg液氮保存肺组织,加入裂解液裂解30 min,4℃12 000 r/min,r=8 cm离心10 min,收集上清,调整蛋白上样量40 μL,10%SDS-PAGE凝胶电泳(80 V恒压电泳20 min,100 V恒压电泳90 min),转至PVDF膜(300 mA恒流转膜1 h),加5%脱脂牛奶室温封闭2 h,加入一抗(1∶1 000),4℃孵育过夜,洗膜后加入二抗(1∶3 000),再次洗膜,滴加ECL显色剂显影,以GAPDH为内参,计算目标蛋白表达量。
1.3 统计学分析
2 结果
2.1 各组幼鼠一般情况
干预1周后,对照组幼鼠精神状态良好,皮毛有光泽,进食、饮水和活动正常;与模型组比较,丹酚酸B各剂量组幼鼠体型消瘦,精神倦怠,活动减少。
2.2 各组幼鼠肺功能指标
与对照组比较,模型组幼鼠FVC和PEF降低(P<0.05);与模型组比较,丹酚酸B各剂量组幼鼠FVC和PEF升高(P<0.05);与丹酚酸B低剂量组比较,丹酚酸B中、高剂量组幼鼠FVC和PEF升高(P<0.05);与丹酚酸B中剂量组比较,丹酚酸B高剂量组幼鼠FVC和PEF升高(P<0.05)。见表1。
表1 各组幼鼠肺功能指标Table 1 Pulmonary function indexes of young mice in each group(±s)
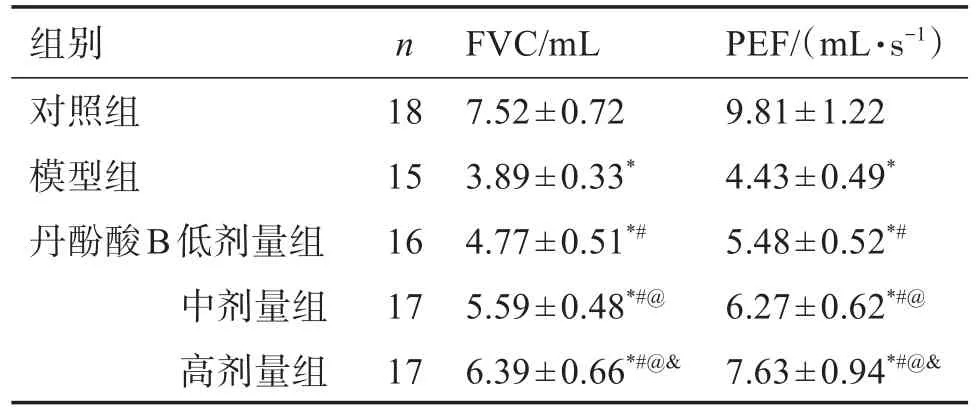
表1 各组幼鼠肺功能指标Table 1 Pulmonary function indexes of young mice in each group(±s)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与丹酚酸B低剂量组比较:@P<0.05;与丹酚酸B中剂量组比较:&P<0.05。
组别对照组模型组丹酚酸B低剂量组中剂量组高剂量组n 18 15 16 17 17 FVC/mL 7.52±0.72 3.89±0.33*4.77±0.51*#5.59±0.48*#@6.39±0.66*#@&PEF/(mL·s-1)9.81±1.22 4.43±0.49*5.48±0.52*#6.27±0.62*#@7.63±0.94*#@&
2.3 各组幼鼠肺组织病理变化
对照组幼鼠肺组织结构完整,无明显病理改变;模型组幼鼠肺组织结构模糊,有大量炎性细胞浸润;丹酚酸B各剂量组幼鼠炎性浸润得到不同程度减轻,其中以丹酚酸B高剂量组减轻效果最明显。见图1。
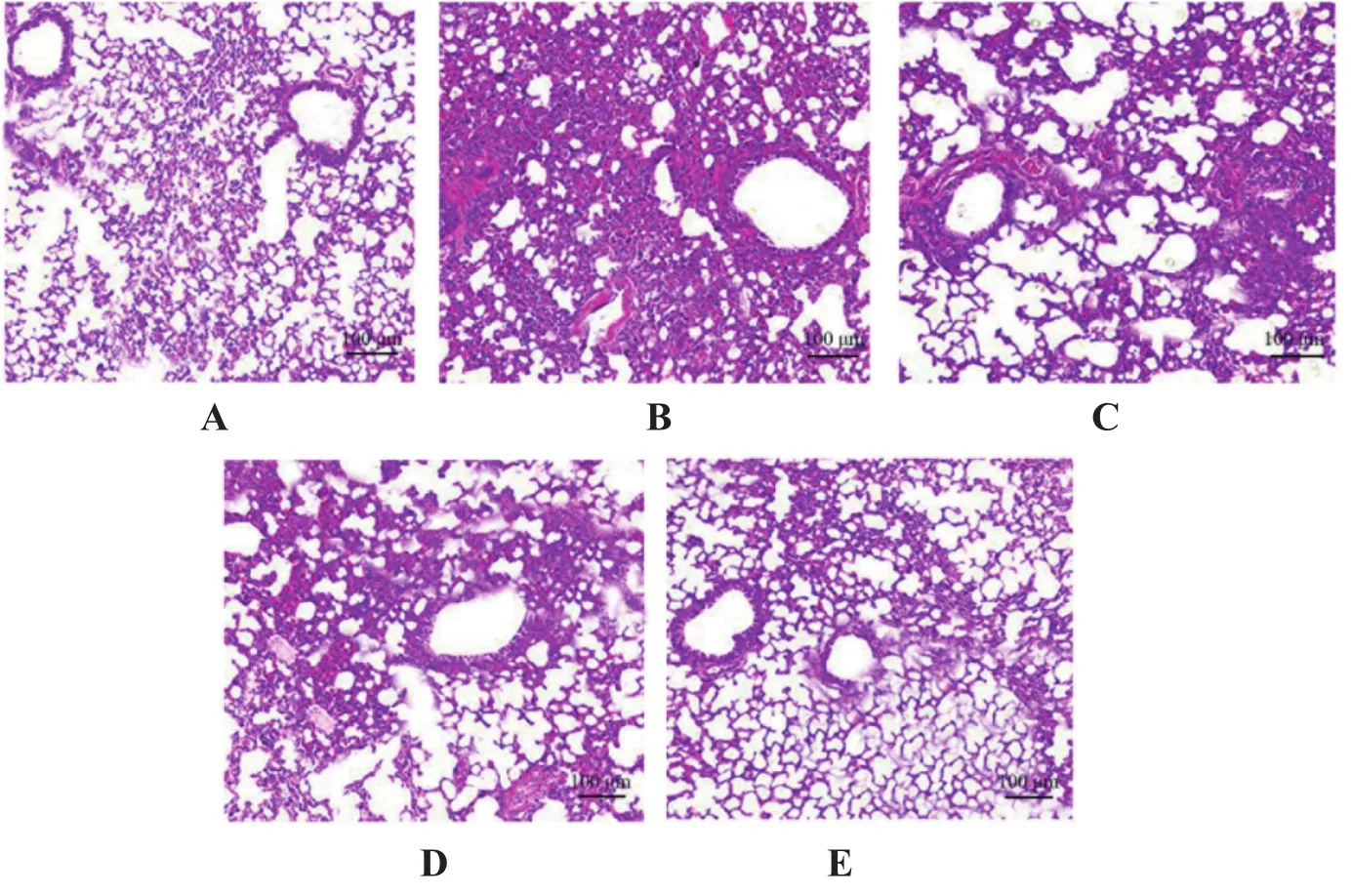
图1 各组幼鼠肺组织HE染色结果(200×)Figure 1 HE staining results of lung tissue of young mice in each group(200×)
2.4 各组幼鼠肺组织TNF-α和IL-6水平
与对照组比较,模型组幼鼠肺组织TNF-α和IL-6水平升高(P<0.05);与模型组比较,丹酚酸B各剂量组幼鼠肺组织TNF-α和IL-6水平降低(P<0.05);与丹酚酸B低剂量组比较,丹酚酸B中、高剂量组幼鼠肺组织TNF-α和IL-6水平降低(P<0.05);与丹酚酸B中剂量组比较,丹酚酸B高剂量组幼鼠肺组织TNF-α和IL-6水平降低(P<0.05)。见表2。
表2 各组幼鼠肺组织TNF-α和IL-6水平Table 2 Levels of TNF-α and IL-6 in lung tissue of young mice in each group(±s,n=5)ρ/(pg·mL-1)
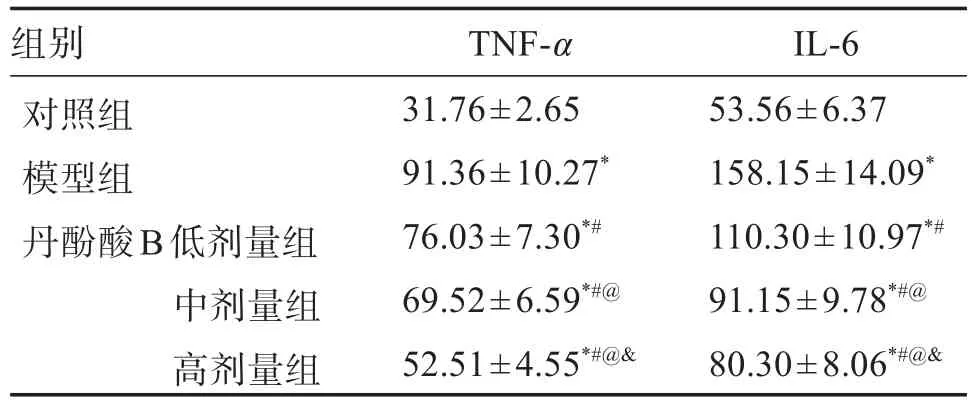
表2 各组幼鼠肺组织TNF-α和IL-6水平Table 2 Levels of TNF-α and IL-6 in lung tissue of young mice in each group(±s,n=5)ρ/(pg·mL-1)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与丹酚酸B低剂量组比较:@P<0.05;与丹酚酸B中剂量组比较:&P<0.05。
组别对照组模型组丹酚酸B低剂量组中剂量组高剂量组TNF-α 31.76±2.65 91.36±10.27*76.03±7.30*#69.52±6.59*#@52.51±4.55*#@&IL-6 53.56±6.37 158.15±14.09*110.30±10.97*#91.15±9.78*#@80.30±8.06*#@&
2.5 各组幼鼠肺组织MyD88、NF-κB p65和NLRP3 mRNA表达水平
与对照组比较,模型组幼鼠MyD88和NLRP3 mRNA表达升高(P<0.05);与模型组比较,丹酚酸B各剂量组幼鼠肺组织MyD88和NLRP3 mRNA表达水平降低(P<0.05);与丹酚酸B低剂量组比较,丹酚酸B中、高剂量组幼鼠肺组织MyD88和NLRP3 mRNA表达水平降低(P<0.05);与丹酚酸B中剂量组比较,丹酚酸B高剂量组幼鼠MyD88和NLRP3 mRNA表达水平降低(P<0.05)。见表3。
表3 各组幼鼠肺组织MyD88、NF-κB p65和NLRP3 mRNA表达水平Table 3 The expression levels of MyD88,NF-κB p65 and NLRP3 mRNA in the lung tissue of young mice in each group(±s)
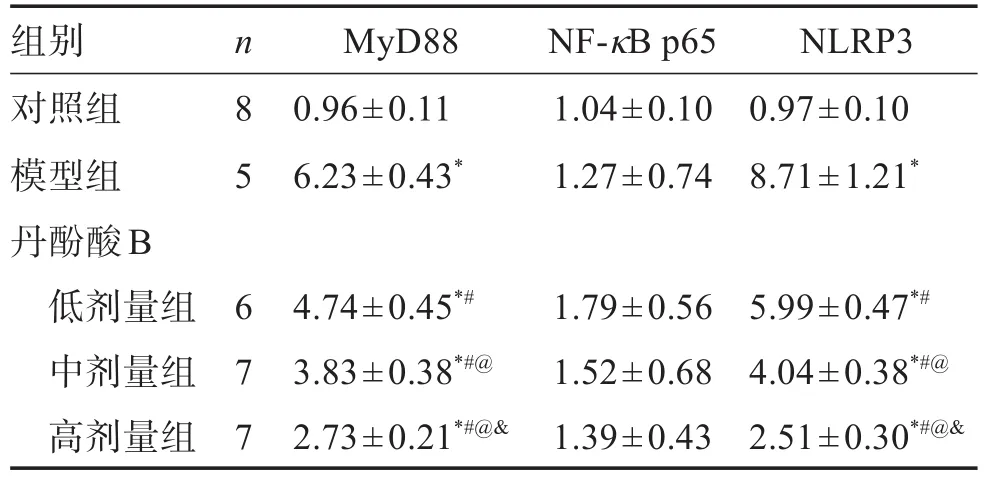
表3 各组幼鼠肺组织MyD88、NF-κB p65和NLRP3 mRNA表达水平Table 3 The expression levels of MyD88,NF-κB p65 and NLRP3 mRNA in the lung tissue of young mice in each group(±s)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与丹酚酸B低剂量组比较:@P<0.05;与丹酚酸B中剂量组比较:&P<0.05。
组别对照组模型组丹酚酸B低剂量组中剂量组高剂量组MyD88 0.96±0.11 6.23±0.43*NF-κB p65 1.04±0.10 1.27±0.74 NLRP3 0.97±0.10 8.71±1.21*5.99±0.47*#4.04±0.38*#@2.51±0.30*#@&n 8 5 6 7 7 4.74±0.45*#3.83±0.38*#@2.73±0.21*#@&1.79±0.56 1.52±0.68 1.39±0.43
2.6 各组幼鼠肺组织MyD88、p-NF-κB p65、NF-κB p65和NLRP3蛋白表达水平
与对照组比较,模型组幼鼠肺组织MyD88、p-NF-κB p65和 NLRP3蛋白表达水平升高(P<0.05);与模型组比较,丹酚酸B各剂量组幼鼠肺组织MyD88、p-NF-κB p65和NLRP3蛋白表达水平降低(P<0.05);与丹酚酸B低剂量组比较,丹酚酸B中、高剂量组幼鼠肺组织 MyD88、p-NF-κB p65 和NLRP3蛋白表达水平降低(P<0.05);与丹酚酸B中剂量组比较,丹酚酸B高剂量组幼鼠MyD88、p-NF-κB p65和 NLRP3蛋白表达水平降低(P<0.05)。见表4、图2。
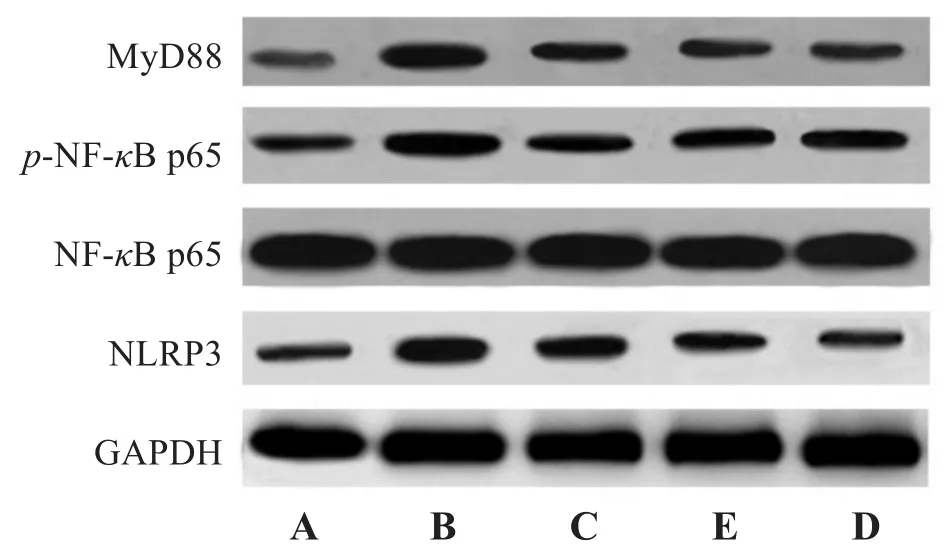
图2 各组幼鼠肺组织 MyD88、p-NF-κB p65、NF-κB p65 和NLRP3蛋白表达图Figure 2 The protein expression of MyD88,p-NF-κB p65,NF-κB p65 and NLRP3 in the lung tissue of young mice in each group
表4 各组幼鼠肺组织MyD88、p-NF-κB p65、NF-κB p65和NLRP3蛋白表达水平Table 4 The protein expression levels of MyD88,p-NF-κB p65,NF-κB p65 and NLRP3 in the lung tissue of young mice in each group(±s)

表4 各组幼鼠肺组织MyD88、p-NF-κB p65、NF-κB p65和NLRP3蛋白表达水平Table 4 The protein expression levels of MyD88,p-NF-κB p65,NF-κB p65 and NLRP3 in the lung tissue of young mice in each group(±s)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与丹酚酸B低剂量组比较:@P<0.05;与丹酚酸B中剂量组比较:&P<0.05。
组别对照组模型组丹酚酸B低剂量组中剂量组高剂量组n 8 5 6 7 7 MyD88 0.19±0.02 0.79±0.05*0.58±0.06*#0.42±0.04*#@0.29±0.02*#@&NF-κB p65 1.01±0.07 1.04±0.09 1.02±0.09 1.01±0.07 1.04±0.06 p-NF-κB p65 0.21±0.02 0.82±0.06*0.63±0.05*#0.49±0.05*#@0.36±0.03*#@&NLRP3 0.26±0.03 0.88±0.07*0.68±0.05*#0.49±0.06*#@0.41±0.04*#@&
3 讨论
肺炎可分为细菌性肺炎和病毒性肺炎,肺炎链球菌是细菌性肺炎的常见致病菌[8],当机体免疫力低下时,肺炎链球菌侵入人体,引起肺泡壁水肿、肺泡炎、甚至累及全肺[9],儿童的自身免疫功能尚不成熟,因此,肺炎患者中儿童较多[10]。本研究采用鼻腔滴入肺炎链球菌菌液的方式建立肺炎链球菌肺炎幼鼠模型,HE染色结果显示,对照组幼鼠肺组织结构完整,无明显病理改变,而模型组幼鼠肺组织结构模糊,有大量炎性细胞浸润,提示模型制备成功。
FVC和PEF是判断肺功能的重要指标,指标低于正常值表示肺功能低下[11],通过检测发现,模型组幼鼠FVC和PEF较对照组降低,与模型组比较,丹酚酸B各剂量组幼鼠FVC和PEF升高,提示丹酚酸B可改善肺炎链球菌肺炎幼鼠肺功能,且改善作用存在剂量依赖性。机体感染肺炎链球菌后,巨噬细胞活化,产生大量TNF-α、IL-6和IL-1β等促炎因子,促进炎症反应[12],因此,减轻炎症反应是延缓肺炎链球菌肺炎发展的关键。李建成等[13]研究表明,丹酚酸B能够减轻金黄色葡萄球菌肺炎小鼠体内炎症,促进肺组织修复。本研究结果显示,模型组幼鼠肺组织中TNF-α和IL-6水平较对照组显著升高,经丹酚酸B治疗后,TNF-α和IL-6水平显著下降,提示丹酚酸B可减轻肺炎链球菌肺炎幼鼠炎症反应。
MyD88/NF-κB/NLRP3是机体内经典的促炎信号传导途径[14]。MyD88是Toll样受体(TLR)信号通路中的关键接头分子,NF-κB家族由p50、p52、p65、c-Rel和Rel B 5个相关的转录因子组成[15],其中,NF-κB p65是细胞内最常见的作用形式,NF-κB p65蛋白在磷酸化后发挥作用[16]。NLRP3炎症小体是NF-κB介导的炎性途径中重要的下游因子,当机体受到刺激时,MyD88可激活NF-κB,诱导NLRP3炎症小体表达[17]。通过抑制TLR4/MyD88/NF-κB信号通路,可抑制NLRP3炎症小体激活,从而减轻炎症反应[18]。本研究结果显示,与对照组比较,模型组幼鼠肺组织MyD88、NLRP3 mRNA和蛋白表达水平以及p-NF-κB p65蛋白表达水平均显著升高,与模型组比较,丹酚酸B各剂量组幼鼠肺组织中以上mRNA和蛋白表达水平均下降,提示丹酚酸B可能通过抑制MyD88/NF-κB/NLRP3通路相关蛋白及基因表达,减轻肺炎链球菌小鼠炎症反应。
综上所述,丹酚酸B对肺炎链球菌肺炎幼鼠具有治疗作用,其机制可能与抑制MyD88/NF-κB/NLRP3通路,减轻炎症反应有关。

