常压室温等离子体(ARTP)诱变介导的赤藓糖醇生产菌的筛选与优化
赵静宇,陈 泉,马琳琳,孙欢欢,祁庆生,,王 倩
(1.山东大学 国家糖工程技术研究中心 微生物技术国家重点实验室,山东 青岛 266237;2.中国科学院 青岛生物能源与过程研究所 生物材料重点实验室,山东 青岛 266101)
赤藓糖醇(1,2,3,4-丁醇)是一种四碳糖醇,由于其能替代糖、抗氧化且安全,被广泛用作食品和药物添加剂[1-5],目前已成为低热量健康食品原料的新宠,其需求量逐年增加。
赤藓糖醇可以通过化学合成法和生物发酵法来合成。由于低产率和高成本,化学合成法尚未被工业化[6]。赤藓糖醇的生物合成研究主要集中在高产赤藓糖醇的微生物菌株的选择和发酵工艺的优化上。目前,一些微生物如Aureobasidiumsp.[7]、Torulasp.[8]、Trichosporonsp.[9]、Candidamagnolia[10-11]和Staphylococci[12]可被用于生物法生产赤藓糖醇。在酵母或真菌中,如在Torulacorallina[8]、Candidamagnolia[10-11]和Ustilaginomycetes[13]中赤藓糖醇的合成是通过磷酸戊糖途径进行的[14]。细菌中的赤藓糖醇通常是在厌氧条件下情况下通过6-磷酸己糖浓度增加进行积累的。
菌种诱变可以增加赤藓糖醇的产量。高蕾蕾等[15]用紫外线和有机溶剂诱变获得性能稳定的酿酒酵母ERY237,在最佳发酵条件下的赤藓糖醇产量为87.8 g/L。Ishizuka等[16]用紫外光照射酵母Aureobasidiumsp.SN-124A,并用N-甲基-N′-硝基-N-硝基-胍盐(NTG)处理,突变体在培养过程中不会起泡沫,赤藓糖醇的最大产量可以达到164.8 g/L。从蜂蜜中分离出的Moniliellasp.440经过NTG处理后,突变体N61188-12能够吸收肌醇并微弱吸收赤藓糖醇,最终赤藓糖醇的产量达到237.8 g/L[17]。
此外,代谢工程方法[18]也可用于增加赤藓糖醇的产量。编码甘油激酶和甘油3-磷酸脱氢酶的基因的过表达增强了Yarrowialipolytica吸收甘油的能力,而且当甘油激酶和甘油3-磷酸脱氢酶共表达时,赤藓糖醇的生产率可达到35%[19]。球头三型孢菌(Trichosporonoidesoedocephalis)在高产赤藓糖醇的同时还会产生甘油和核糖醇,对产品的分离带来一定困难,可通过敲除与高渗透压甘油途径相关的HOG1基因得到TO3,从而减少发酵过程中副产物甘油的产生[20]。
赤藓糖醇的生产也受到培养条件的影响。通常,微生物耐受的糖浓度和渗透压越高,赤藓糖醇的生产和产能越强。耐高渗酵母在500 g/L葡萄糖溶液中旺盛生长并产生赤藓糖醇[15]。有研究发现,解脂耶氏酵母(Yarrowialipolytica)可以发酵甘油生产赤藓糖醇,产量达到93.6 g/L,得率为49%[15]。另外,金属离子也会影响赤藓糖醇的发酵产量。如发酵Torulasp.时添加金属离子Cu2+可以增加细胞中赤藓糖还原酶的活性。Mn2+可以改变细胞的通透性并降低细胞中赤藓糖醇的浓度[21]。Mn2+和Cu2+也可以提高三角酵母的赤藓糖醇产量[15]。
本研究中,笔者从蜂巢、土壤、花粉和花蜜中筛选了1株高产菌株并鉴定为Moniliellasp.MU1。通过常压室温等离子体(ARTP)生物育种系统对其进行诱变,选择具有高赤藓糖醇产率的4个菌株,通过不同的碳源、葡萄糖浓度和金属离子对其进行发酵条件优化,以期为后期的生产提供基础数据。
1 材料和方法
1.1 材料
本研究中使用的土壤、蜂巢、花蜜和花粉是从青岛附近的果园和养蜂场收集的。将这些样品在30 ℃的富集培养基[22](300 g/L葡萄糖,10 g/L酵母粉)上富集3~6 d,然后将样品转移到补充有20 g/L琼脂的固体富集培养基中。从富集培养基中选出的单菌落在发酵培养基(200 g/L葡萄糖,10 g/L酵母粉,1 g/L尿素)[23]中30 ℃、180 r/min培养4 d。
用于发酵优化的培养基中含有10 g/L的酵母粉、1 g/L尿素、200~300 g/L葡萄糖和不同的金属离子溶液(CuSO4·5H2O 2 g/L,MnSO4·4H2O 50 mg/L,CaCl21 g/L,FeSO4·7H2O 2 g/L)。将培养基的pH控制在5.5。所选菌株接种到50 mL发酵优化培养基中,在30 ℃下培养24 h,然后以5%的接种量接种至摇瓶发酵中。将发酵摇瓶置于30 ℃或34 ℃的振动器中8 d,每24 h取样一次以测量葡萄糖剩余量。
限制性内切酶、DNA聚合酶、连接酶及凝胶提取试剂盒购自Thermo Fisher Scientific公司;ITS1和ITS4引物(ITS1:cgcaatggttacgatcaccag,ITS4:aggatgcggggtcagtttgcac)由擎科生物科技有限公司合成。
1.2 发酵产品分析方法
赤藓糖醇最初是使用薄层色谱法鉴定的[24]。将挑选的菌株接入发酵培养基,在30 ℃、180 r/min下培养4 d,并将发酵上清液用于薄层色谱分析。薄层色谱展开剂为正丁醇-乙酸-水,体积比为4∶ 1∶ 1。显影液A为1 g/L高碘酸钠溶液;显影液B为80 mL的体积分数为95%乙醇、70 mL的蒸馏水、30 mL的丙酮、1.5 mL的盐酸中加入0.8 g联苯胺溶剂,静置12 h,以备后用。通过高效液相色谱(HPLC)检测赤藓糖醇生产菌株的发酵液[25-26],以计算出每种发酵液产物的含量。HPLC条件:Waters 510泵,410折射率检测器,U6K手动进样器,810色谱工作站。4.6 mm×250 mm的Waters NH2色谱柱,柱温35 ℃,流动相为乙腈与水(体积比 80∶ 20),流速为1.5 mL/min。
1.3 ARTP诱变方法
为了获得生产赤藓糖醇的突变菌株,利用ARTP生物育种系统(清华大学和北京四清源生物技术有限公司)。该系统由气体供应控制子系统、同轴等离子发生器、不锈钢制成的样品板和射频电源组成。将要突变的菌株在摇瓶中培养至指数期。将15 μL培养物浸在无菌不锈钢板上,射频功率输入设为100 W,等离子炬喷嘴出口与样品板之间的距离为2 mm,空气流量为10 mL/min,等离子流温度为25~35 ℃。为了找到最佳的诱变处理时间,将等离子处理时间设置为0、15、30、60、120和180 s。洗涤细菌样品,然后将其涂在准备好的钢板上进行诱变。诱变后,将钢板浸入含有1 mL无菌水的EP管中,并以10-2、10-4和10-6的稀释倍数涂布钢板。
2 结果与讨论
2.1 赤藓糖醇生产菌的筛选
富集培养收集到的样品,将选出的20株菌落在高浓度葡萄糖发酵培养基中培养4 d。将发酵液通过薄层色谱法对赤藓糖醇进行鉴定,发酵液中有较多的赤藓糖醇积累。通过HPLC对含量进行测定,结果如图1所示。由图1可知:待检测的4种菌株(C18、C34、C91、C97)中,赤藓糖醇的质量浓度均超过40 g/L;同时还发现,C91与C97菌株的葡萄糖剩余量为0,而C18和C34菌株的残糖量很高,当葡萄糖初始质量浓度为300 g/L时,分别剩余106和78 g/L。此外4种菌株中均有副产物甘油的产生,其中C91、C97、C18 以及C34菌株的甘油产量分别为3、3、18和19 g/L,C91与C97菌株的甘油产量明显低于C18与C34菌株。发酵液中除了甘油、赤藓糖醇的积累,并未发现其他的副产物产生。
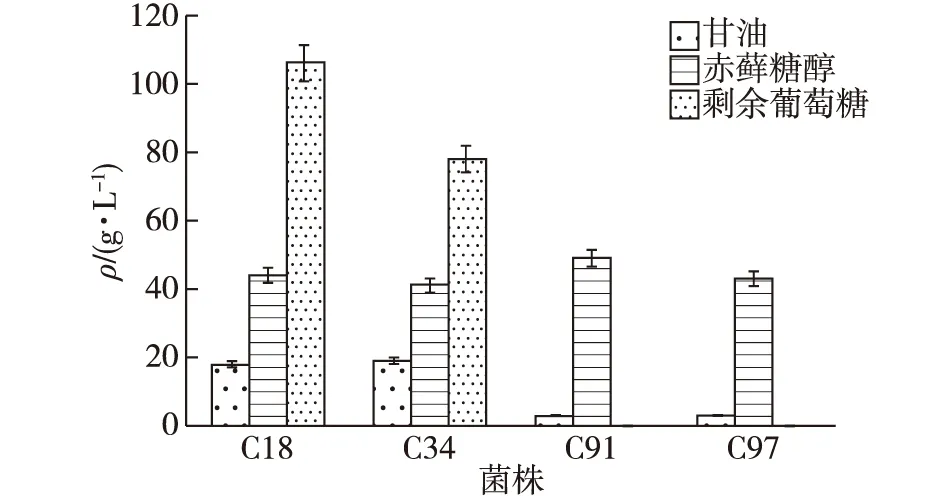
图1 4种筛选菌株的产物浓度和葡萄糖消耗情况Fig.1 Product concentration and glucose consumption of the four screened strains
为了鉴定这些筛选到的菌株,合成了真菌ITS序列的引物ITS1和ITS4。选择赤藓糖醇产量较高的菌株C18、C34、C91和C97的基因组作为模板进行PCR扩增并测序。最后,仅C91菌株被鉴定出来,将通过PCR扩增获得的产物进行序列比对,其基本上与真菌ITS序列的大小匹配,确定其为Moniliellasp.。
2.2 ARTP诱变结果
将C91菌株在摇瓶中培养至对数生长期,清洗细菌并将其涂布在钢板上。在诱变期间,将离子束照射时间分别设置为1、2和3 min。诱变完成后,将细菌溶液稀释并涂板。从平板菌落中挑选细菌后,获得了135个MU1突变体,并根据诱变时间进行了编号和划线。对上述菌株进行发酵实验,在24孔细胞培养板中于30 ℃和200 r/min下培养4 d,将发酵液稀释100倍并通过HPLC分析。从这135个MU1突变菌株中选出了赤藓糖醇产量超过15 g/L的22个菌株,赤藓糖醇、葡萄糖的浓度和糖转化率如图2所示。由图2可知:这些突变菌株中赤藓糖醇的产量大小范围为20~60 g/L,最高产量可以达到60 g/L的突变株分别是YE-A12、YE-B18和YE-B29。基于对糖转化率的分析,选择YE-A3、YE-A27、YE-B10和YE-B22作为后续的实验菌株,它们糖转化率大于60%,分别为62.5%、64.3%、64.3%和66.7%。

图2 ARTP突变菌株的赤藓糖醇发酵中赤藓糖醇的生产情况、糖转化率和葡萄糖的消耗情况Fig.2 Erythritol production,sugar conversion rate and glucose consumption in erythritol fermentation of ARTP mutant strain
2.3 赤藓糖醇发酵条件的优化结果
2.3.1 不同碳源对赤藓糖醇产量的影响
笔者首先优化了在不同碳源下的赤藓糖醇产量(初始200 g/L葡萄糖或甘油)。在YPD培养基中挑选了4种菌株,分别为YE-A3、YE-A27、YE-B10和YE-B22,添加200 g/L的葡萄糖或甘油,发酵24 h后检测赤藓糖醇的合成情况,结果如图3所示。由图3可知:上述4种菌株利用葡萄糖生产赤藓糖醇的能力明显优于甘油。当利用甘油作为碳源时,4种菌株的赤藓糖醇平均产量为11 g/L,而当利用葡萄糖作为碳源时,4种菌株的赤藓糖醇平均产量高达30 g/L。同时,当利用葡萄糖作为碳源时,最佳菌株YE-B10可以产生40 g/L的赤藓糖醇,是利用甘油作为碳源的赤藓糖醇浓度的2倍(利用甘油作为碳源时,YE-B10只能产生20 g/L的赤藓糖醇)。此外还发现,不论利用哪种碳源,4种菌株赤藓糖醇的产量从大到小依次为顺序为YE-B10、YE-A3、YE-B22、YE-A27。当利用甘油作为碳源时,4种菌株的赤藓糖醇产量从大到小依次为20、10、7.5和5 g/L;当利用葡萄糖作为碳源时,4种菌株的赤藓糖醇产量从大到小依次为40、35、25和20 g/L。
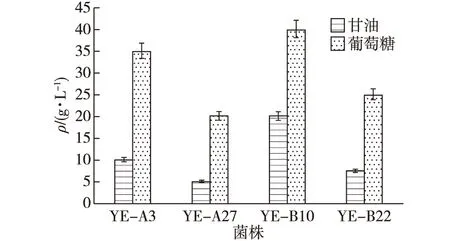
图3 不同碳源对赤藓糖醇产量的影响Fig.3 Effects of different carbon sources on erythritol production
2.3.2 不同金属离子对赤藓糖醇产量的影响
为了研究赤藓糖醇产量与添加金属离子类型之间的关系[27](金属离子分别为Ca2+、Mn2+、Fe2+和Cu2+,最终质量浓度为1 g/L、50 mg/L、2 g/L和2 g/L),在发酵开始时,将不同的金属离子溶液加入摇瓶中持续发酵8 d,结果如图4所示。由图4可知:添加Ca2+和Mn2+可以显著增加这4种菌株的赤藓糖醇产量,添加Ca2+的效果通常高于Mn2+,添加Ca2+时4种菌株的赤藓糖醇平均产量约为62 g/L;添加Mn2+时4种菌株的赤藓糖醇平均产量约为50 g/L。与添加Ca2+和Mn2+的效果相比,Cu2+和Fe2+促进赤藓糖醇生成的能力相对不足。当添加Ca2+时,YE-A27菌株的赤藓糖醇产量最高,为73 g/L ;当添加Mn2+时,YE-B10菌株的赤藓糖醇产量最高,为71 g/L ;当添加Cu2+时,YE-B22菌株的赤藓糖醇产量最高,为28 g/L ;当添加Fe2+时,YE-A27菌株的赤藓糖醇产量最高,为32 g/L 。
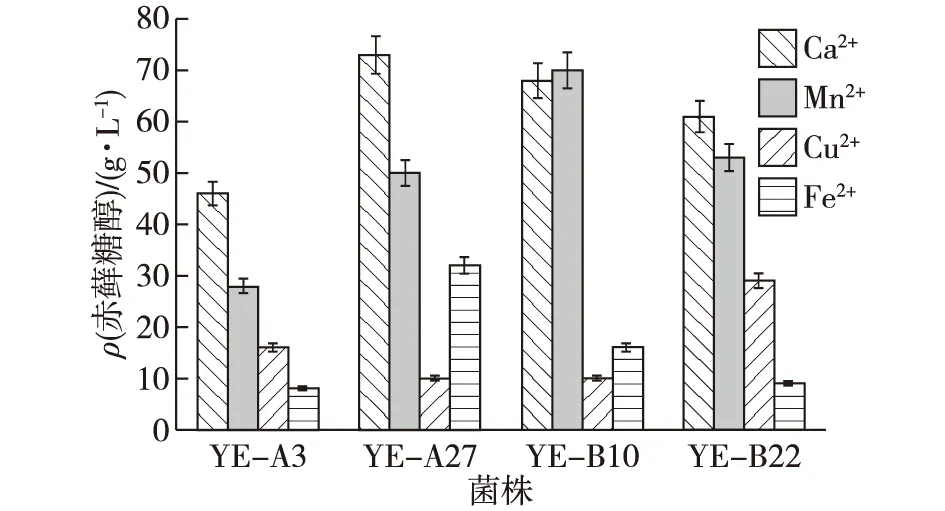
图4 不同离子菌株对赤藓糖醇产量的影响Fig.4 Effects of different ion on erythritol production
2.3.3 不同菌株葡糖糖代谢及产物积累分析
为了分析葡萄糖初始浓度对赤藓糖醇积累的影响,选择YE-A27和YE-B10作为生产菌株,初始葡萄糖质量浓度分别为200和300 g/L[8](均在培养基中),并提供25 mmol/L Ca2+,考察发酵液中赤藓糖醇及甘油积累曲线,结果如图5所示。由图5可知:YE-A27和YE-B10在200 g/L与300 g/L葡萄糖作为初始碳源的情况下分别生长168、168、192和192 h,赤藓糖醇产量分别为72.9、97.6、66.3和88.5 g/L。经过比较发现,无论是YE-A27还是YE-B10菌株,300 g/L葡萄糖作为初始碳源的最大产量普遍高于200 g/L葡萄糖作为初始碳源的最大产量,且YE-A27在300 g/L葡萄糖作为初始碳源的情况下获得最高赤藓糖醇产量97.6 g/L。此外,在YE-A27和YE-B10菌株中还发现了一个现象,除YE-B10在300 g/L葡萄糖作为初始碳源的情况下不明显外,其余发酵情况下的甘油浓度先升高后降低,且无论在何种浓度葡萄糖作为初始碳源,YE-B10菌株生成最大甘油量的时间普遍长于YE-A27菌株。因此推测,在发酵初期葡萄糖浓度较高时,该菌株可以利用葡萄糖产生赤藓糖醇,也可以合成甘油;葡萄糖耗尽后,产生的甘油可再次用作碳源,从而导致甘油浓度随之降低。
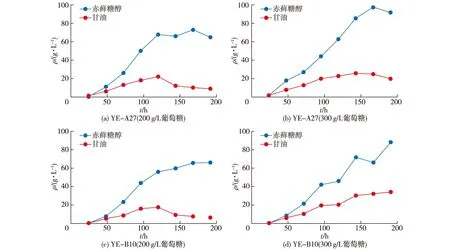
图5 不同葡萄糖质量浓度下YE-A27和YE-B10的赤藓糖醇和甘油合成曲线Fig.5 Erythritol and glycerol synthesis curves for YE-A27 and YE-B10 at different glucose concentration
综上所述,碳源浓度影响会赤藓糖醇的产生,初始碳源浓度越高越有利于赤藓糖醇的产生。在300 g/L葡萄糖和25 mmol/L Ca2+培养条件下,菌株YE-A27的赤藓糖醇产量最高,为97.6 g/L。
2.4 讨论
由于市场对赤藓糖醇的需求不断增加,赤藓糖醇的生物合成和产率的优化变得越来越重要。尽管在含有葡萄糖或果糖的合成培养基上发酵赤藓糖醇的研究较多,但是很少有关于讨论使用不同碳源生产这种多元醇的报道。前期研究时,笔者分别使用葡萄糖和甘油作为碳源来研究赤藓糖醇的生产,发现甘油作为碳源不适合于工程菌株生产赤藓糖醇。此外,金属离子与赤藓糖醇的产生密切相关,而Cu2+和Mn2+已被证明对Torulasp.产生赤藓糖醇非常有益[21]。据推测,Ca2+的添加可能影响工程菌株中与赤藓糖醇合成有关的酶的活性,或通过改变细胞的渗透性来促进赤藓糖醇的产生。
赤藓糖醇生产的优化可以通过控制葡萄糖浓度来实现。通常,如果微生物能耐受的糖浓度和渗透压越高时,碳源葡萄糖的初始浓度越高,对赤藓糖醇的产率和产量越有益。笔者总结了不同菌株在以葡萄糖或者甘油为底物时赤藓糖醇的产量(表1),以葡萄糖为底物时比以甘油为底物时的产量普遍偏高。2009年,Jeya等[28]使用葡萄糖作为碳源,在分批饲料培养中对P.tsukubaensisKN75进行有氧培养,赤藓糖醇的产量达到241.0 g/L。Moniliellasp.是一种渗透性酵母,对葡萄糖浓度的合理控制有助于提高赤藓糖醇的产量。在本研究中,与在含有200 g/L葡萄糖的高渗培养基中相比,Moniliellasp.在含有300 g/L葡萄糖的高渗培养基中能更好地产生赤藓糖醇。

表1 不同菌株中赤藓糖醇的产量及产率分析Table 1 Analysis of yield of erythritol in different strains
3 结论
笔者筛选了在蜂巢中产生赤藓糖醇的菌株。通过突变育种和发酵条件的优化,赤藓糖醇的产量提高到了97.6 g/L,且金属离子的类型对赤藓糖醇的生产有较大的影响,尤其Ca2+的添加可以提高赤藓糖醇的产量。同时还发现,碳源也对赤藓糖醇的生产有影响。当使用葡萄糖作为碳源时,高浓度的碳源有利于赤藓糖醇的生产。添加辅助碳源可能会增加赤藓糖醇的产量,这将在以后的研究中进一步研究。

