光对暗反应中几种关键酶的调控
邢瑞 殷宁
摘要 介绍了参与暗反应的几种关键酶,论述了它们的活性受到光的调控。
关键词 光合作用 暗反应 卡尔文循环 酶活性
中图分类号Q-49
文献标志码E
光合作用分为光反应和暗反应两个阶段,暗反应过程也被称为卡尔文循环。在暗反应中,CO2和受体1,5--磷酸核酮糖(RuBP,一种五碳糖)在1,5--磷酸核酮糖羧化酶/力口氧酶( Rubisco)的作用下结合,形成一个不稳定的六碳化合物,其随即水解生成2分子的3-磷酸甘油酸(3-PGA)。3-PGA利用来自光反应中的ATP和NADPH,并在酶的作用下被还原为3-磷酸甘油醛(3-GAP或G3P)。此时,光合作用的贮能过程完成,而生成的3-GAP -部分转化为葡萄糖等有机物,一部分经过一系列化学反应重新变为RuBP,参与下一次的循环。在暗反应中一些关键酶发挥着重要作用,但它们的活性与光的调控密切相关。lRubisco、Rubisco激活酶
1.1 两种酶的活性作用
Rubisco是一种双功能酶,在其处于活性状态下,O2和CO2都能竞争其活性部位。在细胞内O2分压高、CO2分压低时,更多的RuBP与O2结合,体现加氧酶的功能;在细胞内O2分压低、CO2分压高时,更多的RuBP与CO2结合,体现羧化酶的功能。影响植物光合速率的限制因子不是Rubisco的总量,而是被活化的Rubisco量。Rubisco活性受到Rubisco激活酶(Rubisco acti-vase,RCA)的调节,而RCA是由核基因编码的,该酶与ATP水解耦联而活化Rubisco。在黑暗条件下,Rubisco更容易结合RuBP,但没有催化活性,因此RuBP也是Rubisco活性的强抑制剂;在光照条件下,RCA能使Rubisco的构象发生变化,Rubisco释放RuBP,作为活化辅助因子的C02(不作为羧化底物)结合到Rubisco大亚基活性位点(赖氨酸的氨基)上,随即Rubisco迅速结合Mg2+,这样Rubisco就具有了催化功能。
1.2 光对两种酶的基因表达调控
高等植物的Rubisco由8个相同的大亚基和8个相同的小亚基组成。光照强度会影响Rubisco大、小亚基的基因转录水平。在小亚基基因的上游区域还有光调节的启动子,这种启动子中有光诱导的顺式作用元件,被称为光响应元件(light responsive cis-ele-ments,LREs)。研究表明,在弱光下生长的黄瓜(cum-is sativus)叶片中rbcL、rbcS及rca的轉录水平均有所下降,且Rubisco大小亚基的含量明显减少,表明弱光严重影响了叶片中rbcL、rbcS及rca基因的表达,从而抑制了Rubisco和RCA的合成,在水稻中也有类似的发现。一些研究对5d龄的黄化豌豆幼苗用红光、远红光和白光三种不同光源处理后,发现Rubisco两种亚基的mRNA水平、酶合成速率和酶含量发生变化。红光处理后两种亚基的mRNA水平上升,白光处理能加强红光的作用,而远红光处理则起抑制作用。这些结果表明,Rubisco的光诱导由光敏色素介导并受两种mRNA水平的控制。在对水稻RCA的研究中发现,水稻黄化苗在光照条件下,细胞质中由RCA基因表达的mRNA和蛋白质的含量明显增加,并能维持在相对稳定的水平,这说明光可以诱导水稻RCA基因的表达。进一步的研究表明,RCA基因的表达在转录和翻译水平上存在不同的调控机制,转录过程既受光暗交替调控,又受植物自身节奏调控,但翻译过程在更大程度上受光的调节。在对马铃薯的RCA基因的研究中发现,其表达具有光诱导特性,在其他培养条件相同的情况下,基因表达水平与光照处理时间呈正相关,每天8h光照下表达量极少,而每天24 h连续光照下表达量最高;在黑暗条件下,RCA基因不表达。
2 PRK, GAPDH, FBPase, SBPase
在卡尔文循环中,存在着5-磷酸核酮糖激酶(PRK)、3-磷酸甘油醛脱氢酶(GAPDH)、1,6一二磷酸果糖磷酸酶(FBPase)、1,7-_磷酸景天庚酮糖磷酸酶( SBPase)。这四种酶在暗反应中协调配合,共同调节暗反应。
2.1 四种酶与铁硫中心的关系
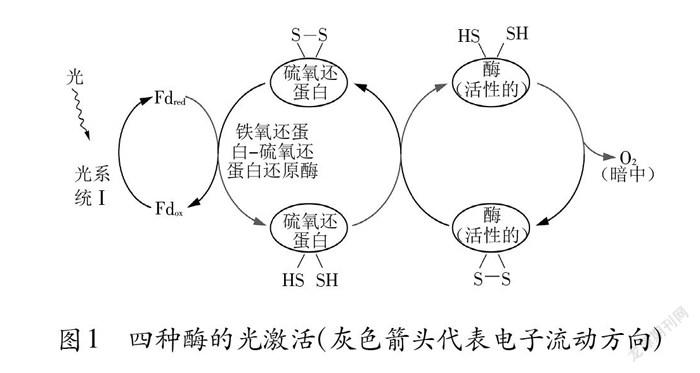
四种酶的半胱氨酸残基之间均具有二硫键。在光照下,二硫键被光还原成巯基,酶被活化;在夜间无光时,半胱氨酸残基之间的巯基被重新氧化形成二硫键,酶则失去活性。二硫键的断裂和形成与叶绿体中类囊体膜上的铁硫中心有关。铁硫中心也称为铁氧还蛋白/硫氧还蛋白( Fd/Trx)系统。在类囊体膜上存在着与光反应密切相关的光系统I和光系统Ⅱ,铁硫中心是光系统I中与类囊体膜疏松缔合的复合体。照光时,光合电子从光系统I流到氧化型Fd,氧化型Fd被还原,还原型Fd再继续提供电子给Trx,最后还原四种酶,使其中的二硫键断裂形成巯基,酶的构象发生变化,酶活性恢复。因此,这四种酶的活性受到光的间接调控(图1)。
2.2 四种酶的活性作用
PRK和GAPDH是卡尔文循环的关键酶,消耗光反应过程中产生的ATP和NADPH,还原态时为激活状态,氧化态时为失活状态。PRK为卡尔文循环的特有酶,催化卡尔文循环的最后一步反应,即借助ATP磷酸化催化5-磷酸核酮糖(Ru5P)形成CO2的受体RuBP,对调节卡尔文循环中糖的流动起着至关重要的作用。GAPDH在卡尔文循环中催化1,3-_磷酸甘油酸转变为3-GAP。叶绿体蛋白12(CP12)是与光合作用相关的蛋白。GAPDH、PRK能和CP12形成PRK/GAPDH/CP12多酶复合体,共同调控卡尔文循环:CP12先通过C端(羧基端)与GAPDH活性位点区结合形成GAPDH-CP12,降低GAPDH与其他底物结合的概率;CP12再通过N端(氨基端)与PRK结合形成PRK/GAPDH/CP12多酶复合体。在对蓝细菌的研究中发现,氧化态PRK上ATP结合位点被破坏,导致多酶复合体中氧化态的CP12占据了Ru5P的结合位点,从而使PRK的酶活性受到抑制。在弱光条件下,还原态的Trx含量较低,导致氧化态的CP12含量增加,促进多酶复合体的形成,从而抑制GAPDH和PRK的酶活性。光照下,叶绿体基质中NADP (H)INAD(H)升高,促使GAPDH-CP12解离,从而恢复GAPDH活性;黑暗下,NADP (H)INAD (H)降低,GAPDH-CP12再次形成,使GAPDH失活。
在卡爾文循环中,FBPase和SBPase的活性具有光活化暗失活的特点。FBPase催化1,6-_磷酸果糖(FBP)转化为6-磷酸果糖(F-6-P),F-6-P进一步形成葡萄糖。FBPase的活性直接影响着光合速率与碳水化合物的积累。SBPase催化1,7-_磷酸景天庚酮糖(SBP)转变为7-磷酸景天庚酮糖(S-7-P),S-7-P进一步形成RuBP。SBPase催化的反应是卡尔文循环中C02固定同化和RuBP再生的关键点,控制着整个卡尔文循环中的碳流通量。
2.3 光对四种酶的基因表达调控
在对拟南芥PRK基因的研究中发现,基因表达受到光调控,光照条件下PRK的表达量维持在一个较高的水平,但随着黑暗时间的延长,PRK的表达量逐渐下降,并维持在一个较低的水平。在对水稻PRK基因进行序列分析后发现,PRK基因的5'端存在许多光响应元件,进一步研究发现光处理能够显著提高PRK基因的转录水平。叶绿体中GAPDH基因包括GapA和GapB两种,是由光诱导的核基因。将烟草从暗处转移至白光条件下时,GapA和GapB的mRNA水平至少增加30-50倍,且GapA和GapB的mRNA积累速率相同,在24-48 h光照后达到平稳状态。还有研究发现,将成年植物的叶片从正常的光/暗循环转移到持续的黑暗中时,GapA -1、GapB、PRK和CP12-2的转录产物以相似的速率缓慢下降。
在研究外源油菜素内酯对弱光下番茄幼苗光合碳同化酶及其相关基因的影响中,发现弱光显著降低了光合速率,降低了碳同化相关酶如Rubisco、RCA和FBPase的活性,下调了碳同化相关基因如RCA、SB-Pase、PRK、GAPDH和FBPase等的表达量。在针对莱茵衣藻SBPase基因的研究中发现,黑暗中基因只有少量转录,而照光后的转录量显著增高。在对小麦和拟南芥幼苗的研究中,也发现SBPase基因的转录水平在黑暗条件下极低,而将幼苗转移到光下,mRNA含量增加至少20倍。曾有研究者克隆马铃薯FBPase的cDNA,去分析该基因在光合活性部位(叶片、茎)和非光合活性部位(块茎、根、匍匐茎)的转录水平,结果表明该基因只在光合活性部位表达,且受光的调节。
3 结语
依据上文可以得出,在卡尔文循环中,多种酶的基因表达与活性都会受到光的调控,因此,暗反应与光照完全无关的前概念是错误的。在教学中要纠正学生的错误前概念,教师需要设置相关的问题情境,使学生产生认知冲突,从而引导学生在分析与比较的基础上重构正确的暗反应概念。
参考文献:
[1]崔国新,侯杰,佟玲等.植物基因光反应元件及其结合蛋白[J].植物生理学通讯,2010,46(10):991-1000.
[2]孙建磊,王崇启,肖守华等.弱光对黄瓜幼苗光合特性及Rubisco酶的影响[J].核农学报.2017,31(06):1200-1209.
[3]Suzuki Y,Makino A.Translational downregulation of RBCLis operative in the coordinated expression of Rubisco genes in se-nescent leaves in rice [J]. Joumal of Experimental Botany,2013, 64(4): 1145-1152.
[4] Suzuki Y,Makino A.Availability of Rubisco small sub-unit upregulates the transcript levels of large subunit for stoichio-metric assembly of its holoenzyme in rice[J]. Plant Physiology,2012, 160(1):533-540.
[5] Suzuki Y, Ohkubo M, Hatakeyama H, et al.IncreasedRubisco content in transgenic rice transformed with the 'sense’rbcS gene[J]. Plant Cell Physiology, 2007, 48 (4): 626-637.
[6] Sasaki Y, Sakihama T, Kamikubo T, et al.Phyto-chrome-mediated regulation of two mRNAs, encoded by nucleiand chloroplasts of ribulose-l, 5-bisphosphate carboxylase/oxy-genase[J]. European Journal of Biochemistry, 1983, 133 (3):617-620。
[7]唐如航,贾军伟,李立人.光和糖对水稻Rubisco活化酶基因表达的影响[J].植物生理学报,1997,(4):337-341.
[8]张峰,蒋德安,翁晓燕等.水稻叶片Rubisco活化酶表达的昼夜变化[J].植物生理与分子生物学学报,2002,28(1):37-40.
[9]宋扬.马铃薯Rubisco活化酶基因组织特异性启动子的克隆及功能鉴定[D].北京:中国农业科学院.
[10] 朱圣庚,徐长法.生物化学[M].北京:高等教育出版社,2017.
[11] Yu A, Xie Y, Pan X, et al. Photosynthetic phosphoribu-lokinase structures: enzymatic mechanisms and the redox regula-tion of the Calvin-Benson- Bassham cycle [J]. The Plant Cell.2020, 32(5) : 1556-1573.
[12] Lopez-Calcagno PE, Howard TP, Raines CA. The CP12protein family: a thiore- doxin-mediated metabolic switch? [J].Frontiers in Plant Science, 2014, 5(9) : 1-9.
[13] Matsumura H, Kai A, Maeda T, et al. Structure basisfor the regulation of glyceral- dehyde-3-phosphate dehydroge-nase activity via the intrinsically disordered protein CP12[J].Structure , 2011 , 19 ( 12) : 1 846-1854.
[14]Pettersson C, Ryde- Pettersson U. Dependence of theCalvin cycle activity on kinetic parameters for the interaction ofnon-equilibrium cycle enzymes with their substrates [J]. Europe-an Journal of Biochemistry , 1989, 186: 683-687.
[15] Marri L, Sparla F, Pupillo P, et al. Coordinated geneexpression of photosynthetic glyceraldehyde-3-phosphate dehy-drogenase, phosphoribulokinase, and CP12 in Arabidopsisthaliana [J]. Joumal of Experimental Botany, 2004, 56 (409) :73-80.
[16] Chen X F, Yu T, Xiong J H, et al. Molecular cloningand expression analysis of rice phosphoribulokinase gene that isregulated by environmental stresses [J]. Molecular Biology Re-ports , 2005 , 31(4) : 249-255.
[17] Martin W, Brinkmann H, Savonna, C, et al. Evidencefor a chimeric nature of nuclear genomes: eubacterial origin ofeukaryotic glyceraldehyde- 3- phosphate dehydrogenase genes[J]. Proceedings of the National Academy of Sciences of theUnited States of America, 1993, 90(18) : 8692-8696.
[18]Shih MC, Goodman HM. Differential light regulated ex-pression of nuclear genes encoding chloroplast and cytosolic glyc-eraldehyde- 3- phosphate dehydrogenase in Nicotiana tabacurn[J]. The EMBO Journal, 1988, 7(4) : 893-898.
[19]李翔 ,桑勤勤 ,束勝等.外源油菜素内酯对弱光下番茄幼苗光合碳同化关键酶及其基因的影响 [J].报 , 2016, 43(10) : 2012-2020.
[20] Hahn, D, Kaltenbach C, Kuck, U. The Calvin cycle en-zyme sedoheptulose- 1, 7- bisphosphat - ase is encoded by alight-regulated gene in Chlamydomonas reinhardtii[J]. Plant Mo-lecular Biology , 1998, (36) : 929-934.
[21] Willingham NM, Lloyd JC, Raines CA. Molecular clon-ing of the Arabidopsis thaliana sedoheptulose- 1, 7- bisphospha-tase gene and expression studies in wheat and Arabidopsis thali-ana[J]. Plant Molecular Biology, 1994, (26) : 1191-1200.
[22] KoBmann J, MullerRober B, Dyer TA, et al. Cloningand expression analysis of the plastidic fructose- 1, 6-bisphos-phatase coding sequence from potato: circumstantial evidencefor the import of hexoses into chloroplasts [J].Planta, 1992,(188): 7-12.

