醋酸菌菌膜生产工艺条件优化
张九裕,孙楠,张薇,樊明涛, 1b
醋酸菌菌膜生产工艺条件优化
张九裕1a,孙楠2,张薇2,樊明涛1a, 1b
(1.西北农林科技大学 a.生命科学学院 b.食品科学与工程学院,陕西 咸阳 712100;2.陕西师范大学 食品工程与营养科学学院,西安 710119)
优化用醋酸菌生产菌膜的最适培养条件和方法,以期获得天然、安全的食品包装用膜的生产工艺。以涩柿醋为原料,分离筛选出高产菌膜的优良醋酸菌种,通过单因素和Plackett−Burman 等试验设计优化醋酸菌菌膜最适培养方法和工艺条件。从涩柿醋中分离纯化获得产膜醋酸菌,经鉴定为葡糖醋杆菌。用醋酸菌生产醋酸菌菌膜最优培养条件:蔗糖质量分数为5%、蛋白胨质量分数为0.7%、酵母提取物质量分数为1.2%、柠檬酸钠质量分数为0.15%、K2HPO4质量分数为0.16%、乙酸体积分数为1%、无水乙醇体积分数为2%,种龄为32 h,接种量为9%;培养5 d后,醋酸菌菌膜的平均产率为364.65 g/L,是优化前的(246.03 g/L)的1.48倍。湿膜平均含水率为99.38%,复水率为71.09%~83.39%,菌膜干膜复水率高且复水速度快,复水1 min其含水率便可达到70%以上。醋酸菌用经过优化选择的培养液和方法,可生产出高质量的菌膜。
醋酸菌;菌膜;包装;条件优化
细菌纤维素(Bacterial cellulose)与一般的植物纤维素相比,具有纯度高(由一个单糖单位组成的同聚多糖)、细腻、持水性高、复水性高以及湿态柔韧性强等优良特性[1]。目前,细菌纤维素已在多个领域获得商业化的应用,如食品工业中用作增稠剂、成型剂、结合剂等[2];在医学上常用作伤口敷料,如作为人工皮肤治疗烧伤;在其他方面,如声音震动薄膜、化妆品和生物材料方面也得到了较好的应用。Jipa等[3]报道,使用含乳酸链球菌素的细菌纤维素来包装frankfurter香肠,有效地控制了李斯特杆菌并减少了香肠表面的好氧型细菌总数。Xiao等[4]发现细菌纤维素与多聚乳酸的复合物具有更好的细菌纤维素透明度和生物适应性,并且力学性能变得更好,该复合物更加适用于食品包装。Hsiao等[5]发明了管状细菌纤维素可直接应用于素食食品包装。虽然,细菌纤维素的理化性质和柔韧性均优于植物纤维素,在工业生产中有很广泛的应用前景,但由于细菌纤维素的合成过程非常复杂,产量不高,使它在工业中的应用受到限制[6]。
醋酸菌菌膜(Acetic Acid Bacteria Pellicle,AP)是食醋生产过程或贮存中在醋液表面形成的一层凝胶状薄膜,是醋酸菌发酵食醋时代谢的副产物,随着醋液发酵或贮存时间的延长而慢慢变厚增多[7-8],该层薄膜实际就是由食醋中含有的醋杆菌属微生物发酵形成的一种细菌纤维素薄膜。醋酸菌膜在陕西、山西等地常加工成“醋粉”,视其为地方名食。笔者发现,用涩柿和杏等水果生产食醋时,在醋液表面极易产生大量的菌膜。
用醋酸菌加工的食品包装膜天然、安全、环保,生产这种包装膜是食品包装材料的发展趋势,迄今未见更多的研究报道。文中以试验室自酿的涩柿醋为材料,从中分离筛选出产菌膜的优势菌株,通过试验对醋酸菌高产菌膜的工艺条件进行优化,以期通过微生物发酵,获得可用于食品包装的醋酸菌膜的生产技术和工艺参数,为包装材料的生产和发展提供理论依据和实践指导。
1 试验
1.1 材料与仪器
主要材料:涩柿醋、杏醋,食品发酵试验室酿制,2种醋液表面都长有1 cm厚的菌膜;葡萄糖、酵母提取物、蛋白胨、琼脂、无水乙醇、冰乙酸、Na2HPO4、柠檬酸钠、K2HPO4、CaCO3。
AE培养基[9](醋酸乙醇培养基)组成:质量分数为0.5%的葡萄糖,质量分数为0.3%的酵母提取物,质量分数为0.4%的蛋白胨,质量分数为1.5%的琼脂,体积分数为3%的无水乙醇,体积分数为3%的冰乙酸。
RAE培养基(强化AE)组成:质量分数为4%的葡萄糖,质量分数为1%的酵母提取物,质量分数为1%的蛋白胨,质量分数为0.338%的Na2HPO4,质量分数为0.15%的柠檬酸钠,体积分数为2%的无水乙醇,体积分数为1%的冰乙酸,质量分数为1.5%的琼脂。
增殖培养基组成:质量分数为4%的葡萄糖,质量分数为1%的酵母提取物,质量分数为1%的蛋白胨,质量分数为0.338%的Na2HPO4,质量分数为0.15%的柠檬酸钠,体积分数为2%的无水乙醇,体积分数为1%的冰乙酸。
分离培养基组成:质量分数为10%的葡萄糖,质量分数为1%的酵母提取物,质量分数为2%的CaCO3,质量分数为1.5%的琼脂。
斜面保藏培养基组成:质量分数为0.8%的酵母提取物,质量分数为2%的葡萄糖,质量分数为0.03%的CaCO3,质量分数为0.03%的琼脂,质量分数为0.5%的蛋白胨,体积分数为0.5%的无水乙醇。
主要仪器设备:立式高压灭菌器,上海佳腾试验设备有限公司;恒温振荡器,跃进医疗机械厂;净化工作台,新苗医疗机械制造有限公司;电热恒温水槽,跃进医疗机械厂;智能恒温恒湿培养箱,宁波江南仪器厂;鼓风干燥箱,北京科伟永兴仪器有限公司;Motic(BA200、BA300),光学显微镜。
1.2 醋酸菌培养
1.2.1 种子液制备
用无菌接种针分别从长有AP薄膜的杏醋、涩柿醋中挑取适量的菌膜至无菌研钵中,并在无菌条件下进行研磨后分别吸取10 mL至装有90 mL已灭过菌的液体RAE培养基的三角瓶中,置于摇床(120 r/min、30 ℃)培养24 h。
1.2.2 接种培养
分别制备RAE培养基、AE培养基各500 mL,在121 ℃高压下灭菌20 min,冷却至50~60 ℃后加入无水乙醇和冰乙酸混匀,倒入平板;每平板接种子液0.2 mL,涂布,30 ℃倒置培养,每天观察生长情况。
1.3 产膜菌种筛选分离
1.3.1 菌种分离
增殖培养:将菌膜与醋醪用无菌研钵在无菌条件下研磨后,吸取10 mL的菌悬液于装有90 mL增殖培养基的三角瓶中,用摇床(120 r/min,30 ℃)培养24 h制成种子液。
稀释涂布:吸取种子液用无菌水依次稀释制成不同浓度梯度的菌悬液,选取3个较小浓度的菌悬液,分别吸取0.2 mL于平板中均匀涂布,每个浓度梯度做3组平行,置于30 ℃恒温箱中培养3~4 d后,观察菌体的生长情况。查看是否生出小型菌落,菌落周围出现透明圈的是醋酸杆菌,挑选透明圈较大的单菌落[10]进行革兰氏染色后在显微镜下观察菌体形态,观察结果如果显示为革兰氏阴性、短杆菌,则挑选其中分布均匀、透明圈大的单菌落移植于斜面培养基中,在30 ℃条件下恒温培养24~48 h。
划线分离:待斜面长出丰厚的菌苔后,挑取斜面菌种进行划线分离,30 ℃恒温培养3 d后镜检,若为纯培养物,则转入斜面保存培养基,在4 ℃下保藏。
1.3.2 菌种鉴定
菌落形态观察:观察记录培养3~5 d的平板培养基中菌落的形态。
生理生化试验[11-16]:根据细菌常规生理生化试验方法,对初步筛选菌种进行鉴定。
1.4 醋酸菌产膜生产条件优化
1.4.1 种龄和接种量选择
1)种龄选择。挑取适量斜面保藏菌种于增殖培养基中,振荡混匀后用8层纱布封口,置于摇床(120 r/min、30 ℃)依次振荡培养16、18、20、22、24、26、28、30、32、34、36、38 h后,测定菌液光密度(OD值)[17](600 nm),并以5%的接种量接入装有100 mL基础培养基的三角瓶(量程为250 mL)中,振荡混匀后用8层纱布封口,30 ℃静置培养5 d,测定AP的产率。
2)接种量选择。接种量是指移入种子液的体积和接种后培养液体积的比。挑取斜面菌种于装有增殖培养基的三角瓶中,振荡混匀后用8层纱布封口,并以得出的最适种龄为培养时间,分别以1%、3%、5%、7%、9%、11%、13%的接种量接入装有100 mL基础培养基的三角瓶(量程为250 mL)中,振荡混匀后用8层纱布封口,30 ℃静置培养5 d,测定AP的产率。
1.4.2 培养基成分优化
1)碳源选择及用量确定。以质量分数为4%的不同单一碳源(葡萄糖、麦芽糖、蔗糖、乳糖、甘露醇),分别替代原基础培养基中的葡萄糖,同时设定空白对照(即在基础培养基中不添加葡萄糖),分别接入体积分数为5%的种子液,30 ℃静置培养5 d后测定AP的产率,选出AP产率高的碳源并确定其最适添加量[14]。质量分数水平为1%、2%、3%、4%、5%、6%、7%。
2)氮源用量确定。通过查阅相关文献并综合经济考虑,试验选用有机氮源酵母提取物和蛋白胨,分别确定最适质量分数,分别将质量分数为0.3%、0.6%、0.9%、1.2%、1.5%的酵母提取物,质量分数为0.1%、0.4%、0.7%、1.0%、1.3%的蛋白胨添加到基础培养基中,在30 ℃下静置培养5 d后,分别测定AP的产率。
3)无机盐选择及用量确定。以质量分数为3%的不同无机盐(Na2HPO4、柠檬酸钠、K2HPO4、MgSO4)代替原基础培养基中的Na2HPO4和柠檬酸钠,30 ℃静置培养5 d后测定AP的产率,选出AP产率高的无机盐并确定其最适用量。
4)有机酸选择及用量确定。以体积分数为1%的不同有机酸(柠檬酸、酒石酸、苹果酸、富马酸、冰乙酸)代替原基础培养基中的冰乙酸,并设定空白对照,30 ℃静置培养5 d后测定AP的产率,选出AP产率高的有机酸并确定其最适用量。体积分数水平为0%、1%、2%、3%、4%。
5)无水乙醇用量确定。在基础培养基中分别添加体积分数为0%、1%、2%、3%、4%、5%、6%的无水乙醇,在30 ℃下静置培养5 d后测定AP的产率。
以上每组试验均设3组平行。
1.4.3 Plackett−Burman 试验设计
根据葡糖醋杆菌代谢产细菌纤维素的一般影响因素以及前期的单因素试验,设计Plackett−Burman试验[18],选取蔗糖、酵母提取物、K2HPO4、柠檬酸钠、蛋白胨、冰乙酸、无水乙醇为试验因素,以AP湿膜质量为评价指标,利用Minitab 16统计软件对试验所得数据进行分析,因素及编码水平见表1。
表1 Plackett−Burman试验因素及编码水平
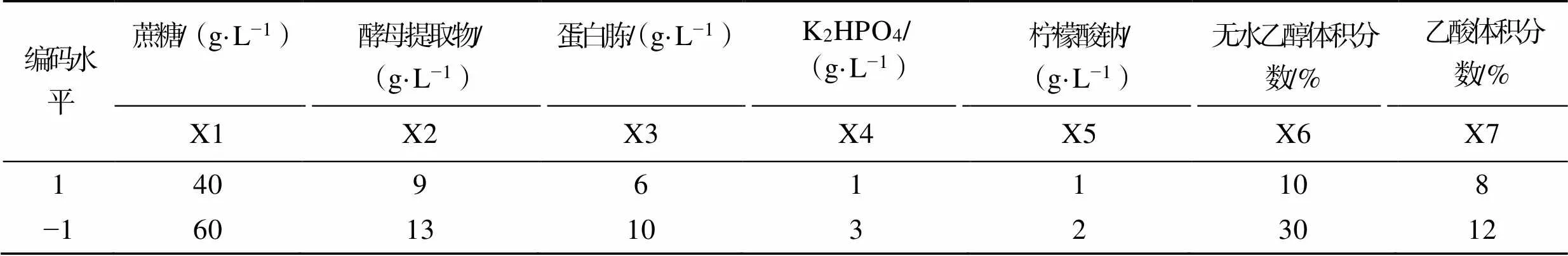
Tab.1 Experimental factors and coding level of Plackett−Burman
1.4.4 响应曲面(RSM)试验设计
结合Plackett–Burman试验的结果来确定影响AP产率的主要因素及其水平范围,再采用Box–Benhnken试验设计方法对细菌纤维素培养条件进行响应曲面分析试验,从而获得培养AP的最适培养基[19-20]。因素水平及编码见表2。
表2 Box−Behnken试验因素及编码水平

Tab.2 Experimental factors and coding level of Box-Behnken
1.4.5 醋酸菌菌膜参数测定
1)菌膜的处理及AP产率。将培养好的膜从三角瓶中取出,用蒸馏水冲洗数次,浸泡一夜(除去膜中的培养基和表面的杂质),再用浓度为0.1 mol/L的NaOH溶液90 ℃浸泡处理2 h,直到膜呈乳白色,半透明状;将膜取出用水清洗数次,用体积分数为0.5%的乙酸溶液浸泡5 min,再用蒸馏水冲洗数次,直至用pH试纸测其表面水分为中性时,除去AP湿膜表面的多余水分,即为细菌纤维素湿膜;将细菌纤维素湿膜置于干燥箱中(90±3)℃下烘至完全干燥,即为细菌纤维素干膜[21-22]。AP产率计算方法为:
AP产率=湿膜质量/培养液体积
2)AP湿膜含水率与干膜复水率计算。
AP湿膜的含水率计算式为:

AP的干膜称完质量后,放入培养皿中并向其中加入蒸馏水,浸泡24 h后,取出用滤纸吸干表面水分,称量其吸水后的质量,计算醋酸菌菌膜干膜的复水率:
2 结果与分析
2.1 产膜醋酸菌的形态和生化鉴定
将产膜醋酸菌接种于柿醋中,培养5 d。发现2种果醋所制种子液在RAE、AE培养基上均能产膜,但在RAE培养基上的生长速度均比在AE培养基上要快。杏醋醋酸菌所产膜易碎不易揭起,柿醋醋酸菌所产膜韧性较强,不易碎且易揭起。故选择RAE培养基作为产膜醋酸菌的基础培养基,选择长有AP膜的涩柿醋作为分离产膜菌种的原材料。用RAE培养培养从涩柿醋中分离的产膜醋酸菌,进行了菌落形态观察和生理生化特征测定。
菌体形态结果见图1—2,分离的醋酸菌菌落表面光滑乳白色,菌体呈短杆状,单个或成对出现,革兰氏染色呈阴性。生理生化特征试验结果见表3。依据菌体形态观察及生理生化试验结果,初步确定筛选分离所得菌种为葡糖醋杆菌()。

图1 醋酸菌菌落形态

图2 醋酸菌显微观察
表3 菌种生理生化特征鉴定

Tab.3 Biochemical and physiologica characteristics of bacteria
2.2 培养基琼脂对醋酸菌产膜的影响
在培养过程中发现,培养基中琼脂含量越低,其膜生长速度越快越容易揭起,并分别以琼脂质量分数为0%、0.5%、0.9%、1%、1.2%、1.5%进行验证。结果表明培养1 d,液体培养基表面便覆盖一层薄膜,可揭起,而添加琼脂的量越大,其醋酸菌产菌膜的速率越慢,约2 d培养基表面才长出膜,培养5 d膜仍不易揭起,且液体培养不易被杂菌污染,故选择液体培养基作为AP生产培养基。
2.3 种龄对菌膜产率的影响
种龄即“种子”的群体生长年龄,种龄的长短都会影响AP的产率,种龄不够或种龄过长都会使AP的产率下降,因此,选择合适的种龄对提高AP产率有着重要作用。由图3可知,种龄在32 h时,菌液OD值最高,说明此时菌液密度最高,种子活力最高。同时以培养32 h的种子培养液接种培养5 d后所得AP湿膜产率也均高于其他培养时间,见图4,说明种龄为32 h时最适合发酵生产AP。
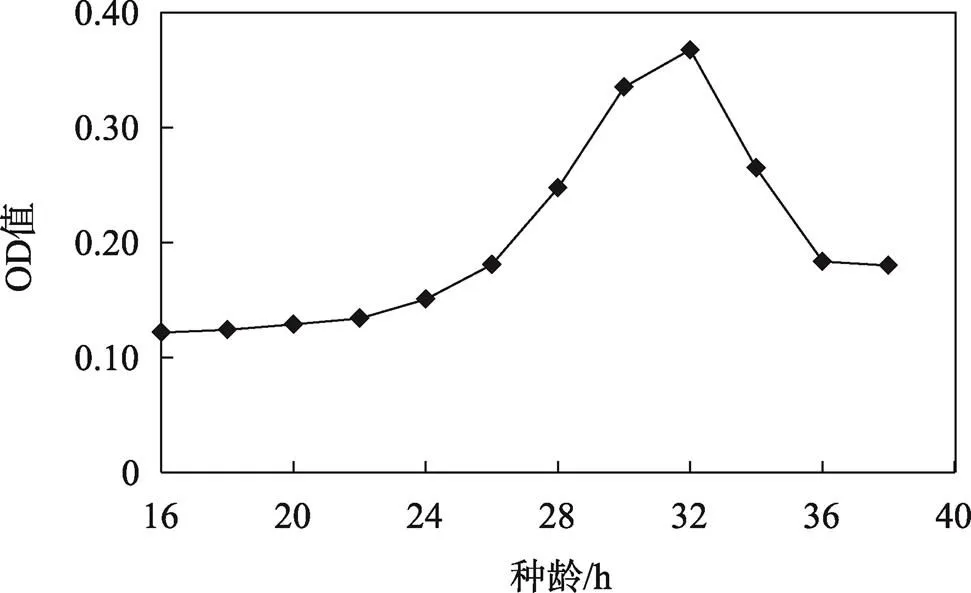
图3 种龄对醋酸菌生长影响

图4 种龄对AP产率的影响
2.4 接种量对AP产率的影响
接种量过多或过少均不利于AP生产,接种量过多会导致培养底物前期消耗过快,同时菌体浓度过大会导致培养基中的溶氧量过少,致使大量菌体死亡,从而影响AP产率;接种量过少,AP的合成速度变慢,致使AP产率下降。由图5可知,当接种量在9%以下时,AP产率随接种量的增加产率不断增加,但当接种量高于9%时AP产率反而下降,因此确定9%为最佳接种量,AP湿膜产率为260 g/L。
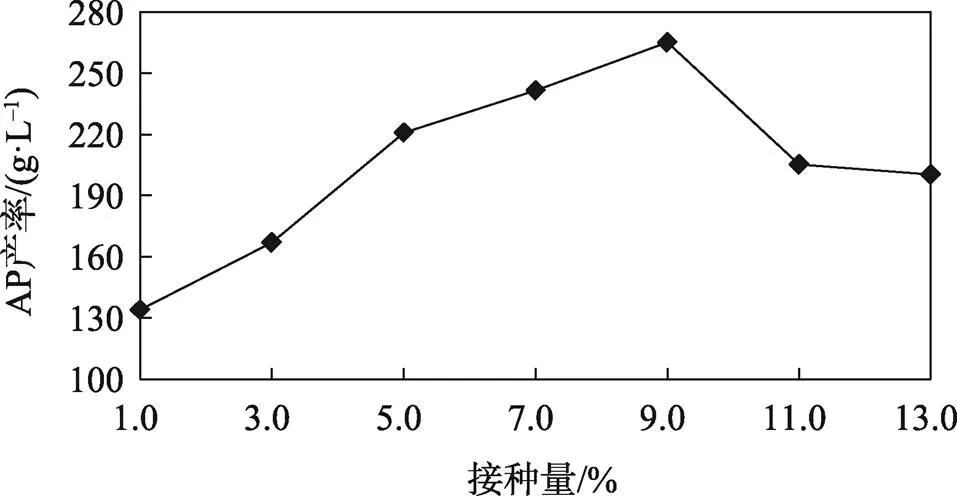
图5 接种量对AP产率的影响
2.5 碳源对AP产率的影响
每种微生物的生理特性不同,所能利用的碳源种类也不一样,培养基中添加不同的碳源,葡糖醋杆菌的利用程度不一样,则醋酸菌菌膜的产率就有差异[18]。该试验在基础培养基的上添加质量分数为4%的不同单一碳源,以不含碳源的培养基作为空白对照,在30 ℃下静置培养5 d后,结果见图6。

图6 不同碳源对AP产率的影响
碳源种类不同,发酵所获得的AP产率不同,葡萄糖、蔗糖和甘露醇作为碳源,产率较高,其中蔗糖产率高于甘露醇和葡萄糖,蔗糖作为碳源更有利于葡糖醋杆菌代谢产生AP,故选择蔗糖为碳源,并确定其最适用量。由图7可知,蔗糖质量分数为4%时,AP产率最高。
2.6 氮源用量对醋酸菌菌膜产率的影响
氮源是微生物发酵的主要原料之一,有无机氮源和有机氮源之分,通过查阅文献并从经济角度考虑[19],试验选择蛋白胨、酵母提取物作为氮源发酵生产AP。AP产率随蛋白胨和酵母提取物质量分数的变化趋势分别见图8—9。

图7 蔗糖质量分数对AP产率的影响

图8 蛋白胨质量分数对AP产率的影响
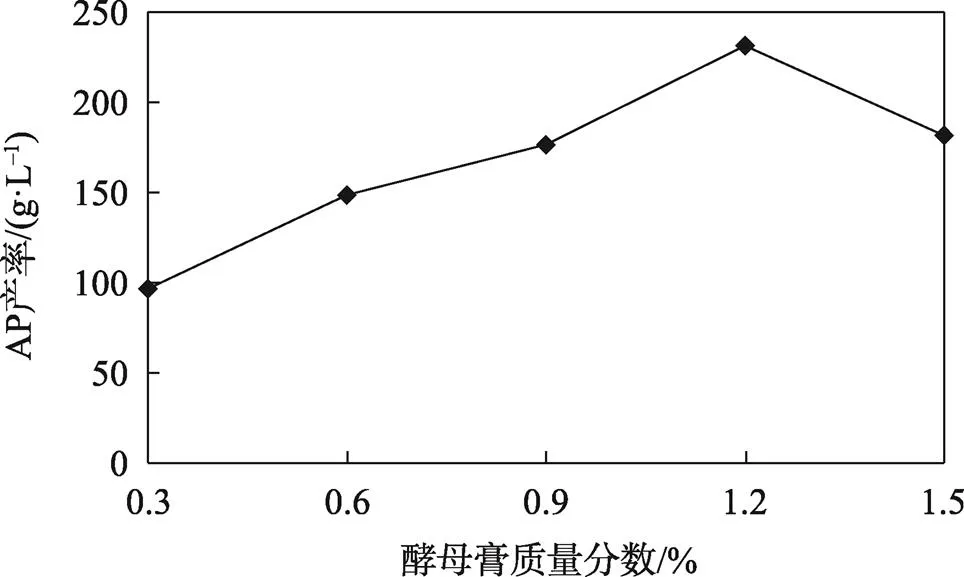
图9 酵母提取物质量分数对AP产率的影响
结果显示AP产率在酵母提取物质量分数为1.2%,蛋白胨质量分数为0.7%时最高。
2.7 无机盐对醋酸菌菌膜产率的影响
无机盐是微生物生命过程中不可缺少的营养物质,不同的无机盐对不同微生物的生长繁殖所起到的作用也不一样。不同无机盐对AP产率的影响图10,其中K2HPO4和柠檬酸钠对AP产率影响较为明显,因此试验选择K2HPO4和柠檬酸钠作为生产AP的无机盐。
通过设定不同的质量分数梯度确定K2HPO4和柠檬酸钠最适质量分数以获得较高产率的AP。从图11和图12所示结果可以看出,当K2HPO4质量分数为0.3%,柠檬酸钠质量分数为0.15%时AP产率最高。
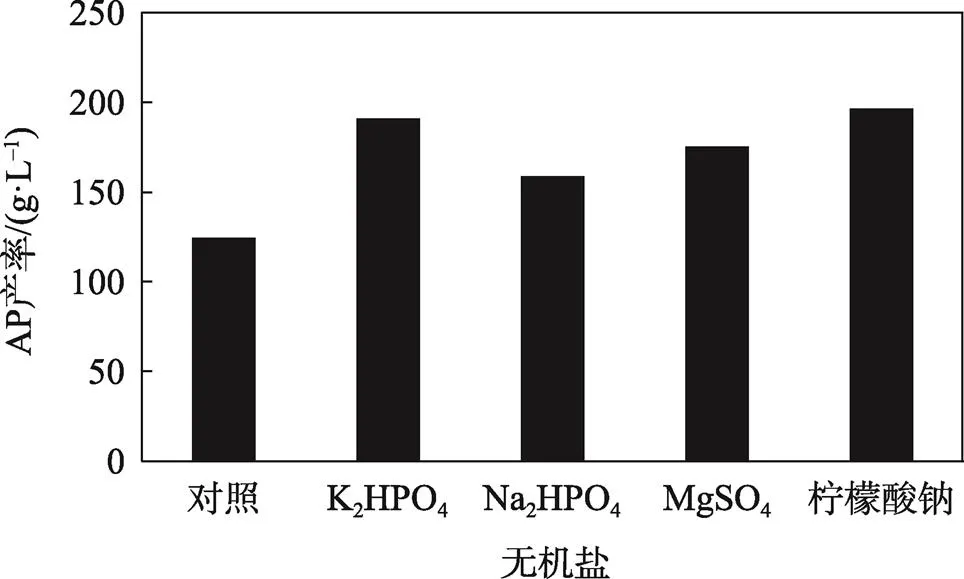
图10 不同无机盐对AP产率的影响

图11 K2HPO4质量分数对AP产率的影响
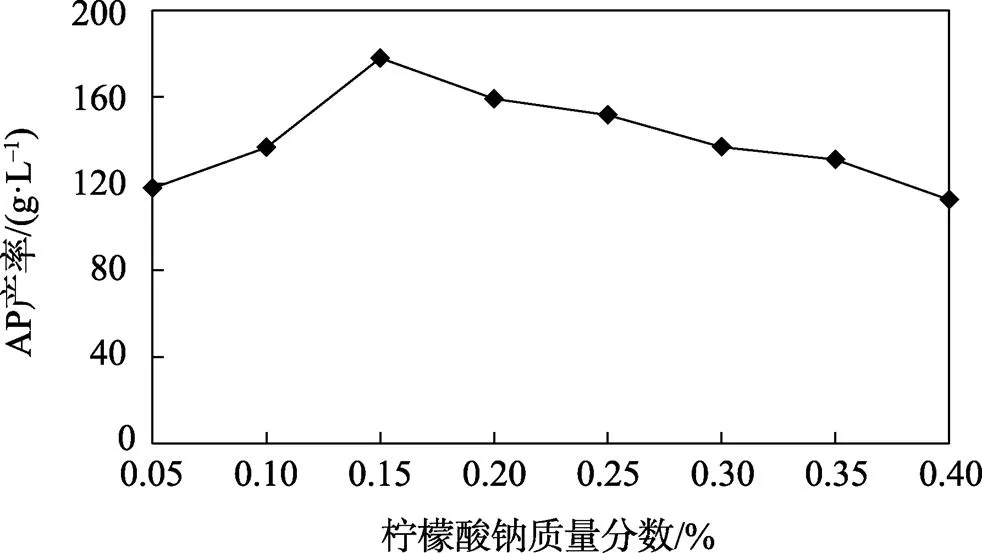
图12 柠檬酸钠质量分数对AP产率的影响
2.8 有机酸对醋酸菌菌膜产率的影响
在增殖培养基的基础上添加体积分数为1%的不同有机酸代替乙酸,在30 ℃下静置培养5 d后结果见图13。乙酸对AP产率影响较为明显,苹果酸与柠檬酸对其产率影响不大,而富马酸与酒石酸对AP产率不仅没有促进作用,而且抑制了菌体生长,降低了AP产率,故而选择乙酸作为进一步优化的有机酸。AP产率随乙酸浓度变化趋势见图14,当乙酸体积分数为0.1%时,菌体能产生最大量的AP。当乙酸的体积分数过大时,抑制了菌体生长反而降低了AP的产率。
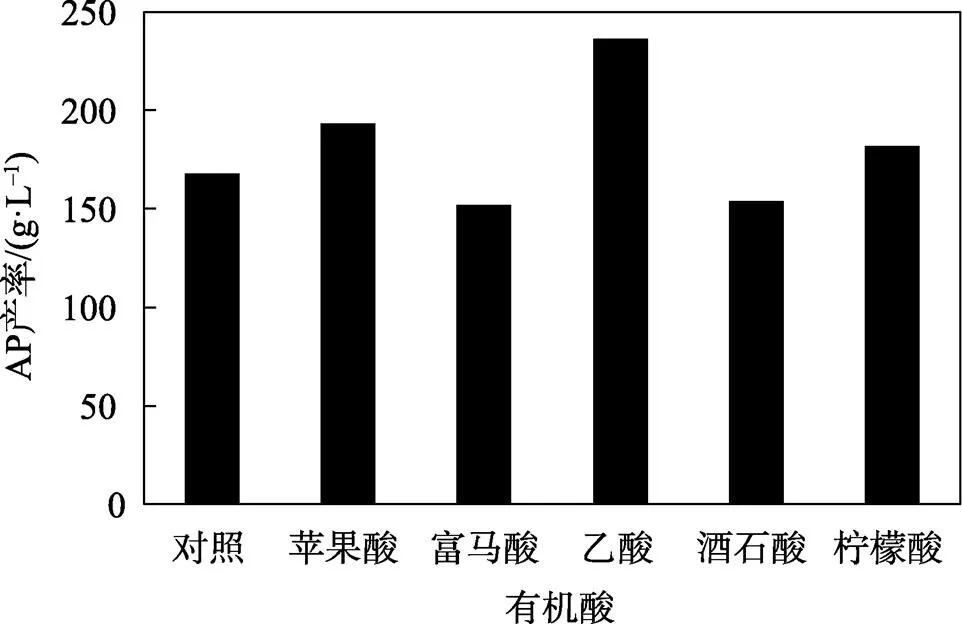
图13 不同有机酸对AP产率的影响

图14 乙酸体积分数对AP产率的影响
2.9 无水乙醇用量确定
葡糖醋杆菌能够将较低体积分数的无水乙醇转化成生命活动所需要的高能化合物,因此较低体积分数的无水乙醇可以促进葡糖醋杆菌发酵产生醋酸菌菌膜[20]。如图15所示,当无水乙醇体积分数低于2%时,菌体细胞代谢所需要的能量能够得到满足,促进AP的生成,AP产率增加。当无水乙醇体积分数大于2%时,随着其体积分数的增加,菌体生长受到抑制,AP产率降低。综上,无水乙醇体积分数为2%时,促进作用最为明显,AP产率最大。
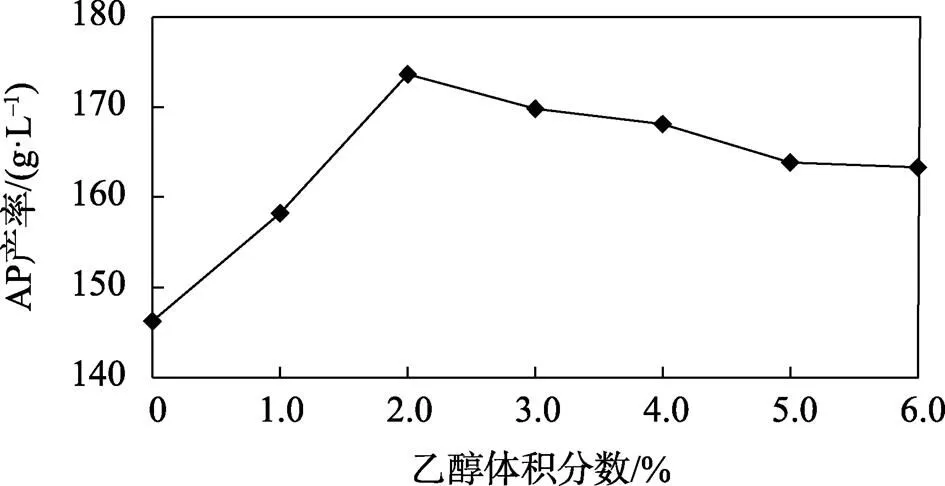
图15 乙醇体积分数对AP产率的影响
2.10 AP培养基优化
在前期单因素试验的基础上,以蔗糖、蛋白胨、酵母提取物、K2HPO4、柠檬酸钠、乙酸、无水乙醇为考察因素,利用Plackett–Burman试验设计,进行12组试验,数据分析结果见表4。由表4可知,主效应中影响AP产率的主要因素为蔗糖(=0.002)、无水乙醇(=0.003)、K2HPO4(=0.009),主要因素的值均小于 0.050,可以作为进一步优化的关键因素。其他因素对AP产率影响不大(>0.05),在进一步研究中作为条件因素考虑。
2.11 培养基组成与醋酸菌菌膜产率关系的二次方程的建立
参照前期的单因素试验及Plackett–Burman试验,对影响菌体代谢合成AP的主要因素蔗糖、K2HPO4、无水乙醇按Box–Behnken试验设计进行17组试验(培养基其他成分按单因素试验结果配制:蛋白胨质量分数为0.7%、酵母提取物质量分数为1.2%、柠檬酸钠质量分数为0.15%、乙酸质量分数为1%),结果见表5。
表4 Plackett−Burman试验主效应分析
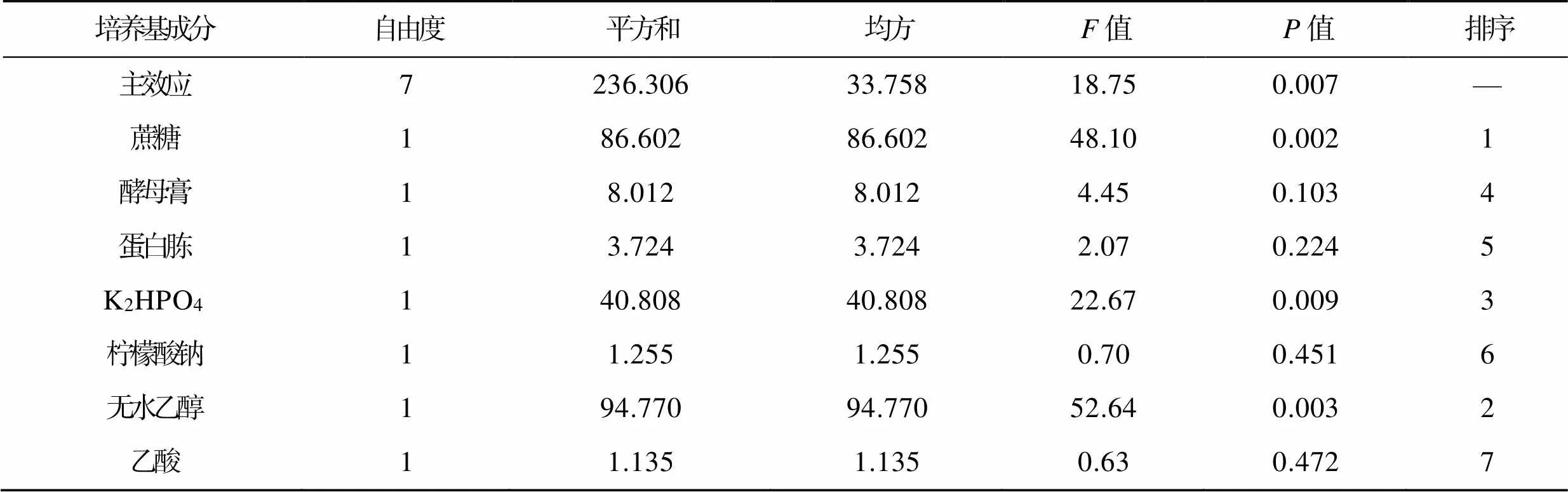
Tab.4 Analysis of main effects for Plackett−Burman experiment
表5 Box–Behnken 试验设计结果
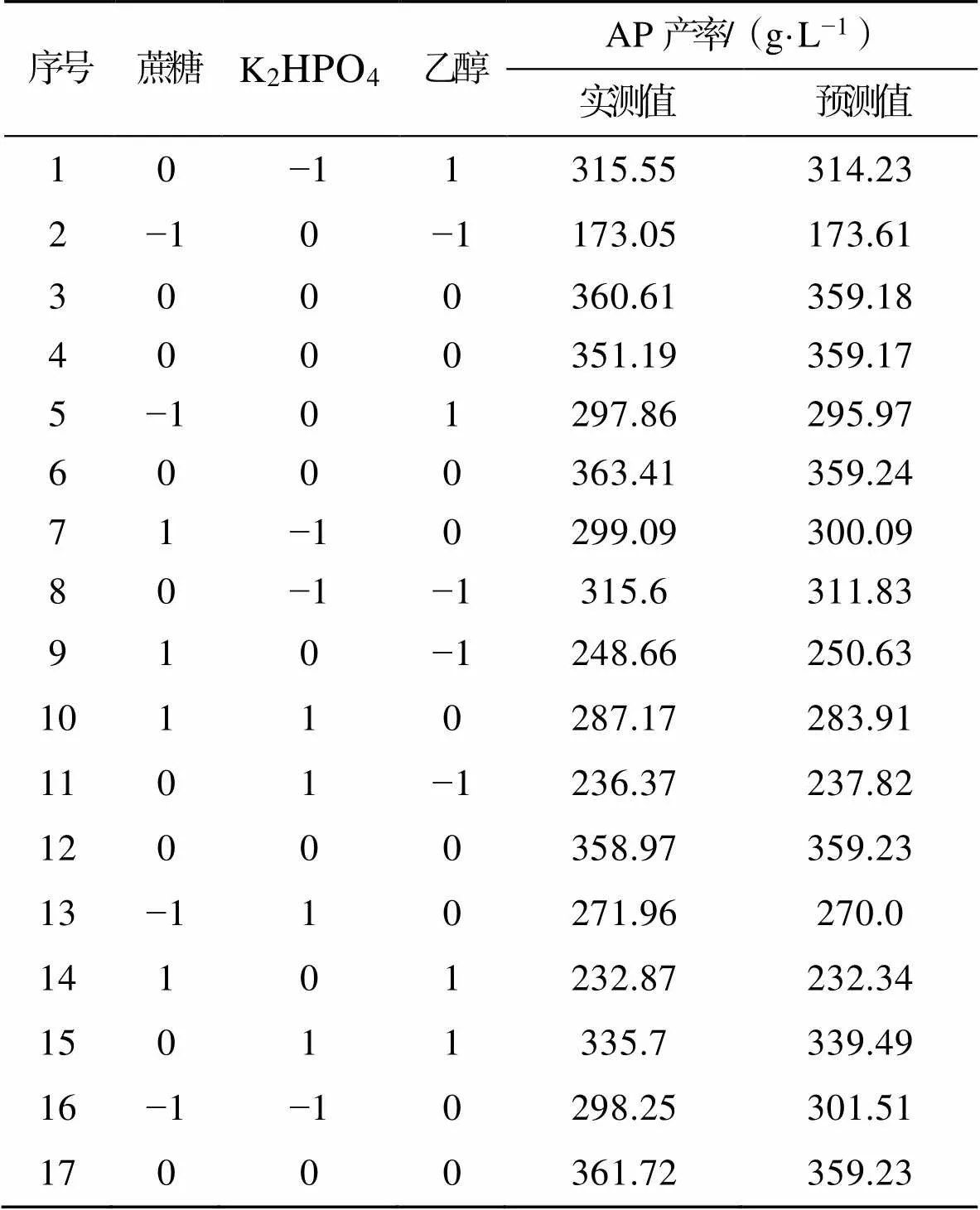
Tab.5 Results of Box - Behnken experiment design
利用design expert软件对表5中的试验数据进行分析,得到AP产率()对自变量蔗糖(1)、K2HPO4(2)、乙醇(3)的多元回归方程为:
=35.92+0.331−1.222+2.63+0.3612−3.5213+2.4823−6.6412−0.3722−5.4732
由方差分析可知(表6),此模型极显著(<0.000 1),失拟项不显著(=0.467 6),预测值与真实值间有高度相关性(2=0.996 6),说明模型与实际拟合良好,可应用于AP生产产率的分析与预测。
从表7培养基成分的回归方程系数显著性检验结果可以看出,在模型参数中1与3、2与3之间的交互作用对AP产率的影响极显著,1与2的交互作用对AP产率的影响不显著。
2.12 AP表观形态观察
静态培养条件下,AP膜浮于液体培养基表面。AP膜经水处理后呈现乳黄色不透明状,经碱液处理后呈白色或乳白色半透明状,外表光滑细腻,类似冻状,有弹性,经(90±3)℃处理后,结构致密,韧性强[21-22]。未处理的AP湿膜、经水处理后的AP湿膜、经碱液处理后的AP湿膜、干膜表观形态对照见图16。
2.13 AP湿膜含水率与干膜复水率
由表8可得,醋酸菌菌膜膜具有很强的持水性,醋酸菌菌膜湿膜平均含水率为99.38%,最低含水率也可达到99.22%,最高可达99.53%,复水率为71.09%~83.39%,AP干膜不仅复水率高且复水速度快,复水1 min其含水率便可达到70%以上。
表6 AP 发酵培养基多元二次方程方差分析
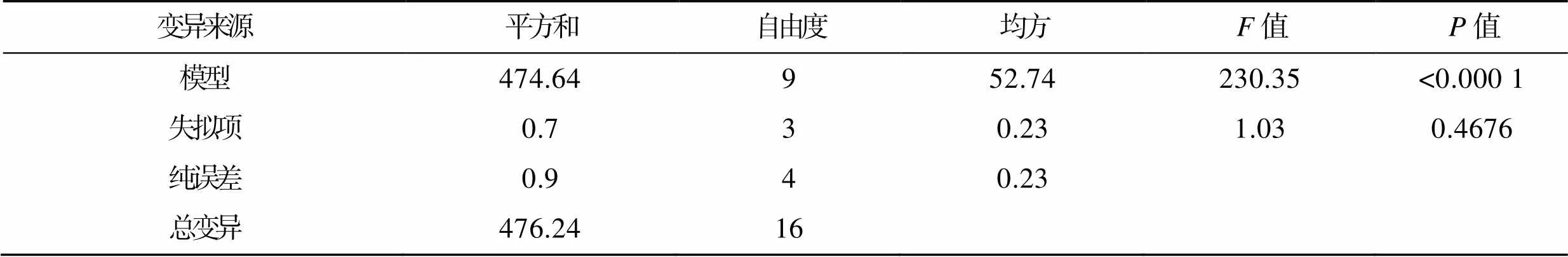
Tab.6 Anova for multivariate quadratic equation of AP fermentation medium
表7 培养基成分回归方程系数显著性检验

Tab.7 Regression equation coefficient significance test of medium components
注:**表示在0.01水平上的显著性。

图16 AP形态
表8 AP 湿膜含水率和干膜复水率
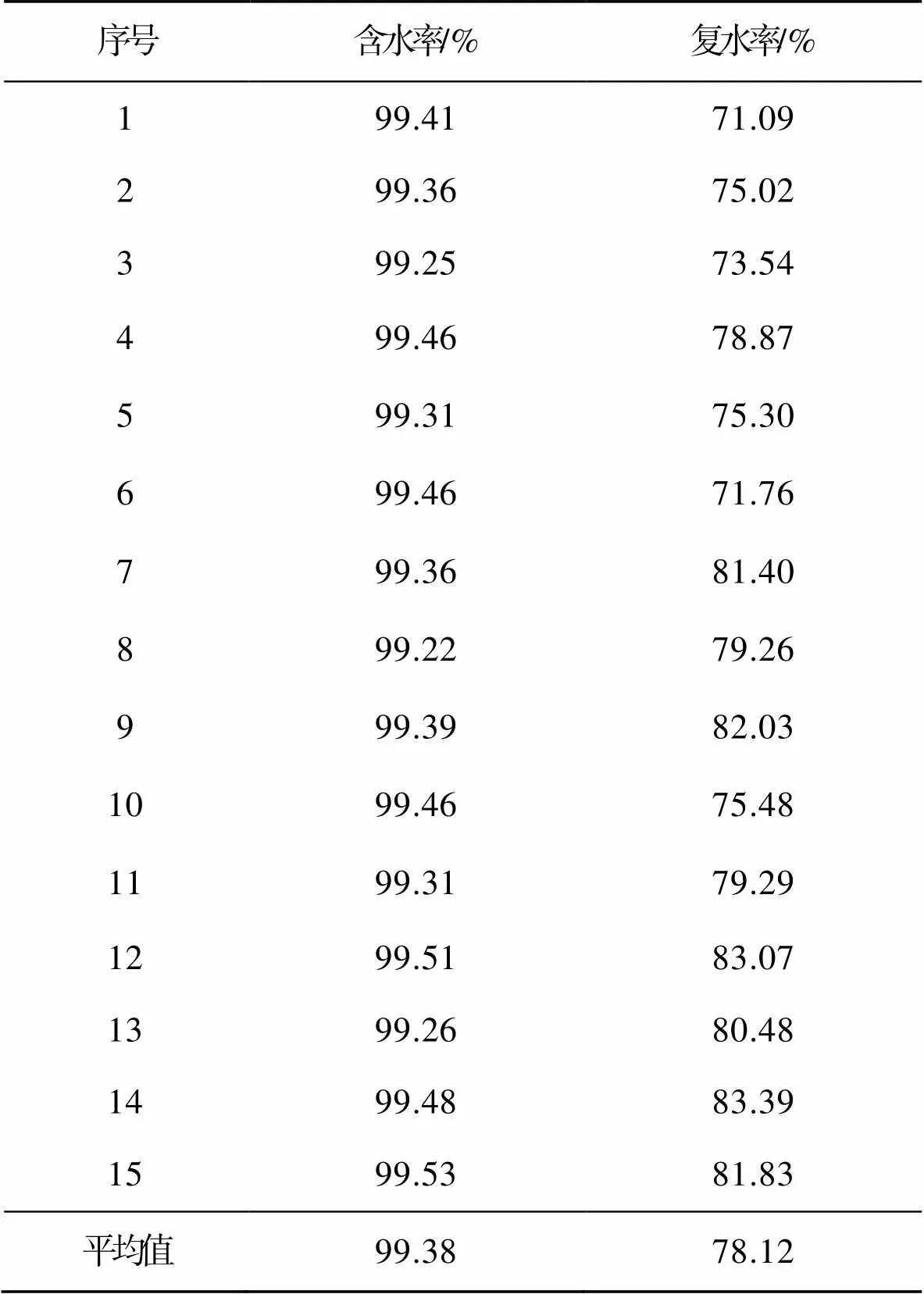
Tab.8 AP wet membrane water content and dry film rehydration rate
3 结语
以柿醋菌膜为材料,从中筛选分离出高产醋酸菌菌膜的菌种,运用单因素试验获得各因素水平范围,再通过响应曲面(RSM)试验设计对醋酸菌菌膜培养基进行优化,以获得最佳生产条件。同时,对醋酸菌菌膜膜的基本性质做了研究,得到结论如下。
1)分离的产菌膜菌株经形态观察及生理生化鉴定后得出,该菌种为葡糖醋杆菌()。
2)通过单因素试验,确定了最佳培养条件(接种量为9%,种龄为32 h,培养时间为5 d)和各因素用量水平范围。
3)通过Plackett–Burman 试验选出影响细菌纤维产率的主要因素为蔗糖、无水乙醇、K2HPO4。
4)利用响应曲面优化试验,并综合各试验设计结果得出最优生产培养基成分组成:蔗糖质量分数为5%、蛋白胨质量分数为0.7%、酵母提取物质量分数为1.2%、柠檬酸钠质量分数为0.15%、K2HPO4质量分数为0.16%、冰乙酸体积分数为1%、无水乙醇体积分数为2%,在此条件下得到的实际AP的平均产率为364.65 g/L,是优化前的(246.03 g/L)的1.48倍;醋酸菌菌膜湿膜平均含水率为99.38%,复水率为71.09%~83.39%,AP干膜不仅复水率高且复水速度快,复水1 min其含水率便可达到70%以上。
[1] ESA F, TASIRIN S M, RAHMAN N A. Overview of Bacterial Cellulose Production and Application[J]. Agriculture and Agricultural Science Procedia, 2014, 2: 113-119.
[2] MERLI G, BECCI A, AMATO A, et al. Acetic Acid Bioproduction: The Technological Innovation Change[J]. The Science of the Total Environment, 2021, 798: 149292.
[3] JIPA I M, STOICA-GUZUN A, STROESCU M. Controlled Release of Sorbic Acid from Bacterial Cellulose Based Mono and Multilayer Antimicrobial Films[J]. LWT - Food Science and Technology, 2012, 47(2): 400-406.
[4] XIAO Lin, MAI Yi-yong, HE Feng, et al. Bio-Based Green Composites with High Performance from Poly(lactic acid) and Surface-Modified Microcrystalline Cellulose[J]. Journal of Materials Chemistry, 2012, 22(31): 15732-15739.
[5] HSIAO H C, LU Ting-sheng, CHEN Han-ken, et al. Bioreactor and Method for Producing Microbial Cellulose: US, 8551740[P]. 2013-10-08.
[6] RANI M U, APPAIAH A. Optimization of Culture Conditions for Bacterial Cellulose Production from Gluconacetobacter Hansenii UAC09[J]. Annals of Microbiology, 2011, 61(4): 781-787.
[7] 魏冉, 张宝善, 李亚武, 等. 醋酸菌产膜机理及膜对食醋发酵品质的影响[J]. 食品与发酵工业, 2014, 40(3): 182-186.
WEI Ran, ZHANG Bao-shan, LI Ya-wu, et al. Mechanism of Production of Pellicle by Acetic Acid Bacteria and Its Effect on Fermentation Quality of Vinegar[J]. Food and Fermentation Industries, 2014, 40(3): 182-186.
[8] 郑梅霞, 刘波, 朱育菁, 等. 细菌纤维素的生物合成及在食品工业的应用[J]. 食品安全质量检测学报, 2019, 10(19): 6412-6421.
ZHENG Mei-xia, LIU Bo, ZHU Yu-jing, et al. Bacterial Cellulose Biosynthesis and Application on Food Industry[J]. Journal of Food Safety & Quality, 2019, 10(19): 6412-6421.
[9] 张宝善. 食醋酿造学[M]. 北京: 科学出版社, 2014: 193-194.
ZHANG Bao-shan. Vinegar Brewing[M]. Beijing: Science Press, 2014: 193-194.
[10] KHAN S B K T, KHAN S B, KAMAL T. Bacterial Cellulose: Synthesis, Production, and Applications[M]. Boca Raton: CRC Press, 2021
[11] 廖博文, 黄轶敏, 谭玉静, 等. 摇瓶发酵细菌纤维素的木糖驹形氏杆菌P1‒1筛选及培养基初步优化[J]. 纤维素科学与技术, 2021, 29(2): 11-21.
LIAO Bo-wen, HUANG Yi-min, TAN Yu-jing, et al. Screening and Preliminary Optimization of Culture Medium for Komagataeibacter Xylinus P1-1 for Bacterial Cellulose Production in Shake Flask[J]. Journal of Cellulose Science and Technology, 2021, 29(2): 11-21.
[12] ISLAM M U, ULLAH M W, KHAN S, et al. Strategies for Cost-Effective and Enhanced Production of Bacterial Cellulose[J]. International Journal of Biological Macromolecules, 2017, 102: 1166-1173.
[13] 布坎南, 吉本斯. 伯杰细菌鉴定手册第八版[M]. 8版. 北京: 科学出版社, 1984: 634-635.
BUCHANAN R E, GIBBONS N E. Bergey's Manual of Determinative Bacteriology[M]. 8th ed. Beijing: Science Press, 1984: 634-635.
[14] GAO H, SUN Q, HAN Z, et al. Comparison of Bacterial Nanocellulose Produced by Different Strains under Static and Agitated Culture Conditions[J]. Carbohydr Polym, 2020, 227: 115323.
[15] SHARMA A, TEWARI R, RANA S S, et al. Cellulases: Classification, Methods of Determination and Industrial Applications[J]. Applied Biochemistry and Biotechnology, 2016, 179(8): 1346-1380.
[16] AITZHANOVA A, OLEINIKOVA Y, MOUNIER J, et al. Dairy Associations for the Targeted Control of Opportunistic Candida[J]. World Journal of Microbiology & Biotechnology, 2021, 37(8): 143.
[17] 赵浩杰, 王光翟, 廖博文, 等. 响应面法优化动态发酵细菌纤维素菌株HS01培养基[J]. 纤维素科学与技术, 2020, 28(4): 1-9.
ZHAO Hao-jie, WANG Guang-zhai, LIAO Bo-wen, et al. Optimization of Fermentation Medium of Shake Flask for Bacterial Cellulose Producing Strain Komagataeibacter Hansenii HS01 by Response Surface Methodology[J]. Journal of Cellulose Science and Technology, 2020, 28(4): 1-9.
[18] WU S C, LI M H. Production of Bacterial Cellulose Membranes in a Modified Airlift Bioreactor by Gluconacetobacter Xylinus[J]. Journal of Bioscience and Bioengineering, 2015, 120(4): 444-449.
[19] RAMANA K V, TOMAR A. Effect of Various Carbon and Nitrogen Sources on Cellulose Synthesis by[J]. World Journal of Microbiology & Biotechnology, 2000, 16: 245-248.
[20] BI J C, LIU S X, LI C F, et al. Morphology and Structure Characterization of Bacterial Celluloses Produced by Different Strains in Agitated Culture[J]. Journal of Applied Microbiology, 2014, 117(5): 1305-1311.
[21] HEO M S, SON H J. Development of an Optimized, Simple Chemically Defined Medium for Bacterial Cellulose Production by Acetobacter Sp. A9 in Shaking Cultures[J]. Biotechnology and Applied Biochemistry, 2002, 36(1): 41-45.
[22] 罗仓学, 张岢薇, 丁勇. 干燥方法对细菌纤维素复水性能的影响[J]. 陕西科技大学学报, 2017, 35(6): 120-124.
LUO Cang-xue, ZHANG Ke-wei, DING Yong. Influence of Drying Methods on Rehydration Quality of Bacterial Cellulose[J]. Journal of Shaanxi University of Science & Technology, 2017, 35(6): 120-124.
Optimization of Production Conditions of Acetic Acid Bacteria Pellicle
ZHANG Jiu-yu1a, SUN Nan2, ZHANG Wei2, FAN Ming-tao1a, 1b
(1a. College of Life Science b. College of Food Science and Engineering, Northwest A&F University, Shaanxi Xianyang 712100, China; 2. College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi'an 710119, China)
The work aims to optimize the optimum culture conditions and methods for production of bacterial pellicle with acetic acid bacteria to obtain a natural and safe production process of pellicle for food packaging. Astringent persimmon vinegar was used as raw material, and excellent acetic acid bacteria with high yield membrane were isolated and screened. The optimum culture method and technological conditions of acetic acid pellicle were optimized by single factor and Plackett−Burman experimental design. The pellicle producing acetic acid bacteria was isolated and purified from astringent persimmon vinegar and identified as gluconacetobacter xylinum. The optimum conditions for culture of pellicle with acetic acid bacteria were as follows: sucrose 5% (mass fraction), peptone 0.7% (mass fraction), yeast extract 1.2% (mass fraction), sodium citrate 0.15% (mass fraction), K2HPO40.16% (mass fraction), acetic acid 1% (v/v), absolute ethanol 2% (v/v), seed age 32 h, inoculation amount 9%, cultured for 5 days. The average yield of pellicle was 364.65 g/L, which was 1.48 times as high as that before optimization (246.03 g/L). The average moisture content of wet pellicle was 99.38%, and the rehydration rate was 71.09%-83.39%. The rehydration rate of dry membrane was high and the rehydration speed was fast. The water content can reach more than 70% after one minute of rehydration. With the optimized culture medium and method, high-quality pellicle can be produced with acetic acid bacteria.
acetic acid bacteria; pellicle; packaging; condition optimization
TS206
A
1001-3563(2022)13-0031-11
10.19554/j.cnki.1001-3563.2022.13.005
2021‒08‒27
大学生创新创业训练计划(X202010712283);西安市科技计划(20193044YF032NS032);中国富硒产业研究院2019年富硒专项“236”计划(2019QCY–2.3–02)
张九裕(2001—),女,西北农林科技大学本科生,主攻生物科学。
樊明涛(1963—),男,博士,西北农林科技大学教授、博导,主要研究方向为食品生物技术与食品安全。
责任编辑:曾钰婵

