全球病毒载体疫苗产品研发态势分析*
陈 娟,潘黎姿,杨潇逸,李卓婷,欧阳昭连,吴旭生
(1.中国医学科学院医学信息研究所,北京 100020; 2.中国医学科学院北京协和医院,北京 100730;3.广东省深圳市卫生健康发展研究和数据管理中心,广东 深圳 518000)
病毒载体疫苗是将编码病原体关键蛋白的基因转入载体病毒基因内制成的疫苗[1]。人体接种病毒载体疫苗后,病毒载体可进入人体细胞,载体本身因基因缺陷无法复制,但其基因内整合的病原体基因可翻译成病原体关键蛋白,该蛋白转移到细胞外可刺激免疫反应发生[2]。因此,病毒载体疫苗技术也简化了疫苗生产过程[3]。由于该技术中的病毒载体自身无法复制,可避免由此导致的疾病;且人体内病原体关键蛋白的产生过程可持续较长时间,可刺激人体持续产生免疫反应[2]。鉴于其在安全性和有效性方面的优势,该技术成为了新型冠状病毒肺炎(简称新冠肺炎,COVID −19)疫苗研发的主要技术路线之一[4]。近几年,众多机构和国家在该技术领域取得突破,先后将产品推向市场。本研究中拟从产品数量、研发阶段、适应证分布、机构分布等角度,分析全球病毒载体疫苗产品研发态势,比较各国研发进展,为科技管理人员和领域研究人员提供参考。现报道如下。
1 资料与方法
2021 年7 月21 日在Cortellis 数据库中检索全球范围内的病毒载体疫苗产品研发信息,将处于早期发现、临床前、临床研究、预注册、注册上市及暂停研发状态的产品汇总形成数据集,排除处于停止研发状态的产品。从以下4 个方面分析全球病毒载体疫苗研发态势:1)展示全球病毒载体疫苗产品数量及所处研发阶段;2)分析全球病毒载体疫苗产品适应证分布及各类适应证的研发进展;3)识别病毒载体疫苗主要研发机构;4)基于Ⅲ期临床试验、预注册和注册上市的产品数据比较各国在病毒载体疫苗领域的研发进展。
2 结果
2.1 全球产品数量及研发阶段
共检索到病毒载体疫苗667 个,其中337 个已停止研发,330 个正在研发或已成功上市,纳入数据集进行分析。疫苗产品研发需经历早期发现、临床前研究、临床研究、预注册、注册、上市等多个环节,其中预注册是指已向监管部门提出注册申请但尚未获批,注册是指已经获得监管部门发放的注册批件,上市是指已将产品推向市场。全球病毒载体疫苗当前最新研发状态见图1。可见,330 个产品中有13 个已注册或上市,151 个处于临床研究阶段(其中5个处于Ⅲ期临床试验阶段),其余166个尚未进入临床研究阶段。
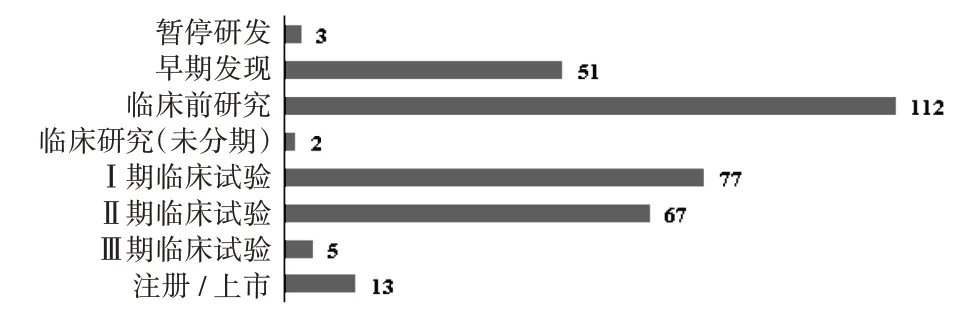
图1 全球330个在研或上市病毒载体疫苗当前最新研发状态分布Fig.1 Distribution of the latest R & D status of 330 viral vec⁃tor-based vaccines under development or have been launched in the worldwide
2.2 适应证分布
病毒载体疫苗主要用于感染类疾病适应证(见表1),数量排前5位的分别为COVID −19(60个)、艾滋病(37个)、流行性感冒(简称流感,22个)、宫颈病变(18个)和埃博拉出血热(15 个)。用于预防COVID −19 的病毒载体疫苗研发进展较快,目前已有5 个产品注册上市,分别是美国强生公司的JNJ −78436735、中国康希诺生物的Ad5 −nCoV、俄罗斯Gamaleya 流行病学与微生物学研究所的Sputnik V 和Sputnik Light,以及英国詹纳研究所的AZD −1222;用于预防流感和埃博拉出血热的病毒载体疫苗产品分别有3个获批注册或上市;用于预防登革热、天花和猴痘的病毒载体疫苗产品分别有1个获批注册或上市。
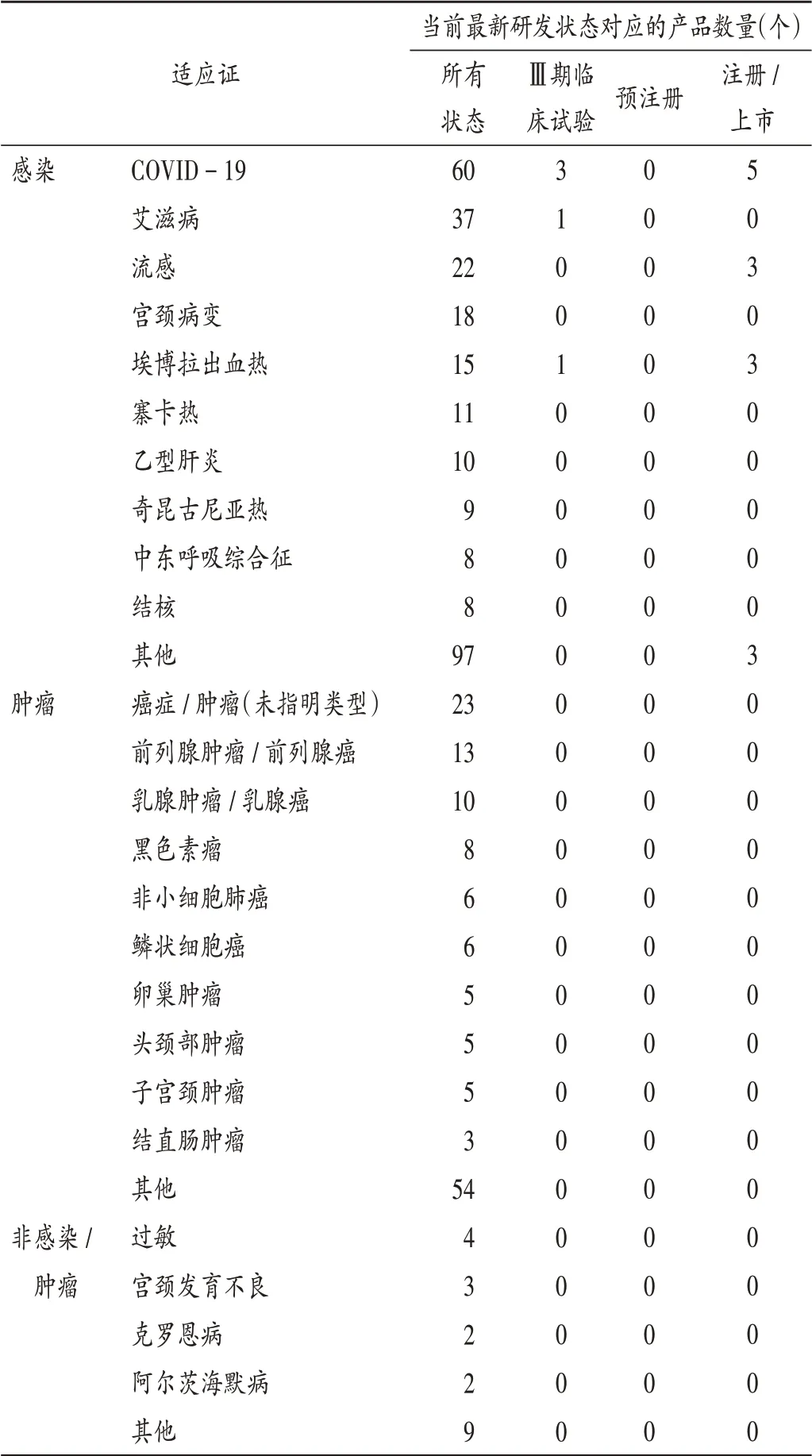
表1 全球330个在研或上市病毒载体疫苗适应证分布Tab.1 Distribution of indications for 330 viral vector-based vaccines under development or have been launched in the worldwide
部分病毒载体疫苗正在开发肿瘤类适应证,如前列腺肿瘤/ 前列腺癌(13 个)、乳腺肿瘤/ 乳腺癌(10 个)、黑色素瘤(8 个)、非小细胞肺癌(6 个)和鳞状细胞癌(6 个)。另有少数病毒载体疫苗正在开发除感染和肿瘤外的适应证,如过敏、宫颈发育不良、克罗恩病、阿尔茨海默病等。上述适应证开发进展相对较慢,尚无任何产品进入Ⅲ期临床试验,距上市尚需较长时间。
2.3 主要原研机构
全球原研病毒载体疫苗个数不少于5 个的机构共计14 个,其中美国9 个,英国2 个,丹麦、荷兰和瑞典各1 个。牛津大学研发的病毒载体疫苗达21 个,另外Greffex 公司、NantCell 公司、AlphaVax 公司和Bavarian Nordic 公司研发的病毒载体疫苗均超过10 个。详见图2。

图2 原研病毒载体疫苗不少于5个的机构Fig.2 Institutions with no less than five original vaccines
2.4 各国研发进展
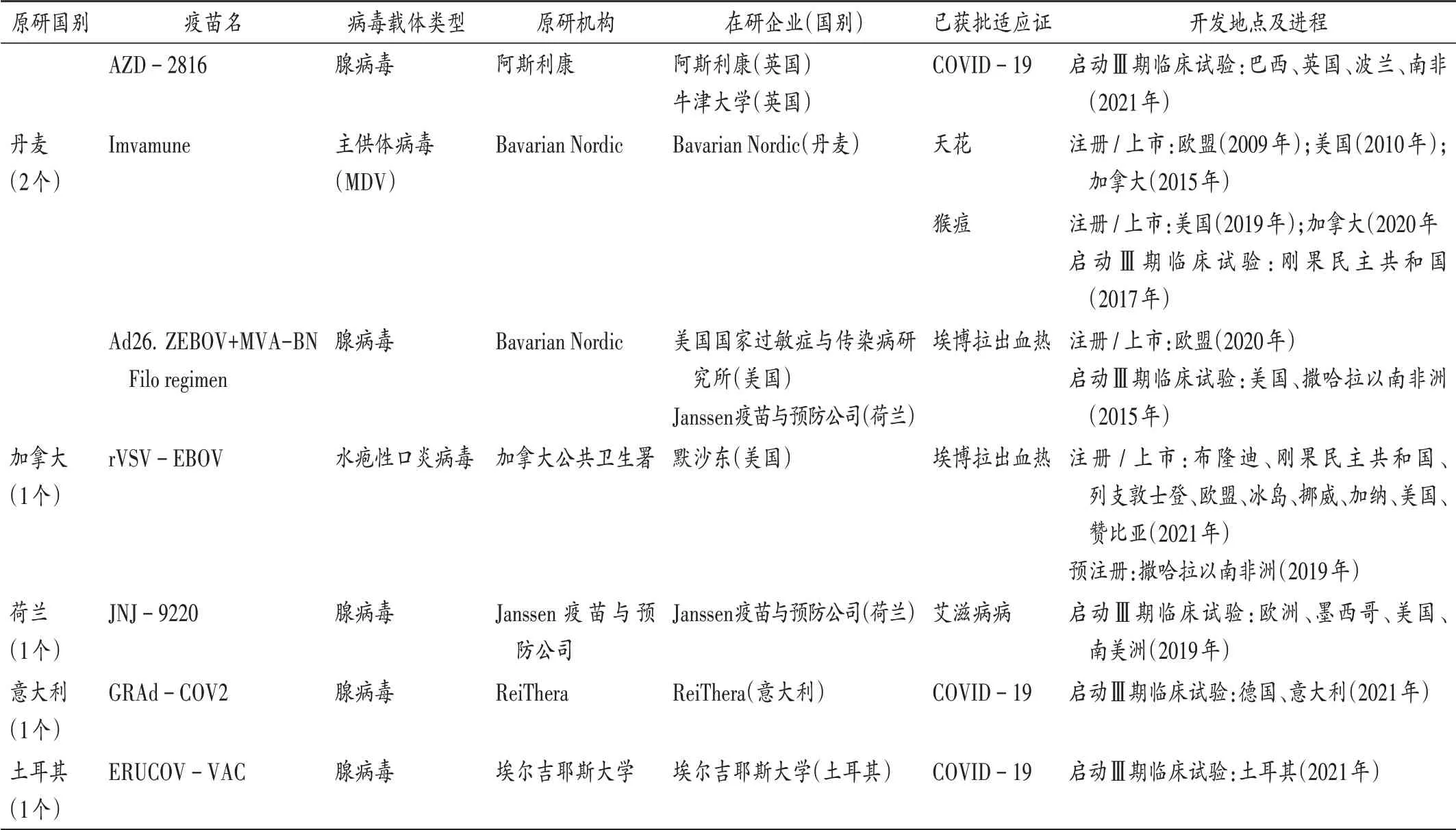
可见,美国、中国、俄罗斯、英国、丹麦、加拿大均有病毒载体疫苗产品已获批注册或上市,荷兰、意大利和土耳其有产品进入Ⅲ期临床试验阶段。其中,美国机构研发实力较强,密歇根大学、MedImmune 公司、圣路易斯大学、强生公司和美国国家过敏症和传染病研究所研发进展较快。美国机构在2009 年至2013 年先后研发成功3 个预防流感的疫苗,于2016 年上市预防登革热的疫苗,美国强生公司于2021 年上市了1 个预防COVID −19 的病毒载体疫苗产品。我国机构研发进展也相对较快,其中中国人民解放军军事医学科学院联合康希诺生物,于2017 年成功研发1 个预防埃博拉病毒感染的病毒载体疫苗,并于2021 年成功上市1 个用于预防COVID −19 的病毒载体疫苗。俄罗斯Gamaleya流行病学与微生物学研究所已在多个国家注册了2 个用于预防COVID −19 的病毒载体疫苗。英国牛津大学詹纳研究所也在多个国家注册了用于预防COVID −19 的病毒载体疫苗。丹麦的Bavarian Nordic 成功研发了用于预防天花、猴痘和埃博拉出血热的病毒载体疫苗。加拿大公共卫生署研发成功1 个预防埃博拉出血热的病毒载体疫苗。另外,荷兰、意大利和土耳其分别有1 个病毒载体疫苗已进入Ⅲ期临床试验阶段。详见表2和表3。
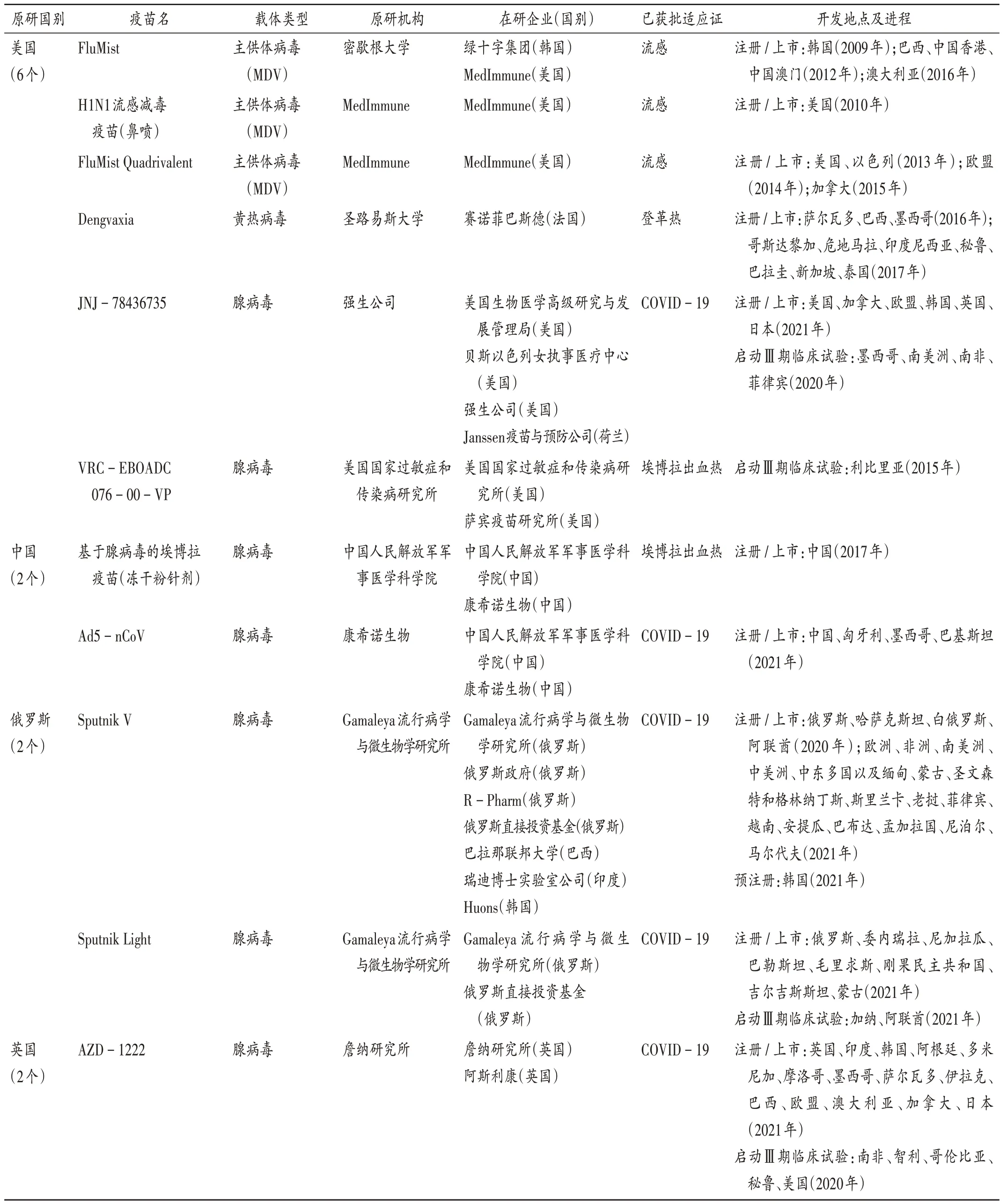
表2 全球已启动Ⅲ期临床试验、预注册、注册或上市的病毒载体疫苗Tab.2 Viral vector - based vaccines that have been investigated in phase Ⅲclinical trials,pre - registration,registration or have been launched in the worldwide
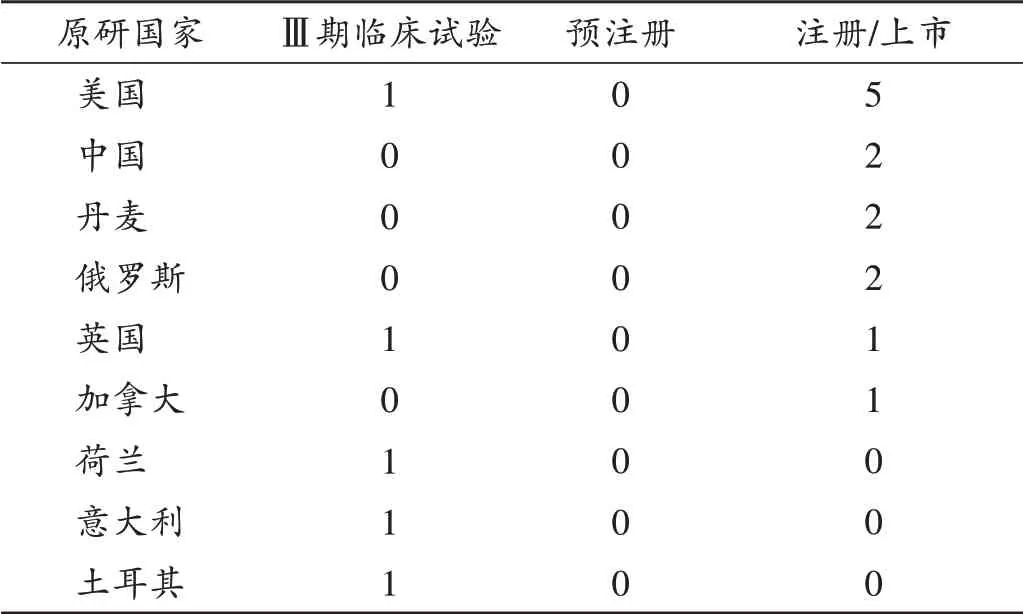
表3 各国处于Ⅲ期临床试验、预注册、注册或上市阶段的病毒载体疫苗数量(个)Tab.3 Number of viral vector-based vaccines that have been investigated in phase Ⅲclinical trials,pre-registration,registra⁃tion or have been launched in various countries(n)
3 讨论
3.1 上市时间趋势
2020年至2021年,在新冠肺炎疫情的冲击下,世界各国均加大了病毒载体疫苗研发投入,各大生物医药公司以最快的速度推进该类疫苗研发。据世界卫生组织(WHO)统计,截至2021 年1 月22 日,全球范围内有64个COVID −19疫苗进入临床阶段[5],到2021年12月14 日,进入临床研究阶段的COVID −19 疫苗已达137个[6]。在2019 年之前,全球病毒载体疫苗平均每年有1~2个产品注册或上市,0~1个启动Ⅲ期临床试验;新冠肺炎疫情发生后,仅2021 年上半年注册上市或启动Ⅲ期临床试验的产品就达8 个,多数产品的适应证为COVID −19 感染。新冠肺炎疫情明显加速了病毒载体疫苗的研发,随着技术的加快成熟,在未来几年内将会有更多病毒载体疫苗成功上市。
续表2 全球已启动Ⅲ期临床试验、预注册、注册或上市的病毒载体疫苗Continued Tab.2 Viral vector-based vaccines that have been investigated in phase Ⅲclinical trials,pre-registration,registration or have been launched in the worldwide
3.2 适应证分布
病毒载体疫苗目前已上市或在研的适应证以感染类疾病为主,已有较多疫苗在抗感染领域发挥重要作用。如由中国人民解放军军事医学科学院和康希诺生物共同研发的埃博拉腺病毒载体疫苗(Ad5 −EBOV)具有强免疫原性,于2017 年10 月获得原国家食品药品监督管理总局的注册批准[7]。但截至2021 年7 月,尚无以肿瘤为适应证的病毒载体疫苗进入Ⅲ期临床试验阶段。探究其原因,针对肿瘤的病毒载体疫苗技术发展相对不成熟,其中的难点包括肿瘤相关抗原免疫原性较弱、肿瘤细胞形成的免疫抑制微环境难以克服、抗原选择难度高、运输载体效率低等[2]。近几年,仅在肿瘤组织表达而不在正常组织中表达的新抗原成为抗肿瘤病毒载体疫苗的研发热点,此类抗原同时具有高特异性和强免疫原性的特点,为肿瘤的免疫治疗提供了理想的靶标[8]。随着基因测序技术的发展,为每位肿瘤患者进行单独测序和新抗原的筛选,从而使利用新抗原疫苗实现个体化治疗已成为可能[9]。未来,新抗原病毒载体疫苗在肿瘤治疗领域潜力极大。
3.3 原研机构
大部分病毒载体疫苗的原研机构为高校和研究所,研发后期也会有生物医药企业参与,另有部分产品由高校或研究所共同研发。高校和研究所在学科前沿性研究和基础研究方面更擅长,同时具有人才和资源的优势,易产生较强的学术影响力,但在市场、商业及应用性研究方面略显不足;企业在产品研发过程中可提供较充足的资金、系统性的商业管理,从而有效推进科研成果转化[10−11]。产学研合作的创新网络可有效地在合作主体之间共享资源、互补优势及提高创新效率[12−13]。
3.4 原研机构国别
美国机构研发的病毒载体疫苗数量最多,这是由于美国较早开始重视疫苗的研发与投入,并拥有多家疫苗研发技术较为成熟的企业[14−15]。中国近几年也加大了对生物医药研发的投入,并取得了一定成果。在新冠肺炎疫情中,中国人民解放军军事医学科学院与康希诺生物联合研发的腺病毒载体疫苗Ad5 −nCoV 早在2020 年4 月和9 月就分别进入了Ⅱ期和Ⅲ期临床试验,且具有良好的免疫原性及较低的药品不良反应发生率,目前已在多个国家上市[16−17]。
3.5 预存免疫问题
许多病毒载体疫苗在研发初期假设人体缺乏对载体病毒的免疫,但实际上,预存免疫问题在一定比例患者中存在,且可能影响产品的安全性和有效性。如康希诺生物的疫苗Ⅱ期临床试验结果显示,对5型腺病毒有高水平预存免疫的人数占52%,这部分受试者接种疫苗后产生的免疫反应较弱[16−18]。预存免疫问题对病毒载体疫苗的研发提出了巨大的挑战,科学家们也提出了许多解决方案:一是增加高预存免疫水平接种者的接种剂量;二是在接种疫苗前对接种者进行血浆置换,从而降低预存免疫水平;三是通过基因修饰载体病毒的衣壳避免载体病毒与预存的中和抗体相结合[19−20]。因此,生物技术可在一定程度上改善预存免疫问题。
3.6 结语
全球病毒载体疫苗产品研发成果逐渐积累,已有多款用于感染类适应证的产品获批注册上市,用于肿瘤和其他适应证的产品距离上市较远。美国、中国、俄罗斯、英国、丹麦、加拿大等国研发机构在该领域的研发进展较快。

