同种属来源一抗在乳腺癌量子点多标记荧光染色中的应用
徐 千 陈媛媛 王林伟 熊 斌
1肿瘤生物学行为湖北省重点实验室/湖北省肿瘤医学临床研究中心 湖北 武汉 430071;武汉大学中南医院 2胃肠外科,3肿瘤放化疗科 湖北 武汉 430071
多标记荧光染色技术是利用不同发射波长的荧光染料,通过抗原抗体反应或生物亲和反应等方法,同时标记多个靶标分子,实现多靶标的实时成像和分析的染色技术,是基础研究和临床诊断中实现多分子成像和分析的重要工具[1,2]。目前,荧光染色中广泛使用的荧光染料包括荧光蛋白和小分子有机荧光染料,上述传统的荧光染料存在光化学稳定性差、激发光谱窄、发射光谱宽等缺点,且需要不同波长的激发光进行激发,存在发射光谱交叠和红色拖尾等现象,难以进行实时的多分子成像[3,4]。与之相比,量子点(quantum dots,QDs)作为一种具有优良光学性能的半导体纳米晶体,具有一元激发多元发射、抗光漂白和化学降解强、荧光强度高、发射光谱窄且对称、不易出现光谱重叠等优势,常用于多靶标分子的研究[5-7]。然而,当靶标一抗种属来源相同时,多标记荧光染色会出现交叉反应,限制了其在多分子成像中的应用。
本研究拟使用多色QDs 对浸润性乳腺癌组织中细胞角蛋白(cytokeratin,CK)、人类表皮生长因子受 体2(human epidermal growth factor receptor-2,HER-2)、雌激素受体(estrogen receptor,ER)进行实时成像,探讨QDs 多标记染色的优势,并对如何避免同种属来源一抗的交叉反应等问题进行分析讨论,从而建立同种属来源一抗间接法三标记QDs 荧光染色方案。
1 材料与方法
1.1 主要试剂一抗:小鼠抗人CK 单克隆抗体、兔抗人ER 单克隆抗体购自Dako 公司,兔抗人HER-2 单克隆抗体购自Cell Marque 公司。QDs 试剂:QDs-565 标记的山羊抗小鼠二抗、QDs-605 标记的山羊抗兔二抗、QDs-655 标记的山羊抗兔二抗购自Thermo Fisher 公司。抗原修复缓冲液(EDTA法)、EliVisionTMplus Polyer HRP 二抗试剂盒购自福州迈新生物技术开发有限公司。QDs 和常用荧光染料的激发与发射光谱见图1。
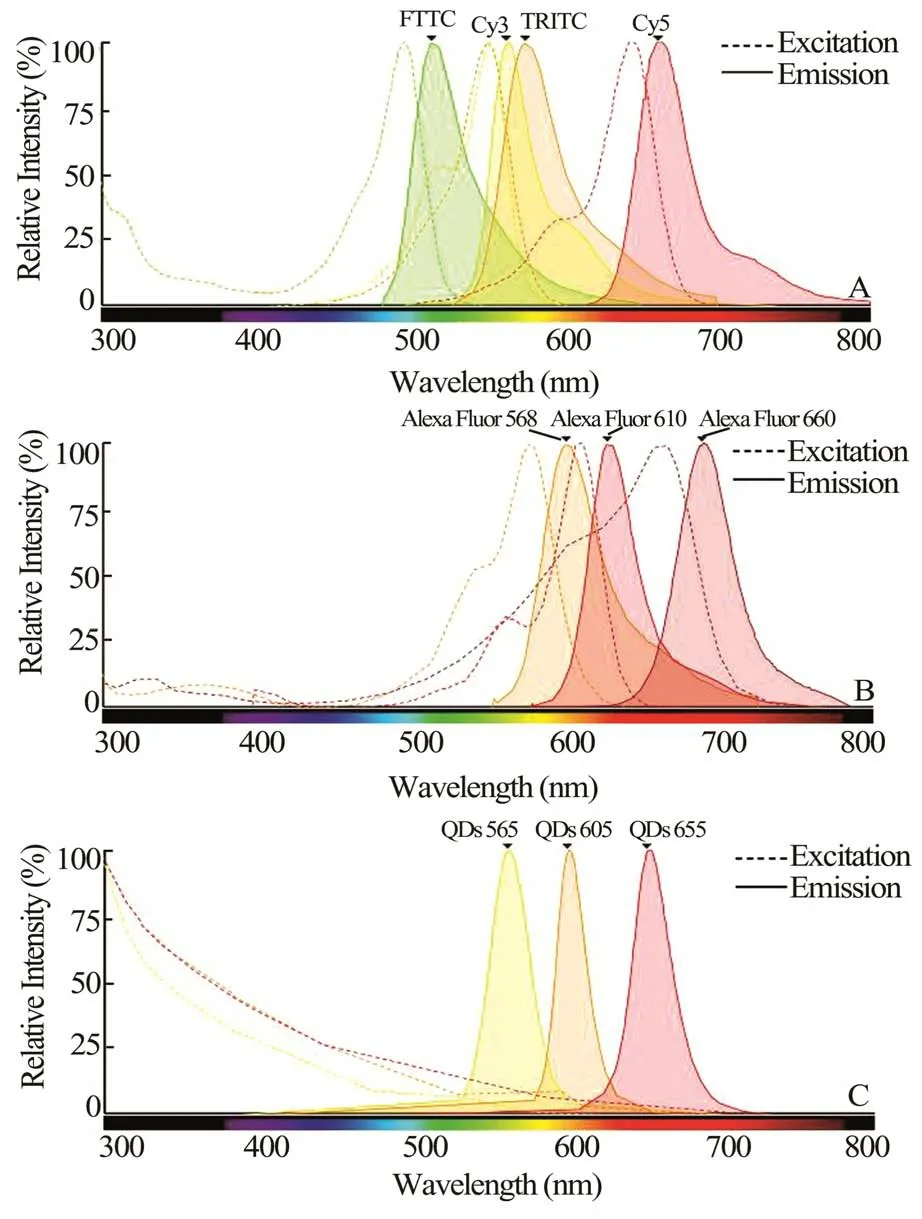
图1 QDs 和常用荧光染料的激发与发射光谱
1.2 组织切片28 例浸润性乳腺癌(非特殊类型)患者的乳腺癌组织标本收集于武汉大学人民医院,组织标本经4%中性甲醛液固定,常规石蜡包埋,4 μm 厚连续切片。28 例乳腺癌组织标本主要包括:CK(+),HER-2(阳性),ER(+)10 例;CK(+),HER-2(阳性),ER(-)7 例;CK(+),HER-2(-)8 例,ER(+);CK(+),HER-2(阴性),ER(-)3 例。
1.3 免疫组织化学EliVision 二步法免疫组织化学染色采用EliVision 二步法进行。其中CK 的工作浓度为1∶200,HER-2 的工作浓度为1∶100,ER 的工作浓度为1∶100。CK(+)定义为低倍镜下可见的胞质着色、ER(+)定义为>1%的肿瘤细胞核染色、HER-2 阳性定义为>10%的肿瘤细胞呈现细胞膜染色。
1.4 间接法单标记荧光染色间接法单标记荧光染色主要流程为:石蜡切片60 ℃烤片2 h,置入二甲苯中脱蜡3 次,每次5 min,梯度乙醇入水后,PBS 洗3 次,每次3 min。在高压锅内加入稀释好的EDTA修复液(pH 8.0)进行加热,煮沸后放入切片,继续加热至压力阀开始喷气,关闭压力阀,4 min 后打开压力阀停止加热,切片冷却至室温。5%BSA 37 ℃封闭半小时,甩去BSA 后,每张切片上滴加50 μL一抗稀释液,4 ℃过夜;PBS 洗3 次,每张切片上滴加50 μL QDs 标记二抗稀释液,37 ℃下孵育1 h;PBS洗3 次,50%甘油封片后于CRi Nuance 多光谱成像系统下观察拍照。其中一抗CK、HER-2、ER 工作浓度同1.3,二抗QDs-565、QDs-605、QDs-655 工作浓度1∶200。
1.5 间接法三标记荧光染色间接法三标记荧光染色过程如图2A 所示。主要流程为:石蜡切片60 ℃烤片2 h,置入二甲苯中脱蜡3 次,每次5 min,梯度乙醇入水后,PBS 洗3 次,每次3 min,对抗原进行高压热修复(见1.4),5%BSA 37 ℃封闭半小时,甩去BSA 后,每张切片上滴加50 μL 小鼠抗人CK单克隆抗体和兔抗人HER-2 单克隆抗体的一抗混合液,CK 工作浓度1∶200,HER-2 工作浓度1∶100,4 ℃过 夜;PBS 洗3 次,每 张 切 片 上 滴 加50 μL QDs-565 标记的山羊抗小鼠二抗和QDs-655 标记的山羊抗兔二抗的二抗混合液,QDs-565 工作浓度1∶200、QDs-655 工作浓度1∶100,37 ℃下孵育1 h;PBS 洗3 次,每张切片上滴加50 μL 兔抗人ER 单克隆抗体的一抗稀释液,ER 工作浓度1∶100,常温下孵 育2 h;PBS 洗3 次,每 张 切 片 上 再 滴 加50 μL QDs-605 标记的山羊抗兔二抗的稀释液,QDs-605工作浓度1∶200,常温下孵育2 h,PBS 洗3 次;50%甘油封片后于CRi Nuance 多光谱成像系统下观察拍照。
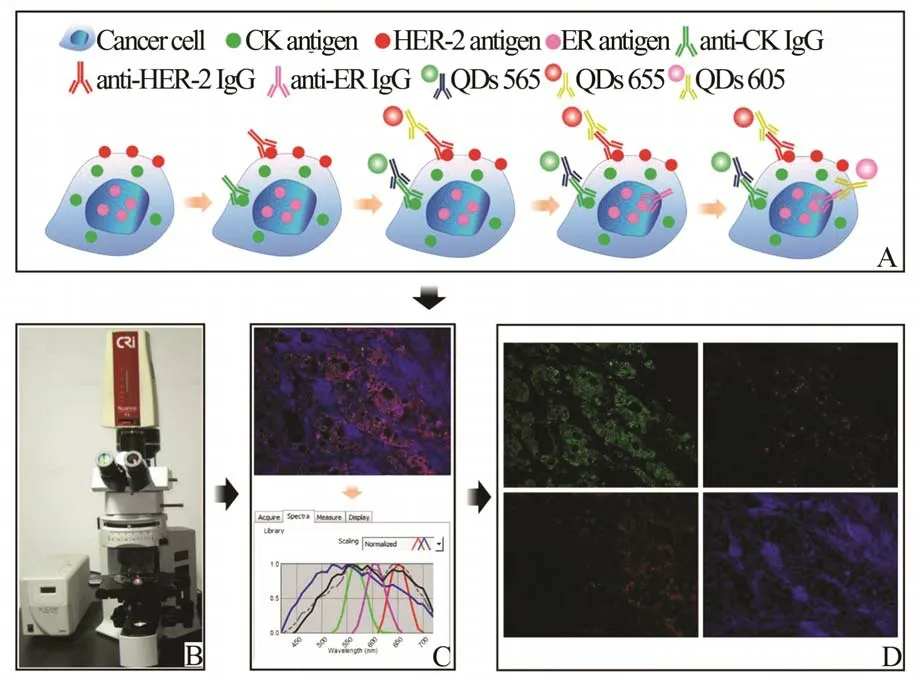
图2 QDs 荧光染色和图像采集分析
1.6 图像采集和分析图像采集和分析过程如图2B→2D,在200 倍镜下,使用装备有CRi Nuance 多光谱成像系统(剑桥研究和仪器股份有限公司,美国)的Olympus BX51 荧光显微镜(奥林巴斯光学有限公司,日本),同时采集CK、HER-2、ER 的荧光光谱信息,采集参数为:采集光谱区间420 至720 nm,采集光谱间隔10 nm,曝光时间800 ms,采集的图像保存为cube 格式。图像采集完成后,使用CRi Nuance 多光谱成像系统内的软件包进行CK、HER-2、ER 光谱信息的分离和分析。该过程包括以下3 个关键步骤。
(1)不同光谱值靶标的选择:在CRi Nuance 多光谱软件操作面板上,准确选择CK(565 nm)、HER-2(655 nm)、ER(605 nm)三个靶标的区域和组织自发荧光(由软件自动化设置)区域,分别将其定义为绿色、红色、品红色和蓝色。
(2)靶标图像的分离和组织自发荧光的消除:基于上述选择的三个靶标的特定光谱,应用CRi Nuance 多光谱软件将含有光谱信息的cube 图像分离为4 个图像,即绿色荧光信号的CK 图、红色荧光信号的HER-2 图、品红色荧光信号的ER 图和蓝色荧光信号的背景图,通过该步骤,从靶标信号中消除组织自发荧光。
(3)靶标光谱信号的分析:应用CRi Nuance 多光谱系统自动化分析CK、HER-2、ER 光谱信号。
1.7 不同靶标分子的亚细胞定位分析从采集的荧光图像中选取了具有代表性的单个乳腺癌细胞,对其轴径进行划线(黄色虚线),使用CRi Nuance 多光谱软件的共定位分析(Co-localization)功能对轴径上3 种靶标的荧光灰度值分布进行分析。以CK、HER-2、ER 3 种靶标的荧光信号的灰度值作为纵坐标,距黄色虚线起点距离作为横坐标作散点图,分析3 种靶标的亚细胞定位和在荧光图像上的重叠情况。
2 结果
2.1 免疫组化染色和QDs 荧光染色免疫组化染色和QDs 荧光染色的结果如图3 所示。免疫组化染色显示CK、HER-2 和ER 分别表达于胞质、胞膜和胞核中,QDs 荧光染色经过Nuance 多光谱软件分离后,其中的CK、HER-2、ER 三种靶标分别呈现绿色、红色和品红色荧光,而组织自发荧光呈现蓝色,与靶标荧光分离清楚。免疫组化染色和QDs 荧光染色都能较清楚地显示靶标的亚细胞定位和表达情况,QDs 荧光染色可以对背景荧光进行去除,显示出靶标单独的荧光信号。
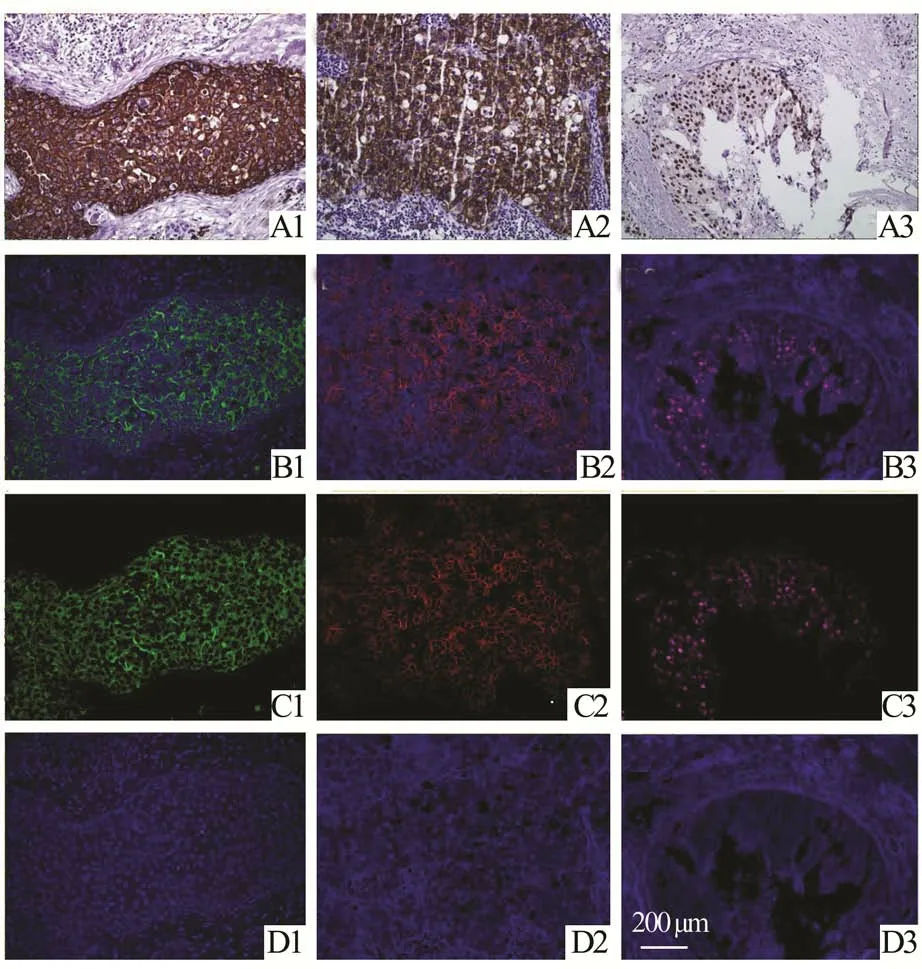
图3 免疫组化染色和QDs 荧光染色
2.2 不同CK、HER-2、ER 表达水平乳腺癌组织的荧光染色不同CK、HER-2、ER 表达水平乳腺癌组织的荧光染色如图4 所示,“Multi”为CRi Nuance多光谱软件采集的三靶标荧光图像,“CK”、“HER-2”、“ER”分别为分离后的CK、HER-2、ER 荧光 图 像。 图4A1、4A2、4A3 和4A4 分 别 对 应CK(+)、HER-2(阳性)、ER(+),CK(+)、HER-2(阴性)、ER(+),CK(+)、HER-2(阳性)、ER(-)和CK(+)、HER-2(阴性)、ER(-)等4 种不同CK、HER-2、ER 表达水平的多标荧光图像。经过Nuance 多光谱软件分离后的图像,可以清楚显示CK、HER-2 和ER 的表达。CK 主要表达于胞质中,呈QDs-565 标记的绿色。HER-2 主要表达于胞膜上,呈QDs-655 标记的红色。ER 主要表达于胞核中,呈QDs-605 标记的品红色。蓝色荧光图像呈现组织的轮廓,代表组织自发成像。不同CK、HER-2 和ER 表达水平乳腺癌组织的荧光染色与患者原始的免疫组化结果一致。
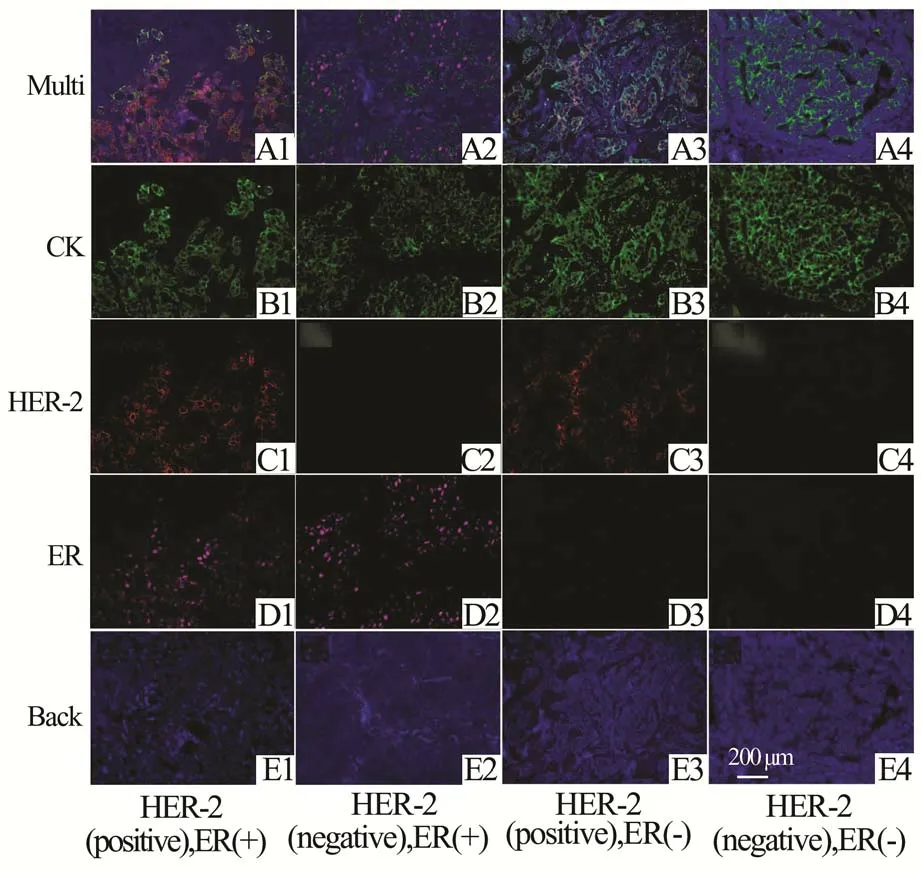
图4 不同CK、HER-2 和ER 表达水平的荧光染色
2.3 乳腺癌细胞中HER-2、ER、CK 的亚细胞定位为了研究三种靶标的亚细胞定位和在荧光图像上的重叠情况,本研究从采集的荧光图像中选取了单个乳腺癌细胞,对其轴径进行划线并使用CRi Nuance 多光谱软件进行了亚细胞定位分析(图5)。结果显示,胞核中ER 的品红色信号与胞膜上HER-2 的红色信号、胞质中CK 的绿色信号在空间上分离清楚,相互交叠的部分较少。而胞膜上HER-2 的红色信号与胞质中CK 的绿色信号在空间上存在小部分交叠,但可经CRi Nuance 多光谱软件进行完全分离,显示各自的亚细胞定位。
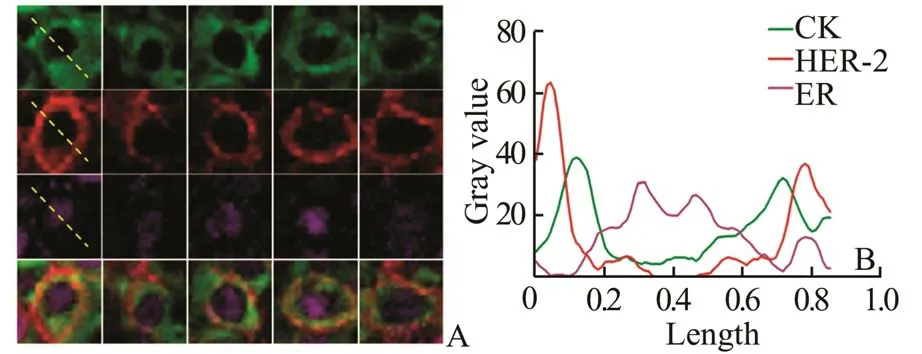
图5 单个乳腺癌细胞中CK、ER 和HER-2 的亚细胞定位
3 讨论
多标记荧光染色方法主要分为直接法和间接法两种方法,直接法利用荧光染料直接标记多种抗体,对目标组织中的靶标分子进行显色[8]。间接法则先通过不同一抗孵育靶标分子,再使用多种荧光染料标记的二抗与对应的一抗结合,对靶标分子进行显色。与直接法多标染色相比,间接法多标染色具有特异性佳、敏感性好、操作简单、性价比高等优势,是目前多标记荧光染色的最常使用方法[9]。间接法多标染色中二抗与一抗Fc 段的结合是非特异性的,要求标记目标分子的一抗种属来源不同,以避免二抗非特异性连接多个靶标一抗,造成交叉染色[10]。但在实际研究过程中,经常遇到一抗种属来源相同的情况,限制了间接法多标记荧光染色的应用[11]。开发新型多标记染色技术,降低同种属来源一抗交叉染色的影响,对基础研究和临床诊断具有重要意义。如图1 所示,传统荧光染料存在光化学稳定性差、激发光谱窄、发射光谱宽等缺点,需要不同波长的激发光进行激发,发射光存在光谱重叠和红色拖尾等现象。因此,使用传统荧光染料克服一抗种属来源限制,进行间接法多标记荧光染色较为困难。而QDs 作为新型荧光材料,具有抗光漂白和化学降解强、荧光强度高等优势,且QDs 的激发光谱宽、发射光谱窄,发射光谱不易重叠,可在一元激发下进行多色成像。同时使用多种QDs 标记靶标分子,发出的荧光信号较易进行分离[12,13]。因此,本研究利用多色QDs 对乳腺癌中CK、ER、HER-2 多个靶标进行了间接法荧光染色,证实了同种属来源一抗多标记染色的可能性和应用效果。
本课题组之前的研究表明,对于单个靶标,QDs荧光染色和免疫组化染色均能显示靶标的亚细胞定位和表达情况,染色结果有较好的相关性和一致性,这与本次研究的结果一致(图3)[14,15]。随后本研 究 利 用QDs-565、QDs-655 和QDs-605 三 种 颜 色的量子点对浸润性乳腺癌组织中CK、HER-2 和ER三个靶标分子进行荧光染色,其中CK 一抗种属为小鼠抗人,而HER-2 和ER 一抗种属均为兔抗人,通过顺序法先利用QDs-565、QDs-655 对CK、HER-2进行双标记染色,再利用QDs-605 对同种属的ER进行染色,并使用CRi Nuance 多光谱软件采集荧光图像。Nuance 多光谱软件光谱分离后三靶标荧光染色结果显示,绿色QDs-565 标记了主要表达于肿瘤细胞质的CK,呈现出癌巢的轮廓。而红色QDs-655 和品红色QDs-605 分别标记了表达于肿瘤细胞膜的HER-2 和细胞核的ER。两种同种属来源的一抗HER-2 和ER 未发生明显的交叉反应,针对不同CK、HER-2 和ER 表达水平乳腺癌组织的荧光染色效果满意(图4)。对三种靶标的亚细胞定位分析显示,胞核中ER 的品红色信号与胞膜上HER-2的红色信号和胞质中CK 的绿色信号在空间上分离清楚,未发生明显光谱重叠现象。而胞膜上HER-2的红色信号与胞质中CK 的绿色信号在空间上存在小部分交叠,但可经CRi Nuance 多光谱软件进行完全分离,显示各自的亚细胞定位(图5)。
同种属来源一抗发生交叉反应可由多种原因导致。第一,若第一轮二抗(二抗A)不足以封闭一抗(一抗A)所有的结合位点,第二轮二抗(二抗B)将与一抗A 余留的位点结合。针对这种情况,在第一轮染色过程中我们使用了浓度1∶100 的QDs-655,高于推荐浓度,同时在37 ℃下进行孵育,使一抗A 与二抗A 充分结合。第二,若第一轮染色结束后漂洗不充分,残余的二抗A 将与第二轮一抗(一抗B)结合。针对这种情况,使用PBS 彻底漂洗可避免。第三,在第二轮染色过程中,已结合的一抗A 和二抗A 由于温度、漂洗等因素再次分离,引起二抗A 和二抗B 的交叉染色。针对这种情况,在第二轮染色过程中,我们在常温下进行孵育,同时降低了漂洗的力度,防止二抗A 从一抗A 上脱离。除了对抗体浓度、孵育时间、封闭条件、清洗程度进行优化外,也有研究报道了其他预防同源一抗交叉染色的方法。Xing 等[16]认为在顺序法荧光染色中,在孵育第二轮一抗前,用无标记的二抗孵育组织,使第一轮一抗的结合位点饱和,能降低QDs 二抗的交叉染色。Liu 等[17]报道通过甲醛、戊二醛或碳二亚胺交联QDs-抗体-抗原复合物,可避免QDs-二抗从一抗结合位点分离,结合到其他同源一抗上引起交叉染色。此外,多项研究[18-20]应用了一种酪酰胺信号放大技术,利用酪酰胺的过氧化物酶反应产生大量的酶促产物,与周围的蛋白残基结合,在抗原-抗体结合部位形成大量的生物素沉积,生物素与随后加入的链霉素-荧光基团结合,每一轮染色后非共价结合的抗体被洗脱,而共价结合的荧光基团留存在组织上,进而克服抗体交叉反应和一抗二抗种属匹配问题,基于此的Opal/TSA 多标记病理切片染色方案,可用于多达7~10 种标记的同步染色和共定位及定量分析[21,22]。
除了克服了一抗种属来源限制外,QDs 的优良光学特性还保证了多重染色的成像效果。QDs 的发射光谱呈现窄且对称的特点,结合CRi Nuance 多光谱成像系统,无论是三种以上色调的多重染色,还是位于同一区域多种抗原的染色,都可以对相应靶标进行单独分离和分析,而不会发生光谱交叠,造成目标信号间的干扰。
综上,本研究中建立的基于多色QDs 的间接法多标记荧光染色方案,通过调整抗体浓度、优化孵育时间、彻底清洗等手段,可较好地避免一抗种属来源相同时的交叉染色,达到了同时检测多个生物靶标的目的。利用CRi Nuance 多光谱成像系统进行后续荧光图像采集,有利于对单个靶标分子进行分离和亚细胞定位,实现更准确的光谱定量分析。两者结合建立的新型多分子成像技术,有助于将来进行深度的多分子成像和研究。

