植物响应环境变化的长距离信号传导
罗熹晨,刘慧,刘学英,李欣欣,廖红,傅向东,,3
植物响应环境变化的长距离信号传导
罗熹晨1,刘慧2,刘学英2,李欣欣1,廖红1,傅向东1,2,3
1. 福建农林大学根系生物学研究中心,福州 350002 2. 中国科学院遗传与发育生物学研究所,植物细胞与染色体工程国家重点实验室,北京 100101 3. 中国科学院大学,北京 100049
高等植物在应对复杂环境变化时,需要整合和协调不同器官与组织感知的信息,并通过一套精细且复杂的机制经维管系统向受体组织或器官传递,进而系统性协调植物整体的生长发育和环境响应。在维管系统中移动的信号物质称为长距离信号。近年来研究发现,能够长距离移动的信号分子主要有小RNA、mRNA、小肽、激素、第二信使以及蛋白质等几类,这些信号分子能够将细胞外刺激从感知组织传递到靶器官,从而系统性地调控植物发育进程和环境响应。本文重点总结了植物体内长距离移动的RNA、小肽和蛋白质这3类长距离信号分子在调控植物器官发育、养分吸收以及环境响应等方面的研究进展,并对该领域在作物育种方面的应用潜力进行了探讨和展望,以期为作物遗传育种应用提供理论基础。
长距离信号;长距离移动;维管;系统性调控
感知并适应生存环境的变化对于植物的生存和生长发育至关重要。近年来,有关植物细胞内响应外界环境变化和生物、非生物胁迫的分子机制的研究越来越多。研究表明,植物不同器官之间存在的长距离信号传导是植物系统性适应环境的重要方式。例如,地上部利用光能和二氧化碳进行光合作用获得植物生长发育所需的能量,同时根系从土壤中吸收水分和矿质营养,这两个过程之间通过长距离信号传导互相制约、互相调控、互相促进,最终达到整体上的协调与平衡以获得更好的生存[1~3]。在逆境条件下,植物能够感知逆境胁迫信号,并在器官之间整合信息,以协调逆境抵抗和生长发育[4~6]。
动物通过神经系统调控体内信息交流,植物虽然不具备神经系统,但是其维管系统能够精准地连接各个组织和器官,在信息交流和传递过程中发挥重要的桥梁作用。维管束系统主要包括木质部和韧皮部两部分:木质部中含有运输水分的细胞,其主要作用是运输水分以供植物进行呼吸作用,同时能够介导一些根部的多肽物质运输至地上;韧皮部的主要作用是运输光合产物以及多种信号物质,以促进植物的生长[7]。筛管和伴胞是韧皮部的主要组成部分,两者通过胞间连丝形成的共质体运输信号分子[8]。研究表明,胞间连丝的孔能够扩张,不仅允许水分、养分、激素或代谢物等小分子在细胞间运输,而且允许最大67 kDa的大分子通过[9],因此RNA、小肽和蛋白质等大分子也能通过,实现地上–地下、地下–地上、器官–器官的长距离物质运输和信号传递,对植物生长发育和环境适应具有重要作用(图1)。
1 RNA长距离移动
RNA分子作为遗传信息的重要载体,在编码、转录、调控基因表达等方面发挥作用,而且作为活跃的信号分子,从合成部位长距离运输到其他组织,响应外界环境变化从而调控基因的表达和植物的发育[10]。研究表明,植物体内至少有3类RNA分子能够通过胞间连丝进行长距离运输:(1)外源类病毒或RNA病毒;(2)非编码RNA;(3)植物内源mRNA[11]。
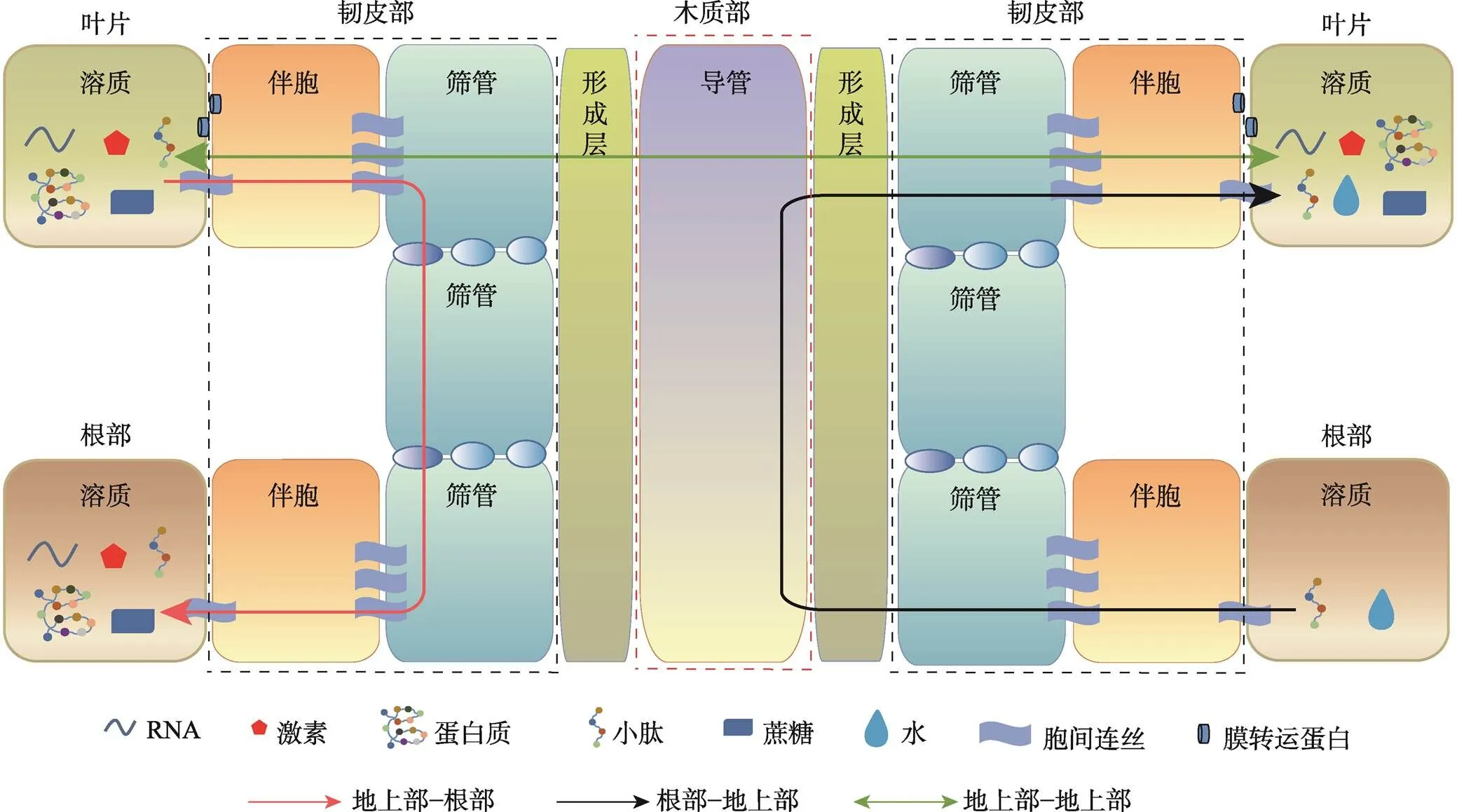
图1 长距离信号物质在细胞间的传递过程
1.1 病毒与类病毒RNA在病毒传播过程中的长距离运动
研究人员在研究病毒感染的传播过程中首次观察到了RNA的长距离运动。病毒的运动分为两个阶段:局部细胞间的传播和通过韧皮部的全身运动[12]。类病毒感染植物后,首先入侵植物组织局部的细胞核和叶绿体,借助其中的RNA聚合酶Pol II进行复制。新产生的类病毒通过胞间连丝运输到相邻的细胞,再到达维管组织,直至感染整个植株[13]。
病毒含有特殊的运动蛋白(movement protein, MP),具有结合病毒RNA的能力,通过形成MP-RNA复合物促进病毒核酸在宿主细胞间移动,并且能增加胞间连丝的传输极限,协助RNA病毒通过维管束鞘细胞、韧皮部薄壁组织、伴胞等进入韧皮部,并在其中快速地运输,最后在远端位点(如新生的幼叶)建立侵染位点,达到系统侵染的目的[14]。例如,大豆花叶病毒(soybean mosaic virus, SMV)是大豆(L.)病毒性疾病的致病因子之一,该病毒侵入大豆叶肉细胞后,MP帮助病毒RNA通过叶肉细胞的胞间连丝来实现胞间转运,并且经过韧皮部筛管实现长距离运输[15]。苹果茎痘病毒(apple stem pitting virus, ASPV)主要通过嫁接传播,利用植物维管系统实现长距离运输[16]。另外,一些病毒RNA移动还需要有外壳蛋白(coat protein, CP)的存在。例如,烟草花叶病毒(tobacco mosaic virus, TMV)的外壳蛋白关键氨基酸的改变,导致TMV病毒的系统性传播时间延迟[17,18]。有趣的是,一些特定病毒家族的病毒RNA似乎也能够在没有MP或CP存在的情况下从细胞到细胞甚至长距离传播[19],但是其中的分子机制还未揭示。
1.2 非编码RNA的长距离移动介导植物基因沉默与养分胁迫
非编码RNA (non-coding RNA, ncRNA)是由基因组转录的不编码蛋白质的RNA分子,根据其长度大小分为小的非编码RNA (长度在20~200 nt之间)和长链非编码RNA (长度超过200 nt)。研究表明,siRNA (small interfering RNA)、miRNA (microRNA)、lncRNA (long non-coding RNA)等非编码RNA是重要的转录后调控和表观遗传调控因子[20]。
siRNA介导转录后基因沉默(posttranscriptional gene silencing, PTGS),这是一种植物先天防御机制[21]。外源产生的siRNA可以通过宿主胞间连丝在细胞之间移动,也可以通过维管系统进行长距离运输,最终触发的基因沉默可以传播到整个植物。已知siRNA可以从其产生位点扩散,可能以21 nt RNA的形式在胞间传播,而较大的siRNA(24~26 nt)主要参与长距离系统信号传播[22]。同时,来源于转基因或病毒感染的siRNA可以在发生基因沉默的植物韧皮部中检测到,但在未发生基因沉默的植物中却不能检测到,这表明siRNA可能是信号分子本身[23],一旦进入韧皮部,沉默信号沿着韧皮部汁液流动的方向从源头传递到下游。利用转基因植物进行嫁接实验发现,来自砧木的24~25 nt siRNA信号能够移动至接穗传递系统性RNA沉默,导致子代中的PTGS[24]。关于siRNA的转运形式,最近的研究表明,尽管siRNA的正义链和反义链以相近的水平出现在韧皮部汁液中,但不存在双链siRNA分子[23]。这表明siRNA以单链形式通过韧皮部进行运输。
miRNA是由基因组转录的不编码蛋白质的RNA分子,长约21~25 nt,负调控植物的基因表达。与siRNA介导的PTGS不同,miRNA是内源单链RNA,主要作用于靶标基因3′-UTR区,既可以抑制靶标基因的翻译,也可以导致靶标基因降解。虽然韧皮液中存在大量的miRNA,但这些miRNA是否都可以在植物体内移动或进行长距离运输仍然未知。目前,只有少数miRNA在植物体内的移动得到了证实。例如,miR165/166和miR390在植物细胞间移动并调节叶片背腹极性以及根系的发育[25,26];miR156和miR172可能作为一种长距离运输的信号分子调节马铃薯(L.)块茎的形成[27,28];miR399和miR395分别受缺磷和缺硫诱导,通过长距离运输分别调节植物磷营养和硫营养的平衡[29,30]。
lncRNA参与调控植物生长发育的各个方面。lncRNA通过与DNA、RNA和蛋白质分子相互作用来执行其功能,并通过表观遗传、转录、转录后或翻译调控调节其靶标的表达水平[31]。在磷胁迫下,一部分富含ACU多嘧啶束基序(polypyrimidine- tract-binding, PTB)的lncRNA通过韧皮部从叶片向根部进行长距离运输,作为信号分子系统性响应植物的缺磷环境[32]。此外,在菟丝子(spp.)与大豆的寄生系统中发现,lncRNA能够进行长距离的双向移动,从而影响宿主和寄主间的物质交换[33]。
1.3 植物内源mRNA的长距离移动调控植物的生长发育和养分平衡
在系统运输的RNA中,成熟的韧皮部中存在内源性mRNAs。由于成熟韧皮部没有细胞核或核糖体,不具备转录和翻译功能,因此内源性mRNAs很可能作为系统性远距离信号分子,影响目标组织中的基因表达,从而控制植物生长发育和形态发生的各个过程[34]。在南瓜()和黄瓜(L.)植株之间进行的异种嫁接实验中,可以在黄瓜接穗韧皮部和顶端组织中检测到南瓜转录物,证明mRNA能够在韧皮部运输[35]。番茄(Miller)的叶片通常是单羽状复叶,而显性突变体(mouse ears,)的叶片最多有八羽状复叶,这种表型是由()和()两个基因之间的融合引起的。同样通过嫁接实验,Kim等[36]发现mRNA能够从番茄突变体的根部长距离移动至野生型接穗的顶端,影响野生型单羽状复叶的生长。在马铃薯中,类BEL1-like transcription factor 1(BEL1)转录因子StBEL5受光周期的调控,可以跨过嫁接点长距离移动至匍匐茎,调控马铃薯的结薯,过量表达mRNA导致块茎显著增加[37]。此外,GA insensitive (GAI)和Auxin/indole-3-aceticacid (Aux/IAA)等转录因子的mRNA可通过长距离移动影响叶片结构、果实大小及根的生长发育[36,38,39]。
除了调控生长发育,mRNA作为信号分子能够参与植物对环境胁迫响应过程。在磷胁迫响应初期,大量的mRNA在根部被诱导通过韧皮部从源移动至库组织中,协助植物维持内部的磷稳态[40]。缺铁胁迫能够诱导苹果(Mill.)/Hexchanger () mRNA从叶片长距离运输到根,并在根中进行翻译,然后通过促进质膜质子泵的活性和锌的液泡区隔化解毒,从而实现对铁和锌稳态的调节以应对缺铁胁迫[41]。
此外,mRNA的长距离移动受基因修饰的影响。最近的研究表明,mRNA长距离运输受m5C甲基化调控,同时移动的() mRNA可以到达特定细胞后发挥功能来促进根系的生长发育[42]。
2 小肽的长距离移动
植物细胞能够分泌由20个氨基酸残基组成的小分子肽,它们能够结合其细胞表面上的受体,从而调节植物的发育,故小肽也称为多肽激素[43]。植物的小肽根据结构差异分为两种类型:翻译后修饰小肽(post-translationally modified peptides, PMTs)和富含半胱氨酸多肽(cysteine-rich peptides, CRPs)[44]。近年的研究表明,小肽是植物细胞和组织间通讯的重要移动介质,在一定程度上补充了植物激素的调节功能。作为功能性信号分子,它们会在特定环境和组织中释放并被其特异性受体识别,精确地将环境信号从感知器官传递到特定目标组织,从而系统性的调节植物整体的生长和逆境响应(图2A)。
2.1 CLE25小肽长距离传递水分胁迫信号
CLAVATA3/Endosperm surrounding region-related (CLE)小肽家族是植物多肽激素中最大的一个家族,包含32个成员。虽然已经报道的CLE小肽的功能大多与干细胞的发育相关,但是越来越多的研究表明CLE小肽的长距离移动和细胞间通信在植物非生物胁迫响应方面具有重要作用。植物可以感知根部缺水状态,协调和优化自身对渗透胁迫的适应并启动渗透胁迫响应。在脱水胁迫下,植物会增加脱落酸(abscisic acid, ABA)的含量来调节气孔关闭,防止水分从植物体内流失[45]。研究表明,小肽CLE25通过长距离移动调节ABA的生物合成和气孔关闭进而介导渗透胁迫信号由根部向地上部的传递。在缺水条件下,根系维管组织分泌CLE25小肽,其通过维管系统从根部长距离移动到叶片,进一步与BARELY ANY MERISTEM1 (BAM1)和BAM3受体结合,从而诱导()基因表达以增加叶片中ABA的积累,但是目前根部CLE25分泌的调节机制尚不明确[46]。
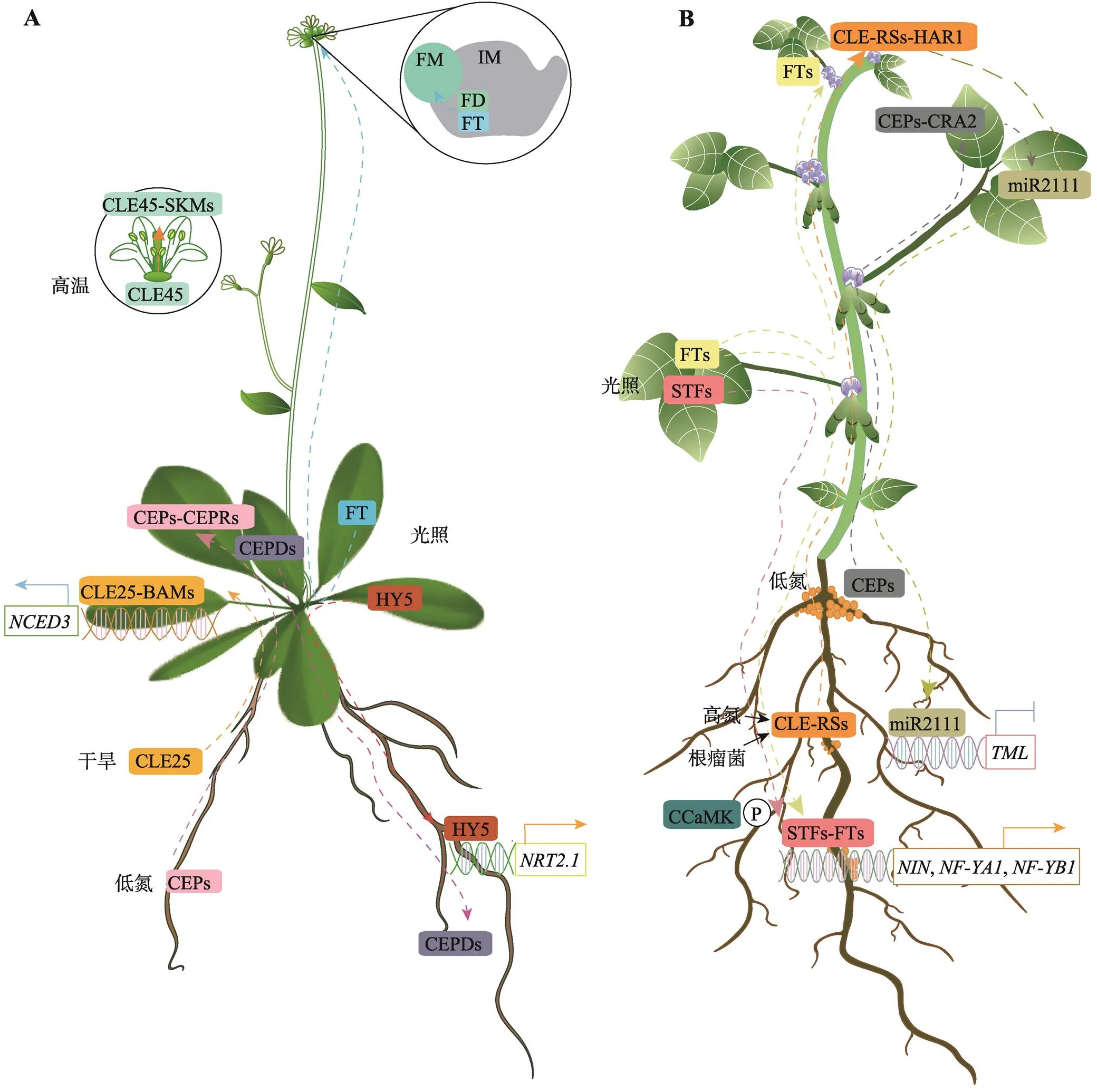
图2 长距离信号调控植物环境响应和豆科植物结瘤
A:长距离信号调控拟南芥响应外界光照、水分、温度以及氮素变化。植物通过长距离和细胞间通信,整合远端器官之间的环境信息,以适应变化的环境条件。在缺水条件下,拟南芥CLE25小肽长距离传递水分胁迫信号至叶片,诱导叶片中ABA的积累,从而调节气孔关闭,防止水分从植物体内流失;在氮浓度分布不均的土壤中,分泌的小信号肽CEP1受到根的局部氮缺乏上调,并通过木质部转移到地上部,当CEP1被叶片韧皮部中的CEPR1和CEPR2感知时,诱导非分泌的小信号肽CEPD1和CEPD2表达,并进一步通过韧皮部转移至高氮区域的根系中,促进根系发育;高温环境下,CLE45在雌蕊中移动可以改善高温下花粉管的伸长缺陷;开花转变过程中,FT编码的成花素蛋白长距离转运至花序分生组织中调控植物的开花时间;光照条件下,HY5蛋白能够从植物地上部长距离移动至根系,自激活根系HY5表达,同时激活高亲和性硝酸根转运蛋白基因的表达,进而促进根系生长和氮吸收。B:长距离信号调控豆科植物开花以及结瘤过程。在施肥较多时,诱导信号肽CLE-RS在豆科植物根中的表达,CLE-RS肽通过木质部向外移动至地上部,被受体激酶HAR1识别,调节细胞分裂,抑制根瘤的形成。另一方面,CLE-RS-HAR1复合体可导致地上部miR2111下调。miR2111能够通过韧皮组织从叶片移动至根部,抑制参与结瘤的基因表达,促进结瘤。在低氮条件下,CEP1能够长距离运输到地上部分,与CRA2受体结合,并促进miR2111前体的表达,从而抑制靶基因在根部表达,促进结瘤;在光照诱导条件下,GmFT2a与GmSTF3/4能够长距离移动至根中并发生相互作用,且在GmCCaMK激酶的磷酸化作用下,GmCCaMK-STF-FT三者共同激活结瘤起始关键基因的转录,调控根瘤形成。
2.2 CEP1/CEPD1/2小肽长距离移动调控根系对硝酸盐分布不均的响应
由于硝酸盐在土壤中往往分布不均匀,这样植物根系的不同部位常常会处于不同浓度的硝酸盐土壤环境下,因此植物需要通过地上–地下、地下–地上甚至细胞–细胞的信息交流并进行信号精细整合,以调节硝酸盐同化和自身的发育。分根实验表明,氮需求信号从根系的低NO3−一侧传递到高氮一侧,促进()基因表达进而促进硝酸盐吸收和高氮一侧根的发育[47]。研究发现,()编码一个在C-末端附近具有保守结构域的分泌肽,在植物系统性氮响应的过程中发挥着重要作用。在低NO3−一侧,诱导根中的CLE1和CLE3短肽的表达水平上调,然后通过韧皮部转移到地上部分,与叶片中的受体激酶C-TERMINALLY ENCODED PEPTIDE receptor (CEPR)识别,CEP-CEPR信号增强了地上部CEP下游多肽CEP downstream 1 (CEPD1)和CEPD2的积累,CEPD1和CEPD2又可以从地上运输到NO3−丰富的一侧,从而促进的表达[48]。因此,长距离肽信号通路在调节整个植株水平上的氮获取和氮需求之间的协调方面非常重要。
2.3 CLE45长距离移动调控高温耐受性
拟南芥(L.)在生殖发育阶段对热胁迫敏感。用CLE家族的合成肽进行的生物活性测定表明,CLE45可以改善高温下花粉管的伸长缺陷。CLE45在雌蕊的转移通道中表达以响应热胁迫,其受体Skeletal muscle sodium channel 1 (SKM1)和SKM2在花粉和花粉管中组成型表达。CLE45- SKM1/SKM2使植物在高温胁迫下仍能够正常结实。韧皮部的CLE45通过BAM3受体样激酶介导初生韧皮部分化,表明CLE45在不同的靶器官通过特异性受体触发下游不同的生理功能[49]。
3 蛋白的长距离移动
蛋白质作为长距离信号,其功能相对复杂,对其长距离移动的相关研究没有其他小分子移动物质透彻。对于移动蛋白的研究方法,目前主要采用对韧皮部汁液中的蛋白进行分析,研究异源嫁接体系的嫁接植物接穗筛管内容物来验证蛋白是否在结合处移动[50,51]。韧皮部汁液中存在大量的不同种类的蛋白质,且具有多种功能,证明长距离移动的蛋白质调控植物生长的多个过程(图2A)。
3.1 FT蛋白长距离移动调控植物开花时间
关于长距离移动蛋白最直接的一个例子是FLOWERING LOCUS T (FT)蛋白。“成花素(florigen)”假说是由俄国学者Chailakhyan于1937年提出的概念。在光照下,成花素能够从叶片长距离运输至芽的顶端,进而促进开花。之后通过嫁接实验证明,成花素广泛存在于不同种类及不同光周期中的植物。多年来研究表明,植物中FT蛋白即为“成花素”。
FT蛋白属于磷脂酰乙醇胺(phosphatidylethanolamine-binding proteins, PEBP)蛋白家族[52],在植物成花诱导过程中发挥重要调控作用。在拟南芥中利用GFP荧光标记追踪FT蛋白,发现其能够从韧皮部转运到茎尖;通过嫁接验证,FT蛋白能够转移到突变体中,并诱导其开花[53]。利用免疫定位分析,发现带有Myc标签的FT蛋白在胞内和胞间运输并诱导花芽分化,在茎尖组织中并没有检测到mRNA表达,仅检测到Myc-FT蛋白;利用核定位信号肽(nuclear localization signal, NLS)与FT融合,并以维管组织特异启动子()驱动,发现NLS能够限制FT在细胞间移动,无法促进开花[54]。水稻(L.)中同源基因()在叶片中的表达量在短日照条件下逐渐提高,Hd3a蛋白同样能在叶片中表达,之后通过维管系统被转运到顶端,进而诱导水稻开花[55]。
此外,FT还可以从地上向地下移动。在马铃薯中存在两个FT同源蛋白,分别调控马铃薯的开花转变和结薯,其中SELF-PRUNING 3 D (StSP3D)能够从叶片中长距离移动到分生组织,诱导马铃薯开花;短日照条件下,SELF-PRUNING 6A (StSP6A)从叶片长距离移动到匍匐茎顶端,诱导马铃薯的块茎形成[56]。
对于FT蛋白运输的机制目前已有报道,通过筛选FT的互作蛋白,鉴定到与FT运输相关的FT-INTERACTING PROTEIN 1 (FTIP1)蛋白。FTIP1蛋白可能通过与FT蛋白互作保证了FT蛋白从筛管伴胞到茎尖分生组织的运输。FT在FTIP1的帮助下,从筛管伴胞进入筛管,并通过共质体途径的胞间连丝运输到顶端分生组织(shoot apical meristem, SAM)。在SAM,FT从韧皮部卸载下来,进一步移动到茎尖分生组织的内锥状区域,并在此与bZIP转录因子FD互作,激活位于花序分生组织(inflorescence meristem, IM)的另一个开花途径元件()基因和位于花分生组织(flower meristems, FM)的()基因,进而调节开花[57]。
3.2 HY5蛋白长距离移动协调根系生长和养分代谢
拟南芥()是利用突变体克隆的与光形态建成相关的重要基因,其编码168个氨基酸组成的核定位蛋白,分子量为18.5 kDa,是碱性亮氨酸拉链类型的转录因子[58]。HY5能通过不同的光感受器,如光敏色素(phytochromes, PHYs)、隐花色素(cryptochrome 1, CRYs)、紫外线B (ultraviolet-B, UV-B)光感受器接收光信号[59~61],并通过维管系统长距离移动到根部,并将光信号从叶肉细胞传递给下游作用元件,进而调控光形态建成、根系发育、养分汲取等生物过程。HY5蛋白在叶片见光时保持稳定活性,一旦进入黑暗,该蛋白被降解[62]。
研究表明,在白光和远红光条件下,HY5积累,并通过长距离移动至侧根原基中,降低了质膜中生长素转运蛋白PIN-FORMED3 (PIN3)和LIKE-AUX1 3 (LAX3)的丰度,从而减少生长素(indole-3-acetic acid, IAA)向侧根原基的运输,抑制侧根的形成[63]。HY5不仅调节根系的伸长,还能够协调光和重力信号。光敏色素互作因子(phytochrome-interacting factors, PIFs)和HY5可以直接结合基因并激活该基因的表达。基因的过表达可以在黑暗条件下部分拯救的负向重力性表型;在光照下HY5蛋白积累,从而激活基因的表达,进而促进根中的正向重力性,使得根系在土壤中下扎深入[64]。
此外,HY5参与植物养分汲取与碳氮代谢。研究表明,HY5在地上部一方面能够通过增强()、()等基因的表达,促进光合固碳。另一方面,HY5蛋白能通过维管系统从地上部长距离移动至根系,自激活根部基因自身的表达,同时激活高亲和性硝酸根转运蛋白基因的表达,进一步促进根系生长和氮吸收,进而维持植物碳–氮平衡[65]。此外,在缺磷胁迫下,phyB在红光诱导下促进HY5在茎和根中的积累,地上部的HY5移动至根中调节磷饥饿响应基因的表达并促进磷的吸收,并激活()的表达[66]。在光照条件下,番茄中的HY5在叶片中积累并从地上部移动到根部,激活转录因子()基因表达,进而促进根部对铁的摄取[67]。
4 长距离信号调控豆科植物结瘤
豆科植物能够根据外界氮供应情况,控制根瘤的数量。在缺氮的环境中豆科植物可以通过与根瘤菌的结合形成专门的共生器官—根瘤。根瘤由皮质细胞分化而来,使植物能够在缺氮的环境下从大气获得氮源并加以固定[68]。然而,共生是一种消耗能量的活动,其中光合作用产物被用作能量来源驱动皮质细胞增殖和固氮等过程[69]。为了优化其生长,植物需要保持氮收益和碳成本的平衡。当氮充足时,植物不必浪费多余的碳源来产生根瘤,造成不必要的碳损失,因此,高硝酸盐会负调控豆科植物结瘤。豆科植物在长期进化过程中发展出一套负反馈调节机制,使已经形成的根瘤能够抑制新根瘤的形成,被称为结瘤自主调控机制(autoregulation of nodulation, AON)[70]。研究表明,一些小肽和蛋白能够通过长距离信号参与调控根瘤的产生和数目,以确保器官发生与环境信号相平衡(图2B)。
在豆科植物中,根瘤菌诱导一些基因的表达,以激活AON途径[71]。在百脉根(Linn)中,CLE肽还参与硝酸盐对结瘤的调节。在施肥较多时,含有RWP-RK结构域的转录因子NODULE INCEPTION (NIN)诱导信号肽CLE ROOT SIGNAL 1/2 (CLE-RS1/CLE-RS2)在根中的表达,CLE-RS肽通过木质部向外移动至地上部,被富含亮氨酸的重复受体激酶HYPERNODULATION ABERRANT ROOT 1 (HAR1)识别,调节细胞分裂,进一步抑制根瘤的形成[72,73]。另一方面,CLE-RS-HAR1复合体可导致地上部miR2111下调。在植物防御反应中,miR2111能够通过韧皮组织从叶片移动至根部,抑制参与结瘤()基因表达,导致未受根瘤菌感染的寄主植物根系维持易感状态,引起百脉根超结瘤现象[74]。在低氮条件下,豆科植物中基因则诱导表达,CEP1能够长距离运输到地上部分,与Compact Root Architecture 2 (CRA2)受体结合,并促进miR2111前体的表达,从而抑制靶基因在根部表达,促进结瘤[75]。
在大豆中,FT同源蛋白GmFT2a和GmFT5a参与光周期调节的开花过程。GmFT2a和GmFT5a虽然在大豆的花期调控中存在功能互补,但二者在长、短日照条件下的开花促进效应差异较大。在短日照条件下,GmFT2a的开花促进效应比GmFT5a强,而在长日照条件下GmFT5a的开花促进效应更强[76]。除了调控开花时间,GmFT2a和HY5同源蛋白Soybean TGACG-motif binding factor 3/4 (GmSTF3/4)还参与大豆的结瘤。在光照诱导条件下,GmFT2a与GmSTF3/4能够长距离移动至根中并发生相互作用,且在GmCCaMK激酶的磷酸化作用下,GmCCaMK-STF-FT三者共同激活结瘤起始关键基因、()和的转录,调控根瘤形成[77]。
5 结语与展望
与小分子物质通过被动方式在细胞间扩散不同,大分子物质则选择性地通过胞间连丝和维管系统在细胞或不同组织间移动,调节植物的生长发育并协调植物抵抗逆境。近年来,对大分子物质长距离移动协调植物器官、组织间的信息交流的研究引起众多学者的广泛关注。虽然,RNA、小肽以及蛋白的长距离移动参与调控植物抵抗逆境(如磷、氮胁迫)、病毒侵染、植物器官发育、养分吸收同化等过程的相关研究很多,但其中的分子机制并不十分清晰,尤其对于大分子物质长距离移动的生物学功能及调控机制的揭示还很欠缺。目前的研究手段主要通过分析嫁接植物的韧皮部汁液成分来探究能够长距离移动的大分子物质[78],但是对于韧皮部中存在的诸多信号分子,未来有必要发展和利用更多的方法和策略来区分出韧皮部特异性成分和长距离移动信号。
长距离移动信号的研究不仅在生物学基础理论方面具有重要的意义,而且在农业生产方面具有潜在的应用前景。例如,在果树中常运用嫁接的方法来培育新品种,改善果实的品质,长距离移动信号调节植物生长发育的分子机制的揭示可为其提供理论和技术支撑。此外,近年来在越来越多的植物中发现,RNA、小肽、蛋白质的长距离移动与作物养分利用和环境胁迫响应密切相关。因此,长距离移动信号的研究,有助于进一步揭示作物对环境的感知与适应机制,可为高产、高效、抗逆作物新品种培育提供重要的指导。
[1] Hohmann-Marriott MF, Blankenship RE. Evolution of photosynthesis., 2011, 62: 515–548.
[2] Jia ZT, Giehl RFH, von Wirén N. Nutrient-hormone relations: driving root plasticity in plants., 2022, 15(1): 86–103.
[3] Yang Y, Liu HT. Coordinated shoot and root responses to light signaling in., 2020, 1(2): 100026.
[4] Chi XF, Han L. Study on plant stress., 2019, 37(13): 122–124.迟晓峰, 韩琳. 对植物逆境胁迫的研究. 种子科技, 2019, 37(13): 122–124.
[5] Yang YQ, Guo Y. Elucidating the molecular mechanisms mediating plant salt-stress responses., 2018, 217(2): 523–539.
[6] Takahashi F, Shinozaki K. Long-distance signaling in plant stress response., 2019, 47: 106–111.
[7] De Rybel B, Mähönen AP, Helariutta Y, Weijers D. Plant vascular development: from early specification to differentiation., 2016, 17(1): 30–40.
[8] Heo JO, Roszak P, Furuta KM, Helariutta Y. Phloem development: current knowledge and future perspectives., 2014, 101(9): 1393–1402.
[9] Stadler R, Wright KM, Lauterbach C, Amon G, Gahrtz M, Feuerstein A, Oparka KJ, Sauer N. Expression of GFP-fusions incompanion cells reveals non-specific protein trafficking into sieve elements and identifies a novel post-phloem domain in roots., 2005, 41(2): 319–331.
[10] Yang YZ, Mao LY, Jittayasothorn Y, Kang YM, Jiao C, Fei ZJ, Zhong GY. Messenger RNA exchange between scions and rootstocks in grafted grapevines., 2015, 15: 251.
[11] Kehr J, Buhtz A. Long distance transport and movement of RNA through the phloem., 2008, 59(1): 85–92.
[12] Santa Cruz S. Perspective: phloem transport of viruses and macromolecules-what goes in must come out., 1999, 7(6): 237–241.
[13] Wang Y, Ding B. Viroids: small probes for exploring the vast universe of RNA trafficking in plants., 2010, 52(1): 28–39.
[14] Carrington JC, Kasschau KD, Mahajan SK, Schaad MC. Cell-to-cell and long-distance transport of viruses in plants., 1996, 8(10): 1669–1681.
[15] Seo JK, Vo Phan MS, Kang SH, Choi HS, Kim KH. The charged residues in the surface-exposed C-terminus of thecoat protein are critical for cell-to-cell movement., 2013, 446(1–2): 95–101.
[16] Mathioudakis MM, Maliogka VI, Katsiani AT, Katis NIIncidence and molecular variability ofandviruses in apple and pear orchards in greece., 2010, 92(1): 139–147.
[17] Koshkina TE, Baranova EN, Usacheva EA, Zavriev SK. A point mutation in the coat protein gene affects long distance transport of the tobacco mosaic virus., 2003, 37(4): 742–748.
[18] Gera A, Deom CM, Donson J, Shaw JJ, Lewandowski DJ, Dawson WOTobacco mosaic tobamovirus does not require concomitant synthesis of movement protein during vascular transport., 1995, 8(5): 784–787.
[19] Gopinath K, Kao CC. Replication-independent long- distance trafficking by viral RNAs in., 2007, 19(4): 1179–1191.
[20] Wang JJ, Meng XW, Dobrovolskaya OB, Orlov YL, Chen M. Non-coding RNAs and their roles in stress response in plants., 2017, 15(5): 301–312.
[21] Waterhouse PM, Wang MB, Lough T. Gene silencing as an adaptive defence against viruses., 2001, 411(6839): 834–842.
[22] Himber C, Dunoyer P, Moissiard G, Ritzenthaler C, Voinnet O. Transitivity-dependent and -independent cell-to-cell movement of RNA silencing., 2003, 22(17): 4523–4533.
[23] Yoo BC, Kragler F, Varkonyi-Gasic E, Haywood V, Archer-Evans S, Lee YM, Lough TJ, Lucas WJ. A systemic small RNA signaling system in plants., 2004, 16(8): 1979–2000.
[24] Hamilton A, Voinnet O, Chappell L, Baulcombe D. Two classes of short interfering RNA in RNA silencing., 2002, 21(17): 4671–4679.
[25] Carlsbecker A, Lee JY, Roberts CJ, Dettmer J, Lehesranta S, Zhou J, Lindgren O, Moreno-Risueno MA, Vatén A, Thitamadee S, Campilho A, Sebastian J, Bowman JL, Helariutta Y, Benfey PN. Cell signalling by microRNA165/6 directs gene dose-dependent root cell fate., 2010, 465(7296): 316–321.
[26] Marin E, Jouannet V, Herz A, Lokerse AS, Weijers D, Vaucheret H, Nussaume L, Crespi MD, Maizel A. miR390,tasiRNAs, and theirtargets define an autoregulatory network quantitatively regulating lateral root growth., 2010, 22(4): 1104–1117.
[27] Bhogale S, Mahajan AS, Natarajan B, Rajabhoj M, Thulasiram HV, Banerjee AK.: a potential graft-transmissible microRNA that modulates plant architecture and tuberization inssp.., 2014, 164(2): 1011–1027.
[28] Martin A, Adam H, Díaz-Mendoza M, Zurczak M, González-Schain ND, Suárez-López P. Graft-transmissible induction of potato tuberization by the microRNA miR172., 2009, 136(17): 2873–2881.
[29] Lin SI, Chiang SF, Lin WY, Chen JW, Tseng CY, Wu PC, Chiou TJ. Regulatory network of microRNA399 andby systemic signaling., 2008, 147(2): 732–746.
[30] Kawashima CG, Matthewman CA, Huang SQ, Lee BR, Yoshimoto N, Koprivova A, Rubio-Somoza I, Todesco M, Rathjen T, Saito K, Takahashi H, Dalmay T, Kopriva S. Interplay of SLIM1 and miR395 in the regulation of sulfate assimilation in., 2011, 66(5): 863–876.
[31] Chen L, Zhu QH, Kaufmann K. Long non-coding RNAs in plants: emerging modulators of gene activity in development and stress responses., 2020, 252(5): 92
[32] Zhang ZL, Zheng Y, Ham BK, Zhang SP, Fei ZJ, Lucas WJ. Plant lncRNAs are enriched in and move systemically through the phloem in response to phosphate deficiency., 2019, 61(4): 492–508.
[33] Wu YG, Luo D, Fang LF, Zhou Q, Liu WX, Liu ZP. Bidirectional lncRNA transfer betweenand their host plant., 2022, 23(1): 561.
[34] Ueki S, Citovsky V. RNA commutes to work: regulation of plant gene expression by systemically transported RNA molecules., 2001, 23(12): 1087–1090.
[35] Ruiz-Medrano R, Xoconostle-Cázares B, Lucas WJ. Phloem long-distance transport ofmRNA: implications for supracellular regulation in plants., 1999, 126 (20): 4405–4419.
[36] Kim M, Canio W, Kessler S, Sinha N. Developmental changes due to long-distance movement of a homeobox fusion transcript in tomato., 2001, 293(5528): 287–289.
[37] Banerjee AK, Chatterjee M, Yu YY, Suh SG, Miller WA, Hannapel DJ. Dynamics of a mobile RNA of potato involved in a long-distance signaling pathway., 2006, 18(12): 3443–3457.
[38] Notaguchi M, Wolf S, Lucas WJ. Phloem-mobiletranscripts target to the root tip and modify root architecture., 2012, 54(10): 760–772.
[39] Haywood V, Yu TS, Huang NC, Lucas WJ. Phloem long-distance trafficking ofRNA regulates leaf development., 2005, 42(1): 49–68.
[40] Zhang ZL, Zheng Y, Ham BK, Chen JY, Yoshida A, Kochian LV, Fei ZJ, Lucas WJ. Vascular-mediated signalling involved in early phosphate stress response in plants., 2016, 2: 16033.
[41] Hao PB, Lv XM, Fu MM, Xu Z, Tian J, Wang Y, Zhang XZ, Xu XF, Wu T, Han ZH. Long-distance mobile mRNAmodulates iron uptake and zinc compartmentalization., 2022, 23(5): e53698.
[42] Yang L, Perrera V, Saplaoura E, Apelt F, Bahin M, Kramdi A, Olas J, Mueller-Roeber B, Sokolowska E, Zhang WN, Li RS, Pitzalis N, Heinlein M, Zhang SD, Genovesio A, Colot V, Kragler F. m5C methylation guides systemic transport of messenger RNA over graft junctions in plants., 2019, 29(15): 2465–2476.e5.
[43] Murphy E, Smith S, De Smet I. Small signaling peptides indevelopment: how cells communicate over a short distance., 2012, 24(8): 3198–3217.
[44] Olsson V, Joos L, Zhu SS, Gevaert K, Butenko MA, De Smet I. Look closely, the beautiful may be small: precursor-derived peptides in plants., 2019, 70: 153–186.
[45] Munemasa S, Hauser F, Park J, Waadt R, Brandt B, Schroeder JI. Mechanisms of abscisic acid-mediated control of stomatal aperture., 2015, 28: 154–162.
[46] Takahashi F, Suzuki T, Osakabe Y, Betsuyaku S, Kondo Y, Dohmae N, Fukuda H, Yamaguchi-Shinozaki K, Shinozaki K. A small peptide modulates stomatal control via abscisic acid in long-distance signalling., 2018, 556(7700): 235–238.
[47] Gruber BD, Giehl RFH, Friedel S, von Wirén N. Plasticity of theroot system under nutrient deficiencies., 2013, 163(1): 161–179.
[48] Ota R, Ohkubo Y, Yamashita Y, Ogawa-Ohnishi M, Matsubayashi Y. Shoot-to-root mobile CEPD-like 2 integrates shoot nitrogen status to systemically regulate nitrate uptake in., 2020, 11(1): 641.
[49] Endo S, Shinohara H, Matsubayashi Y, Fukuda H. A novel pollen-pistil interaction conferring high-temperature tolerance during reproduction via CLE45 signaling., 2013, 23(17): 1670–1676.
[50] Golecki B, Schulz A, Carstens-Behrens U, Kollmann CB. Evidence for graft transmission of structural phloem proteins or their precursors in heterografts of., 1998, 206(4): 630–640.
[51] Golecki B, Schulz A, Thompson GA. Translocation of structural P proteins in the phloem., 1999, 11(1): 127–140.
[52] Putterill J, Varkonyi-Gasic E. FT and florigen long- distance flowering control in plants., 2016, 33: 77–82.
[53] Corbesier L, Vincent C, Jang S, Fornara F, Fan QZ, Searle I, Giakountis A, Farrona S, Gissot L, Turnbull C, Coupland G. FT protein movement contributes to long- distance signaling in floral induction of., 2007, 316(5827): 1030–1033.
[54] Jaeger KE, Wigge PA. FT protein acts as a long-range signal in., 2007, 17(12): 1050–1054.
[55] Tamaki S, Matsuo S, Wong HL, Yokoi S, Shimamoto K. Hd3a protein is a mobile flowering signal in rice., 2007, 316(5827): 1033–1036.
[56] Navarro C, Abelenda JA, Cruz-Oró E, Cuéllar CA, Tamaki S, Silva J, Shimamoto K, Prat S. Control of flowering and storage organ formation in potato by., 2011, 478(7367): 119–122.
[57] Liu L, Liu C, Hou XL, Xi WY, Shen LS, Tao Z, Wang Y, Yu H. FTIP1 is an essential regulator required for florigen transport., 2012, 10(4): e1001313.
[58] Oyama T, Shimura Y, Okada K. Thegene encodes a bZIP protein that regulates stimulus- induced development of root and hypocotyl., 1997, 11(22): 2983–2995.
[59] Li C, Qi LJ, Zhang SM, Dong XJ, Jing YJ, Cheng JK, Feng ZY, Peng J, Li H, Zhou YY, Wang XJ, Han R, Duan J, Terzaghi W, Lin RC, Li JG. Mutual upregulation of HY5 and TZP in mediating phytochrome a signaling., 2022, 34(1): 633–654.
[60] Mao ZL, Wei XX, Li L, Xu P, Zhang JY, Wang WX, Guo TT, Kou S, Wang WT, Miao LX, Cao XL, Zhao JC, Yang GQ, Zhang SL, Lian HL, Yang HQ.cryptochrome 1 controls photomorphogenesis through regulation of H2A.Z deposition., 2021, 33(6): 1961–1979.
[61] Yang Y, Liang T, Zhang LB, Shao K, Gu XX, Shang RX, Shi N, Li X, Zhang P, Liu HT. UVR8 interacts with WRKY36 to regulatetranscription and hypocotyl elongation in., 2018, 4(2): 98–107.
[62] Podolec R, Ulm R. Photoreceptor-mediated regulation of the COP1/SPA E3 ubiquitin ligase., 2018, 45(Pt A): 18–25.
[63] van Gelderen K, Kang C, Paalman R, Keuskamp D, Hayes S, Pierik R. Far-red light detection in the shoot regulates lateral root development through the HY5 transcription factor., 2018, 30(1): 101–116.
[64] Yang PY, Wen QM, Yu RB, Han X, Deng XW, Chen HD. Light modulates the gravitropic responses through organ-specific PIFs and HY5 regulation ofexpression in., 2020, 117(31): 18840–18848.
[65] Chen XB, Yao QF, Gao XH, Jiang CF, Harberd NP, Fu XD. Shoot-to-Root mobile transcription factor HY5 coordinates plant carbon and nitrogen acquisition., 2016, 26(5): 640–646.
[66] Sakuraba Y, Kanno S, Mabuchi A, Monda K, Iba K, Yanagisawa S. A phytochrome-B-mediated regulatory mechanism of phosphorus acquisition., 2018, 4(12): 1089–1101.
[67] Guo ZX, Xu J, Wang Y, Hu CY, Shi K, Zhou J, Xia XJ, Zhou YH, Foyer CH, Yu JQ. The phyB-dependent induction of HY5 promotes iron uptake by systemically activatingexpression., 2021, 22(7): e51944.
[68] Kouchi H, Imaizumi-Anraku H, Hayashi M, Hakoyama T, Nakagawa T, Umehara Y, Suganuma N, Kawaguchi M. How many peas in a pod? Legume genes responsible for mutualistic symbioses underground., 2010, 51(9): 1381–1397.
[69] Tjepkema JD, Winship LJ. Energy requirement for nitrogen fixation in actinorhizal and legume root nodules., 1980, 209(4453): 279–281.
[70] Oka-Kira E, Kawaguchi M. Long-distance signaling to control root nodule number., 2006, 9(5): 496–502.
[71] Ferguson BJ, Mens C, Hastwell AH, Zhang MB, Su HN, Jones CH, Chu XT, Gresshoff PM. Legume nodulation: the host controls the party., 2019, 42(1): 41–51.
[72] Nishida H, Tanaka S, Handa Y, Ito M, Sakamoto Y, Matsunaga S, Betsuyaku S, Miura K, Soyano T, Kawaguchi M, Suzaki T. A NIN-like protein mediates nitrate-induced control of root nodule symbiosis in., 2018, 9(1): 499.
[73] Okamoto S, Tabata R, Matsubayashi Y. Long-distance peptide signaling essential for nutrient homeostasis in plants., 2016, 34: 35–40.
[74] Tsikou D, Yan Z, Holt DB, Abel NB, Reid DE, Madsen LH, Bhasin H, Sexauer M, Stougaard J, Markmann K. Systemic control of legume susceptibility to rhizobial infection by a mobile microRNA., 2018, 362(6411): 233–236.
[75] Gautrat P, Laffont C, Frugier F. Compact root architecture 2 promotes root competence for nodulation through the miR2111 systemic effector., 2020, 30(7): 1339–1345.e3.
[76] Cai YP, Wang LW, Chen L, Wu TT, Liu LP, Sun S, Wu CX, Yao WW, Jiang BJ, Yuan S, Han TF, Hou WS. Mutagenesis ofandmediated by CRISPR/Cas9 contributes for expanding the regional adaptability of soybean., 2020, 18(1): 298–309.
[77] Wang T, Guo J, Peng YQ, Lyu XG, Liu B, Sun SY, Wang XL. Light-induced mobile factors from shoots regulate rhizobium-triggered soybean root nodulation., 2021, 374(6563): 65–71.
[78] Zimmermann MR, Hafke JB, van Bel AJE, Furch ACU. Interaction of xylem and phloem during exudation and wound occlusion in., 2013, 36(1): 237–247.
Long distance signal transduction in response to environmental changes in plants
Xichen Luo1, Hui Liu2, Xueying Liu2, Xinxin Li1, Hong Liao1, Xiangdong Fu1,2,3
The vascular system is responsible for the communication of information between different organs and the environment as a whole, so that it can coordinate the development of plants and respond to the changes of the environment. The signal substances moving in the vascular system are called long-distance signals. In recent years, it has been found that some long-distance molecular signals, such as microRNA, mRNA, small peptides, hormones, second messengers and proteins, can transmit extracellular stimuli from sensing tissues to target organs, so as to systematically regulate plant development process and environmental response. In this review, we summarize the molecular mechanisms of long-distance moving RNA, small peptides and proteins in plants to regulate plant organ development, nutrient uptake and stress resistance. The application potential of this field in crop breeding was discussed and prospected, in order to provide a theoretical basis for the application of genetics and breeding in crops.
long distance signal; long distance movement; vascular; systematic regulation
2022-05-10;
2022-06-08;
2022-07-01
国家自然科学基金项目(编号:31830082,32170251)资助[Supported by the National Natural Science Foundation of China (Nos. 31830082, 32170251)]
罗熹晨,硕士,专业方向:植物营养分子生物学。E-mail: luoxichen1984@163.com
傅向东,研究员,博士生导师,研究方向:植物发育和环境适应的激素调控机理。E-mail: xdfu@genetics.ac.cn
10.16288/j.yczz.22-153
(责任编委: 储成才)