PG-SGA联合生物电阻抗相位角分析技术的个性化营养干预在胃癌化疗中的应用
汤权琪 周美玲 徐皖湘
胃癌是常见消化道恶性肿瘤疾病,发病率逐年上升,且多数患者确诊时为局部进展期或晚期胃癌。局部进展期胃癌临床治疗方式以手术联合术后放化疗为主,晚期胃癌以姑息性化疗为基础的全身系统治疗[1]。由此可见化疗目前仍是胃癌患者重要的治疗手段之一,但化疗期间常见相关不良反应发生,包括恶心呕吐、食欲下降等胃肠反应,以及白细胞减少、贫血、血小板减少等血液毒性,结合部分术后患者胃肠道功能紊乱及晚期患者高肿瘤负荷消耗,大多数患者存在较高的营养不良风险,从而可能引起化疗间期延长,出现非计划性中断治疗,影响患者整体预后;严重的不良反应需要转诊ICU进一步治疗,加重患者家庭经济负担,甚至导致患者死亡。故针对胃癌化疗患者开展营养支持尤为重要[2]。营养风险筛查2002(nutrition risk screening 2002,NRS 2002)是临床用于患者营养不良风险评估的常见工具,根据NRS 2002评估结果对患者进行营养支持,保证其处于良好的营养状态,有助于提高患者化疗耐受性,从而加快治疗进展[3]。而患者主观整体营养状态评估量表(patient-generated subjective global assessment,PG-SGA)则是一种以肿瘤患者为受众的营养状态评估工具,具有较高的特异性[4]。近年来,以生物电阻抗分析(bioelectrical impedance analysis,BIA)为首的营养相关医疗技术逐渐进入大众视野,利用该技术能够精确了解人体成分和质量变化[5]。为寻求一种效率更高、效果更好的营养支持模式,本次研究基于PG-SGA和生物电阻抗相位角(phase angle,PA)分析技术对胃癌化疗患者实施个性化营养干预,并对其临床应用效果。
1 资料与方法
1.1 一般资料 选取2021年3~12月庐江县人民医院肿瘤科收治的70例胃癌化疗患者作为研究对象,所有患者均依照《胃癌诊疗规范(2018年版)》[6]给出的建议进行化疗,根据入院先后顺序将其分为两组,对照组患者2021年3~7月入院,观察组患者2021年8~12月入院。两组患者性别、年龄、病程、TNM分期等基线资料差异无统计学意义(P>0.05),具有可比性。见表1。
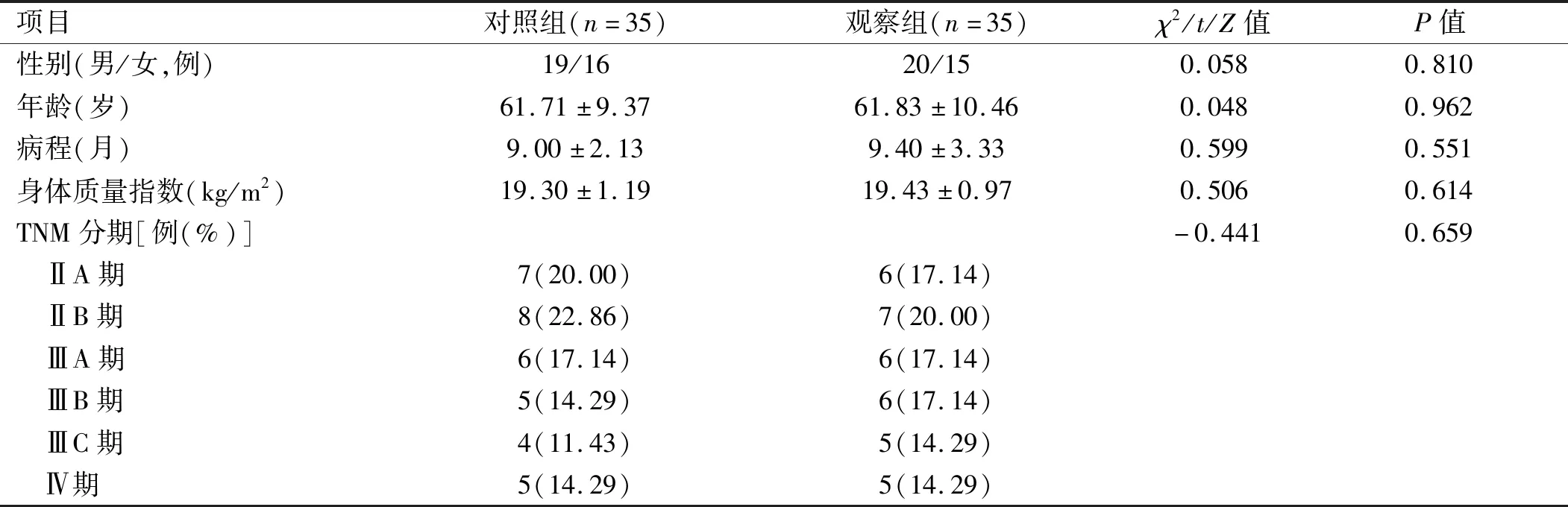
表1 两组患者基线资料比较
纳入标准:①细胞学检查或病理活检结果符合中国临床肿瘤学会制定的《CSCO胃癌诊疗指南2020》[7]中胃癌相关诊断标准;②年龄18~80岁;③TNM分期Ⅱ~Ⅳ期,未发生脑转移;④KPS评分>70分,NRS 2002评估存在营养风险的患者;⑤能进行有效的语言沟通,自愿入选和配合本研究,且知情同意。排除标准:①体内安置金属支架或起搏器;②伴严重感染;③伴严重胸腔积液、腹水;④四肢不健全或伴严重肢体功能障碍;⑤伴骨髓造血功能障碍;⑥伴严重活动性溃疡(胃肠道、皮肤等);⑦化疗前伴重度贫血;⑧伴严重精神心理疾病。伦理审核:根据世界医学大会《赫尔辛基宣言》[8]中涉及人体受试者的医学研究理论原则,本研究获得本院医学伦理委员会批准(批号:202102-01)。
1.2 方法
1.2.1 对照组 根据《CSCO恶性肿瘤患者营养治疗指南》[9]中有关肿瘤患者的营养风险筛查和评估建议,于入组48 h内,选用NRS 2002[10]对患者行营养风险筛查与评估。对于NRS 2002<3 分者,提示其无营养风险,予以常规治疗与护理,并在住院期间每周进行1次营养风险筛查。对于NRS 2002≥3 分者,提示其存在营养风险,采用简明膳食自评表[11],对患者每日实际摄入能量及需要补充的能量缺口进行计算,并据此使用静脉营养液或肠内营养为患者实施营养支持,采用静脉营养时,要求非蛋白质能量20~25 kcal/(kg·d),蛋白质供给量1.5 g/(kg·d);采用肠内营养时,要求总能量25~30 kcal/(kg·d)。静脉营养成分包括脂肪乳注射液、葡萄糖注射液、复方氨基酸注射液、电解质、维生素等;肠内营养根据组成不同分为整蛋白型、氨基酸型、短肽型。
1.2.2 观察组 开展基于PG-SGA[12]和生物电阻抗相位角分析技术[13]的个性化营养干预。①生物电阻抗相位角分析。于入组48 h内,选用临床营养检测分析仪对患者进行生物电阻抗相位角分析,根据肥胖分析、肌肉分析、肌肉均衡分析、身体成分分析结果,对患者营养状态指标予以评价。男性患者以PA<5.0°为存在营养风险,女性以PA<4.6°为存在营养风险。②PG-SGA评估。选用PG-SGA对PA<5.0°的男性患者和PA<4.6°的女性患者进行营养风险筛查与评估,量表内既往症状、体质量变化、活动能力变化及食物摄取情况等自评内容由医师指导患者完成,量表内体格检查、代谢情况、疾病状态及营养需求关系等内容由医师根据检查结果完成,两部分内容评分之和为最终评分。PG-SGA评分0~1分,代表营养状态良好;2~3分,代表疑似营养不良;4~8分,代表中度营养不良;≥9分,代表重度营养不良。③个性化营养干预。根据PG-SGA评估和人体成分分析结果,结合膳食评估,明确营养不良严重程度及类型,如能量缺乏型、蛋白质缺乏型、蛋白质-能量混合缺乏型,有针对性进行营养干预。对于伴有营养不良症状的患者,严格遵循五阶梯治疗原则[14],分别为第一阶梯:饮食+营养教育;第二阶梯:饮食+口服营养补充;第三阶梯:全肠内营养;第四阶梯:部分肠外营养;第五阶梯:全肠外营养。分析患者产生营养不良的原因,提出针对性的、个体化的营养指导、饮食宣教,如调整饮食结构,改善进食频次,减轻心理负担等。经营养教育及膳食指导后,进食量仍不能满足营养需要时,根据患者营养状态,按照从第一阶梯到第五阶梯治疗原则为患者进行营养支持。依照欧洲临床营养和代谢学会《2017 ESPEN专家组建议:防治癌症相关性营养不良的行动》[15]中指导建议,当前一阶梯营养治疗存在3~5 d无法满足患者60%目标能量需求时,应考虑下一阶梯的营养治疗。这五个阶梯既相互连续,又相对独立。此外,根据患者病情需求适当增加营养代谢调节剂,如复方嗜酸乳杆菌片、谷氨酰胺颗粒、醋酸甲地孕酮等。
1.2.3 观察指标 ①营养状态。于入组时(T1)、干预第3天(T2)、干预第7天(T3)、干预第14天(T4)检测患者营养状态指标,包括清蛋白(albumin,ALB)、前清蛋白(prealbumin,PAB)、身体总水分(total body water,TBW)、肌肉量(lean mass,LM)、去脂体质量(fat-free mass,FFM)及体质量(weight,Wt)。正常参考值:ALB 35~51 g/L,PAB 280~360 mg/L,TBW 34.53~42.20 L,LM 44.35~54.21 kg,FFM 46.98~57.42 kg,Wt 53.47~69.36 kg。②化疗不良反应。记录T1~T4期间患者化疗不良反应发生情况,检测指标包括白细胞(white blood cell,WBC)、血小板(blood platelet,PLT)、血红蛋白(hemoglobin,HGB)、谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、恶心程度及呕吐程度。正常参考值:WBC (4.0~10.0)×109/L,PLT(100~300)×109/L,HGB 男性120~165 g/L、女性110~150 g/L,AST 0~40 U/L,ALT 0~40 U/L。本研究以WBC<4.0×109/L、PLT<100×109/L、HGB<110 g/L(女性)或120 g/L(男性)、AST>40 U/L、ALT>40 U/L视为存在化疗不良反应。恶心程度分级:0级,无恶心;Ⅰ级,食欲减退,但无饮食习惯改变;Ⅱ级,经口进食量减少,但无明显体质量减轻、脱水或营养不良;Ⅲ级,经口摄入能量或水分不足,需要鼻饲,全肠外营养或者住院。呕吐程度分级:0级,24 h内未呕吐;Ⅰ级,24 h内呕吐1~2次,呕吐间隔时间≥5 min;Ⅱ级,24 h内呕吐3~5次,呕吐间隔时间≥5 min;Ⅲ级,24 h内呕吐≥6次,呕吐间隔时间≥5 min,需管饲、静脉营养或住院治疗;Ⅳ级,危及生命,需紧急处理。
2 结果
2.1 两组患者T1~T4各阶段营养状态比较 两组患者ALB、PAB、TBW、LM、FFM、Wt水平组间差异均有统计学意义(P<0.05),存在时间效应和交互效应(P<0.05)。见表2。

表2 两组患者T1~T4各阶段营养状态比较
2.2 两组患者T1~T4化疗不良反应发生情况比较 除PLT<100×109/L之外,观察组WBC<4.0×109/L、HGB<110 g/L或120 g/L、AST>40 U/L、ALT>40 U/L等化疗不良反应发生率均低于对照组(P<0.05);观察组恶心程度和呕吐程度均低于对照组(P<0.05)。见表3。
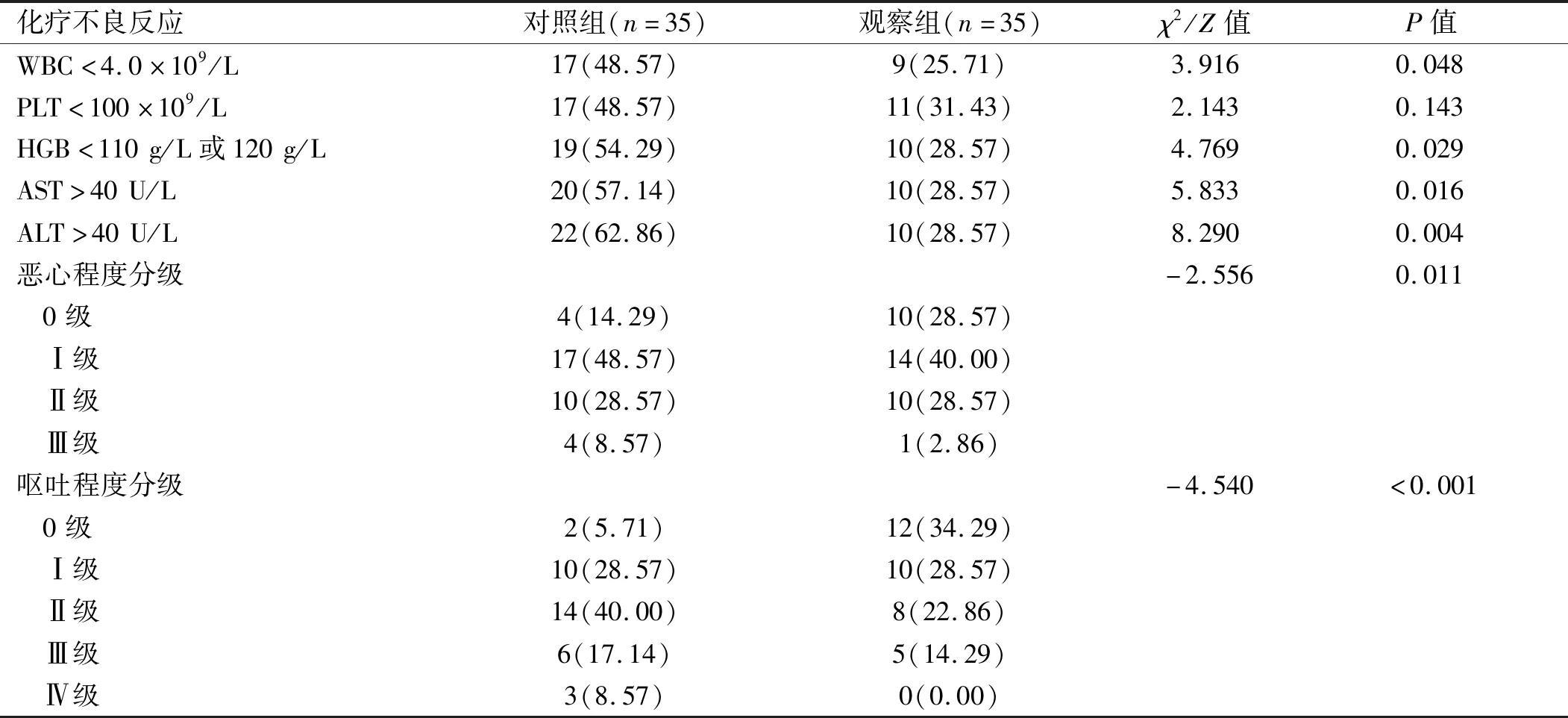
表3 两组患者T1~T4化疗不良反应发生情况比较[例(%)]
3 结论
受恶性肿瘤细胞异常增殖的影响,癌症患者通常长期处于高代谢状态,加上化疗药物产生的毒副效果,使患者无法正常进食,阻碍营养摄入,因而导致癌症患者化疗期间更容易引起营养不良,胃癌患者化疗期间合理开展营养干预,对提高其治疗效果和生活质量均具有重要意义[16]。NRS 2002虽为临床应用最为广泛的营养评估工具,但在临床实践中,该方法无法精准评估患者营养不良的严重程度,从而可能会对营养干预方案的制定造成影响。因此,想要制定更具个性化的营养干预方案,以充分满足患者营养需求,促进患者营养状态改善,则必须从根本入手,寻求一种更加精准的营养评估工具。
与NRS 2002相比,PG-SGA以肿瘤患者为受众,针对性更强,且对患者营养状态的考察内容更加丰富,因而可以更全面反映患者的营养状态,同时也便于医护人员更加准确地找出影响患者营养状态的主要因素。孙乔等[17]和李春蕾等[18]就营养风险筛查研究指出,虽然NRS 2002阳性筛查率更高,但PG-SGA更能反映出患者的营养状态,且PG-SGA对癌症患者的适用性更强,对患者营养状态的研究也更为深入,因此后者更适合作为营养干预方案的制定依据。BIA是目前测量人体成分应用相对广泛的技术手段,具有操作简便、非侵入性、可重复性等特点,PA作为该技术衍生的一项评估人体营养状况的指标,其能在保证对患者无任何影响的前提下,精准获得人体成分结果[19],检测速度比NRS 2002更快,且能在分子层面反映机体各种成分的构成与含量。本研究将PG-SGA和生物电阻抗相位角分析技术有机融合,一方面可凭借BIA检测速度快的优势,在短时间内明确患者是否存在营养风险,提高筛查效率,另一方面可凭借PG-SGA营养考察内容丰富的优势,更加全面地了解患者营养状态,为营养干预方案的制定提供更具价值的参考。
实际临床应用中,NRS 2002更多适用于反应较近的或急性的营养状态改变,有助于营养不良的预防,而PG-SGA则更加侧重于发现患者慢性营养状态的改变,相比其他疾病患者,恶性肿瘤对机体的消耗是持久性的,特别是胃肠道恶性肿瘤患者,对其开展长期的营养状态监测,能为医护人员制定营养支持方案,提供更加可靠的依据,加上PA的人体成分分析结果,使其制定出的营养支持方案,能够在分子水平、细胞水平、组织-系统水平、整体水平等多个层面给予患者营养补充,且这种营养补充会根据患者营养状态的改变发生持续性改变,从而确保患者的营养状态长期处于较高的水平,此外,PA除分析人体成分外,其还会对患者的肥胖程度、肌肉含量、肌肉均衡情况等进行分析,并计算出机体基础代谢率,因而可以精准反映患者机体内各成分的盈亏与否,便于医护人员进一步调整营养支持方案,重复测量方差分析结果显示,两组患者T1~T4期间各项营养指标水平均存在组间效应、时间效应及组间和时间的交互效应(P<0.05),提示PG-SGA与PA在改善胃癌化疗患者营养状态中作用突出。陈媛媛等[20]研究指出,通过改善机体营养状态,可更好地维持血浆蛋白水平稳定,提高治疗耐受。随患者营养状态逐渐趋于正常水平,其机体内可用蛋白质和氨基酸的数量也会随之增加,而这两种营养物质正是构成机体免疫防御功能的基础,使得患者机体免疫功能持续升高,机体控制炎性反应的能力也不断强化,从而实现患者化疗耐受性的有效提高,此外,充足的营养摄入,尤其是维生素的摄入量达到正常水平后,可刺激机体内乙酰胆碱的合成,促使机体神经传导逐步恢复正常,增强胃动力,从而有效抑制胃肠道不良反应的发生。
本研究结果显示,胃癌患者化疗期间合理开展基于PG-SGA和生物电阻抗相位角分析技术的个性化营养干预,有助于患者营养状态改善,并能减少化疗相关不良反应发生。

