金雀花根水提物和乙醇提取物对小鼠高尿酸血症的影响Δ
赵俊杰,张金娟,张春雷,朱勤凤,廖尚高#(.贵州医科大学药学院,贵阳 550025;2.贵州医科大学附属医院药剂科,贵阳 550002;.贵州医科大学基础医学院,贵阳 550025)
高尿酸血症(hyperuricemia,HUA)是由于体内尿酸分泌过多或排泄不足而引起的,现已被证实是引起痛风、肾功能不全、高血压、高脂血症、糖尿病和肥胖等症的关键因素[1]。早期预防和治疗HUA 对上述疾病的预防具有重要意义。尿酸是黄嘌呤氧化酶(xanthine oxidase,XOD)氧化黄嘌呤和次黄嘌呤产生的代谢产物。XOD长期过量产生尿酸和/或肾脏排泄尿酸不足可能导致HUA 和尿酸钠晶体沉积。目前治疗HUA 的化学药主要有2类:一类是减少尿酸过量生成类药物,如别嘌醇和非布索坦等;另一类是促进尿酸排泄类药物,如苯溴马隆和丙磺舒等[2]。这2 类药物虽疗效尚可,但靶点较单一、副作用较大,患者的耐受性、依从性均较差[3-4]。
金雀花根又名锦鸡儿根、阳雀花根,是豆科植物锦鸡儿Caragana sinica(Buc’hoz)Rehd.的根,主要分布在我国河北、陕西、江苏、四川、云南等地,具有补肺健脾、活血祛风的功效,临床上主要用于风湿骨痛、痛风、肺虚、久咳等症的治疗[5]。本课题组前期考察了27种中草药的醇提物和水提物对XOD 的抑制活性,发现金雀花根水提物(water extract ofC.sinica,WCS)及乙醇提取物(ethanol extract ofC.sinica,ECS)具有显著的XOD抑制活性[6]。本研究采用氧嗪酸钾联合次黄嘌呤建立HUA小鼠模型,研究WCS及ECS对HUA模型小鼠尿酸生成和排泄的影响,初步探讨其可能机制,以期为抗HUA药物的研发提供理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括ELX815型全波长扫描式多功能读数仪(美国Bio-Tek 公司)、5200 型全自动化学发光成像分析系统(上海天能科技有限公司)、P50002F型高速冷冻离心机(德国Eppendorf公司)、BS223S型电子天平[赛多利斯科学仪器(北京)有限公司]、KQ5200E型超声波清洗器(昆山市超声仪器有限公司)、ZYCGF-Ⅱ-10T 型超纯水机(四川卓越水处理设备有限公司)、TGL16M型台式低速离心机(湖南凯达科学仪器有限公司)、DYY-6C 型电泳仪(北京六一仪器厂)、ECLIPSE E100型正置光学显微镜(日本Nikon公司)等。
1.2 主要药品与试剂
金雀花根药材于2020 年9 月采自河北省保定市定州市,经贵州医科大学标本馆馆长龙庆德教授鉴定为豆科植物锦鸡儿C.sinica(Buc’hoz)Rehd.的根,标本存放在贵州医科大学天然药物化学教研室(标本号202009)。别嘌醇、苯溴马隆、次黄嘌呤、氧嗪酸钾(批号分别为L2001089、L2010564、L2007066、D0901A,纯度均大于98%)和高效RIPA 裂解液、BCA 蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳制备试剂盒、彩虹180广谱蛋白Marker、HRP Substrate Peroxide Solution超敏发光液、辣根过氧化物酶标记的山羊抗鼠免疫球蛋白G 二抗(批号分别为R0010、PC0020、P1200、PR1910、PE0010、G202117)均购自北京索莱宝科技有限公司;XOD 测定试剂盒(比色法)、血清尿酸(serum uric acid,SUA)测定试剂盒(微板法)、血尿素氮(blood urea nitrogen,BUN)测定试剂盒(微板法)、肌酐测定试剂盒(微板法)(批号分别为A002-1-1、20191011、20190907、20190916)均购自南京建成生物工程研究所;小鼠源葡萄糖转运蛋白9(glucose transporter 9,GLUT9)、尿酸盐转运蛋白1(urate transporter 1,URAT1)、有机阴离子转运蛋白1(organic anion transporter 1,OAT1)单克隆抗体(批号分别为14937-1-AP、NBP1-05054、ab135924)均购自上海优宁维生物科技股份有限公司;小鼠源甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体(批号T0004)购自美国Affinity 公司;聚偏二氟乙烯(PVDF)膜(批号P2938)购自德国Merck 公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 动物
SPF级雄性昆明种小鼠,100只,体质量18~22 g,由贵州医科大学实验动物中心提供,生产许可证号为SCXK(黔)2018-0001。小鼠饲养环境通风良好,温度18~25 ℃,相对湿度40%~70%,12 h/12 h 光照昼夜循环。本实验通过贵州医科大学实验动物伦理委员会审批(编号2000069)。
2 方法
2.1 WCS与ECS的制备
分别称取金雀花根2 kg,加16 L水煎煮提取或16 L 75%乙醇回流提取,均提取2 h,再同法提取1 h,过滤,合并相应的滤液,减压浓缩为浸膏,得WCS 400 g、ECS 519 g,备用。
2.2 分组、建模与给药
小鼠适应性饲养1 周后,按体质量随机分为正常对照组、模型组、别嘌醇组(阳性对照,5 mg/kg[7])、苯溴马隆组(阳性对照,7.8 mg/kg[8])和WCS 低、中、高剂量组(38、75、150 mg/kg,根据临床常用剂量的0.5、1、2 倍换算)以及ECS低、中、高剂量组(50、100、200 mg/kg,根据临床常用剂量的0.5、1、2倍换算),每组10只。除正常对照组小鼠腹腔注射和灌胃等体积生理盐水外,其余各组小鼠于每天早上9:00 腹腔注射氧嗪酸钾100 mg/kg 联合灌胃次黄嘌呤500 mg/kg,连续7 d,建立HUA 模型[7]。从建模第3 天起,各给药组小鼠于建模给药后1 h分别灌胃相应药物,正常对照组和模型组小鼠灌胃等体积生理盐水,每日1次,连续5 d。
2.3 取样与体质量、脏器指数分析
分别称定各组小鼠建模给药第1、3、5、7 天的体质量。末次给药前,禁食不禁水24 h,末次给药1 h后小鼠眼眶取血,室温静置2 h,以3 500 r/min离心15 min,取血清,于-20 ℃中保存备用。采血后脱颈椎处死小鼠,剖取内脏,称定质量,计算肝、肾和脾的脏器指数[脏器指数=脏器质量(g)/体质量(g)×100%]。然后快速将一部分肾组织固定于4%多聚甲醛中保存备用,另一部分肾组织与肝组织于-80 ℃中保存备用。
2.4 血清中生化指标和肝组织中XOD活性检测
取各组小鼠血清适量,按照试剂盒说明书操作,检测XOD 活性和SUA、BUN、血肌酐(serum creatinine,SCR)含量。另取各组小鼠肝组织100 mg,加入生理盐水制成10%的匀浆液,以2 500 r/min 离心10 min,取上清液,按照试剂盒说明书操作,检测XOD活性。
2.5 肝组织中XOD mRNA表达检测
采用实时定量聚合酶链反应(polymerase chain reaction,PCR)法检测。取各组3只小鼠的冻存肝组织,研磨后,转移至1.5 mL 预冷的EP 管中,裂解组织后,抽提RNA,逆转录合成cDNA,然后取1 μL 逆转录产物进行PCR检测。PCR的反应总体系为Takara SYBR Premix Ex Tap 10 μL,上下游引物(20 μmol/L)各0.2 μL,cDNA 2 μL,用ddH2O补至20 μL。反应条件如下:95 ℃预变性2 min;95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸60 s,共40个循环。以GAPDH为参照,采用2-ΔΔCt法计算各组小鼠肝组织中XOD mRNA的相对表达量。引物序列和产物长度见表1。

表1 PCR引物序列和产物长度
2.6 肝组织中XOD 蛋白和肾组织中GLUT9、URAT1、OAT1蛋白表达检测
采用Western blot 法检测。分别称取各组3 只小鼠的冻存肝组织与肾组织样本各100 mg,加RIPA 组织裂解液1 mL,于冰上研磨成匀浆,于4 ℃以12 000 r/min离心10 min,取上清液,采用BCA 法测定蛋白浓度。取蛋白终浓度为1 μg/μL的样本上样15 μL,加入5×蛋白上样缓冲液,于100 ℃加热5 min变性,然后进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,80 V 电泳至Marker 红色条带出现,转换电压120 V 至电泳结束。采用湿转法将蛋白转到PVDF 膜上,用5%脱脂奶粉将膜在室温下封闭1.5 h,用TBST 缓冲液清洗3 次,每次10 min,分别加入XOD、GLUT9、URAT1、OAT1、GAPDH 一抗(目标蛋白稀释比例均为1∶1 000,内参蛋白稀释比例均为1∶3 000),4℃孵育过夜;用TBST缓冲液清洗3 次,每次10 min,加入二抗(稀释比例为1∶3 000),室温孵育1 h,用TBST缓冲液清洗3次,每次10 min,显影成像。采用Image J 1.8.0 软件分析条带的灰度值,以目标蛋白灰度值与内参蛋白(GAPDH)灰度值的比值评价蛋白的相对表达量。
2.7 肾组织病理学观察
取4%多聚甲醛固定的肾组织,乙醇脱水、石蜡包埋、切片,经苏木精-伊红染色后,于正置光学显微镜下观察肾组织的病理学变化。
2.8 统计学分析
所有数据均用SPSS 19.0 软件进行统计分析,数据以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 WCS和ECS对HUA模型小鼠体质量的影响
如表2所示,与正常对照组比较,别嘌醇组小鼠建模给药第3、5、7天的体质量均显著降低(P<0.01),其余各给药组小鼠体质量的差异无统计学意义(P>0.05),表明别嘌醇可抑制小鼠体质量的自然增长,WCS 和ECS对小鼠体质量的增长没有影响。
表2 WCS和ECS对HUA模型小鼠体质量的影响(,n=10,g)
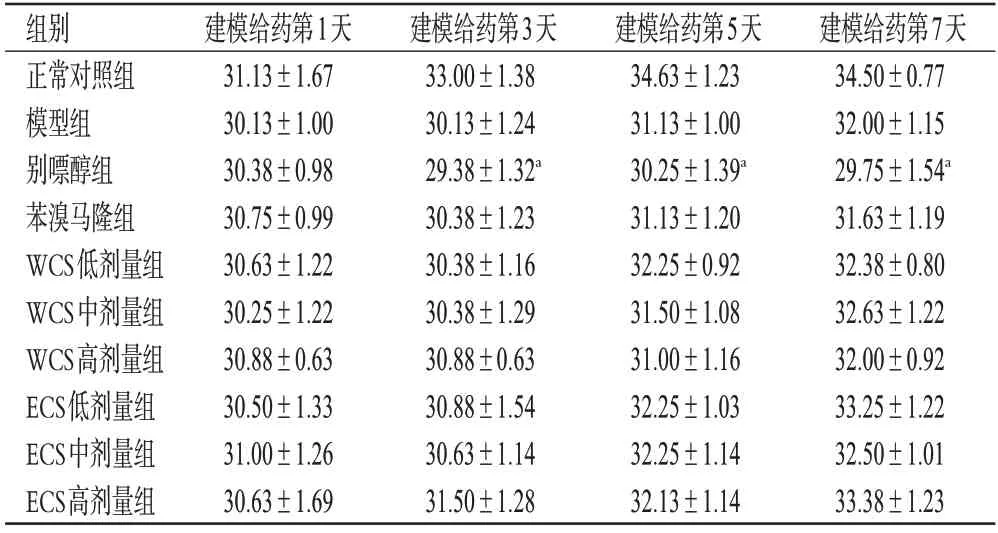
表2 WCS和ECS对HUA模型小鼠体质量的影响(,n=10,g)
a:与正常对照组比较,P<0.05
3.2 WCS和ECS对HUA模型小鼠脏器指数的影响
如表3 所示,各组小鼠的肝脏指数和脾脏指数的差异均无统计学意义(P>0.05),表明WCS 和ECS 对小鼠肝脏和脾脏无明显影响。与正常对照组比较,模型组和别嘌醇组小鼠的肾脏指数均显著升高(P<0.05),表明建模剂(氧嗪酸钾、次黄嘌呤)以及阳性药物别嘌醇对小鼠肾脏有毒副作用。与模型组比较,WCS 和ECS 各剂量组小鼠的肾脏指数均显著降低(P<0.05),表明WCS和ECS能减轻由建模剂引起的肾损伤。
表3 WCS 和ECS 对HUA 模型小鼠脏器指数的影响(,n=10,%)
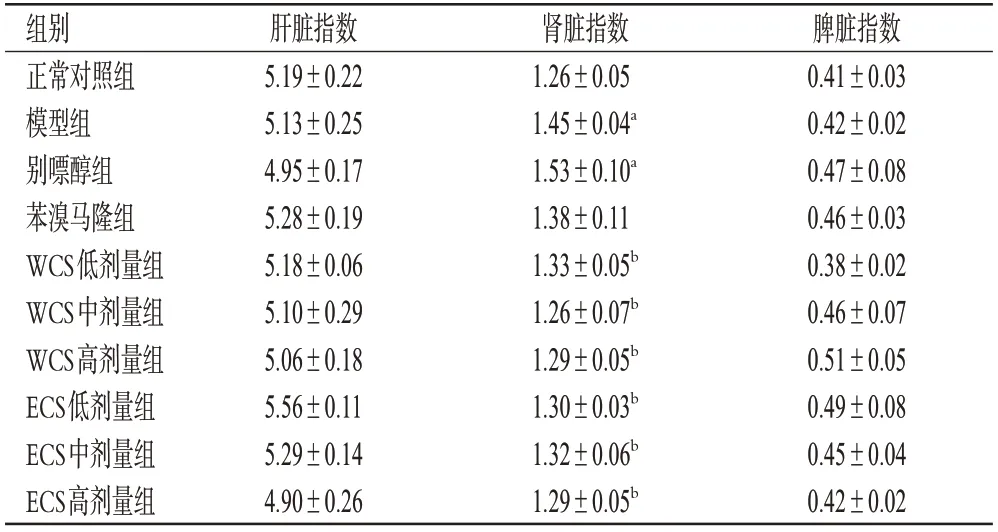
表3 WCS 和ECS 对HUA 模型小鼠脏器指数的影响(,n=10,%)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05
3.3 WCS和ECS对HUA模型小鼠SUA、BUN、SCR含量的影响
如表4 所示,与正常对照组比较,模型组小鼠SUA含量显著升高(P<0.05),表明HUA 小鼠模型建立成功。与模型组比较,各给药组小鼠SUA含量均显著降低(P<0.05),表明WCS和ECS均具有抗HUA活性。与正常对照组比较,别嘌醇组小鼠BUN、SCR 含量均显著升高(P<0.05),其余各给药组小鼠BUN、SCR含量差异均无统计学意义(P>0.05),表明别嘌醇可能会损伤肾功能,WCS和ECS对小鼠肾功能无明显影响。
表4 WCS 和ECS 对HUA 模型小鼠SUA、BUN、SCR含量的影响(,n=10)

表4 WCS 和ECS 对HUA 模型小鼠SUA、BUN、SCR含量的影响(,n=10)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05
3.4 WCS 和ECS 对HUA 模型小鼠血清和肝组织中XOD活性的影响
如表5所示,与正常对照组比较,模型组小鼠血清和肝组织中XOD活性均显著升高(P<0.05)。与模型组比较,各给药组小鼠血清、肝组织中XOD活性均显著降低(P<0.05),表明WCS和ECS能抑制HUA模型小鼠血清和肝组织中XOD活性。
表5 WCS 和ECS 对HUA 模型小鼠血清和肝组织中XOD活性的影响(,n=10)
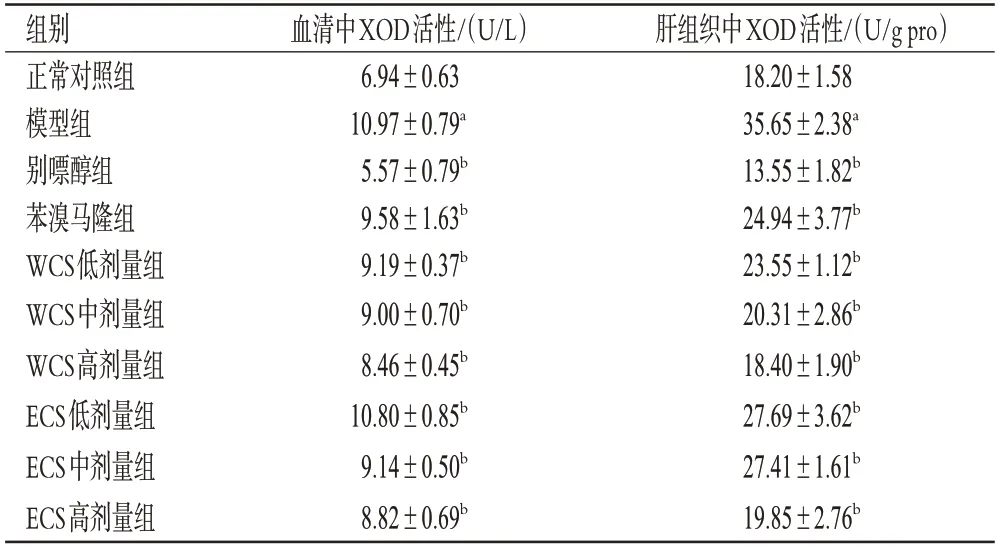
表5 WCS 和ECS 对HUA 模型小鼠血清和肝组织中XOD活性的影响(,n=10)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05
3.5 WCS 和ECS 对HUA 模型小鼠肝组织中XOD mRNA和蛋白表达的影响
如图1和表6所示,与正常对照组比较,模型组小鼠肝组织中XOD mRNA和蛋白的相对表达量均显著升高(P<0.05)。与模型组比较,各给药组小鼠肝组织中XOD mRNA、蛋白的相对表达量均显著降低(P<0.05),表明WCS 和ECS 可能通过下调XOD 的表达来发挥抗HUA作用。
表6 WCS 和ECS 对HUA 模型小鼠肝组织中XOD mRNA和蛋白表达的影响(,n=3)
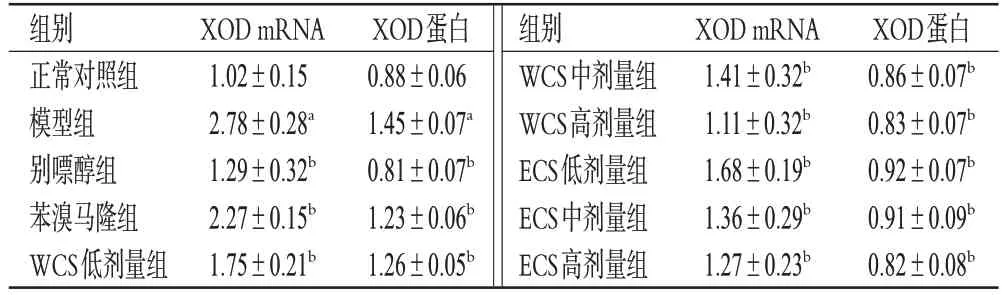
表6 WCS 和ECS 对HUA 模型小鼠肝组织中XOD mRNA和蛋白表达的影响(,n=3)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05

图1 各组小鼠肝组织中XOD蛋白表达的电泳图
3.6 WCS 和ECS 对HUA 模型小鼠肾组织中GLUT9、URAT1、OAT1蛋白表达的影响
如图2和表7所示,与正常对照组比较,模型组小鼠肾组织中GLUT9、URAT1 蛋白的相对表达量均显著升高(P<0.05),OAT1 蛋白的相对表达量显著降低(P<0.05)。与模型组比较,苯溴马隆组和ECS 高剂量组小鼠肾组织中GLUT9蛋白的相对表达量以及各给药组小鼠肾组织中URAT1蛋白的相对表达量均显著降低(P<0.05),苯溴马隆组和WCS低、高剂量组以及ECS低剂量组小鼠肾组织中OAT1 蛋白的相对表达量均显著升高(P<0.05),表明WCS和ECS抗HUA作用的机制可能与下调URAT1表达有关。
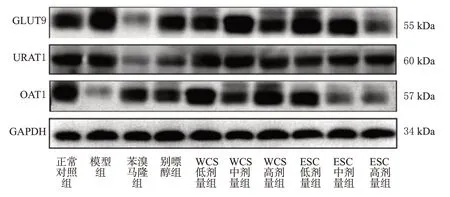
图2 各组小鼠肾组织中GLUT9、URAT1、OAT1 蛋白表达的电泳图
表7 WCS和ECS对HUA模型小鼠肾组织中GLUT9、URAT1、OAT1蛋白表达的影响(,n=3)
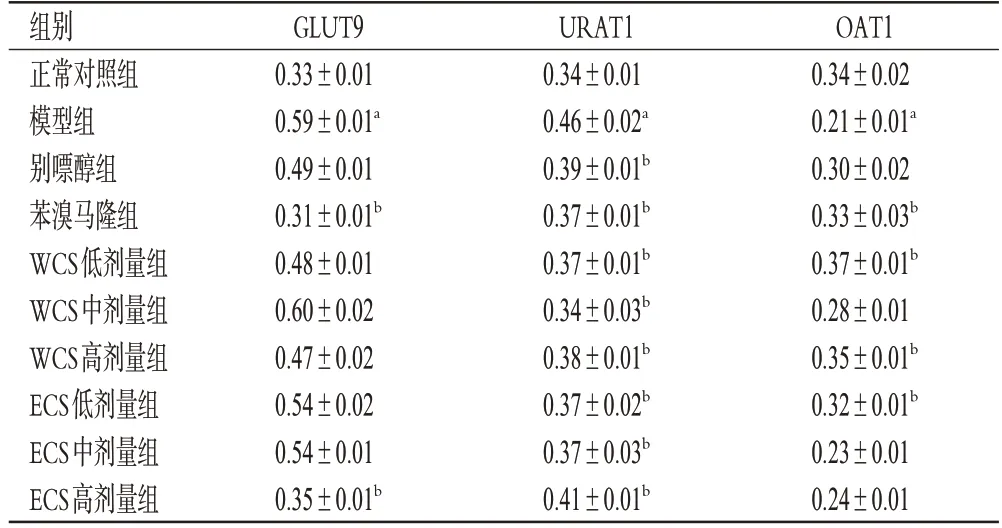
表7 WCS和ECS对HUA模型小鼠肾组织中GLUT9、URAT1、OAT1蛋白表达的影响(,n=3)
a:与正常对照组比较,P<0.05;b:与模型组比较,P<0.05
3.7 WCS 和ECS 对HUA 模型小鼠肾组织病理变化的影响
如图3所示,正常对照组小鼠肾小管边界清晰,上皮细胞排列整齐;模型组小鼠出现肾小管间质病变,以肾小管扩张和轻度肾水肿为特征;别嘌醇组小鼠出现重度肾水肿和肾小管严重扩张;苯溴马隆组小鼠出现肾小管轻度扩张和轻度肾水肿。与模型组小鼠比较,WCS 和ECS各剂量组小鼠的肾小管扩张均有所减轻,肾水肿程度均明显减轻,其中WCS 高剂量组和ECS 高剂量组小鼠已恢复到正常水平,表明WCS 和ECS 可在不同程度上改善HUA模型小鼠的肾损伤状态。

图3 WCS和ECS对HUA模型小鼠肾组织病理变化的影响(×200)
4 讨论
氧嗪酸钾是选择性竞争性尿酸酶抑制剂,次黄嘌呤是尿酸代谢产物的前体。已有研究报道,上述2种药物联合使用可使小鼠体内尿酸含量上升并减少尿酸的排泄量[9]。本研究通过腹腔注射氧嗪酸钾联合灌胃次黄嘌呤成功建立了HUA小鼠模型。
XOD是一种分布于脏器和血管的钼羟化酶,为还原酶的一种,能催化次黄嘌呤与黄嘌呤产生尿酸。当嘌呤代谢紊乱时,可使患者血清中XOD水平增加,进而导致体内尿酸增加。正常机体中,尿酸多从肾脏排泄;当尿酸水平过高或肾功能低下时,易导致尿酸积聚在各脏腑和关节中,引发HUA 或痛风性关节炎,因此抑制XOD活性或改善肾功能是治疗HUA 的主要途径[10]。本研究结果显示,与模型组比较,WCS和ECS各剂量组小鼠体内的SUA含量、XOD活性以及XOD mRNA和蛋白的相对表达量均明显降低,表明WCS 和ECS 通过抑制XOD的活性,下调其mRNA和蛋白的表达,从而降低HUA模型小鼠体内SUA含量。
肾脏指数、BUN 和SCR 是检测肾功能的灵敏指标[11]。本研究结果显示,与模型组比较,WCS 和ECS 可降低小鼠肾脏指数和血清中SUA含量,改善肾小管间质病变,减轻肾小管扩张和肾水肿程度,表明WCS和ECS对HUA模型小鼠肾功能损伤具有一定的改善作用。
据研究报道,尿酸转运蛋白是促尿酸排泄药物的主要作用靶点,临床上约90%的HUA 是由肾尿酸排泄不足而产生[12]。GLUT9与URAT1是尿酸盐在肾小管重吸收的主要转运体;OAT1是尿酸排泄的转运体,其作用是将尿酸从血液吸收到细胞内肾小管细胞[13-14]。抑制URAT1 和GLUT9 转运体的表达以及促进OAT1 转运体的表达是降低体内尿酸的有效方式[15-16]。本研究结果显示,与模型组比较,WCS和ECS对HUA模型小鼠肾组织中OAT1和GLUT9的表达影响不显著,但可明显下调URAT1 的表达,表明WCS 和ECS 可能是通过减少肾脏对尿酸的重吸收来调节HUA 模型小鼠体内的尿酸水平。
综上所述,WCS 和ECS 能够显著降低HUA 模型小鼠SUA 含量,改善其肾脏的病理状态,其作用机制可能与抑制XOD 活性和尿酸重吸收、下调XOD 蛋白和mRNA 表达有关。本研究仅为WCS 和ECS 对HUA 模型小鼠药效机制的初步验证,HUA的病理机制还与炎症因子、免疫等因素密切相关,本课题组会继续探究WCS和ECS 对HUA 干预的机制,为临床寻找新型降尿酸药提供有效的数据支撑。

