miR-199a靶向调控TAB2调节内皮祖细胞抑制深静脉血栓形成
牛帅 裴月颖 唐雷 丁殿柱
(河北省人民医院,河北 石家庄 050000)
下肢深静脉血栓(DVT)是指由于深静脉内血液发生非正常凝集而引起的静脉管腔阻塞,导致血液回流障碍而形成的一种血栓,多发于下肢〔1〕。DVT发病范围广,且发病原因复杂,慢性期DVT由于静脉瓣膜功能损伤易导致血栓形成后综合征(PTS),而急性期DVT易并发致死性肺栓塞(PTE),严重影响患者的生活质量甚至生命健康〔2,3〕。目前,溶栓治疗仍是临床上用于治疗DVT的主要方法〔4〕。内皮祖细胞(EPCs)是血管内皮的前体细胞,在病理因素刺激下,可从骨髓动员到外周参与损伤血管的修复,促进EPCs发挥功能有利于治疗DVT〔5〕。miRNAs是广泛存在于动植物体内的一种高度保守的内源性非编码单链RNA,可参与调控细胞增殖、分化、迁移等多个生理过程〔6〕。且有研究表明相关miRNA可参与DVT的血栓溶解再通过程〔7,8〕。本研究发现DVT大鼠EPCs中miR-199a表达量异常,提示miR-199a在DVT病理过程中可能发挥重要作用,因此对miR-199a在DVT内皮祖细胞中表达和功能及其可能作用机制进行探究。
1 材料方法
1.1主要试剂 6~8周龄雄性SD大鼠及血栓模型大鼠均购自北京维通利华有限公司;DMEM低糖培养基、胎牛血清及双抗购自Gibco公司;SYBR PrimeScriptTMRT-PCR试剂盒、RNAiso试剂盒、反转录试剂盒等购自Takara公司;荧光标记的乙酰化低密度脂蛋白(Dil-Ac-LDL)试剂购自北京博蕾德科技发展有限公司;苏木素-伊红(HE)染色试剂盒、大鼠脏器组织淋巴细胞分离液试剂盒购自Solarbio公司;Transwell小室购自Corning公司;基质胶购自上海浩然生物技术有限公司;红蛋白标记蛋白ACD133抗体(CD133-PE-A)、荧光素APC标记重组纯化蛋白A血管内皮生长因子受体2抗体(VEGFR-2-APC-A)、异硫氰酸荧光素标记的血管内皮生长因子受体2抗体(VEGFR-2-FITC)、接头蛋白(TAB2)抗体购自Abcam公司;RIPA裂解液、辣根过氧化物酶(HRP)标记荧光二抗、乙二胺四乙酸(EDTA)胰酶购自Sigma公司;荧光素酶报告基因检测试剂盒、4′,6-二脒基-2-苯基吲哚二盐酸盐(DAPI)工作液购自碧云天公司;si-NC质粒、si-TAB2质粒由上海生工生物工程有限公司合成;miR-199a模拟物(mimics)、miR-199a抑制剂(inhibitor)及miR-199a激动剂(agomir)均由吉玛基因设计合成。
1.2EPCs分离培养 参照Brice等〔9〕的分离培养方法及大鼠脏器组织淋巴细胞分离液试剂盒说明书进行EPCs的分离和培养,颈椎脱臼法处死SD大鼠后,分离双侧股骨和胫骨,用含有10%胎牛血清(FBS)的磷酸盐缓冲液(PBS)冲洗3次,剪除骨骺端以暴露骨髓腔,匀浆冲洗液冲洗骨髓腔,收集含骨髓细胞的冲洗液,过滤后离心弃上清,样本稀释液重悬细胞备用。取6 ml组织淋巴细胞分离液于15 ml离心管中,缓慢加入细胞悬液,2 000 r/min离心30 min,离心后细胞分为三层,吸取中层细胞接种于6孔板中置于37℃,5%CO2培养箱中培养,48 h后更换为含有20% FBS的DMEM低糖培养基继续培养。
1.3EPCs鉴定 取培养至第7天的EPCs细胞,弃去培养基,PBS清洗2次,胰酶消化后收集至15 ml离心管中,800 r/min离心10 min,弃上清,PBS冲洗3次后用100 μl重悬。将制得的细胞悬液转入流式细胞仪的上样管中,分别加入10 μl荧光标记的CD133-PE-A抗体和VEGFR-2-APC-A抗体,4℃避光孵育90 min加入500 μl PBS,1 500 r/min离心10 min,弃上清,300 μl标准结晶牛血清白蛋白(BSA)重悬细胞,置于流式细胞仪检测表面抗原CD133和VEGFR-2的表达。
免疫荧光鉴定:将EPCs细胞培养于24孔板中(孔内提前放入爬片),待细胞长满单层的80%后进行试验。弃去培养基,PBS洗涤3次,每次间隔5 min。每孔加入400 μl 4%多聚甲醛,室温固定15 min。弃掉多聚甲醛,立即加入1 ml预冷的甲醇,室温透化10 min。PBS洗涤3次,加入300 μl 5%BSA溶液,4℃过夜封闭。弃掉封闭液,加入300 μl按1∶300稀释的VEGFR-2-FITC抗体,避光温育1 h。弃掉抗体,每孔加入400 μl按1∶10稀释的DAPI染料,避光作用15 min。弃掉DAPI,PBS洗涤3次,将爬片转移至载玻片上,置于倒置荧光显微镜下观察。
1.4qRT-PCR 参照RNAiso试剂盒说明书提取细胞总RNA,反转录为cDNA后以其作为模板并按照qRT-PCR试剂盒说明书进行PCR扩增反应,同时选择U6作为内参,每个样本均进行3次独立重复检测,取平均值利用2-ΔΔCt法进行统计分析。miR-199a所用引物序列〔10〕为:正义链:5′-TCCAGCTGGGCCCAGTGTTCAGACTAC-3′;反义链:5′-TCCAGCTGGGCCCAGTGTTCAGACTAC-3′。U6引物序列为:正义链:5′-GTGCTCGCTTCGGCAGCACAT-3′;反义链:5′-TACCTYGCGAAGTGCTAAAC-3′。
1.5电穿孔转染法 收集生长至对数期细胞,PBS清洗2次,胰酶消化细胞,完全培养基终止消化后收集至15 ml离心管中,1 000 r/min离心5 min,弃上清液,用转染试剂减血清培养基(Opti-MEM)重悬细胞,制成细胞悬液并计数,调整细胞密度为4×108/L,随机分为4组,分别为转染miR-199a mimics组和转染miR-199a inhibitor组及NC-mimics组和NC-inhibitor组。
miR-199a mimics组和NC-mimics组转染:取50 μl细胞悬液,分别与10 μl miR-199a mimics和10 μl NC-mimics充分混匀,按照脉冲20 ms,电阻90 Ω,电压150 V的条件电击细胞。培养48 h后,通过qRT-PCR检测转染效率。
miR-199a inhibitor组和NC-inhibitor组转染:方法同上,将miR-199a mimics和NC-mimics替换为miR-199a inhibitor和NC-inhibitor。
1.6Transwell试验测定迁移能力 将Transwell小室置于24孔板上,37℃温育。向下室中加入600 μl完全培养基,上室中分别加入100 μl无血清培养基悬浮的各组细胞,细胞密度以2×105/ml为宜。培养24 h后,取出小室,弃掉上室液体,甲醇固定30 min后吉姆萨(Giemsa)室温染色15~30 min,PBS洗涤3次,显微镜下观察拍照,测定细胞迁移能力。
1.7基质胶成管试验 试验前24 h将基质胶置于4℃冰箱过夜,使基质胶缓慢融化。转染的各组EPCs细胞用不含血清的培养基饥饿培养24 h后制备密度为2×105/ml的细胞悬液,取50 μl细胞悬液加入铺有基质胶的24孔板中,培养8 h后置于显微镜下采集图像,观察血管形成情况。
1.8Western印迹 收集各组EPCs细胞,加入现配的裂解液,冰浴30 min。超声破碎,4℃ 12 000 r/min离心10 min,收集上清测定蛋白浓度。进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE),65 V恒压电泳30 min后更换为120 V至电泳结束,恒流250 mA转印2 h,将蛋白转移至聚偏氟乙烯(PVDF)膜,封闭2 h。加入1∶1 000稀释的TAB2抗体,室温孵育4~6 h,TBST洗膜3次,每次10 min。加入1∶3 000稀释的HRP标记荧光二抗孵育2 h,TBST洗膜3次,每次10 min。在Bio-Rad膜成像系统下显色并分析结果。
1.9荧光素酶报告试验 按照试剂盒说明书分别扩增TAB2-WT和TAB2-MUT目的基因片段,电泳鉴定后切胶回收,根据试剂盒说明书中的酶切体系,对目的基因和连接载体进行酶切,酶切后对产物进行切胶回收。然后根据连接体系进行连接,构建含有荧光素酶报告基因标记的TAB2-WT 3′非编码区(UTR)及TAB2-MUT 3′UTR重组质粒,参照1.5中的转染方法将重组质粒分别转染细胞。
将转染TAB2-WT 3′UTR重组质粒组细胞随机分为4组,分别再转染miR-199a mimics、NC-mimics、miR-199a inhibitor及NC-inhibitor质粒,再进行后续试验。弃掉细胞培养液后直接加入充分混匀的报告基因细胞裂解液以充分裂解细胞,33 334 r/min离心5 min,取上清用于测定。按照说明书配制荧光素酶检测工作液,取100 μl裂解后细胞样品,加入100 μl荧光素酶检测试剂,吹打混匀后置于荧光测定仪下测定各组RLU。转染TAB2-MUT 3′UTR重组质粒组试验方法同上。
1.10EPCs移植 选取30只大鼠建立DVT模型,饲养至15 d后分为3组:Blank组、EPCs/vector组和EPCs/miR-199a agomir组,每组10只,移植所用的EPCs事先用VEGFR2-FITC荧光抗体对其表面VEGFR2受体进行标记。移植后14 d,将大鼠麻醉后开腹,分离其下腔静脉,在血栓上下静脉段夹闭血管,剖开管腔,取出血栓后置于烘箱中烘干后称量血栓重量并做好记录。
1.11HE染色 根据标准操作规程进行HE染色。将取下的血栓投入10%甲醛中进行固定,固定后置于包埋盒中流水冲洗30 min,置于酒精中脱水处理后再置于二甲苯中透明,之后浸蜡包埋再进行切片。将烤干的切片置于二甲苯中脱蜡10 min。依次置于100%、95%、85%、70%酒精中各2 min,移入水中3 min以洗去酒精,再移入蒸馏水中2 min。苏木素染液染色10~15 min,洗去多余染液,置于1%盐酸酒精中分化10 s,流水冲洗30 min。伊红染液浸染5 min,洗去多余染液。而后依次置于70%、85%、95%、100%酒精中脱水各2 min。移入二甲苯中透明2次,时间共约10 min。擦去多余二甲苯,迅速滴加中性树胶封片,平置晾干后进行观察。
1.12统计学方法 采用SPSS24.0软件进行单因素方差分析。
2 结 果
2.1EPCs的鉴定 培养3 d后,倒置显微镜下观察EPCs形态,发现EPCs集落呈圆形,并形成中心簇(图1A),流式细胞仪检测显示第14天EPCs表达干细胞表面抗原VEGFR-2和CD133(图1B),免疫荧光方法检测细胞表面标记VEGFR-2,结果显示,绝大多数细胞表达内皮表面标志物VEGFR-2,且VEGFR-2主要表达在细胞质中(图1C)。
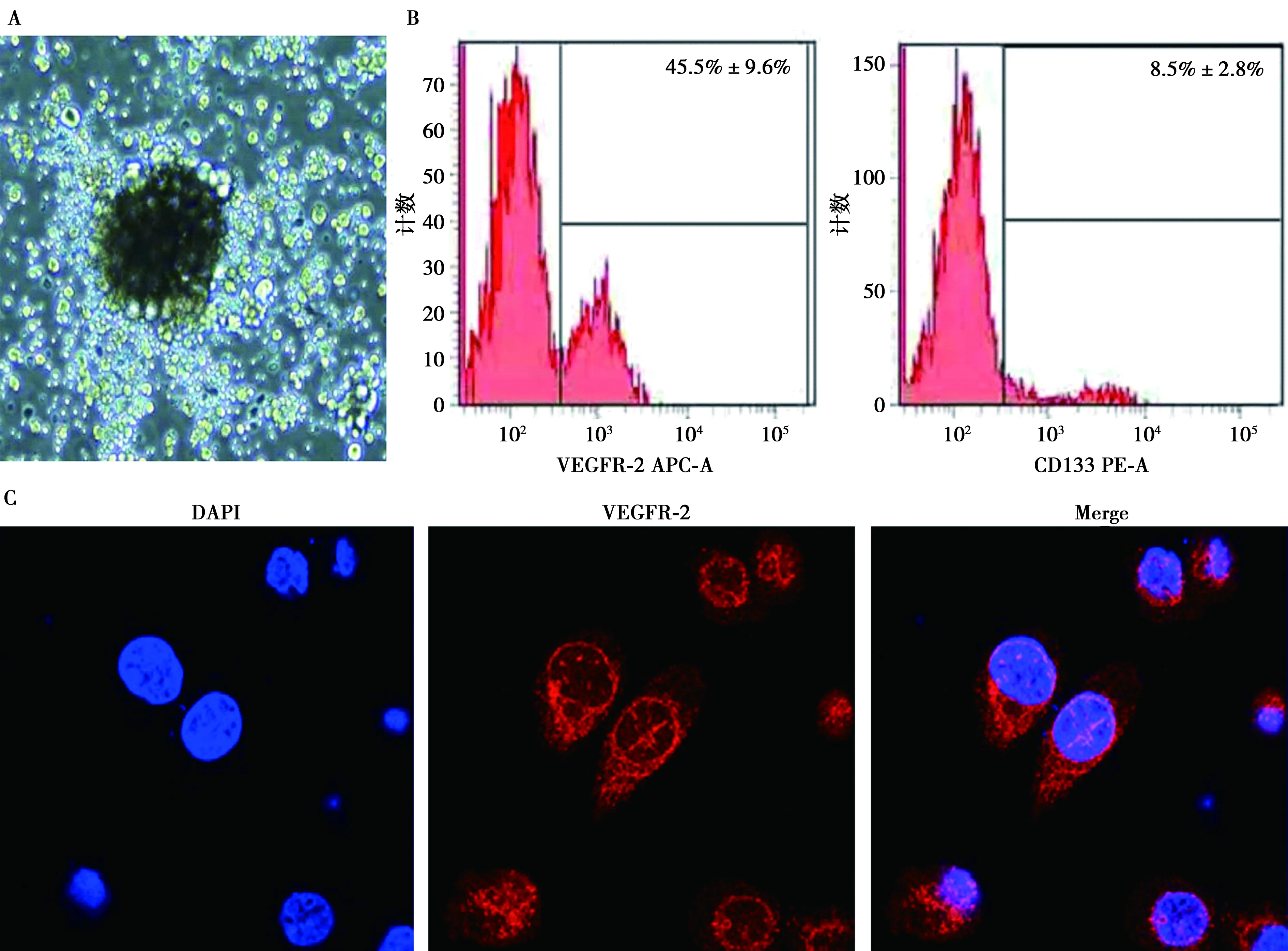
A.倒置显微镜下观察EPCs形态(免疫荧光,×400);B.流式细胞仪检测第14天EPCs干细胞表面抗原VEGFR-2和CD133的表达;C.免疫荧光方法检测EPCs表面标记VEGFR-2(×400)图1 EPCs的鉴定
2.2miR-199a在DVT大鼠EPCs中表达 qRT-PCR检测DVT大鼠和正常组SD大鼠分离的EPCs细胞中miR-199a表达(0.24±0.02 vs 0.98±0.05),结果发现,miR-199a在DVT大鼠中表达显著下调(t=33.660,P<0.05,n=6)。
2.3miR-199a促进EPCs细胞迁移和血管形成 miR-199a mimics组miR-199a表达显著高于NC-mimics组,miR-199a inhibitor组miR-199a表达显著低于NC-inhibitor组(P<0.05)。miR-199a mimics组迁移能力和血管形成能力显著高于NC-mimics组,miR-199a inhibitor组迁移能力和血管形成能力显著低于NC-inhibitor组(P<0.05)。见表1、图2、图3。
表1 miR-199a 促进 EPCs 细胞迁移、血管形成及TAB2蛋白表达比较
图2 Transwell实验检测各组EPCs迁移能力(结晶紫染色,×200)

图3 基质胶成管实验检测血管形成能力(×400)
2.4TAB2是miR-199a的靶基因 生信网站targetscan预测TAB2 3′UTR存在与miR-199a结合的位点(图4),荧光素酶报告实验显示,miR-199a可以与TAB2 3′UTR WT结合,显著抑制荧光素酶活性(P<0.05);miR-199a mimics组TAB2蛋白表达明显低于NC-mimics组,miR-199a inhibitor组TAB2蛋白表达明显高于NC-inhibitor组(P<0.05)。见表1、图5。

图4 TAB2 3′UTR存在与miR-199a结合的位点

1~4:NC-mimics组、miR-199a mimics组、NC-inhibitor组、miR-199a inhibitor组图5 敲减或过表达miR-199a后TAB2蛋白表达
2.5miR-199a通过调控TAB2促进EPCs细胞迁移和血管形成 miR-199a in+si-TAB2组TAB2表达显著低于miR-199a in+si-NC组(P<0.05),迁移和血管形成能力比较,miR-199a in+si-TAB2组均显著高于miR-199a in+si-NC组(P<0.05)。见图6、表2、图7、图8。
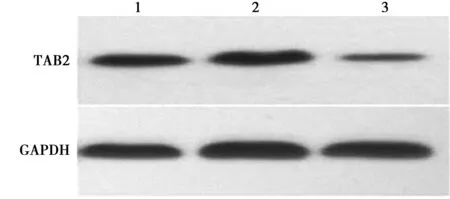
1~3:NC组、miR-199a in+si-NC组、miR-199a in+si-TAB2组图6 TAB2蛋白表达
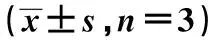
表2 miR-199a 通过调控 TAB2 促进 EPCs 细胞迁移和血管形成

图7 Transwell实验检测各组EPCs迁移能力(结晶紫染色,×400)
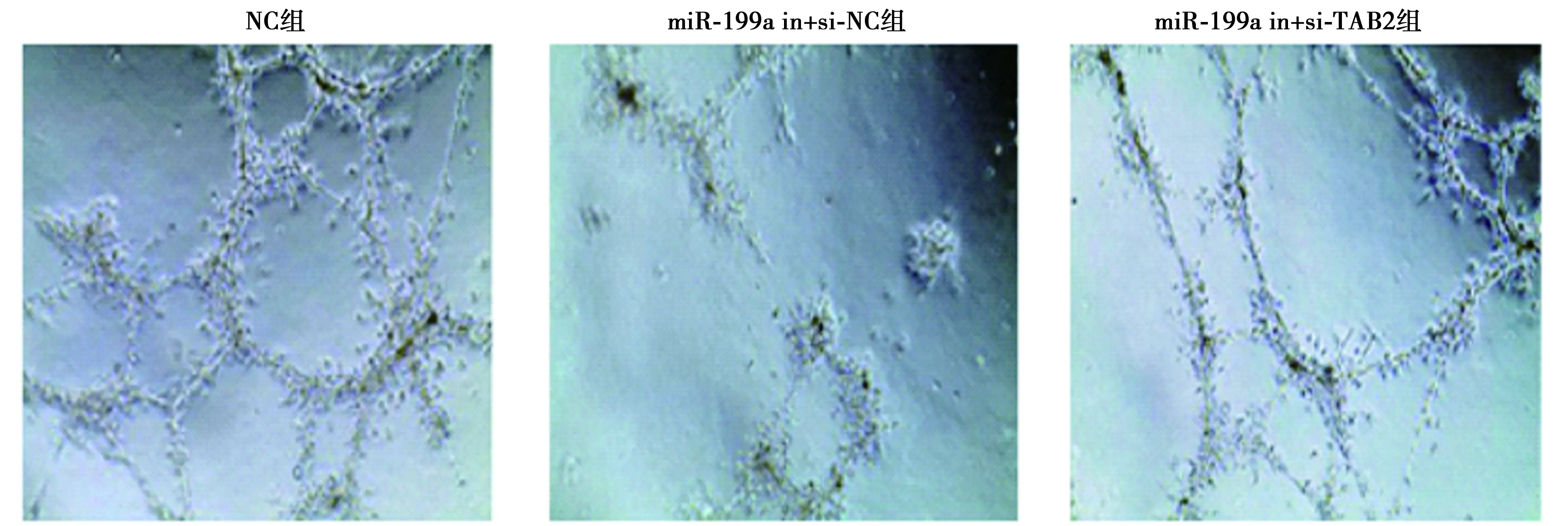
图8 基质胶成管实验检测血管形成能力(×400)
2.6miR-199a调节内皮祖细胞抑制深静脉血栓形成 EPCs移植后第7天,EPCs示踪结果显示,EPCs/miR-199a agomir组大鼠的EPC归巢明显高于EPCs/vector组(P<0.05)。HE染色结果可见,与Blank组比较,EPCs/miR-199a agomir组和EPCs/vector组进入血栓的有核细胞明显增多,血栓外周区见少量红细胞,逐渐形成官腔样结构,机化程度较高,而与EPCs/vector组比较,EPCs/miR-199a agomir机化程度更高。与Blank组比较,EPCs/miR-199a agomir组和EPCs/vector组重量显著减轻,而miR-199a agomir组重量显著小于EPCs/vector组(P<0.05)。见图9、图10、表3。
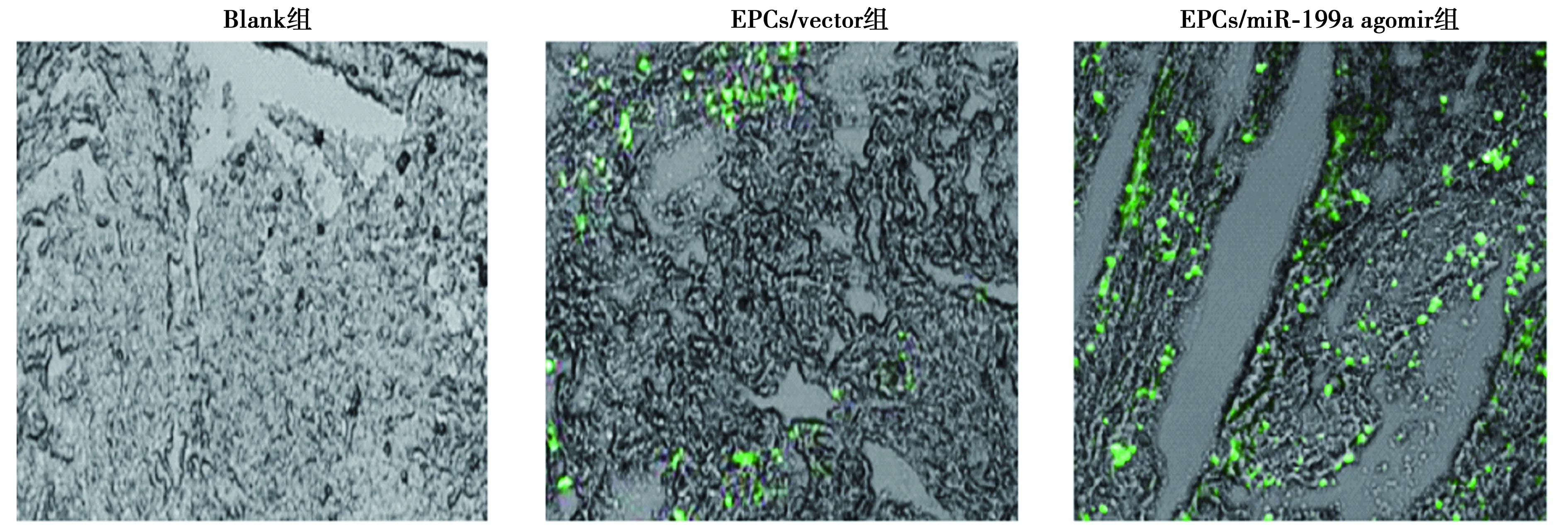
图9 EPCs示踪,荧光显微镜观察各组荧光强度(×400)
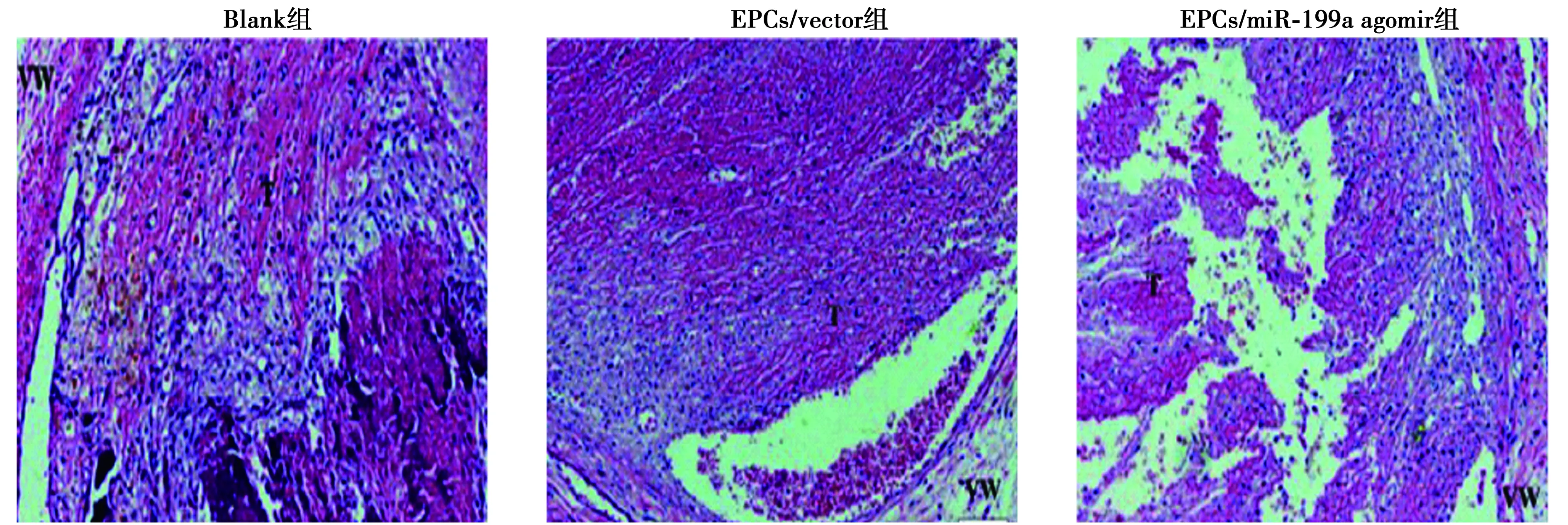
图10 HE染色观察各组血栓机化(×400)

表3 miR-199a 调节内皮组细胞抑制DVT形成
3 讨 论
DVT是临床上常见的外周血管疾病,其发病率虽然不高,但由于经常继发PTS而存在潜在死亡风险,据统计,30%~40% DVT患者在治疗后1~2年内发生PTS,治疗后5年内PTS的发生率则超过50%〔11,12〕。目前,临床上用于治疗DVT采用的方法主要为药物抗凝或溶栓治疗,但对于慢性期DVT治疗效果不理想,因此,寻找一种更为有效的治疗慢性期DVT的方法是当前研究的重点。血栓机化再通的关键在于使血栓内的血管新生,EPCs是一群具有游走性,能进一步增殖分化的幼稚内皮细胞,主要参与血管发生及血管损伤后修复等过程,研究发现外周血中的内皮祖细胞可归巢到DVT促进血栓内血管新生、血栓溶解和再通〔13,14〕,应用内皮祖细胞治疗DVT不失为一种具有广阔应用前景的新方法。但外周血中EPCs含量很少,在VEGF等外源性细胞因子或血管损伤等内源性因素刺激下骨髓中EPCs动员至外周血循环中,而如何促进外周血中EPCs迁移及增强其归巢至DVT中的能力是治疗DVT的关键。miRNA是一类普遍存在于细胞中的长度为18~25 nt的非编码小分子RNA,在基因转录后水平上与靶mRNA结合,降解或抑制mRNA的翻译,发挥对多种蛋白的表达调控作用〔15〕。miR-199a家族广泛存在于人体组织中,研究表明miR-199a在多种肿瘤组织中异常表达,除参与肿瘤细胞的生长增殖、凋亡、分化与转移等生物学过程之外,还可调控肿瘤细胞的血管生成过程〔16,17〕。本研究发现,miR-199a在DVT大鼠EPCs中表达异常,采用过表达和抑制EPCs中miR-199a表达的研究策略发现miR-199a可促进内皮祖细胞的迁移、血管形成及归巢至DVT中,有利于内皮祖细胞发挥功能抑制DVT。
经典Wnt信号通路可通过调节β-catenin-LEF1/TCFs转录复合物的形成而影响下游基因的表达变化,可参与细胞的增殖、分化及凋亡等进而调控许多疾病过程〔18〕。莫建文等〔19〕研究发现Wnt信号通路可参与调节血管内皮祖细胞功能,对Wnt信号传导途径进行干预,可能减轻血栓的严重程度甚至终止血栓的形成。Li等〔20〕研究发现经典Wnt信号通路受到多种分子和信号途径的调节,其中TAK1-NLK非经典MAPK激酶途径就是通过抑制β-catenin-LEF1/TCFs转录复合物来影响Wnt信号通路在细胞分化及发育等过程中的功能。然而,尽管TAK1能激活NLK分子的激酶活性,但二者之间并没有直接的相互作用,表明二者之间的信号传递需要依赖其他分子的协助。该研究还发现TAK1的一个结合蛋白TAB2可直接并特异性的结合NLK,TAB2可作为一种“脚手架蛋白”连接TAK1和NLK形成复合物,从而引起二者之间的间接相互作用。TAB2通过这种方式促进TAK1对NLK的激活,导致NLK底物LEF1/TCFs分子的磷酸化而抑制其转录活性,进而对Wnt信号通路发挥抑制作用。本研究通过生信网站targetscan预测发现TAB2蛋白的3′UTR存在与miR-199a的结合位点。在转染miR-199a抑制剂的EPCs中利用小干扰RNA技术敲减TAB2表达后,EPCs迁移和血管形成能力显著增高,且过表达miR-199a后可有效促进DVT的机化再通,进一步证实了miR-199a通过靶向TAB2调节EPCs发挥生物学功能。

