基于代谢组学技术筛选与血压升高相关的差异性代谢物
李淑敏蒋海强齐冬梅*杨雯晴*
(1.山东中医药大学,中医学院, 济南 250355;2.山东中医药大学,中医药创新研究院,济南 250355;3.山东中医药大学,实验中心, 济南 250355;4.山东省中医药基础研究重点实验室,济南 250355;5.教育部中医药经典理论重点实验室,济南 250355)
高血压是全球性危害较大的心血管疾病,也是引起心脏、肾等器官损害等的主要因素,具有较高的发病率和致死率[1],而在发展中国家对血压的控制并不理想[2]。 近年来SHR 血清的代谢组学研究发现在高血压病理状态下存在多种代谢紊乱,如脂质代谢(甘油磷脂、鞘磷脂和花生四烯酸)、氨基酸(色氨酸、酪氨酸)、三羧酸循环、尿素代谢、5-羟色胺突触传导通路等[3-5]。
针对代谢紊乱的研究,代谢组学是近二十年来发展的系统生物学方法,旨在识别生物系统内源性代谢物在内在和外在因素影响下的变化,通过非靶向、半靶向及靶向方式揭示人体在生理病理状态下的整体的、动态的代谢变化,是医学药学研究的重要研究手段[6-7]。 为进一步筛选在血压升高过程中与血压变化相关联的代谢物,本研究采用非靶向代谢组学技术,将筛选出处于血压升高阶段的不同周龄SHR 大鼠与正常组大鼠的差异代谢物与血压值进行相关性分析,从而阐明高血压发病过程中的代谢模式和代谢标志物变化,以期为高血压的防治提供指导。
1 材料和方法
1.1 实验动物
24 只4 周龄SPF 级雄性Wistar 京都种大鼠(Wistar-Kyoto rats,WKY)分为3 个正常组(C1、C2、C3)和24 只4 周龄SPF 级雄性SHR 分为3 个模型组(M1、M2、M3)每组均为8 只,WKY 大鼠体重约45~60 g,SHR 体重约40~55 g,购自北京维通利华实验动物科技有限公司[SCXK(京)2021-0006],所有大鼠喂以标准饲料,饲养在山东中医药大学实验中心[SYXK(鲁)2017 0022]SPF 设施中,温度为(23±1)℃,相对湿度环境为55%±5%,标准的12 h/12 h(光/暗)循环,每笼4 只,并按实验动物使用的3R 原则给予人道的关怀。 实验方案及过程经山东中医药大学实验动物中心动物伦理委员会批准(SDUTCM20201019003)。
1.2 主要试剂与仪器
乙腈、 甲醇、 甲酸(批号:190268、172071、186935,色谱级,美国Fisher 公司);超纯水(屈臣氏,屈臣氏(中国有限公司));2-氯-L-苯丙氨酸(批号:C10007806,MACKLIN,上海麦克林生化科技有限公司)。
智能无创血压计(BP-2010A,Softron,北京,中国);高速台式离心机,美国Thermo Fisher Scientific公司;Vortex-Genie2 型涡旋震荡器,美国SI 公司;静电场轨道阱质谱仪(QE)和Ultimate 3000 UPLC 系统(Thermo Fisher,CA,USA);Halo-C18 色谱柱(2.1×100 mm,2.7 μm;AMT,美国)。
1.3 实验方法
1.3.1 血压测量
采用无创套尾法检测大鼠安静状态下的血压,打开电源,选取安静、无人、温暖的环境,将温度调至38℃,敏感度设置为2,预热5 min,控制测定时笼内温度保持不变,将大鼠前半身用鼠网网住并置入保温筒中,配合鼠袋包裹住,暴露尾巴在鼠袋外,将尾部穿过加压感应装置,加压感应器标志的尖端与鼠尾尖端方向保持一致,将加压感应器置于大鼠尾根处,待大鼠稳定5~10 min 后,点击血压测定,图像波动平稳时记录数据,每周同一时间测量血压3 次取平均值。
1.3.2 血清非靶向代谢组学分析
(1)样本准备
5 周龄时取C1、M1 组,7 周龄时取C2、M2 组,9周龄时取C3、M3 组,按照30 mg/kg 剂量的腹腔注射1.5%戊巴比妥钠麻醉后采集腹主动脉血。 将血样置于Eppendorf 管中,室温凝固30 min,离心(4500 r/min,4℃)15 min,得到血清样品。 将血清样品储存在-80℃直至下次检测。
血清样品在冰上4℃解冻,加入400 μL 预冷甲醇,涡旋1 min,以2-氯-L-苯丙氨酸(60 μg/mL)作为内标,取100 μL 血清样品。 将混合物在4℃下以15 000 r/min 的速度离心15 min。 将上清液(400 μL)置于2 mL Eppendorf 管中,用氮气吹干,然后加入100 μL 初始流动相重新溶解。 随后,将上清液转移到LC-MS 小瓶中。 为确保代谢分析的数据质量,通过混合来自每个样品的5 μL 上清液制备混合质量控制样品(quality control,QC)。
(2)血清非靶向代谢组学分析
使用UltiMate3000 超高效液相色谱仪和四极杆/静电场轨道阱高分辨质谱联合分析。 应用Halo-C18 色谱柱进行分析,柱温:45℃,进样量:10 μL。流动相由溶剂A(0.05%甲酸水溶液)和溶剂B(0.05%甲酸乙腈溶液)组成。 线性梯度程序如下:0 min,2% B;3 min,40% B;9 min,98% B;18 min,98% B;18.1 min,2% B;3.0 min 的平衡。 流速为0.3 mL/min。 运行样品前,运行6 个QC 样品以平衡仪器,然后每运行6 个样品后运行1 个QC 样品。质谱条件:毛细管温度350℃;正离子模式和负离子模式毛细管电压:3.5 kV 和3.5 kV;鞘气45 arb;辅助气10 arb;质量扫描范围:80~1200 Da;质量分辨率:70000;S-Lens RF Level 为55。
(3)血清非靶向代谢组学数据处理
LC-MS 色谱数据的整体分析通过使用CD3.1(Compound Discoverer,Thermo Fisher,CA,USA)软件对数据进行预处理,包括峰值检测、峰值对齐和数据清洗,从CD 中筛选出各周龄中P<0.05 的差异性代谢物,通过SIMCA-P(13.0 版;Umetrics,Umea,瑞典)对不同周龄的正常组和模型组分别采用无监督的主成分分析(principal component analysis,PCA)及有监督的偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)以寻找正常组与模型组之间及不同周龄的模型组间的差异,对数据进行100 次随机排列实验,根据R2 和Q2 检验数学模型建立的准确性。 筛选投影变量重要性(Projected Variable Importance,VIP)>1 的变量为潜在生物标记物。 通过 MS/MS、 HMDB 数据库(http:/ /www. hmdb. ca/) 和KEGG(https:/ /www.kegg.jp/)分析鉴定内源性代谢物的鉴定和确认的代谢物。
使用MetaboAnalyst 5.0 软件[8](http:/ /www.metaboanalyst.ca)进行通路分析。 Coefficients 是代谢表征与小分子代谢物相关联程度,将血压值设置为Y 变量与非靶向代谢数据相关联, 通过Coefficients 值筛选差异代谢物与血压变化的相关性。 原始数据经过CD 软件数据处理后可得到具体的生物标志物,包含mass 值、保留时间、相对峰面积在内的数据矩阵,将同周龄的正常组模型组分析后与不同周龄相比较,观察不同周龄相对峰面积的变化趋势。
1.4 统计学方法
2 结果
2.1 不同周龄下大鼠血压的变化
由表1 发现与正常组相比,模型组各周龄的收缩压与舒张压在五周龄时具有显著差异性,且随着周龄的增大模型组血压显著升高尤以收缩压变化最为明显,而正常组各周龄之间的收缩压变化无明显差异性。
表1 不同周龄的正常组与模型组收缩压和舒张压的变化(±s)Table 1 Changes of systolic and diastolic blood pressure in the normal group and the model group of different ages

表1 不同周龄的正常组与模型组收缩压和舒张压的变化(±s)Table 1 Changes of systolic and diastolic blood pressure in the normal group and the model group of different ages
注:与正常组相比,*P<0.05,**P<0.01。Note. Compared with the normal group, *P<0.05, **P<0.01.
周龄Weeks正常组WKY收缩压SBP (mmHg)舒张压DBP (mmHg)收缩压SBP (mmHg)舒张压DBP (mmHg)模型组SHR 4 139±680±3135±676±5 154±2*88±8*140±385±6 7 160±3*95±6*154±286±3 9 174±4*107±7**156±684±5 5
2.2 血清代谢组学结果
2.2.1 代谢组学图谱
在各周龄正、负离子模式下正常组与模型组的总离子流图有一定的差异,以5 周龄正常组与模型组大鼠为例说明两组之间存在不同的代谢物(图1)。

图1 正常组和模型组在正负离子模式下的总离子流图Note, A, Normal group in positive ion mode. B, Normal group in negative ion mode. C, Model group in positive ion mode. D, Model group in negative ion mode.Figure 1 Total ion current diagram of normal group and model group in positive and negative ion mode
2.2.2 潜在代谢物及代谢趋势
将质谱获得的原始数据导入CD 软件进行分析,以P<0.05 为条件分别筛选出各周龄的差异性代谢物。 在将以上数据导入SIMCA-P 软件中进行下一步分析,采用有监督的PLS-DA 进行模式识别发现在正负离子下两组大鼠分离较好,各周龄的模型的拟合能力和预测能力指数分别为:5 周龄正离子:R2Y=0.998,Q2=0.985;负离子:R2Y=0.994,Q2=0.956,7 周龄正离子:R2Y=0.994,Q2=0.989;负离子:R2Y=0.996,Q2=0.977,9 周龄正离子:R2Y=0.993,Q2=0.948;负离子:R2Y=0.989,Q2=0.901表明模型预测能力较好,且不同周龄下100 次随机排列实验验证模型成功,在此模型下进一步通过VIP>1 筛选重要的差异性代谢物,通过比对HMDB及KEGG 数据库找出在5、7、9 周大鼠正负离子模式下共有的10 个差异性代谢物(图2),分别是:胆碱、花生四烯酸(arachidonic acid,AA)、二十二碳六烯酸( docosahexaenoicacid, DHA )、 血 栓 烷 B2(thromboxanes B2,TXB2)、尿酸、16-羟基十六烷酸、十二烷二酸、12(13)-DiHOME、胆酸、牛磺鹅去氧胆酸,详细信息见表2。

表2 不同周龄大鼠共有的10 中差异性代谢物Table 2 10 different metabolites shared by rats of different ages
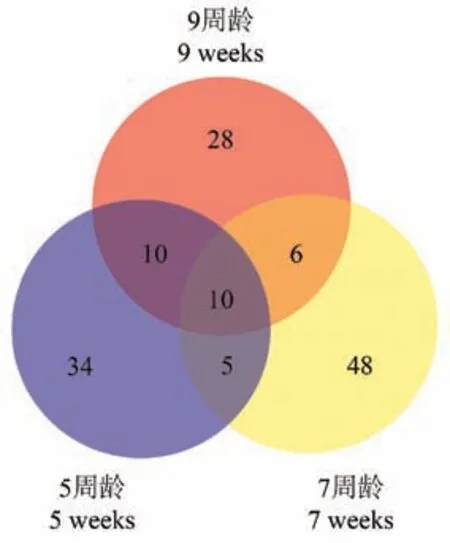
图2 5、7 及9 周下差异性代谢物韦恩图Figure 2 Venn diagram of differential metabolites at 5, 7 and 9 weeks
对代谢物进行动态分析(见图3),结果显示在5周龄时10 种代谢物在正常组与模型组大鼠均无明显变化,7 周龄时胆碱、AA、DHA、尿酸、16-羟基十六烷酸、十二烷二酸、12(13)-DiHOME、牛磺鹅去氧胆酸相对含量与正常组相比升高(P<0.01),TXB2在7 周龄时相对含量较5 周龄下降(P>0.05);在9 周龄时十二烷二酸、尿酸、胆酸与7 周龄及正常组相比相对含量相比降低(P<0.01)。 在上述10 种代谢物中胆酸、16-羟基十六烷酸、12(13)-DiHOME、牛磺鹅去氧胆酸在5、7、9 周中相对含量持续上升(P<0.01)与正常组无明显差异。

图3 不同周龄大鼠体内生物标志物相对含量比较(±s)Note. Compared with the normal group, **P<0.01.Figure 3 Comparison of the relative content of biomarkers in rats of different ages
2.3 代谢通路分析及相关性分析
代谢通路代表一组代谢物通过生物化学方式联系在一起的生物途径,从代谢物异常到代谢通路的变化可以深入了解在生理及病理条件下的机制,通常用来表示从非靶向代谢组学中获得的表示病理状态下受到干扰的常见通路,为下一步疾病中的生物学联系的验证提供依据[6]。 通过MetaboAnalyst 将上述代谢物输入,筛选影响值大于0.1 的代谢通路(图4),发现花生四烯酸通路与血压的升高密切相关。 进一步进行与血压相关性分析如图5,5 周时尿酸与血压成负相关,DHA、TXB2、十二烷二酸、胆酸、AA 与血压呈正相关,由于5 周时10 种差异性代谢物两组相比均无差异性;7 周时TXB2与血压正相关,DHA、尿酸、十二烷二酸、胆酸、AA 为负相关;9 周时十二烷二酸、DHA、胆酸与血压呈正相关,TXB2、尿酸、AA 与血压呈负相关。

图4 10 种差异代谢物的通路分析Figure 4 Pathway analysis of 10 different metabolites

图5 与血压的相关分析Note. A, 5 weeks old. B, 7 weeks old. C, 9 weeks old.Figure 5 Correlation analysis with blood pressure
3 讨论
SHR 高血压模型与人类高血压病高度类似,是目前研究高血压病发病机制的理想动物模型[9]。SHR 模型血压值在大鼠出生后随着鼠龄增大而升高,大量研究表明2~4 月为高血压的确立期[10],在4 周时SHR 和WKY 血压无明显差异,在6 周时高血压的病理状态仍不稳定,在9~11 周时血压值逐渐达到稳定状态[11-12],根据我们的实验数据分析发现在第9 周时血压已经是较稳定的高血压状态。 综合以上我们选取了高血压确立期内的5、7、9 周为研究对象,在高血压前期阶段分析血压升高过程中的代谢紊乱,有利于准确发现与血压升高相关的生物标志物。 高血压的发生发展与早期的代谢紊乱密切相关,代谢紊乱进一步引起代谢综合症的发生,最终导致高血压、高尿酸血症、动脉粥样硬化等疾病及心脏、肾脏等靶器官损伤的发生,因此我们选用早期SHR 大鼠,探究高血压早期的代谢紊乱,以期在早期恢复正常代谢,从而达到降低血压延缓靶器官损害的目的[13-14]。 本研究运用代谢组学对不同周龄大鼠体内小分子代谢物持续观察,筛选出在血压升高过程中共有的10 种代谢物,进一步与血压进行相关性分析,结果表明花生四烯酸代谢通路与血压的升高密切相关,同时发现脂质类代谢物密切影响血压的变化,如AA、TXB2、DHA。
在正常组和模型组大鼠中有差异性变化的代谢物中包括多种脂类化合物,如TXB2、DHA、AA 等,脂质代谢物的异常与血管炎症、动脉粥样硬化等心血管疾病的发生发展密切相关[15]。 DHA 是一种长链、高度不饱和的omega-3(n-3)脂肪酸,存储在脂肪组织中以转化为甘油三酯释放到血液中[16],omega-3 脂肪酸通过激活内皮型一氧化氮合酶,增加一氧化氮的可用性改善内皮功能,此过程只发生在心血管疾病人群中[17],在本研究中发现5 周时无显著性差异,在7、9 周时模型组的DHA 相对峰面积高于正常组,尽管在9 周低于7 周,通过相关性分析发现,7 周时DHA 与血压呈负相关,9 周时虽然呈正相关,但7 周时候相关系数绝对值远大于9 周时相关系数的绝对值,说明DHA 的升高不能引起血压的升高,符合上述结论,并由此推测DHA 在血压升高中仍发挥抑制作用。
AA 也属于一种omega-6 多不饱和脂肪酸,广泛存在于各种组织结构中[18],在磷脂酶A2的作用下从细胞膜磷脂中释放出游离的花生四烯酸[19]。 AA也是多种常见脂质代谢产物的前体,在环氧合酶(cyclooxygenase,COX)、脂氧合酶和细胞色素P450途径下产生多种生物活性的代谢衍生物,如前列腺素(prostaglandins,PGs) 及血栓素(thromboxane,TXs)、白三烯及环氧二十二烷基类化合物。 其中前列腺素类代谢物,如PGD2、PGF2α等,具有改变血管张力、促进血小板的聚集作用,与高血压、动脉粥样硬化及糖尿病等心血管疾病密切相关[20]。 在本研究中发现5 周龄时正常组与模型组AA 相对丰度值无差异性,在7、9 周时模型组的AA 相对丰度值迅速增加且与血压呈负相关,可能与AA 释放具有血压调节作用的代谢物相关。
在高血压状态下,COX 的表达增加促进了AA向前列腺素类代谢物的转化,促进前列腺素类及血栓烷类代谢物的释放,其中血栓烷类代谢物发挥重要的血压调节作用,TXA2、TXB2作为前列腺素类物质是一种有效的血管收缩物质,它在高血压动物的内皮细胞中合成增加,TXA2半衰期较短,半小时内可代谢成更稳定无活性的TXB2,引起血管收缩升高血压[20]。 在本研究中TXB2在5、7 周时无差异性且与血压的升高呈正相关,在9 周时相对丰度高于正常组,且在9 周时与血压的升高呈负相关,通过研究表明补充DHA 能够减少大鼠前列腺素和活性氧的释放,增加一氧化氮的产生和抗氧化能力,改善脂质代谢,且激活钾离子并恢复血管超极化机制参与血管扩张反应,在一定程度上减少SHR 大鼠中TXA2、PGI2和PGE2释放的增加,改善血管内皮功能障碍[21],因此发生这种变化的原因根据以上研究猜测7 周时TXB2的下降可能与同时期DHA 的升高有关。
众多研究表明尿酸与高血压密切相关,尿酸主要通过引起对肾的损害引起的血压升高,包括肾脏中肾素-血管紧张素系统的激活和尿腔内尿酸盐晶体沉积,尿酸盐在血管中的沉积能进一步引发促炎因子的转录,从而更直接的导致血管内皮功能障碍,促进了心血管疾病的发生[22]。 另外尿酸在缺氧条件下通过降低内皮型一氧化氮合酶磷酸化而损伤血管内皮功能[23]。 有研究表明尿酸可以上调内皮中的醛糖还原酶的表达[24],醛糖还原酶的表达上调可以阻断一氧化氮和内源性果糖的产生,这一机制是高血压状态下血压升高的重要发病机制[25]。本研究中在5 周时正常组与模型组无差异性,7 周时正常组高于模型组同时相关分析为负相关,9 周时模型组尿酸相对丰度值高于正常组,且与血压升高具有正相关性,证明尿酸含量的增多与血压的升高相关,符合上述结果。
本研究在高血压自然发展状态下将外在血压表征与大鼠体内小分子代谢物相关联,发现花生四烯酸通路代谢异常是引起高血压发生发展的主要通路,由于DHA、TXB2等脂质类代谢物及尿酸等的异常对血压的变化起到主要的调控作用,因此可以依据这一结果指导我们从改善生活饮食方式来减少胰岛素抵抗、尿酸水平等方面精准的发挥对血压的调节作用。 然而,本实验中与血压升高相关代谢物对高血压发生发展具体的促进或抑制作用仍需通过设计全面的实验加以阐明,并以公认的降压药作为对照药物进一步明确上述代谢物对高血压发生发展的具体作用,为阐明高血压的发生发展机制做出新的探索,以期为延缓高血压的发生发展提供可靠的实验依据。

