乳杆菌耐消化应激能力及消化应激对其肠道黏附能力的影响
陈大卫,程 月,任晨瑜,陈春萌,瞿恒贤,瓦云超,燕宪涛,陈 霞,黄玉军,张臣臣,关成冉,郑英明,顾瑞霞,*
(1.扬州大学食品科学与工程学院,江苏省乳品生物技术与安全控制重点实验室,江苏 扬州 225127;2.江苏宇航食品科技有限公司,江苏 盐城 224000)
乳杆菌作为人体肠道中的重要益生菌,不仅能够调节机体肠道的微生态平衡,还具有提高免疫、抗氧化以及促进营养物质吸收等功能。在发挥益生作用之前,乳杆菌需经过口腔、胃及肠道等一系列的消化应激,而口腔中的溶菌酶能够通过水解-乙酰葡糖胺和-乙酰胞壁酸破坏乳杆菌的细胞壁结构,胃中的酸性环境(pH 2.0~5.0)会使菌体细胞中维持正常生理功能的蛋白发生变性,肠道中的胆盐(0.1%~0.3%)、胰酶(0.1%)及pH值等也会导致菌体细胞相关蛋白的变性;这些不良环境不仅会对乳杆菌的黏附能力产生较大的影响,更会造成乳杆菌的损伤甚至死亡。而乳杆菌在肠上皮细胞上的黏附有助于延长其在肠道中的停留时间,加强其与肠上皮细胞间的信息交流,并通过调节肠道菌群、免疫反应、代谢产物及抑制肠道病原菌的定植等改善低免疫、过氧化、腹泻等对机体健康产生的不良影响。因此,乳杆菌只有耐受口腔、胃液和肠液等消化道的不良环境,以较高的活菌数到达并黏附在肠道上,才能更好地发挥其益生作用。
乳杆菌的黏附主要分为2 个阶段,首先由非特异性的物理结合如疏水相互作用、表面电荷驱动黏附;随后通过菌株细胞的表层蛋白、胞外多糖、脂磷壁酸等细胞壁的组成成分与宿主进行特异性黏附。表层蛋白是在菌株细胞内合成后通过信号肽穿过细胞膜被分泌到细胞外,通过与菌体表面的肽聚糖层和磷壁酸结合发挥其黏附作用;胞外多糖则是乳杆菌在生长代谢过程中分泌到细胞壁外的糖类化合物,根据与菌体的紧密连接程度可分为黏液多糖和荚膜多糖;而脂磷壁酸主要是与细胞壁肽聚糖共价结合的壁磷壁酸,以及锚定在细胞膜上的脂磷壁酸。
目前,对乳杆菌黏附的大部分研究仅分别单独考察其在模拟胃肠道环境下的存活情况和对肠上皮细胞的黏附能力;而关于乳杆菌在依次经过模拟唾液-胃液-肠液等连续消化应激后的黏附能力及其表面黏附素变化的研究较少,主要集中在单个消化应激对乳杆菌黏附能力的影响,对于连续消化应激对乳杆菌黏附能力的影响仍未知,具体的响应和适应机制也不明确。因此,本实验首先研究乳杆菌在依次经过模拟唾液-胃液-肠液等连续消化应激后的存活能力,然后研究其对肠道的黏附能力以及连续消化应激对其黏附能力和表面黏附素的影响;最后通过透射电镜(transmissim electnonic microscopy,TEM)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分别探讨连续消化应激对乳杆菌表层微观结构及表层蛋白的影响,以期阐明消化应激对乳杆菌黏附影响的作用机制。
1 材料与方法
1.1 材料与试剂
鼠李糖乳杆菌()m1、LYO、m98、W157、W116、W78,副干酪乳杆菌()W125、m54、96、m38、m64、m111,发酵乳杆菌()56、m91、57、146、147、118来自江苏省乳品生物技术与安全控制重点实验室;人结肠腺癌细胞系Caco-2细胞株湖南丰晖生物科技有限公司;大肠杆菌() CICC10899、沙门菌()WX29 中国工业微生物菌种保藏中心。
磷酸盐缓冲液(phosphate buffer saline,PBS)、氯化锂(LiCl)、牛胆盐 北京索莱宝科技有限公司;SDS-PAGE低分子质量标准蛋白Marker(10~180 kDa)赛默飞世尔科技(中国)有限公司;黏蛋白(Type II)上海麦克林生化科技有限公司;高碘酸钠 国药集团化学试剂有限公司;牛血清白蛋白(bovine serum albumin,BSA) 生工生物工程(上海)股份有限公司;最小基本培养基(minimum essential medium,MEM)、丙酮酸钠溶液、氨基酸溶液、谷氨酰胺添加剂美国Gibco公司。
1.2 仪器与设备
JF-SX-500全自动灭菌锅 日本TOMY公司;DNP-9272恒温培养箱 上海精宏实验设备有限公司;Legend mach1.6 R高速冷冻离心机 美国塞默飞世尔科技有限公司;SW-CJ-1F超净工作台 苏州净化设备有限公司;IC1000细胞计数仪 美国Count Star公司;IX2-ILL100荧光倒置显微镜 日本Olympus公司;JEM1200EX型TEM日本JEOL公司;HX-2000 SDS-PAGE仪 美国Bio-Rad公司。
1.3 方法
1.3.1 常用试剂及培养基的配制
模拟唾液:按表1的比例配制模拟唾液缓冲液,加入100 mg/L的溶菌酶溶解后,用1 mol/L的HCl溶液调节pH 7.0,0.22 μm滤膜过滤除菌,现用现配。

表1 模拟消化液成分组成Table 1 Composition of simulated digestion fluids mmol/L
模拟胃液:按表1的比例配制模拟胃液缓冲液,加入3 g/L的胃蛋白酶溶解后,用1 mol/L的HCl溶液调节pH 3.0,0.22 μm滤膜过滤除菌,现用现配。
模拟肠液:按表1的比例配制模拟肠液缓冲液,加入0.1%的胰蛋白酶、0.3%的牛胆盐溶解后,用1 mol/L的HCl溶液调节pH 8.0,经0.22 μm滤膜过滤除菌,现用现配。
MEM完全培养液:77% MEM培养液、20% Clark胎牛血清、1% MEM非必需氨基酸溶液、1%丙酮酸钠溶液、1% GlutaMAX谷氨酰胺添加剂,4 ℃贮藏备用。
MRS(De Man, Rogosa and Sharpe)液体培养基:无水乙酸钠5.0 g,KHPOg7HO 0.2 g,MnSOg4HO 0.05 g,蛋白胨10.0 g,吐温-80 1 mL,葡萄糖20.0 g,牛肉膏10.0 g,酵母膏5.0 g,蒸馏水1 000 mL,121 ℃灭菌15 min,放置室温冷却后使用。MRS固体培养基则加入15.0 g琼脂。
1.3.2 乳杆菌的消化应激能力
活化后的乳杆菌于8 000h离心10 min,无菌PBS(pH 7.2)洗涤后将菌体沉淀悬浮于模拟唾液中,37 ℃培养5 min,8 000h离心10 min后将菌体沉淀重悬于模拟胃液中,37 ℃培养3 h,8 000h离心10 min后再将菌体沉淀重悬于模拟肠液中,37 ℃培养2 h;每次应激后均采用平板菌落计数法测定乳杆菌的活菌数。
1.3.3 乳杆菌对黏蛋白的黏附能力
称取一定量的黏蛋白溶于PBS,配制成1 mg/mL的黏蛋白溶液,取0.5 mL加至24 孔细胞培养板中,37 ℃培养1 h后4 ℃过夜,然后加入等体积的黏蛋白继续在37 ℃培养2 h以弥补空白位点,PBS(pH 7.2)洗涤2 次后,接种0.5 mL 10CFU/mL的菌株,37 ℃培养2 h;再用PBS洗涤2 次以除去未黏附的菌株,加入0.5 mL 5 mL/L TritonX-100溶液,于37 ℃孵育30 min解除已黏附的菌株,用枪头轻轻刮取收集菌悬液,采用平板菌落计数法测定乳杆菌的活菌数,按照式(1)计算乳杆菌对黏蛋白的黏附率:

1.3.4 乳杆菌对Caco-2细胞的黏附能力
取0.5 mL 2h10cell/mL Caco-2细胞接种于24 孔细胞培养板中,每天换液1 次,培养至单层,无菌PBS洗涤2 次,加入0.5 mL 10CFU/mL的未消化应激或消化应激后的乳杆菌,37 ℃培养2 h;用无菌PBS洗涤3 次除去未黏附的菌株,加入150 μL 0.25%胰酶消化液后在37 ℃、5% CO培养箱中消化3~5 min至Caco-2细胞完全脱落,再加入350 μL MEM完全培养基终止消化,收集菌悬液,采用平板菌落计数法测定乳杆菌的活菌数,按照式(1)计算乳杆菌对Caco-2细胞的黏附率。
1.3.5 乳杆菌表面主要黏附素的测定
将0.5 mL 2h10cell/mL Caco-2细胞接种于24 孔细胞培养板中,培养至单层,分别取10CFU/mL未消化应激或消化应激后的乳杆菌用无菌PBS洗涤3 次,离心后分别加入5 mol/L LiCl溶液、50 mmol/L高碘酸钠(NaIO)溶液和2% BSA去除菌株细胞表层蛋白、多糖和脂磷壁酸;无菌PBS洗涤离心收集菌体,并悬浮至10CFU/mL,接种0.5 mL至Caco-2细胞单层,37 ℃培养2 h,PBS洗涤3 次除去未黏附的菌株,加入0.15 mL胰酶细胞消化液,待细胞完全脱落后加入350 μL MEM完全培养基终止消化,收集菌悬液,采用平板菌落计数法测定乳杆菌活菌数。按照式(1)计算乳杆菌对Caco-2细胞的黏附率,分别去除菌株表层蛋白、多糖和脂磷壁酸等表面黏附素后,测得黏附率最低的即为该菌株的主要黏附素。
1.3.6 乳杆菌抑制病原菌黏附肠道的能力
取0.5 mL 2h10cell/mL Caco-2细胞接种于24 孔细胞培养板中,培养至单层,无菌PBS(pH 7.2)洗涤2 次;接种菌株分别研究其通过排除、竞争和替代等方式抑制大肠杆菌和沙门菌黏附肠道的能力。
排除实验:先接种0.5 mL 10CFU/mL乳杆菌菌悬液和0.5 mL 无菌PBS至24 孔细胞培养板中,37 ℃、5% CO培养1 h,无菌PBS洗涤3 次,除去未黏附的菌体;然后再分别加入0.5 mL 10CFU/mL的大肠杆菌或沙门菌和0.5 mL 无菌PBS,37 ℃、5% CO培养1 h。竞争实验:同时接种0.5 mL 10CFU/mL乳杆菌菌悬液和大肠杆菌或沙门菌至24 孔细胞培养板中,37 ℃、5% CO培养2 h。替代实验:先接种大肠杆菌或沙门菌和无菌PBS,37 ℃、5% CO培养1 h,PBS洗涤3 次,除去未黏附的病原菌,然后再接种乳杆菌和无菌PBS,37 ℃、5% CO培养1 h。
用无菌PBS分别洗涤上述培养后的细胞和病原菌的共培养物,除去未黏附的病原菌,每孔加入0.15 mL胰酶细胞消化液消化,待细胞完全脱落后加入350 μL MEM完全培养基终止消化,收集菌悬液,平板计数法于LB培养基中检测大肠杆菌和沙门菌活菌数;每组做3 个平行实验,根据式(2)计算乳杆菌对病原菌的黏附抑制率:
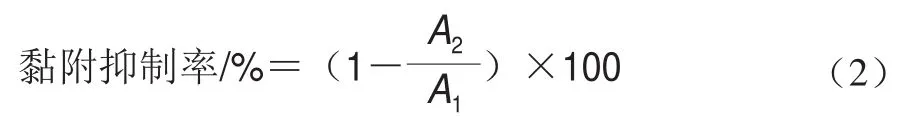
式中:为未接种菌株时,黏附在Caco-2细胞上的病原菌活菌数;为接种菌株后,黏附在Caco-2细胞上的病原菌活菌数。
1.3.7 乳杆菌表层蛋白的SDS-PAGE
利用LiCl提取乳杆菌表层蛋白后,4 ℃、8 000h离心10 min收集上清液,得到表层蛋白粗提液,用0.22 μm的无菌亲水性微孔滤膜过滤,于4 ℃ 2 000 Da透析袋中进行透析,期间多次更换透析液,48 h后将悬浊液于4 ℃、8 000h离心10 min离心收集沉淀,并进行冷冻干燥,得到表层蛋白粗提物;用去离子水溶解粗提物,与4×电泳上样buffer以3∶1(/)比例充分混匀,60 ℃金属浴30 min后进行SDS-PAGE,然后用考马斯亮蓝染色液对凝胶进行染色,再用乙酸脱色液脱色到出现清晰的蛋白质条带。
1.3.8 消化应激对乳杆菌菌体形态的影响
将消化应激前后的乳杆菌1 000h离心5 min,吸去上清液,沿管壁缓慢加入1 mL 2.5%的戊二醛固定液,于4 ℃ 2.5%戊二醛中固定24 h后,用50 mmol/L PBS(pH 7.2)洗涤5 次,加入1%四氧化锇于不透光环境中固定2 h,PBS(pH 7.2)洗涤3 次后,分别利用30%、50%、70%及90%的乙醇溶液脱水,然后用90%~100%的丙酮溶液脱水。将脱水后样品包埋在Spurr低黏度包埋树脂中,利用TEM进行观察。
1.4 数据分析

2 结果与分析
2.1 乳杆菌的消化应激能力
将乳杆菌菌体依次悬浮于模拟唾液、模拟胃液及模拟肠液中,37 ℃分别培养2 h后,研究乳杆菌对模拟消化道的耐受情况,结果如表2所示。模拟唾液和模拟唾液-胃液的应激对实验乳杆菌的存活率影响较小,活菌数下降均小于0.35(lg(CFU/mL)),甚至还促进了乳杆菌的生长;而模拟唾液-胃液-肠液的应激对乳杆菌的存活率影响较大,活菌数下降了0.96~5.04(lg(CFU/mL)),其中鼠李糖乳杆菌LYO,副干酪乳杆菌W125、m54、m38、m111,发酵乳杆菌57、146的活菌数下降较低且存活率显著高于其他菌株(<0.05),均分别大于7(lg(CFU/mL))和1.32%,表明这7 株乳杆菌具有较强的耐唾液-胃液-肠液应激的能力并能够以大于10CFU/mL的活菌数到达肠道。
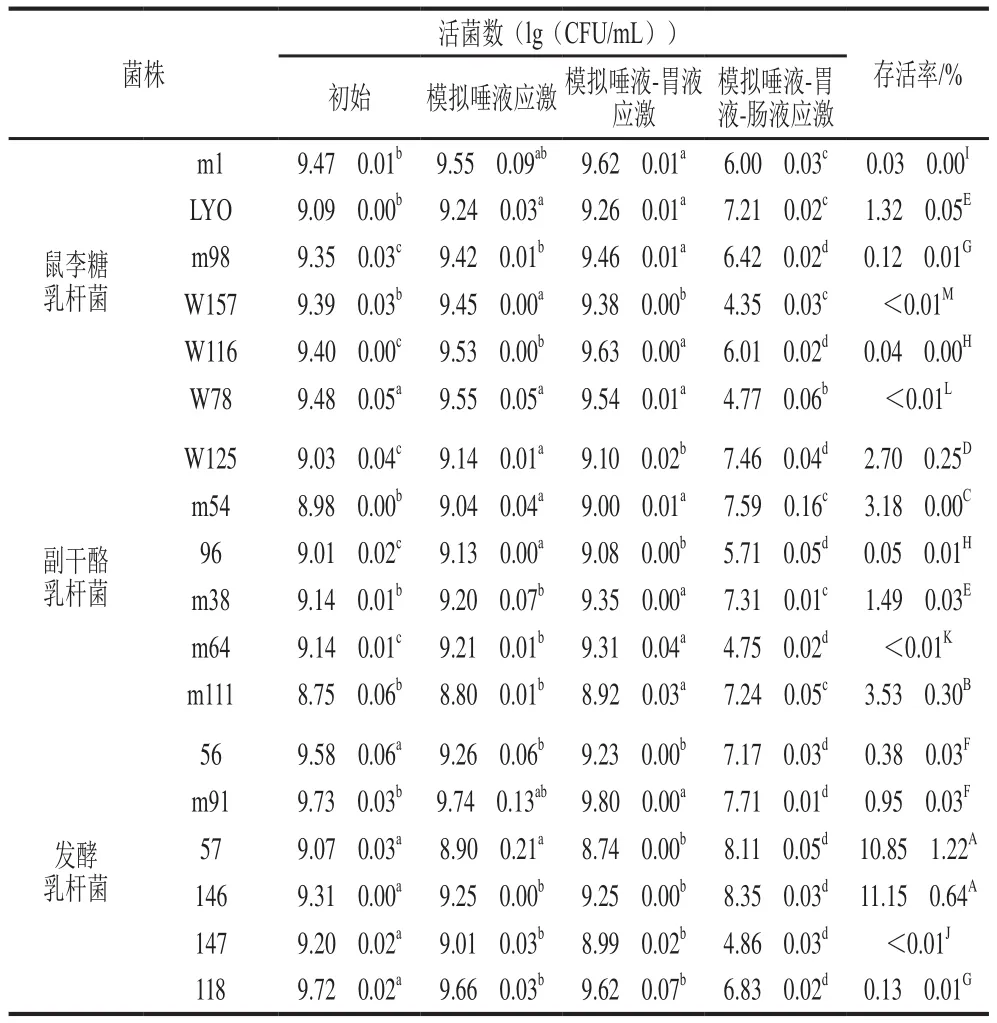
表2 乳杆菌的耐消化应激能力(n=3)Table 2 Digestive stress tolerance of Lactobacillus (n = 3)
2.2 乳杆菌的黏附能力
将耐消化应激能力较强的乳杆菌接种至肠道黏蛋白溶液和Caco-2单层细胞中,研究菌株对肠道黏蛋白和Caco-2细胞的黏附能力,结果见图1。7 株乳杆菌的黏附率差异较大,其中副干酪乳杆菌W125、m111和发酵乳杆菌146对黏蛋白的黏附率分别为15.67%、8.75%、8.38%,显著高于其他菌株(<0.05);副干酪乳杆菌W125、m111、m38和发酵乳杆菌146对Caco-2细胞的黏附率分别为11.47%、21.34%、10.51%及10.44%,显著高于其他菌株(<0.05)。

图1 乳杆菌对黏蛋白(A)和Caco-2细胞(B)的黏附能力Fig.1 Adhesion capacity of Lactobacillus to mucins (A) and Caco-2 cells (B)
由图2可知,实验的乳杆菌对Caco-2细胞和黏蛋白之间的黏附呈显著正相关(<0.05),相关系数为0.64,因此后续仅通过菌株对Caco-2细胞的黏附实验评价菌株对肠道的黏附能力。
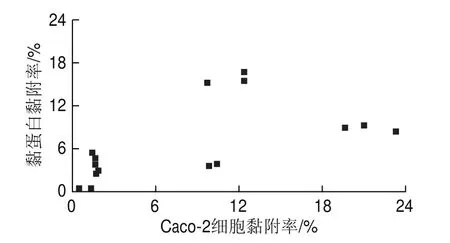
图2 乳杆菌对黏蛋白和Caco-2细胞黏附能力相关性分析Fig.2 Correlation between the adhesion capacities of Lactobacillus to mucins and Caco-2 cells
2.3 乳杆菌抑制肠道病原菌黏附能力
接种黏附能力较强的菌株至Caco-2细胞单层,研究菌株通过排除、竞争和替代的方式对大肠杆菌和沙门菌黏附肠道的抑制能力,结果如图3所示。3 株乳杆菌均具有抑制大肠杆菌和沙门菌黏附肠道的能力,分别通过排除、竞争和替代方式对大肠杆菌和沙门菌的黏附抑制率均大于13.51%,其中发酵乳杆菌146通过排除、竞争和替代的方式对沙门菌黏附肠道的抑制率分别为94.14%、92.53%和95.61%,显著高于其他菌株(<0.05);副干酪乳杆菌W125和m111通过竞争方式对大肠杆菌黏附肠道的抑制率显著高于发酵乳杆菌146(<0.05),而副干酪乳杆菌m111和发酵乳杆菌146则是通过替代方式对大肠杆菌黏附肠道的抑制率显著高于副干酪乳杆菌W125(<0.05)。
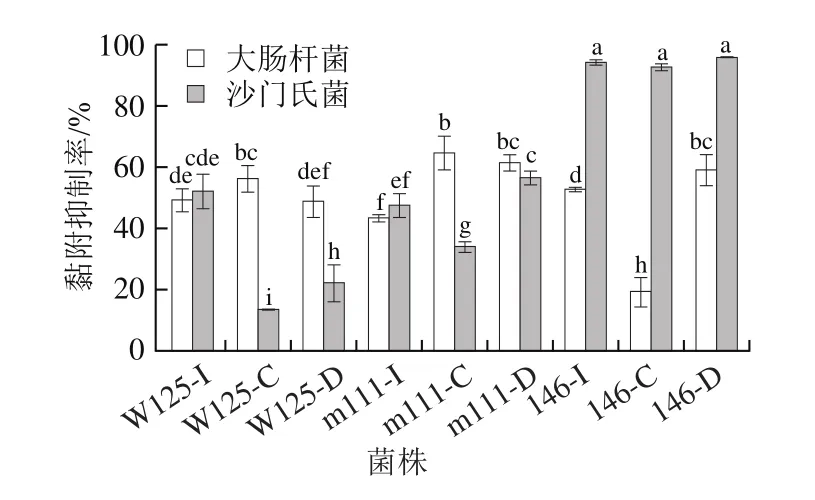
图3 乳杆菌对病原菌的黏附抑制作用Fig.3 Inhibitory effect of Lactobacillus on pathogen adhesion to Caco-2 cells
2.4 消化应激对乳杆菌黏附能力的影响
机体的消化应激会影响乳杆菌对肠上皮Caco-2细胞的黏附能力,菌株在依次经过模拟唾液、模拟胃液及模拟肠液应激后的黏附率见图4。模拟唾液-胃液-肠液应激显著降低了副干酪乳杆菌W125和发酵乳杆菌146的黏附能力(<0.05),黏附率分别由11.46%和10.43%下降到3.09%和7.35%;但显著增加了副干酪乳杆菌m111的黏附能力(<0.05),黏附率由17.60%增加到30.45%。

图4 消化应激对乳杆菌黏附能力的影响Fig.4 Effect of digestive stress on adhesion capacity of Lactobacillus
2.5 消化应激对乳杆菌表面黏附素的影响
利用LiCl、NaIO和BSA分别去除菌株细胞的非共价结合表层蛋白、表面多糖和抑制菌株细胞的脂磷壁酸研究消化应激对副干酪乳杆菌m111表面黏附素的影响。由图5可知,副干酪乳杆菌m111在消化应激前,经LiCl处理后的黏附能力显著低于未经处理的对照组及NaIO和BSA处理组(<0.05),表明表层蛋白是菌株m111表面主要的黏附素;当菌株m111经过模拟唾液-胃液-肠液应激后,LiCl和NaIO处理后的黏附能力显著低于BSA处理(<0.05),表明菌株m111经过消化应激后,表层蛋白和多糖是其表面主要的黏附素。
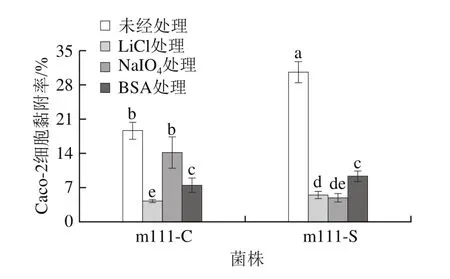
图5 消化应激对副干酪乳杆菌m111表面黏附素的影响Fig.5 Effect of digestive stress on surface adhesin of L.paracasei m111
2.6 消化应激对菌株表层蛋白表达的影响
采用BCA试剂盒测定提取的菌株表层蛋白含量,同时利用SDS-PAGE研究消化应激对其表达的影响。由表3可知,在消化应激前后,副干酪乳杆菌m111表层蛋白粗提物中均能检测到蛋白,表明菌株表面存在蛋白类物质;在依次经过模拟唾液-胃液消化应激后,菌株表层蛋白粗提物中蛋白质量浓度为0.70 mg/mL,是未消化应激的表层蛋白粗提物的1.56 倍(<0.05);依次经过模拟唾液-胃液-肠液应激后,菌株表层蛋白粗提物中蛋白含量较模拟唾液-胃液应激和未经消化应激显著降低(<0.05)。
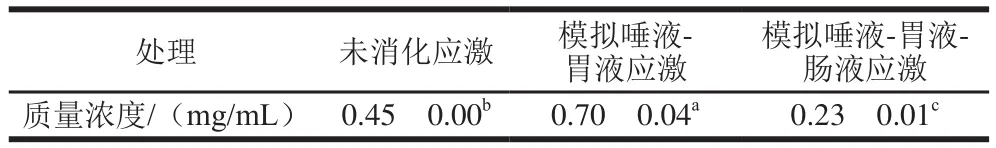
表3 副干酪乳杆菌m111表层蛋白含量Table 3 Content of surface protein in L.paracasei m111
由图6可知,在消化应激前,副干酪乳杆菌m111在15~120 kDa范围内存在条带,表明菌株携带表层蛋白;在模拟唾液-胃液应激后,蛋白条带的颜色在36~100 kDa范围内加深,同时在14 kDa出现了新的条带,表明模拟唾液-胃液的应激增加了菌株m111的蛋白表达;而经过模拟唾液-胃液-肠液应激后,在15~120 kDa范围内未检测到蛋白条带,14 kDa处的蛋白条带颜色变浅。
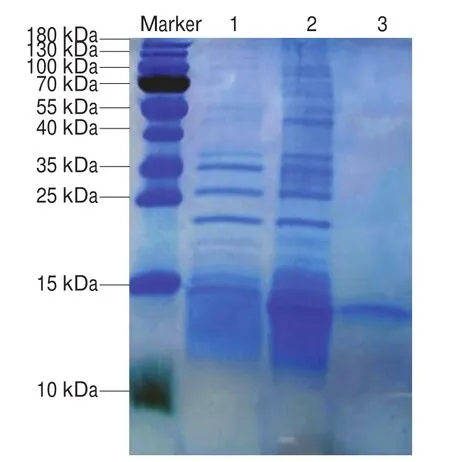
图6 消化应激对副干酪乳杆菌m111表层蛋白表达的影响Fig.6 Effect of digestive stress on surface protein expression in L.paracasei m111
2.7 消化应激对乳杆菌细胞形态的影响
通过TEM观察副干酪乳杆菌m111在依次经过模拟唾液-胃液-肠液应激后的细胞形态变化,并利用TEM粒径统计软件分析消化应激对菌株表层物质厚度的影响。由图7A、B可知,消化应激前后副干酪乳杆菌m111的细胞形态均为长梭形和圆润的杆状;由图7C、D及表4可知,消化应激前后菌株m111的表层厚度无显著影响(>0.05),表明消化应激对菌株的形态及表层物质的厚度影响较小。
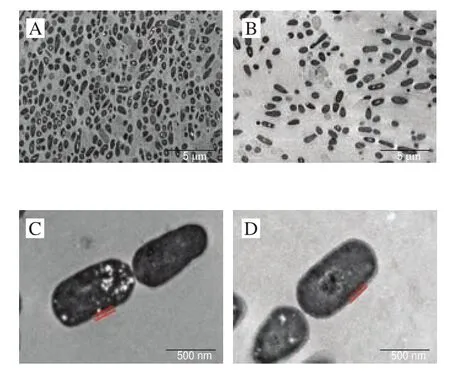
图7 消化应激对副干酪乳杆菌m111表层物质厚度的影响Fig.7 Effect of digestive stress on the thickness of surface layer in L.paracasei m111

表4 消化应激后副干酪乳杆菌m111细胞的表层物质厚度Table 4 Thickness of surface layer in L.paracasei m111 before and after digestive stress
3 讨 论
乳杆菌必须能够经受住消化道的应激,才能够到达肠道并发挥有益作用,而乳杆菌在经过消化道时,会激发各种保护机制以抵抗胃酸性环境、肠内胆汁等不良环境。实验乳杆菌在暴露于模拟唾液时,均能保持较高的活性,与Bove等的研究结果相似,可能是由于实验菌株的基因被口腔应激显著上调所致;研究还发现,鼠李糖乳杆菌和副干酪乳杆菌的存活率均高于100%,表明在短时间内(5 min),鼠李糖乳杆菌和副干酪乳杆菌对口腔中的溶菌酶具有较强的耐受能力;当经过模拟胃部消化时,大部分实验乳杆菌均能保持较高的活性,甚至有些菌株还得到了生长,这与Mangia等的研究结果相似,可能是由于实验乳杆菌在遭受胃部不良环境的胁迫后能够通过调动自身质子移位膜ATP酶、谷氨酸脱羧酶、精氨酸脱氨酶和脲酶等改善细胞内外的pH值平衡进而维持其活性;而Bove及Ouwehand等发现,当乳杆菌以牛奶或多糖为载体进入肠道时,能提高其在唾液和胃液中的存活率,表明牛奶等载体能增强乳杆菌对消化道的应激能力。当实验乳杆菌依次经过模拟唾液-胃液-肠液消化应激时,大部分实验菌株的存活率显著下降(<0.05),表明连续的消化过程中胃蛋白酶、pH值、胰酶及胆盐等不良环境的应激对实验菌株活性影响较大。
乳杆菌能够通过其表面的3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)等兼职功能蛋白与肠道中的黏蛋白相结合实现其对肠道的黏附,而其对肠Caco-2细胞的黏附不仅可以通过GAPDH等兼职功能蛋白,还可以通过SlpA等表面蛋白及胞外多糖等物质实现;因此,不同的黏附素及其黏附机制会使乳杆菌对肠道黏蛋白和肠Caco-2细胞的黏附能力产生差异;同时,表面蛋白等黏附素的数量、组成及其功能的不同也会造成同一种属不同菌株对Caco-2细胞黏附能力的差异。乳杆菌表层蛋白在其抑制病原菌黏附肠道的过程中发挥着重要作用,添加一定量的表层蛋白能提高菌株抑制病原菌黏附的能力;因此,表层蛋白含量的差异可能是副干酪乳杆菌m111抑制大肠杆菌黏附肠道的能力显著高于副干酪乳杆菌W125的重要因素(<0.05)。
通过SDS-PAGE发现,模拟唾液-胃液应激增加了菌株m111在36~100 kDa处的蛋白表达,而大部分乳杆菌表层蛋白分子质量在25~71 kDa之间,表明模拟唾液-胃液的应激可能通过刺激菌株m111分泌更多的蛋白至胞外维持菌株的黏附能力,同时,在14 kDa检测到新的蛋白条带;而在模拟唾液-胃液-肠液的连续消化应激后,菌株在14 kDa的蛋白条带颜色变浅,15~120 kDa之间的蛋白条带消失,蛋白质量浓度由0.70 mg/mL显著降低至0.23 mg/mL,表明连续的消化应激不仅会将菌株m111的表层蛋白降解为更小分子的蛋白,而且还会显著降低蛋白含量(<0.05),进而降低乳杆菌黏附肠道的能力;同时,也容易减弱乳杆菌与大肠杆菌竞争肠细胞表面黏附位点的能力及降低乳杆菌表面物质水解大肠杆菌细胞壁肽聚糖的能力,导致乳杆菌抑制病原菌黏附肠道能力的下降。虽然连续消化应激显著降低了菌株m111表层蛋白的含量(<0.05),但同时也可能刺激了菌株m111通过启动自身的群体感应系统等自我保护机制分泌多糖等物质至细胞外增强其对消化应激的耐受性,从而维持了菌株表层物质的厚度,使其未发生显著变化(>0.05),其主要黏附素也由应激前的表层蛋白变为应激后的蛋白和多糖;这些物质也有助于改善菌株黏附肠道的能力,其黏附能力显著高于未消化应激(<0.05),而降解产生的小分子蛋白(14 kDa)与分泌的多糖是否有利于菌株抑制病原菌黏附肠道能力提升还需进一步研究。
4 结 论
副干酪乳杆菌W125、m111和发酵乳杆菌146具有较强的耐唾液-胃液-肠液消化应激和肠道黏附能力,并可以通过排除、竞争和替代的方式抑制大肠杆菌和沙门菌对肠道的黏附;消化应激显著降低了菌株W125和146的黏附能力(<0.05),但显著提高了菌株m111对肠道的黏附能力(<0.05)。因此,副干酪乳杆菌m111是一株潜在的具有较高应用价值的益生菌。该研究为高耐受消化应激和高肠道黏附的益生乳酸菌的筛选提供参考,也为消化应激对乳杆菌黏附肠道的影响机制研究提供理论依据。

