基于孢粉素微胶囊的共包埋、保护及递送益生菌和乳糖酶的体系
邓紫玙,丁 一,侯欣尧,李 斌,梁宏闪*
(华中农业大学食品科技学院,环境食品学教育部重点实验室,湖北 武汉 430070)
全球有超过70%的人口患有不同程度的乳糖不耐症,该病症是由于人体内缺乏乳糖酶(-galactosidase,-Gal)所致。-Gal制剂和益生菌制剂均可以有效治疗乳糖不耐症,且它们均不会引起食品质量或营养状况的改变,因此上述补充剂法是极有前景的治疗乳糖不耐症方法。然而,补充剂中的-Gal和益生菌在加工、运输、贮存和摄食过程中均会面临许多不利环境,例如温度变化、冻干处理、极端pH值和各种消化酶,导致-Gal和益生菌的活性大幅度降低,这将极大地影响这类补充剂的使用效果。为了降低这些不利因素的影响,研究人员已设计多种递送系统,例如纳米颗粒、胶束、乳液、微胶囊和脂质体等,用于保护-Gal制剂和益生菌制剂。尽管相关研究已取得了一些进展,但是依旧存在许多问题,一方面,仍缺乏成本效益高的递送系统,并且作为食品补充剂,递送载体需要由食品级成分构成,且具备良好的稳定性以满足商业应用的需求。另一方面,目前几乎没有报道过益生菌和-Gal的共包埋材料,其可以同时提高益生菌和-Gal的胃肠道稳定性、贮存稳定性和热稳定性。
花粉中提取的孢粉素外壁胶囊(sporopollenin exine capsules,SECs)被认为是一种安全、可食用的天然植物基微胶囊。SECs具有结构形貌均一、内腔大、弹性好、抗物理化学性、紫外线屏蔽能力和抗氧化活性等优点。因此,SECs可以抵抗pH值、离子强度、温度、光、氧和机械应力的变化。此外,SECs的黏膜黏附特性有助于延长负载物在体内的停留时间,从而提高负载物的生物利用度。综上,由于SECs具有经济成本效益和独特的性质,因此它被认为是口服递送载体的热门候选者。但SECs表面存在许多孔洞,这些孔洞就像一把双刃剑,既为负载物进入SECs提供通道,同时也会导致负载物的泄露。
针对SECs存在的问题,可以利用核壳结构包裹SECs上的孔洞并调节负载物在胃肠道中的释放行为。常用于构建核壳结构的海藻酸钙(Ca-alginate,Ca-Alg)凝胶具有pH值响应性,但它在胃肠道中的稳定性较差。研究表明Alg与其他聚合物结合制备的复合凝胶比Ca-Alg凝胶在胃肠道中具有更好的稳定性。之前的研究结果表明:羧甲基茯苓多糖(carboxymethylpachymaran,CMP)是一种益生菌的冻干保护剂,并且具有pH值响应性,因此可以考虑采用Alg与CMP制备复合凝胶构建核壳结构,提高体系冻干稳定性和pH值响应性能力。核壳结构虽然可以解决SECs存在孔洞的问题,但前期研究发现核壳结构不能提高负载物的热稳定性能,因此可以尝试采用热致凝胶对核壳结构进行二次包裹,从而进一步提高负载物的热稳定性。
本研究设计一种益生菌和-Gal共包埋的递送体系,该体系以SECs为核,Ca-Alg/CMP凝胶为壳,旨在同时提高益生菌和-Gal的胃肠道、冻干和贮存稳定性;并尝试使用热致凝胶对体系进行二次包裹,旨在进一步提高益生菌和-Gal的热稳定性。本实验研究核壳结构对益生菌和-Gal的释放行为、冻干和贮存稳定性的影响,并研究CMP的引入对凝胶壳层形貌、质构和水分分布的影响。最后研究热致凝胶的二次包埋对益生菌和-Gal热稳定性的影响,并通过热致凝胶的微观结构和流变性能阐明其热稳定机理,以指导体系在实际生产中应用。本研究旨在提供酶和益生菌制剂共包埋的递送体系,其可以应用在医疗食品、功能食品或食品补充剂等领域。
1 材料与方法
1.1 材料与试剂
海藻酸钠(alginate,Alg)、羟丙基甲基纤维素(hydroxypropylmethylcellulose,HPMC)、甲基纤维素(methylcellulose,MC) 阿拉丁试剂公司;CMP武汉润歌生物科技有限公司;向日葵花粉 贝儿蜂蜜有限公司;植物乳杆菌()CICC 6240 中国工业微生物菌种保藏管理中心;-半乳糖苷酶(-galactosidase,-Gal,250~600 U/mg)上海源叶生物有限公司;二醋酸羧基荧光素琥珀酰亚胺酯(carboxyfluorescein diacetate succinimidyl ester,CFDA-SE) 碧云天生物科技有限公司;异硫氰酸酯(isothiocyanate,FITC) 美国Sigma公司;模拟胃液(simulated gastric fluid,SGF)为pH 2.0的HCl溶液,含3.20 mg/mL胃蛋白酶和9.0 mg/mL氯化钠,模拟肠液(simulated intestinal fluid,SIF)为pH 7.4的磷酸盐缓冲液,含1.60 mg/mL胰蛋白酶。
1.2 仪器与设备
BSA124S-CW电子分析天平 德国Sartorius公司;DNP-9162恒温培养箱、DZF-6050真空干燥箱 上海精宏实验设备有限公司;FE28 pH测定仪 瑞士Mettler Toledo公司;MultskanGo酶标仪 美国Thermo Fisher公司;DF-101S水浴锅 上海立辰邦西仪器有限公司;DY04-14灭菌锅 上海东亚压力容器制造公司;SU8010扫描电子显微镜(scanning electron microscope,SEM)日本日立公司;LSM880激光共聚焦显微镜(confocal laser scanning microscope,CLSM) 德国Zeiss公司;MesoQMR23-060H低场核磁共振分析仪 苏州纽迈分析仪器股份有限公司;TA-XT Plus质构仪、R2000ex型流变仪 美国TA公司。
1.3 方法
1.3.1 口服递送体系的制备与表征
1.3.1.1 SECs的制备
按照之前研究工作中所优化的制备方法,提取SECs。简而言之,将向日葵花粉与磷酸混合,在70 ℃处理5 h,然后依次用水、丙酮、盐酸和乙醇洗涤。
1.3.1.2 益生菌和-Gal的共包埋
首先将100 mL MRS(De Man, Rogosa and Sharpe)肉汤与100 mg SECs混合,121 ℃灭菌15 min。冷却后接种1 mL菌株,将混合物在30 ℃培养15 h。然后将过滤得到的SECs与-Gal(2 mg/mL)混合,将混合物置于30 ℃的真空干燥箱中2 h,得到包埋益生菌和-Gal的SECs(SECs-encapsulatedand-Gal,SLG)。
将一部分SLG置于10 mL SIF中,100 r/min、37 ℃恒温摇床中孵育480 min。然后收集1 mL溶液,采用10 倍稀释梯度法进行计数,在MRS琼脂平板上测定溶液中的活菌数。益生菌负载量按式(1)计算:

将另一部分SLG置于12 000 r/min离心4 min获得游离的-Gal。按照之前研究方法测定-Gal活性。简而言之,1 mL-Gal(27~95 U)与5 mL 2.5 mg/mL邻硝基苯--半乳吡喃糖苷溶液混合反应10 min,随后快速加入2 mL 0.5 mol/L NaCO溶液以终止反应。使用全自动酶标仪在420 nm波长处测定样品的吸光度。通过酶活力保留率表示-Gal的负载量,如式(2)所示:

1.3.1.3 核壳凝胶的制备
SLG均匀分散在多糖溶液中,该多糖溶液由不同比例的CMP(6 g/100 mL)和Alg(5 g/100 mL)组成。采用挤压法,用5 mL无菌注射器吸取SECs/多糖混合物逐滴加到CaCl(0.05 mol/L,50 mL)溶液中,将获得的核壳凝胶用无菌去离子水洗涤。将Ca-Alg包裹的SLG样品命名为复合凝胶-0。复合凝胶-1、复合凝胶-2和复合凝胶-3代表Ca-Alg/CMP包裹的SLG样品,其Alg-CMP的体积比分别为1∶1、2∶1、3∶1。
1.3.1.4 微观结构分析
样品的图像在SEM(加速电压10.0 kV)观察。将SECs浸入液氮中1 min,使用钢制手术刀片对其进行切割,用于拍摄SECs的横截面图片。
负载菌的SECs置于2 mL无菌生理盐水中,加入10 μL CFDA-SE染料,然后在4 ℃冰箱中避光放置20 min,将染色后的载菌SECs与FITC标记的-Gal混合(1 mL的-Gal溶液中加入50 μL FITC染料,避光搅拌30 min),将混合物置于30 ℃的真空干燥箱中2 h,得到荧光染色后SLG。样品在CLSM上拍摄成像。
1.3.2 体外模拟消化实验
将样品置于SGF中2 h(恒温摇床37 ℃、100 r/min),然后转移至SIF(恒温摇床37 ℃、100 r/min)进一步释放。在固定时间点取出1 mL释放的溶液,测定-Gal活性,并用稀释分离计数法测定释放溶液中的活菌数。
1.3.3 复合凝胶壳层的表征
多糖溶液由不同比例的CMP(6 g/100 mL)和Alg(5 g/100 mL)组成,用5 mL注射器吸取多糖溶液,逐滴加到CaCl(0.05 mol/L,50 mL)溶液中,将获得的凝胶用去离子水洗涤。Ca-Alg凝胶壳层命名为AG,作为对照。ACG-1、ACG-2和ACG-3代表Ca-Alg/CMP凝胶壳层,其Alg-CMP的体积比分别为1∶1、2∶1、3∶1。参考Shang Longchen等的方法,使用低场核磁共振分析成像系统对样品进行测定,采用低场核磁共振分析仪。将约1 g样品放入圆柱形玻璃管(直径15 mm)中,插入核磁共振分析仪中,测定样品的自旋-自旋弛豫时间。
为测定经过不同pH值处理对复合凝胶硬度的影响,将上述得到的湿凝胶在pH 2.0的HCl溶液和pH 7.4的磷酸盐缓冲液中分别浸泡2 h后过滤得到不同pH值处理的样品。使用TA-XT Plus质构仪测定样品的硬度,测定条件如下:TPA模式;铝质圆柱形探头(P/36R);测试触发力1 g;形变压缩率50%;测前速率1 mm/s;测试速率1 mm/s;测后速率1 mm/s。
采用SEM观察复合凝胶壳层的微观结构。
1.3.4 贮存稳定性
在4 ℃和25 ℃条件下,探究样品贮存稳定性。贮存30 d后,测定样品菌数和酶活力损失率,如式(3)、(4)所示:

1.3.5 热稳定性
1.3.5.1 热保护体系的制备
1 g复合凝胶-2分别加入5 mL的HPMC(10 g/100 mL)、MC(10 g/100 mL)和蛋清。湿样混合物分别在45、55、65 ℃热处理30 min和80 ℃热处理1 min,测定样品的菌数和酶活力损失率。
1.3.5.2 热致凝胶的表征
使用AR2000ex型流变仪对样品进行测试,在1 Hz下进行动态应变扫描测定,以确定在25 ℃时应变范围为0.01%~100%的线性黏弹性范围。然后,在25 ℃以0.2%的恒定应变进行0.1~100 rad/s的动态扫频。探究不同温度和时间对样品的黏弹特性的影响,测试温度和时间分别为45 ℃(30 min)、55 ℃(30 min)、65 ℃(30 min)和80 ℃(1 min)。添加样品后,在平板间隙添加甲基硅油防止水分蒸发。
1.4 数据分析
所有实验重复3 次以上,使用SPSS 22.0统计软件分析所有测定结果,利用Origin 2020作图。
2 结果与分析
2.1 口服递送体系的表征
2.1.1 SECs的表征
将脱脂向日葵花粉(defatted sunflower pollen,DSPs)和酸解向日葵花粉(SECs)进行对比分析。由图1 SEM图像可知,DSPs和SECs具有相似的表观形貌,但SECs表面上存在的孔洞数量比DSPs表面存在的孔洞数量多,这可能是由于酸解处理进一步去除了附着在孔洞上的蛋白质等物质,从而使更多的孔洞暴露出来。SEM横截面图表明,DSPs内腔中含有胞内物质而SECs内腔干净,证明酸解处理成功去除花粉的胞内物质。该结果与CLSM图像结果一致:DSPs内腔中观察到由于胞内物质产生的自发荧光,但SECs内腔中没有观察到荧光。综上SECs具有多孔结构和干净的空腔,可为所负载的物质提供更大的空间。

图1 脱脂、提取和益生菌-β-Gal负载后SECs的SEM和CLSM图Fig.1 CLSM and SEM images of defatted, acid-hydrolyzed, and L.plantarum-β-Gal-loaded SECs
2.1.2 益生菌和-Gal的共包埋
由SEM图像(图1)可知,负载后大量富集在SECs内部;采用FITC标记-Gal、CFDA-SE标记,由CLSM图像可知,SLG内观察到杆状益生菌的荧光和绿色荧光背景,进一步证实了和-Gal 成功封装到SECs中。负载处理后,益生菌负载量达到9.63h10CFU/g,酶活力保留率达到80.72%。研究结果表明,SECs可以为和-Gal提供良好的生物相容性环境,这可能归因于SECs具有空腔和亲水性,可以将足够的MRS培养基吸收到空腔中以供给生存所需的营养,利于益生菌的代谢和增殖。值得注意的是,和-Gal可以共存,的存在不会影响-Gal的活性。此外,SEM图表明负载前后SECs具有相似的形貌和结构,这对于封装系统的工业应用非常重要。
2.1.3 复合凝胶壳层表征
尽管和-Gal成功负载到SECs中,但SECs表面存在孔洞,则无法避免负载物泄漏。采用复合凝胶(Ca-Alg/CMP)作为外壳包裹SECs的孔洞以防止和-Gal泄漏。图2显示,复合凝胶-0可以完全覆盖SECs表面纳米级的小孔和部分覆盖微米级的大孔,而复合凝胶-1、复合凝胶-2和复合凝胶-3均可完全覆盖所有孔洞。

图2 包裹复合凝胶涂层SECs的SEMFig.2 SEM images of SECs coated with Ca-Alg or Ca-Alg/CMP systems
2.2 体外释放行为
对比研究不同样品在模拟胃肠条件中的释放行为。负载的SECs(即没有形成凝胶的样品)和负载的Ca-Alg(其不含SECs)作为对照组。不同样品的体外释放曲线见图3。在模拟胃肠条件中,SECs体系中的释放量一直为0 CFU/mL。对于Ca-Alg体系,在SIF中处理5 min,的释放量大幅度增加,达到2.07h10CFU/mL,在60 min达到峰值,约为6.72h10CFU/mL;然而,复合凝胶-0体系在SIF中5 min,释放量约为1.92h10CFU/mL,在120 min达到峰值,约为7.42h10CFU/mL。与复合凝胶-0体系相比,复合凝胶-1、复合凝胶-2和复合凝胶-3体系在SIF中处理5 min,释放量均低于10CFU/mL,随处理时间的延长,释放量逐渐增加并在第480分钟达到最大值,分别为8.60h10、9.61h10CFU/mL和7.87h10CFU/mL。由图3b可知,在模拟胃肠条件下,SECs体系中-Gal累积释放率一直为0%。Ca-Alg体系在SIF中处理5 min,-Gal的累积释放率约为7%,在第60分钟达到峰值,约为8%;然而,复合凝胶-0体系,在SIF中处理5 min,-Gal的累积释放率约为5%,在第240分钟达到峰值,约为15%。相比之下,复合凝胶-1、复合凝胶-2和复合凝胶-3体系中-Gal的累积释放率随处理时间的延长而增加,在第480分钟达到最大值,分别为58.26%、61.67%和54.62%。

图3 不同体系中L.plantarum(a)和β-Gal(b)的体外消化模拟释放曲线Fig.3 In vitro release profiles of L.plantarum (a) and β-Gal (b) from different systems
对于SECs体系,由于SECs表面存在孔洞,使和-Gal在SGF中暴露,从而导致益生菌细胞的死亡和-Gal失去活性。与Ca-Alg体系相比,复合凝胶-0系统具有可持续的释放能力,这可能是由于复合凝胶-0中形成了核壳结构,因此负载物质需要更长的时间才能从核壳结构中释放出来。此外,复合凝胶-2比复合凝胶-0不仅具有更好的缓释能力,而且和-Gal均表现出更大的释放量,表明CMP的加入可提高体系的pH值响应特性,从而增强体系在SGF中的稳定性。CMP与Ca结合具有pH值响应特性在之前的研究中已经报道。

图4显示,在SGF处理后,复合凝胶-0系统只能包裹SECs上的部分孔洞;而复合凝胶-1、复合凝胶-2和复合凝胶-3均包裹SECs上的全部孔洞,表明CMP的引入可以增强系统的抗消化酶性能。SIF处理后,所有样品的壳层都完全溶解,SECs表面孔洞均暴露。此结果与释放研究结果一致,证实该系统可以实现和-Gal的靶向递送和持续释放。

图4 不同样品SGF孵育2 h(a)和SGF孵育2 h后SIF孵育8 h(b)的SEM图Fig.4 SEM images of different samples incubated for 2 h in SGF (a),2 h in SGF and 8 h in SIF (b)
2.3 复合凝胶壳层的表征
2.3.1 低场核磁与微观结构分析
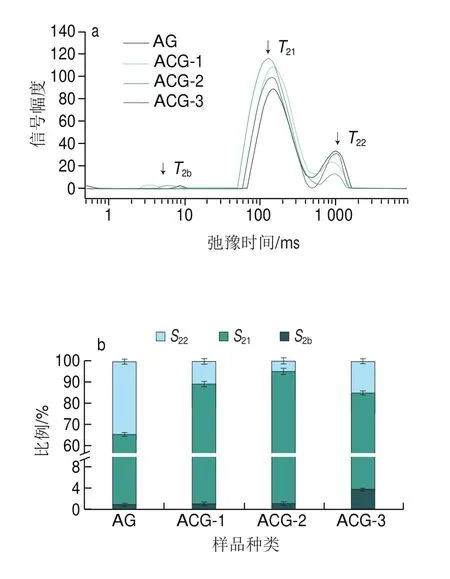
复合凝胶中不同组分水分子的迁移率和比例是反映凝胶特性的重要指标,通过低场核磁共振技术测定复合凝胶中不同状态的水分分布,结果如图5所示。、和代表峰顶点时间,表征该相态水的分子运动性,峰顶点时间越大,则表示该相态水的运动性越强,被束缚的程度越弱,复合凝胶中结合水、不易流动水和自由水可分别用、和表示。一般而言反映与大分子紧密结合的水,反映凝胶结构内的水,对应凝胶结构外的水。、和是相应的峰比例分数,表征该相态水占该样品总水分的含量,峰比例分数越大,表示该相态水占比越多。
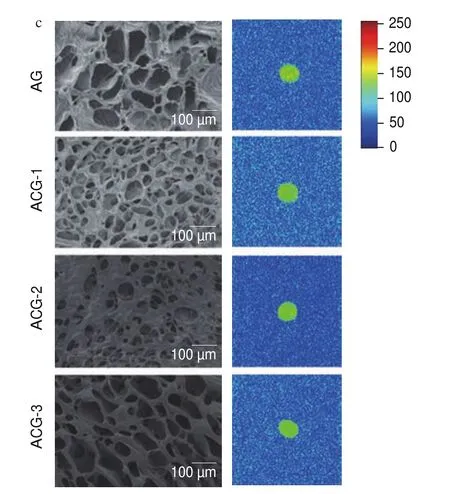
图5 不同样品的T2图谱(a)、不同相态水的分布比例(b)和SEM图像(c)Fig.5 T2 relaxation time spectra of different samples (a), proportion of water distribution in different samples (b), and low-field nuclear magnetic resonance and SEM images of different samples (c)
由图5a可知,所有样品均为信号幅度最大,其次是、的信号幅度最小。与AG相比,ACG中的信号幅度增加,的信号幅度减少;其中ACG-2的的信号幅度最大,的信号幅度最小;该研究结果表明CMP的引入可以改变凝胶中不同状态的水分分布强度。由图5b可知,所有样品均为值最大,其次、值最小。与AG相比,ACG中值增加,值减少;其中ACG-2的值最大,值最小。值降低表明CMP的引入导致ACG对水结合能力增强,更多的自由水转化为不易流动水,表明ACG的凝胶网络状结构比AG更加致密,可以包裹更多的水分子。图5c不同颜色表示不同的流动态氢质子密度,红色代表流动态氢质子分布更密集,其流动态水更多,为高水分含量的区域,蓝色表示低水分含量的区域。红色区域在AG凝胶中占比较ACG大,说明AG凝胶中流动态水更多,与峰比例分布图结果一致。
由图5c SEM可知,ACG平均孔径小于AG,因此ACG的空间网络状结构比AG更加致密;随着复合凝胶中CMP含量的增加,平均孔径呈现减小趋势,相应凝胶空间网络状结构更加紧凑。此结果与低场核磁测定结果一致。结果表明复合凝胶中CMP含量可以通过影响凝胶中的水分分布情况,调节凝胶壳层的微观结构,这可能归因于CMP的加入不仅可以和Ca通过配位键结合,也可以与Alg 之间形成氢键,从而使聚合物链彼此更加接近,减小了凝胶孔径,形成更致密的空间网络状结构。值得注意的是,凝胶的微观结构对其释放行为有显著影响(图3),因为更紧密的凝胶网络状结构不仅可以作为屏障减少和-Gal直接暴露于SGF,还有助于减慢和-Gal在SIF的释放速率。
2.3.2 硬度与微观结构分析
由图6a可知,不同处理后,所有样品硬度均表现出相同的变化趋势,与未处理的样品相比,经过酸处理后,样品的硬度增加;经过碱处理后,样品的硬度减少。在未处理和酸处理的条件下,ACG-2的硬度均大于AG,且ACG-2和AG均经过酸处理后硬度显著增大;而经过碱处理后,硬度显著减小。由图6b所示,处理后,所有样品的空间网络状结构均表现出相同的变化趋势。与未处理的样品相比,经过酸处理后的样品的空间网络状结构更致密;而经过碱处理的样品观察到相反的趋势。且相比于AG,ACG的空间网络状结构更加致密。结果表明复合凝胶具有pH值响应能力,与模拟消化(图3)实验结果一致。复合凝胶壳层具有pH值响应性可能是由于酸性条件促进多糖的羧基的质子化从而增强氢键相互作用,并且碱性条件下Alg和CMP中羧基之间的静电排斥作用增强,该特性使复合凝胶壳层适合作为口服递送材料。
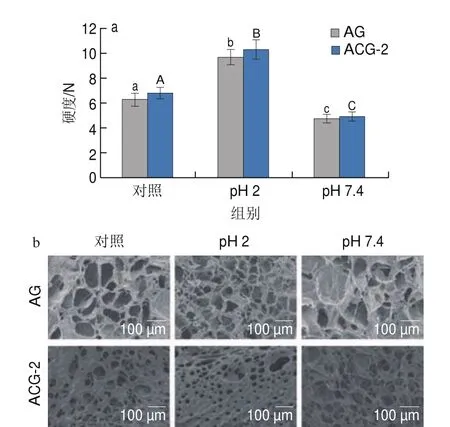
图6 不同处理凝胶的硬度(a)和SEM图(b)Fig.6 Hardness (a) and SEM images (b) of different gels with different treatments
2.4 贮存稳定性
贮存稳定性是评判所递送系统是否适合工业化生产的标准之一,因此探究复合凝胶-2体系经过冻干处理后的贮存稳定性。由表1可知,冻干处理后,纯菌液的菌数损失率达到99.31%,纯酶液的酶活力损失率达到28.32%,而复合凝胶-2体系中菌数损失率为14.37%、酶活力损失率为0.92%。结果表明复合凝胶-2体系可以提高和-Gal的冻干稳定性,这可能是由于SECs和Ca-Alg/CMP 凝胶之间的协同作用。由图7可知,对于所有样品,随着贮存温度的升高,菌数和酶活力损失率均增大,这归因于益生菌细胞在较高温度下代谢更旺盛和蛋白质在高温下易变性;对于而言,复合凝胶-2体系可以降低其在4 ℃贮存条件下的菌数损失率(<0.01);对于-Gal而言,复合凝胶-2体系可以降低其在25 ℃贮存条件下的酶活力损失率(<0.01)。结果表明核壳结构的引入可以提高该体系中和-Gal的贮存稳定性。
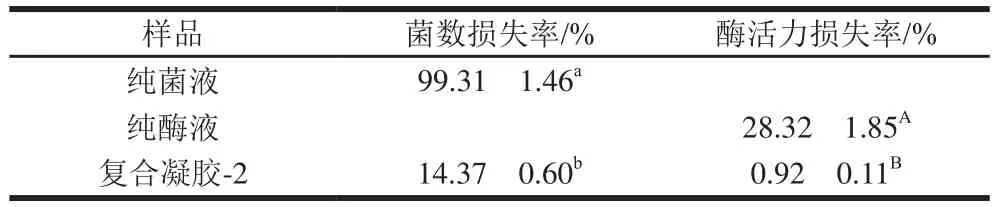
表1 冻干后样品中的菌数损失率和酶活力损失率Table 1 Loss rates of viable cell counts and enzyme activity in samples after freeze-drying process
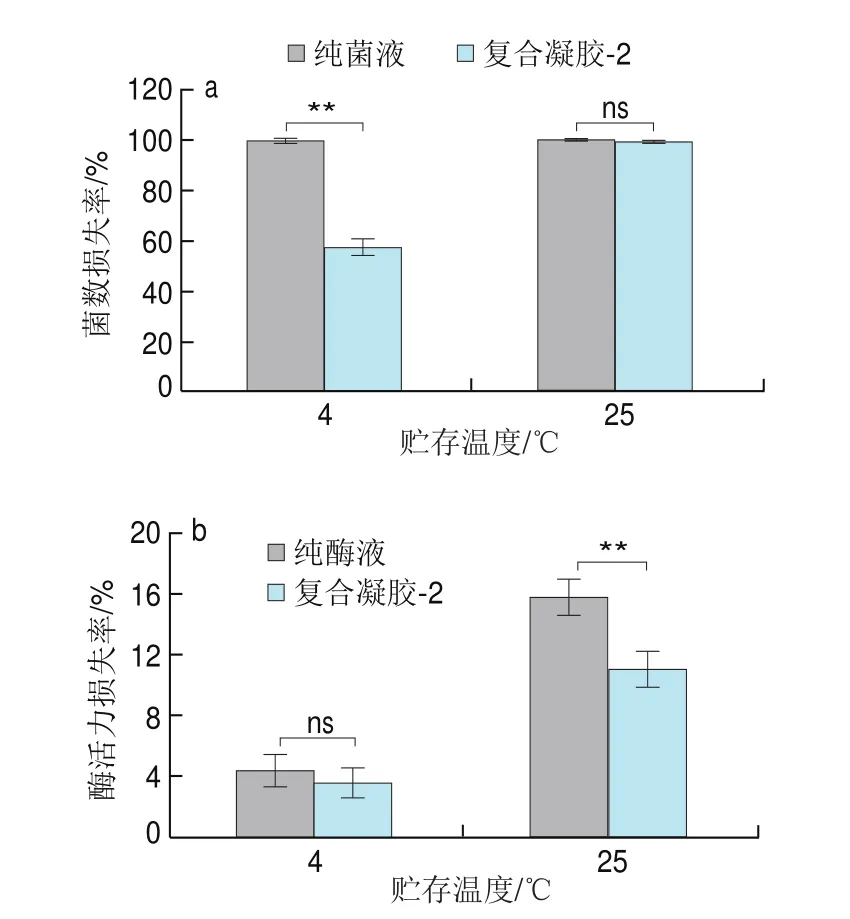
图7 冷冻干燥后不同样品中L.plantarum(a)和β-Gal(b)在4 ℃和25 ℃条件下的贮存稳定性Fig.7 Storage stability of L.plantarum and β-Gal in different lyophilized samples at 4 and 25 ℃
2.5 热稳定性
2.5.1 热稳定性表征
如图8所示,总体而言,随着热处理温度的上升,所有样品中的菌数损失率和酶活力损失率均呈现增大的趋势。在45 ℃条件下处理30 min后(图8a),相比于对照组(纯菌液)的菌数损失率(95.20%),MC体系的菌数损失率降低了92%,为3.77%。其他体系的菌数损失率分别为12.11%(复合凝胶-2体系)、7.65%(HPMC体系)、12.78%(蛋清体系);相比于对照组(纯酶液)的酶活力损失率(8.89%),其他体系除蛋清体系的酶活力损失率均减小,分别为4.51%(复合凝胶-2体系)、1.20%(MC体系)和2.97%(HPMC体系)。在55 ℃条件下处理30 min后(图8b),对照组(纯菌液)的菌数损失率(98.81%)和复合凝胶-2体系的菌数损失率(97.99%)无显著差异,而热致凝胶进行二次包裹后可以降低菌数损失率(<0.05);相比于对照组(纯酶液)的酶活力损失率(25.91%),其他体系除蛋清体系的酶活力损失率均减小,分别为11.39%(复合凝胶-2体系)、2.41%(MC体系)和2.19%(HPMC体系)。在65 ℃条件下处理30 min(图8c)和80 ℃条件下处理1 min(图8d)后,其菌数损失率和酶活力损失率的整体变化趋势与55 ℃条件下处理30 min的变化趋势相同。

图8 不同处理后不同样品中L.plantarum和β-Gal的热稳定性Fig.8 Thermal stability of L.plantarum and β-Gal in different samples after different treatments
在不同处理条件下,蛋清体系的酶活力损失率总是接近100%,这可能是由于蛋清中的某种成分与-Gal发生了相互作用,从而破坏-Gal活性,导致其失活。实验结果表明,热致凝胶的二次包裹,可以提升和-Gal的热稳定性,其中MC的热稳定效果最佳。这可能是由于在加热条件下,MC形成的凝胶具有更加致密的网络状结构,起到隔绝温度的效果,减小和-Gal所处微环境的温度变化,从而提升其热稳定性。
2.5.2 热致凝胶的表征
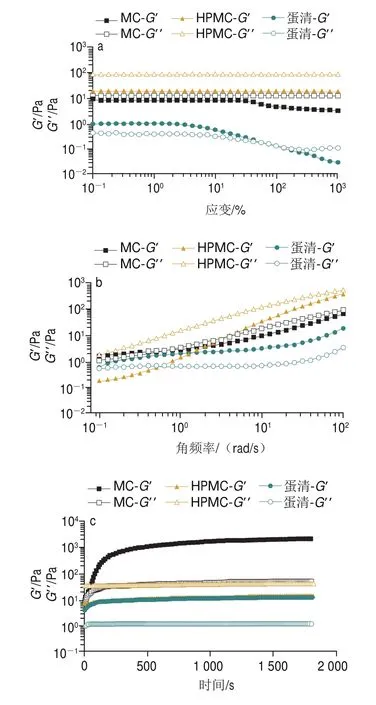
HPMC、MC和蛋清是3 种常见的热致凝胶。为了进一步探索热致凝胶提升体系热稳定性的机理,测定了热致凝胶的黏弹特性,其中2 个重要参数分别为储能模量(’)与损耗模量(”)。如图9a所示,当应变较小时,所有样品的’和”基本保持稳定,直至应变增大到一定程度,所有样品的’和”突然下降,这表明样品的结构发生破裂,由线性行为转变到非线性行为。如图9b所示,随着角频率的增加,所有样品的’和”值均呈增加趋势,说明所有样品都具有频率依赖性。图9c~f显示,在不同的温度下,MC的’在所有样品中最大,’值越大代表了较高的凝胶强度和相应更加致密空间网络状结构,该结果可以解释MC具有最佳热稳定效果的原因。在45 ℃,随着时间的延长,MC和蛋清”和’迅速增大,然后增速逐渐变缓,最终到达平台区,且’始终大于”,表明在MC和蛋清凝胶中,弹性行为占主导;而随着时间的延长,HPMC的”大于’,表现出黏性行为。在55 ℃和65 ℃,随着时间的延长,所有样品的’大于”,表明所有样品均具有弹性行为占主导的凝胶态特性。在80 ℃,随着时间的延长,MC和HPMC均从黏性行为占主导(”>’)转变为弹性行为(”<’)占主导的凝胶态特性。进一步解释,在加热条件下,MC、HPMC和蛋清形成凝胶状结构,内部结构更加紧凑,该结果与热稳定性结果一致。由图10可知,MC和HPMC凝胶均为空间网络状结构,蛋清表现为层状结构;且MC平均孔径小于HPMC,因此MC的空间网络状结构比HPMC的空间网络状结构更加致密。该结果与黏弹性的测试结果一致。
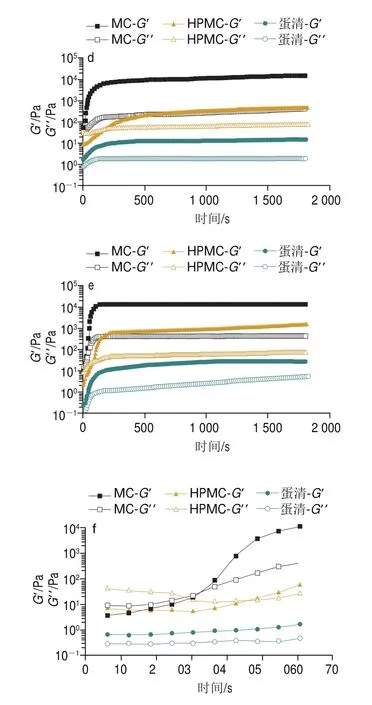
图9 不同样品的应变扫描(a)、频率扫描(b)和45、55、65、80 ℃应变扫描(c~f)Fig.9 Strain scan curves (a), frequency scan curves (b), and time scan curves (c, d, e, f) of different samples

图10 不同样品的SEM图像Fig.10 SEM images of different samples
3 结 论
开发了一种用于益生菌和-Gal共包埋、保护和递送的新型核壳结构载体,不仅可以实现益生菌和-Gal在胃肠道中持续和靶向释放,还可以同时增强益生菌和-Gal的贮存、冻干和热稳定性。研究发现,该体系中益生菌的负载量达到9.63h10CFU/g、酶活力保留率达到80.72%。值得注意的是,复合凝胶-2对和-Gal的缓释能力优于复合凝胶-0,其在模拟胃肠条件中600 min后活细胞数量约为10CFU/mL,酶活力保留率约为62%。相比于纯菌液和纯酶液,复合凝胶-2体系可以减少冻干后的菌数损失率和酶活力损失率(<0.05),分别减少84.94%和27.40%。复合凝胶-2体系可以降低4 ℃贮存条件下的菌数损失率(<0.05)和25 ℃贮存条件下的酶活力损失率(<0.05),提高该体系中和-Gal的贮存稳定性。此外,在Ca-Alg/CMP壳中,CMP引入可以改变体系对水的结合能力,促进凝胶形成更加致密的空间网络状结构;同时其可以提升壳层凝胶的pH值响应能力,进而调节包埋物质在SCG中的释放行为。最后利用MC的热致凝胶特性对核壳结构进行二次包埋,可以提高(<0.05)益生菌和-Gal的热稳定性,综上所述,本研究为食品工业中益生菌和酶制剂的共包埋、保护和输送提供了一种新的思路。进一步的研究可能集中在制剂的感官评价和口服功效的体内评价上。

