可同化氮源磷酸氢二铵对发酵型猕猴桃酒品质的影响
卢丽娟,钟 瑶,秦 义,*
(1.西北农林科技大学园艺学院,陕西 杨凌 712100;2.西北农林科技大学葡萄酒学院,陕西 杨凌 712100)
猕猴桃富含VC等营养物质,深受消费者喜爱。但是,近些年我国猕猴桃产量显著增加,新鲜猕猴桃逐渐出现季节性供过于求。同时,猕猴桃属于呼吸跃变型果实,不易保存且易腐烂,因此,有必要将其加工成如猕猴桃酒、猕猴桃汁、果酱和果脯等相关产品。随着我国果酒消费市场的兴起,猕猴桃酒也具有了良好的发展前景。但目前猕猴桃酒酿造技术还不成熟,猕猴桃酒还存在高级醇含量高、香气弱、酸度高等一系列影响果酒品质的问题,亟待解决。
以铵盐为代表的可同化氮是酵母生长代谢的重要营养因子,酵母在进行果酒发酵时所需要的可同化氮含量与酵母菌株、果汁含糖量、发酵条件等密切相关。对于葡萄酒发酵而言,所需可同化氮的最低质量浓度为140~150 mg/L,适宜可同化氮质量浓度为200~500 mg/L,超过500 mg/L则认为可同化氮含量过量。在包括葡萄酒在内的果酒酿造过程中,根据原料可同化氮水平,在恰当时间内适量补加可同化氮不仅可以保障乙醇发酵的正常进行,也有利于提高果酒发酵香气中的优良香气物质的合成,从而提高果酒品质。葡萄汁可同化氮素质量浓度在200~500 mg/L时,随着可同化氮含量增加,高级醇含量降低。在苹果酒、笃斯越橘果酒、桑葚果酒以及黄酒中,均发现适量的添加无机氮源,可以有效控制酒中的高级醇含量。此外,可同化氮与果酒发酵香气的作用关系比较复杂,包括短链脂肪酸、中链脂肪酸和其酯类等在内,许多挥发性成分含量受氮素种类和浓度的调控。比如,葡萄汁氮素与发酵香气中的乙酸乙酯含量正相关。
尽管可同化氮在葡萄酒上的研究较为详尽,但是可同化氮对发酵型猕猴桃酒品质影响的研究较少。目前对猕猴桃酒的研究主要都集中在猕猴桃品种选择、猕猴桃酿酒原料的前处理和酵母筛选与应用等。
本研究以陕西主栽品种‘徐香’猕猴桃为原料,以目前普遍选择且较为便宜的可同化氮源磷酸氢二铵(diammonium phosphate,DAP)为研究对象,系统研究补充DAP对猕猴桃酒发酵进程,以及对猕猴桃品质相关因素,如高级醇、甲醇、氨基酸、VC、总酚、香气物质等的影响,以期为高品质发酵型猕猴桃酒酿造提供氮源应用依据。
1 材料与方法
1.1 材料与试剂
‘徐香’猕猴桃,采自陕西省杨凌农业高新技术产业示范区,经过自然后熟软化后用于猕猴桃酒的酿造。猕猴桃初始含糖量118.0 g/L,总酸13.9 g/L(以酒石酸计),pH 3.26。
本土酿酒酵母LFN524活性干粉(酿酒酵母LFN524由西北农林科技大学葡萄酒学院刘延琳教授实验室保藏;酵母活性干粉由本课题组团队自制,质量符合GB 31639ü2016《食品加工用酵母》);果胶酶Lallzyme Ex 法国拉曼公司;DAP、葡萄糖、氢氧化钠、甘油、3,5-二硝基水杨酸、亚硫酸、抗坏血酸、福林-酚(均为分析纯) 国药集团化学试剂有限公司;Venusil AA氨基酸分析方法包 天津博纳艾杰尔科技有限公司。
1.2 仪器与设备
固相微萃取(solid-phase microextraction,SPME)装置(配有57330-U联用手柄、DVB/CAR/PDMS萃取纤维(50/30 μm,2 cm)) 美国Supelco公司;QP2020气相色谱-质谱联用仪、UV1800紫外分光光度计 日本岛津公司;1290高效液相色谱仪 美国Agilent公司;Y15全自动葡萄酒分析仪 西班牙BioSystems公司。
1.3 方法
1.3.1 猕猴桃酒发酵条件
发酵容器为1 L玻璃罐,装入700 mL猕猴桃汁,罐口用发酵栓密封。设置添加100、200、300、400 mg/L(氮质量计,下同)的DAP 4 个实验组和一个未添加DAP的对照组(0 mg/L),每组设置3 个平行发酵。
1.3.2 发酵工艺流程与操作要点
‘徐香’猕猴桃→打浆取汁→添加二氧化硫→添加果胶酶→成分调整→添加酵母→启动乙醇发酵→乙醇发酵监控→发酵结束→自然澄清。
原料处理:将自然软化的‘徐香’猕猴桃,去果皮,果肉称质量后投入榨汁机打浆;打浆后及时添加60 mg/L的二氧化硫防止氧化和有害微生物的增殖,静置1 h后添加20 mg/L果胶酶并酶解12 h。
成分调整:添加蔗糖至猕猴桃汁含糖量204 g/L;按照实验设计,除对照外,于不同发酵罐中分别添加100、200、300、400 mg/L的DAP。
添加酵母:活性酵母干粉添加量200 mg/L,利用1∶1的猕猴桃汁和水混合液于37 ℃进行活化,活化后导入发酵罐并搅拌均匀。
乙醇发酵:发酵温度为20 ℃,静置发酵,每隔12 h取样监测糖的消耗,当残糖质量浓度在48 h内不再变化时,乙醇发酵结束,并添加60 mg/L的二氧化硫。
1.3.3 理化指标的检测
残糖的检测采用3,5-二硝基水杨酸法;总酸、挥发酸、乙醇体积分数、甲醇、VC等测定参考GB/T 15038ü2006《葡萄酒果酒分析方法》;氨基酸按照Venusil AA氨基酸分析方法按照使用说明书进行检测;总酚采用福林-酚法测定。
甘油、氨态氮质量浓度和伯胺氮质量浓度,利用Y15全自动葡萄酒分析仪试剂盒测定,可同化氮质量浓度/(mg/L)=伯胺氮质量浓度+0.82氨态氮质量浓度。可同化氮(氨态氮)利用率为发酵结束时酒已利用可同化氮(氨态氮)含量与猕猴桃汁可同化氮(氨态氮)含量的比值。
柠檬酸的检测使用Aminex HPX-87H有机酸分析柱(300 mmh7.8 mm)。流动相为0.005 mol/L HSO溶液,流速0.6 mL/min,进样量5 μL,55 ℃柱温,检测波长为210 nm。配制质量浓度为0.2、0.4、0.6、0.8、1.0、1.2 g/L的柠檬酸标准品,经过0.22 μm有机膜过滤后进样,测定得到相应质量浓度的峰面积与出峰时间,以质量浓度为横坐标,峰面积为纵坐标绘制标准曲线。发酵液按照20~100稀释倍数进行稀释测定并计算。
1.3.4 香气物质分析
猕猴桃酒香气物质检测采用顶空SPME结合气相色谱-质谱联用法进行定量分析,与马娜等的方法相同。
SPME样品处理:取8 mL酒样和20 μL内标溶液(40 μg/L 2-辛醇)置于20 mL装有磁力搅拌子的顶空瓶中,加入2.0 g NaCl,启动搅拌子,在40 ℃水浴中平衡15 min,然后插入萃取纤维,在40 ℃吸附30 min后立即将萃取头在气相色谱进样口230 ℃热解吸5 min。
气相色谱-质谱条件:不分流进样,保持载气(氦气)恒定流速1.5 mL/min;柱升温程序为40 ℃保持5 min,以2 ℃/min上升至130℃,再以5 ℃/min升至220 ℃,保持10 min,总运行时间78 min;进样口温度230 ℃,连接杆温度220 ℃,离子源温度200 ℃,电子电离源,在70 eV质谱扫描范围/35~350。
定性定量分析:采用标准品保留时间对比、保留指数对比和NIST 2017质谱谱库查询进行香气化合物定性。采用内标-标准曲线法定量。通过香气标准品和2-辛醇的相对峰面积建立标准曲线,在0.99以上。将准确定性物质代入标准曲线计算获得定量结果。
1.4 数据分析
利用SPSS 18.0软件进行差异显著性分析,并利用Origin 2021软件进行数据绘图。
2 结果与分析
2.1 添加DAP对猕猴桃汁中糖和氮源利用的影响
添加不同质量浓度DAP,均可以加速猕猴桃酒起酵后48 h内的糖利用速度,特别是添加300 mg/L DAP时的糖消耗速度最快,这也反映了酵母代谢速度和发酵速度的加快(图1A)。伴随着发酵速度的加快,酵母细胞需要消耗更多氮源用于合成细胞代谢相关酶类,从而支撑快速的细胞代谢和增殖。图1B、C显示,添加DAP增加了猕猴桃汁可同化氮和氨态氮的利用率。未添加DAP时,氨态氮和可同化氮利用率分别为70.41%和74.85%,而在添加DAP 100、200、300、400 mg/L的条件下,氨态氮的利用率分别为94.50%、97.36%、97.73%和97.86%,可同化氮的利用率分别为80.92%、84.17%、84.00%和86.96%。与本研究结果类似,Chen Dai等在发酵荔枝酒时也发现了添加DAP促进可同化氮利用率增加的现象。
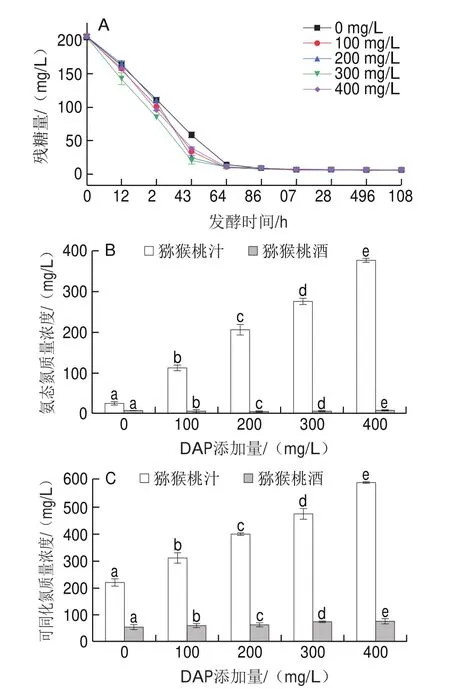
图1 添加DAP对猕猴桃果汁中的糖和氮源利用的影响Fig.1 Effect of DAP addition on the utilization of sugar and nitrogen in kiwifruit juice
2.2 DAP对猕猴桃酒基本理化指标的影响
由于猕猴桃酒酸度较高,以及随着乙醇发酵的进行而不断增高的乙醇体积分数,抑制了发酵末期的酵母代谢活性。因此,在猕猴桃酒的工业大生产中,通常会出现发酵不彻底的现象。本研究也发现,即使外源添加了可同化氮源,在猕猴桃酒发酵结束时,仍然有少量的糖残留。但同时也发现,随着DAP添加量的增加,糖的残留量有减少的趋势。此外,添加DAP对猕猴桃酒的乙醇体积分数没有显著影响。虽然添加DAP对猕猴桃酒中甘油产量也没有显著影响,但与对照相比,添加DAP后的猕猴桃酒中甘油含量略有增加(表1)。
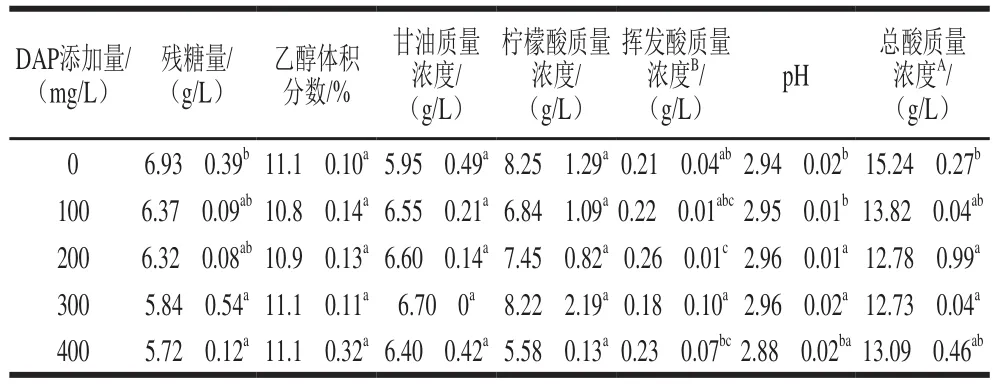
表1 猕猴桃酒发酵结束后的基本理化指标Table 1 Physicochemical parameters of fermented kiwifruit wine
与酸相关的猕猴桃酒理化指标如表1所示,柠檬酸作为猕猴桃酒中主要的有机酸之一,其含量不随DAP添加量的变化而显著改变;挥发酸是果酒质量的重要指标,总体来看,所有猕猴桃酒的挥发酸含量远低于我国食品工业协会颁布的T/CNFIA116ü2019《猕猴桃(果/米)酒》团体标准规定值(≤1.1 g/L)。其中,添加DAP 300 mg/L酒样的挥发酸质量浓度最低,为(0.18f0.1)g/L。类似的,Hernández-Orte等也发现在合成培养基中添加不同浓度的铵均会使挥发酸含量降低。对照组的总酸最高((15.24f0.27)g/L),DAP添加量200 mg/L和300 mg/L时的总酸含量相对较低,但是对于猕猴桃酒而言,所有酒样的总酸含量都偏高。虽然适当的酸含量可以支撑酒体,使酒的口感清爽醇厚,但酸含量过高却会使酒体失去平衡,口感过硬和尖锐。
2.3 添加DAP对猕猴桃酒中潜在有害醇类物质产量的影响
尽管高级醇和甲醇对猕猴桃酒的风味有贡献,但是甲醇和高级醇含量过高,以及摄入过量会对人体健康构成威胁,是果酒中潜在的有害醇类物质,因此,在酿造过程中对甲醇和高级醇含量进行调控,对提升果酒的品质和安全性具有重要意义。
2.3.1 猕猴桃酒中的甲醇产量
果酒在酿造过程中,由于水果的果胶分解和酵母甘氨酸代谢,极易产生一定量的甲醇。由图2可以看出,在猕猴桃汁中添加DAP均可以显著降低猕猴桃酒的甲醇含量,其中,添加DAP 300 mg/L时猕猴桃酒中的甲醇产量最低,为(345.53f14.48)mg/L,比对照组降低了20.1%(图2)。在本研究中,不同DAP处理之间的猕猴桃汁相同,因此甲醇含量降低的原因可能是由于外源添加的速效氮源影响了酵母的甘氨酸代谢。
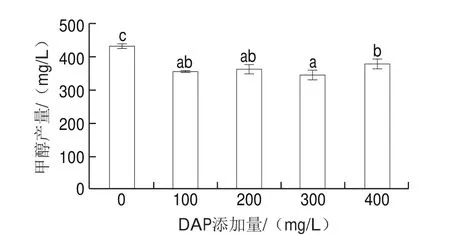
图2 添加DAP对猕猴桃酒中甲醇产量的影响Fig.2 Effect of DAP addition on the methanol yield in kiwifruit wine
目前,我国尚未出台猕猴桃酒国家标准,也没有对猕猴桃酒中甲醇含量作出规定,企业通常参照GB 15037ü2006《葡萄酒》标准执行。GB 15037ü2006规定,红葡萄酒中甲醇质量浓度不大于400 mg/L,白、桃红葡萄酒中甲醇质量浓度不大于250 mg/L。在2020年,浙江省品牌建设联合会发布了T/ZZB1557ü2020《猕猴桃酿造酒》团体标准,规定猕猴桃酒的甲醇质量浓度应不大于1.5 g/L。
2.3.2 猕猴桃酒中的高级醇产量
高级醇是酿酒酵母在果酒酿造过程中产生的主要代谢副产物之一。适量高级醇不仅带来醇甜的口感,还能与酒中的酸发生酯化反应生成酯类物质,从而对果酒风味形成起重要作用。但含量过高会给酒带来辛辣、腐臭等令人不愉快的味道,以及会引起饮用者神经系统充血和剧烈头痛(俗称“上头”)等不适感。尽管高级醇在猕猴桃酒中没有限量要求,但研究认为高级醇总量低于300 mg/L时,可增加葡萄酒香气的复杂性,而质量浓度超过400 mg/L,就会对酒的感官产生不良影响。
果酒中高级醇的产生与发酵基质中的可同化氮含量和种类、发酵温度、溶氧量等多种发酵环境和工艺条件有关。本研究用添加可同化氮DAP的方式调控猕猴桃酒的高级醇含量。在发酵结束后的猕猴桃酒中共检测到正丙醇、正丁醇、异丁醇、1-戊醇、异戊醇、3-甲基-1-戊醇、4-甲基-1-戊醇、正庚醇、正辛醇和苯甲醇10 种高级醇。其中,异戊醇、异丁醇和正丙醇含量相对较高,其他7 种高级醇含量较低。
不同DAP添加量发酵的猕猴桃酒中总高级醇产量具有显著差异(图3)。与对照组相比较,DAP 300 mg/L的总高级醇产量最低((226.47f16.62)mg/L),下降了42.84%,其中异戊醇和异丁醇分别降低41.38%和58.99%;添加DAP 100、200 mg/L和400 mg/L时,猕猴桃酒总高级醇含量分别下降15.94%、34.43%和38.00%。因此本研究结果表明,在发酵开始前添加适量DAP可以有效降低猕猴桃酒中的总高级醇产量。多个相关研究也显示,当发酵醪液中的可同化氮含量适宜时,酒中高级醇产量与发酵起始氮源浓度呈负相关。Torrea等向初始可同化氮为160 mg/L的葡萄汁中添加DAP和氨基酸混合物至480 mg/L,以及Vilanova等向初始可同化氮为250 mg/L的葡萄汁中添加DAP至450 mg/L,发酵结束后的酒中高级醇产量显著降低。
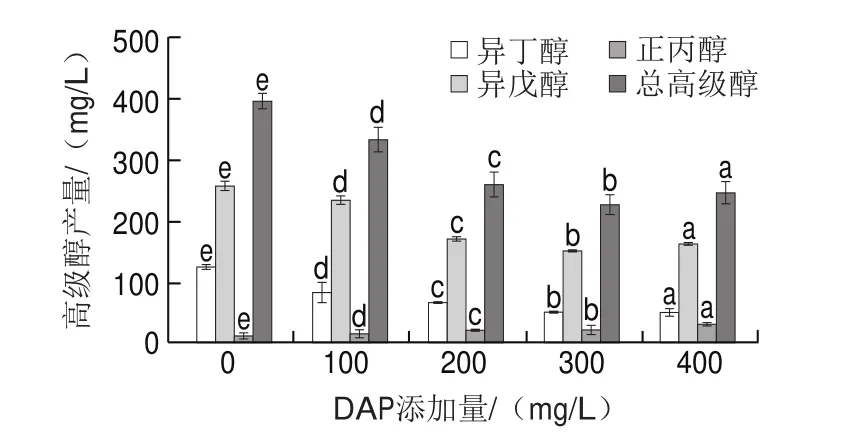
图3 添加DAP对猕猴桃酒中高级醇含量的影响Fig.3 Effect of DAP addition on the content of higher alcohols in kiwifruit wine
2.4 添加DAP对猕猴桃酒营养组分的影响
2.4.1 猕猴桃酒中的VC含量
本研究使用的‘徐香’猕猴桃,VC质量浓度高达546.72 mg/L。经过乙醇发酵后,对照组和添加DAP组的VC含量均降低,分别下降了27.91%、28.64%、32.75%、30.58%和32.27%,但是不同DAP添加水平和对照组之间的VC含量并没有显著差异(图4),这说明添加DAP并不会加速猕猴桃酒中VC显著降解。在猕猴桃加工成果酒、果汁、果脯、果干的过程中VC均会发生降解,但是猕猴桃酒能保留更多的VC。
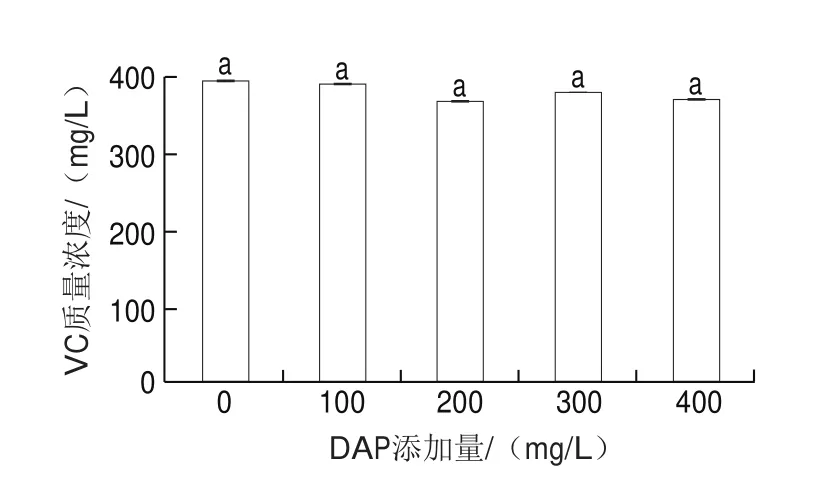
图4 添加DAP对猕猴桃酒VC含量的影响Fig.4 Effect of DAP addition on VC content in kiwifruit wine
2.4.2 猕猴桃酒中的总酚含量
酚类物质也是猕猴桃酒的重要营养物质之一。添加DAP 100、200 mg/L发酵的猕猴桃酒中总酚质量浓度相对较低,分别为(6.88f0.13)、(7.18f0.15)mg/L,而添加300 mg/L DAP时的总酚质量浓度最高((9.72f1.4)mg/L)。但是总体来看,DAP添加并没有极显著改变猕猴桃酒中的总酚含量(图5)。
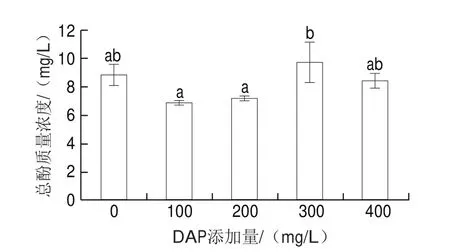
图5 添加DAP对猕猴桃酒总酚含量的影响Fig.5 Effect of DAP addition on total phenol content of kiwifruit wine
2.4.3 猕猴桃酒中的氨基酸含量
在猕猴桃酒中仅检测出了组氨酸、半胱氨酸、异亮氨酸、亮氨酸和脯氨酸5 种氨基酸(表2),其他氨基酸含量低于检出限。在被检出的5 种氨基酸中,组氨酸、脯氨酸、半胱氨酸和异亮氨酸含量相对较高,而亮氨酸含量较低。通常认为,当氨态氮和氨基酸共存在时,酵母通常会优先利用氨态氮,从而使得氨基酸残留量增加。但是本研究数据却显示,添加DAP提高了猕猴桃汁中的氨基酸利用率(表2)。针对上述现象,还需要通过对猕猴桃成分的细致分析,并利用组学技术等手段进行更深入的机制解析。
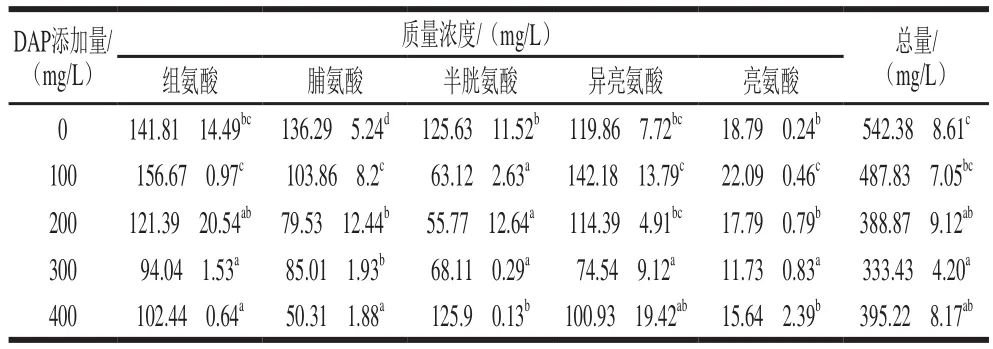
表2 添加DAP对猕猴桃酒中氨基酸含量的影响Table 2 Effect of DAP addition on the amino acid content of kiwifruit wine
2.5 添加DAP对猕猴桃酒香气物质的影响
利用气相色谱-质谱对不同添加量DAP发酵的猕猴桃酒香气物质进行检测,共检测到52 种香气物质(图6)。DAP的添加明显改变了猕猴桃酒的挥发物质含量,特别是添加DAP 300 mg/L和400 mg/L时。
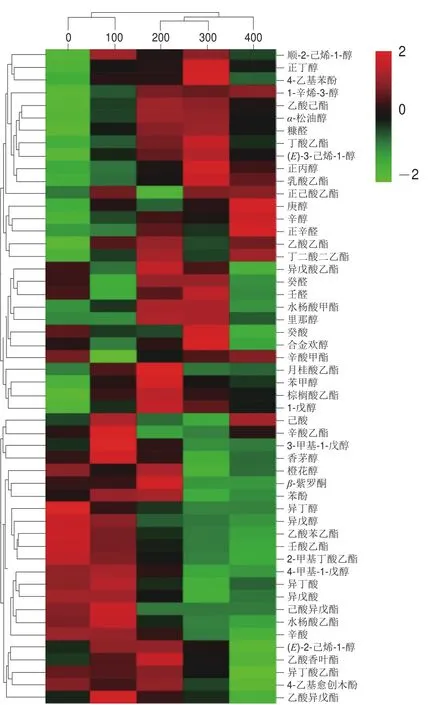
图6 猕猴桃酒香气物质聚类热图Fig.6 Cluster heat map of aroma substances in kiwifruit wine
在所检测到的52 种香气物质中,有9 种挥发性物质的含量超过其嗅觉阈值(OAV>1),8 种挥发性物质的OAV在0.1~1之间(表3)。如表3所示,添加DAP显著增加了乙酸酯类物质和乙酯类物质的含量,其中,乙酸乙酯含量增加显著,分别增加了45.2%、55.6%、49.6%和26.7%。添加100、300、400 mg/L DAP显著提高具有花香和果香特征的正己酸乙酯含量。但同时,DAP的添加显著降低了具有甜蜜香味特征的乙酸苯乙酯的含量,特别是当DAP添加量为300 mg/L时,乙酸苯乙酯含量降低了56.6%。此外,丁酸乙酯被认为是形成猕猴桃香气轮廓的重要物质,但是经过乙醇发酵后,猕猴桃酒中的丁酸乙酯含量较低,其OAV小于0.1。醛酮类物质的感官特征主要表现为柑橘、玫瑰、柠檬、花香等香味,其中辛醛和癸醛具有较低的嗅觉域值,被认为是猕猴桃的关键香气物质。在猕猴桃酒中共检测到4 种醛酮类化合物,并且当DAP添加量为300 mg/L时的醛酮类物质总量最高(94.69 μg/L),特别是正辛醛增加了209.2%。高级醇是果酒中重要的呈味物质和芳香物质,一般认为葡萄酒中高级醇低于300 mg/L时可使葡萄酒产生愉快的香味,一旦超过400 mg/L时就会使葡萄酒产生苦味和辛辣感,刺激味加重,使酒的香气变得粗糙。未添加DAP的猕猴桃酒高级醇接近400 mg/L,添加DAP显著降低了高级醇总量,以及异戊醇和异丁醇的含量,但同时,添加300 mg/L DAP时,庚醇和1-辛烯-3-醇的含量显著增加。赵玉等认为1-辛烯-3-醇是猕猴桃的关键香气组分,具有典型的蘑菇气味。正庚醇具有芳香气味、可可气味等,也被认为是苹果的重要组分。

表3 添加DAP对猕猴桃酒香气物质的影响(x s)Table 3 Effect of DAP addition on volatile compounds contents in kiwifruit wine (x± s)
为了进一步判别添加不同添加量DAP发酵的猕猴桃酒之间的香气成分差异,选用OAV高于0.1的17 种香气物质进行主成分分析(principal component analysis,PCA)(图7)。前两个PC解释了总方差的82.4%,分别为52.2%和30.2%。由图7可以看出,添加300 mg/L DAP的酒样位于PC1和PC2的正向端,周围发酵香气物质丰富,与庚醇、正己酸乙酯、乙酸乙酯和乙酸己酯等靠近,说明在发酵起始阶段添加DAP 300 mg/L有助于猕猴桃酒发酵香气的提升。而对照组酒样位于PC1和PC2的负向端,主要与异戊醇、异丁醇等高级醇和品种香气物质乙酸苯乙酯靠近。

图7 前两个PC处理酒样的活性香气物质(OAV>0.1)的载荷及样品分布图Fig.7 PCA loading plot of PC1 versus PC2 for volatile substances(OAV > 0.1) in kiwifruit wine and distribution of kiwifruit wine samples
整体看,添加DAP 100 mg/L发酵的猕猴桃酒脂肪酸含量偏高,会带来轻微的酸腐味;DAP 200、400 mg/L发酵的猕猴桃酒主要呈现玫瑰和木香香气;DAP 300 mg/L发酵的猕猴桃酒中酯类含量较高,高级醇产量低,脂肪酸含量相对较低,果香和花香较为浓郁。
3 结 论
在猕猴桃酒乙醇发酵前,向猕猴桃汁中添加适量可同化氮源DAP,有利于猕猴桃酒品质的提升。
添加DAP增加了猕猴桃汁中可同化氮和氨态氮的利用率,加快了猕猴桃酒的乙醇发酵速度。乙醇发酵前补加300 mg/L DAP使猕猴桃酒挥发酸质量浓度降低到(0.18f0.1)g/L。同样,添加DAP可以显著降低猕猴桃酒中高级醇和甲醇等潜在有害醇类物质产量,其中,DAP 300 mg/L时的总高级醇产量下降了42.84%,甲醇产量降低了20.1%。而对于猕猴桃酒中的部分营养物质而言,补加DAP没有显著改变猕猴桃酒中的VC和总酚含量,但是却显著降低了猕猴桃酒中的氨基酸总量。
DAP的添加明显改变了猕猴桃酒的挥发性物质含量。在猕猴桃酒香气物质中,乙酸乙酯、乙酸异戊酯、乙酸苯乙酯、正己酸乙酯、1-戊醇、异戊醇、庚醇、正辛醛和壬醛9 种香气物质含量超过嗅觉阈值(OAV>1)。其中,当DAP添加量为300 mg/L可以显著增加乙酸乙酯、正己酸乙酯、正辛醛、庚醇和1-辛烯-3-醇等香气物质含量,从而使猕猴桃酒果香和花香较为浓郁。
综上,在猕猴桃酒发酵前添加适量的可同化氮源DAP,可以有效降低高级醇和甲醇等潜在有害醇类物质产量,同时增加猕猴桃酒的香气物质含量,从而有利于猕猴桃酒的品质提升。

