人类胚胎期和成年期巨核细胞的分子特征比较
李敏敏, 夏美娟, 赵晶晶, 陈肖源, 刘翠翠, 苏培, 王洪涛, 周家喜
中国医学科学院血液病医院(中国医学科学院血液学研究所),北京协和医学院,实验血液学国家重点实验室;国家血液系统疾病临床医学研究中心;细胞生态海河实验室,天津 300020
巨核细胞是一类体积大、数量少的造血细胞,其经典功能是产生血小板,参与机体的止凝血过程[1-2]。与红细胞和巨噬细胞一样,巨核细胞存在于哺乳动物多个发育位点,包括胚胎期的卵黄囊(yolk sac,YS)和胎肝(fetal liver,FL)以及成年期的骨髓(bone marrow,BM)等[3-4]。与成年期相比,胚胎期的巨核细胞呈现出体积小、多倍体化程度低等特点[5]。研究发现,人卵黄囊和胎肝巨核细胞以2倍体和4倍体为主,而成年骨髓巨核细胞则以16倍体为主,提示骨髓巨核细胞血小板生成能力更高[5-6]。然而,由于人类样本的稀缺性及研究手段的缺乏,目前对于不同发育时期原代巨核细胞产板能力的差异尚不明确。
体外巨核细胞分化体系为评估不同来源巨核细胞的差异提供了很好的研究模型。Bluteau等[7]利用人胚胎期干细胞、胎肝、脐带血和成年期骨髓来源的CD34+造血干祖细胞体外诱导分化产生巨核细胞,结果发现,与其他来源的巨核细胞相比,骨髓造血干祖细胞分化产生的巨核细胞产板能力更高;同时对体外不同来源的巨核细胞进行转录组分析发现,不同来源的巨核细胞在转录组分子特征方面存在显著差异。然而,目前对于人类发育不同阶段原代巨核细胞分子特征的差异仍未明确。
近期,有研究者突破了原代巨核细胞分离的技术瓶颈,利用单细胞转录组测序技术分别解析了人类胚胎期卵黄囊、胎肝和成年期骨髓巨核细胞的分子特征[5-6]。本研究在此基础上对不同发育时期巨核细胞之间的相似性和差异性进行对比分析,并探究了转录调控网络的差异,以期为深入了解巨核细胞的发育特征提供理论依据。
1 材料与方法
1.1 数据来源
Wang等[5]对人胚胎期(孕4~9周)YS和FL的巨核细胞进行了Smart-seq2单细胞转录组测序,数据发表于 GEO(gene expression omnibus)数据库,检索号为GSE144024;Liu等[6]对人成年期BM巨核细胞进行了Smart-seq2单细胞转录组测序,数据发表于NODE(national omics data encyclopedia)数据库,检索号为OEP001150。本研究基于以上数据(表1)展开进一步分析。

表1 数据来源信息Table 1 Data source information
1.2 相关性分析
利用Scanpy包的Scanpy.tl.paga函数计算不同来源巨核细胞的相似性,并用Scanpy.pl.paga函数进行了可视化。
1.3 差异基因(differential expression gene,DEG)鉴定及可视化
利用 Seurat包(3.1.5)[8]的 FindAllMarkers函数计算不同组织来源的巨核细胞差异表达基因,参数设置为“only.pos=TRUE,min.pct=0.25,logfc.threshold=0.25”。矫正后以P≤0.01为差异表达基因。利用Seurat包的DoHeatmap功能对差异表达基因进行可视化。
1.4 GO(gene ontology)富集分析
利用R包clusterProfiler[9](3.16.0)各组织来源的巨核细胞差异表达基因进行GO富集分析,对具有代表性的GO条目进行展示。
1.5 基因集富集分析(gene set enrichment analysis,GSEA)
利 用 GSEA[10](http://software.broadinstitute.org/gsea/index.jsp)软件对不同组织来源的巨核细胞进行基因集富集分析和可视化,并以从GSEA下载的小鼠GSEA基因集(msigdb.v7.4.symbols.gmt)作为基因集数据库。
1.6 基因集评分分析
利用Seurat包中的AddModuleScore函数对单个细胞的基因集所有基因的表达进行评分,这些基因集代表了不同的生物学功能。用Wilcox检验对不同组织来源的巨核细胞差异进行显著性检验。
1.7 基因调控网络分析
单细胞基因调控网络推断与聚类(single-cell regulatory network inference and clustering,SCE-NIC)是一个可以计算转录因子及其潜在靶基因共表达和模体分析,并进行基因调控网络重建以及细胞状态鉴定的方法[11]。利用pySCENIC包(0.9.11)对不同组织来源的巨核细胞转录子(转录因子和靶基因)及其活性进行计算,用Pheatmap进行可视化。利用Cytoscape软件对不同组织来源的巨核细胞活性排名前20的转录因子调控网络进行可视化。
2 结果与分析
2.1 人胚胎期和成年期巨核细胞转录组水平相似性分析
为研究胚胎期和成年期巨核细胞在转录组水平的差异,对人胚胎期YS和FL以及成年期BM的巨核细胞单细胞转录组测序数据进行了分析[5-6],如图1所示,共计1 358个细胞,包括胚胎期和成年期两个发育时期;为从整体层面了解3个不同组织来源的巨核细胞转录组相似性,进行了基于分区的图抽象(partition-based graph abstraction,PAGA)相关性分析。结果显示,胚胎期YS和FL来源的巨核细胞间的转录组相似性较高,但与成年期BM来源巨核细胞的差异均较大,YS与FL来源的巨核细胞转录组水平更相似。以上结果提示,人胚胎期和成年期的巨核细胞转录组水平具有明显差异。

图1 人YS、FL和BM来源的巨核细胞转录组水平PAGA图Fig.1 Transcriptome-level PAGA picture of human YS,FL,and BM-derived megakaryocytes
2.2 人胚胎期和成年期巨核细胞分子特征的差异分析
为进一步研究人胚胎期和成年期巨核细胞分子特征的差异,对YS、FL和BM来源的巨核细胞进行了DEG分析。基因表达热图显示,YS来源的巨核细胞显著高表达1 269个基因,FL来源的巨核细胞显著高表达1 599个基因,而BM来源的巨核细胞显著高表达715个基因(图2A)。结果表明,YS和FL来源的巨核细胞的差异基因表达水平更相近。为明确差异表达基因的生物学意义,对YS、FL和BM来源的巨核细胞差异表达的基因进行了GO富集分析,发现YS来源的巨核细胞富集了有丝分裂细胞周期和细胞低氧应答的生物过程,FL来源的巨核细胞富集了细胞周期和蛋白定位的生物过程,而BM来源的巨核细胞富集了止凝血相关的生物过程(图2B)。与成年期相比,胚胎期两个组织的巨核细胞均富集了DNA复制的生物过程,而成年期巨核细胞相比胚胎期的两个组织富集了血小板聚集的生物过程(图2C~D)。胚胎期(YS和FL)巨核细胞高表达编码增殖标记分子结合核仁磷蛋白(MKI67)、增殖细胞核抗原(PCNA)和微染色体支持蛋白5(MCM5)等细胞周期相关蛋白[12],而成年期(BM)巨核细胞高表达肌球蛋白重链9(MYH9)、微管蛋白β1Ⅵ类(TUBB1)以及人血管性血友病因子(VWF)等血小板生成相关基因[13](图2E)。胚胎期(YS和FL)的巨核细胞细胞周期评分高于成年期(BM),而成年期巨核细胞的血小板生成评分高于胚胎期(图2F)。以上结果说明胚胎期巨核细胞的增殖特征较强,而成年期巨核细胞血小板生成特征较强。

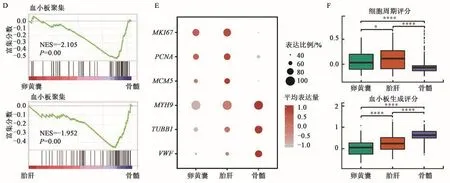
图2 人胚胎期和成年期巨核细胞分子特征的差异分析Fig.2 Differential analysis of molecular characteristics of human embryonic and adult megakaryocytes
2.3 人胚胎期和成年期巨核细胞表达的关键转录因子分析
转录水平的调控是基因表达调控的重要环节,并且与多种疾病和表型相关,转录因子是调控巨核细胞功能的重要组成部分。为在转录因子调控层面了解胚胎期和成年期巨核细胞的差异,本研究运用SCENIC包进行了转录因子调控网络分析。结果显示YS来源的巨核细胞和细胞增殖(ELF3)[14]相关的转录子活性较高,FL来源的巨核细胞的细胞增殖相关的转录因子(E2F1、SOX4)[15]活性较高,而BM来源的巨核细胞分化成熟(NFIB、FLI1、MAX、TAL1)[16]相关的转录子活性较高(图3A~B)。基因表达也证实了以上结论,即胚胎期巨核细胞相对高表达细胞增殖相关的SOX4转录因子,而BM来源的巨核细胞相对高表达巨核细胞分化成熟相关的MAX转录因子(图3C)。上述结果进一步表明,胚胎期和成年期巨核细胞分别具有与细胞周期和血小板产生相关的关键转录因子。
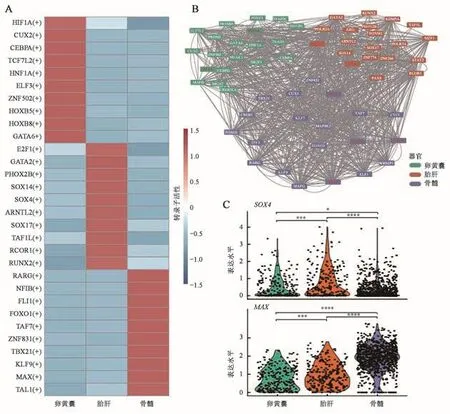
图3 人胚胎期和成年期巨核细胞的关键转录因子Fig.3 The bey transcription factors of megakaryocytes in human embryonic stage and adult stage
2.4 人胚胎期和成年期巨核细胞免疫亚群特征分析
本研究提取了人胚胎期smart-seq2测序获得的巨核细胞免疫亚群(MK6亚群)[5]和成年期的巨核细胞免疫亚群(hBM-MK5)进行差异分析[6]。差异基因分析结果表明,胚胎期的巨核细胞免疫亚群高表达MAF、MRC1等巨噬细胞标志基因,而成年期巨核细胞免疫亚群高表达S100A8、LCN2等中性粒细胞标志基因(图4),提示不同时期巨核细胞免疫亚群的免疫特性可能存在差异。
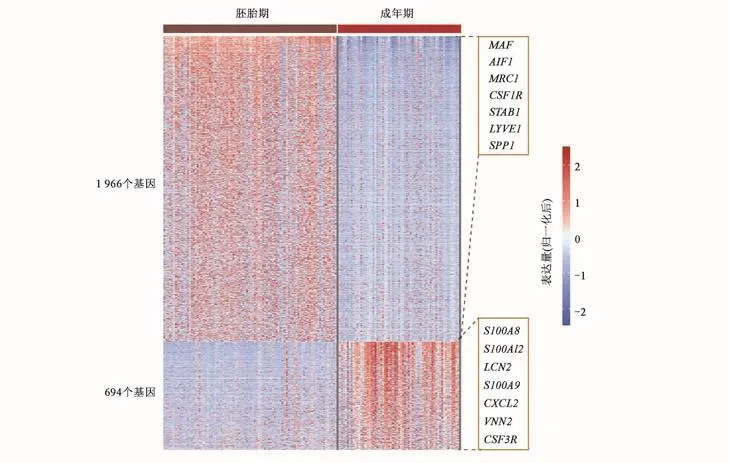
图4 人胚胎期和成年期巨核细胞免疫亚群特征Fig.4 The characteristics of immune subsets megakaryocyte in human embryo stage and adult stage
3 讨论
体外分化研究表明,与人胎肝来源的巨核细胞相比,骨髓来源的巨核细胞具有更高的产板能力[7,17]。受限于样本的稀缺性、巨核细胞的稀少性及技术的局限性,目前对于不同发育时期原代巨核细胞产板能力差异的分子机制尚不清楚。本研究发现,与胚胎期巨核细胞相比,成年期巨核细胞高表达MYH9、TUBB1及VWF等血小板产生相关基因,且富集NFIB、FLI1、MAX、TAL1等调控巨核细胞成熟和血小板生成的转录因子,表明成年期巨核细胞具有更高的产板潜能。大量研究表明,成年期的原代巨核细胞比胚胎期多倍体特性更高,且巨核细胞的多倍体程度与产板能力呈正相关关系[5-6,18]。同时与成年期巨核细胞相比,胚胎期巨核细胞高表达MKI67、PCNA、MCM5等细胞周期相关的基因,且富集E2F1、SOX4等调控细胞增殖的转录因子,表明胚胎期巨核细胞具有更高的增殖能力。结果提示与成年期稳态造血情况下巨核细胞主要由造血干祖细胞分化产生不同,胚胎期巨核细胞可能主要来源于自我扩增,从而满足个体发育对其数量的需求。
Pariser等[19]研究认为,肺脏中的巨核细胞体积小于骨髓巨核细胞,多倍体化程度低于骨髓巨核细胞,提示肺脏巨核细胞的血小板生产能力可能低于骨髓巨核细胞;同时该研究还发现,肺脏中的巨核细胞具有与DC细胞相似的基因表达谱,高表达MHCⅡ类分子和CD11c等基因。本研究发现卵黄囊和胎肝的巨核细胞免疫亚群高表达MAF、MRC1等巨噬细胞标志基因,而骨髓巨核细胞免疫亚群相对高表达S100A8、LCN2等中性粒细胞标志基因。结果提示巨核细胞的产板特性和免疫特征可能均受到微环境的调控。
体外再生血小板作为解决临床血小板短缺的有效手段。人多能干细胞由于具有自我更新能力和多向分化潜能,是血小板再生的重要种子细胞[20]。人多能干细胞生成血小板主要经历造血干祖细胞、高增殖特性的巨核祖细胞、高产板特性的成熟巨核细胞几个阶段,鉴定调控每个阶段细胞产生的核心调控因子对于建立体外高效生成血小板的体系至关重要[21]。通过鉴定系列调控巨核细胞增殖特性和产板特性潜在的转录因子,并对这些转录因子进一步研究与验证,有望显著提高巨核祖细胞和成熟巨核细胞的产生效率,为建立体外高效生成血小板体系奠定理论基础。

