T淋巴细胞亚群CD4+比例标准物质的研制
李妍, 杨镇州, 梁文
上海市计量测试技术研究院化学与电离辐射所,国家市场监管重点实验室(生物分析计量溯源),上海 201203
流式细胞技术(flow cytometry,FCM)是通过流式细胞仪实现的一种单细胞定量分析以及分选技术,属于综合性技术,临床中称作流式细胞分析,主要通过对流式细胞仪的应用,对悬浮细胞进行测量,并根据对计算机、流体力学、电子等生物技术学科的应用对细胞进行分析[1]。流式细胞技术逐渐被应用于诸多领域的检验,如细胞生物检验、肿瘤检验、血液检验等[2-4]。
目前,临床检验过程中已经将流式细胞技术作为机体免疫状况评价的主要检测技术,检验指标以T淋巴细胞、B淋巴细胞及自然杀伤淋巴细胞的水平为主,此外,CD4+T细胞的减少常见于恶性肿瘤,且其是遗传性免疫缺陷症、艾滋病、霍奇金淋巴瘤等的重要特征[5-7]。WS/T 360-2011《流式细胞术检测外周血淋巴细胞亚群指南》[8]中要求实验室开展室内质量控制工作,对于特殊实验,如艾滋病CD4+T细胞计数,至少每周进行一次质控检测。目前市场上销售的流式细胞仪产品种类繁多,已有JJF 1665-2017《流式细胞仪校准规范》[9]、YY/T 0588-2017《流式细胞仪》[10]两项针对流式细胞仪进行性能评价的标准或规范,其中在检测校准仪器的示值误差和重复性时需要用到细胞标准物质。目前国内外用于流式细胞仪校准用的细胞有证标准物质(certified reference materials,CRM)研制较少,可检索到的仅有中国计量科学研究院研制的淋巴细胞CD4+细胞占总淋巴细胞计数比例标准物质(GBW(E)090938),标准值为49.4%,不确定度4.8%。由于常用的细胞质控品保存条件苛刻,有效期短,国内的淋巴细胞有证标准物质稀少。本文采用磁珠纯化方法获得T淋巴细胞,并将纯化后的细胞分装于西林瓶中冷冻干燥,制备一批T淋巴细胞CD4+比例标准物质候选物。同时,联合8家检测实验室对标准物质候选物协同定值,检测标准物质的均匀性和储存稳定性,以期为CD4+T细胞的检测提供精准的标准物质。
1 材料与方法
1.1 仪器与试剂
流式细胞仪(美国BD公司);低温离心机(德国Eppendorf公司);离心机(中国卢湘仪公司);超低温冰箱(美国Thermo Fisher Scientific公司);1×PBS pH7.2(Gibco公司);CD4-FITC抗体(Beckman Coulter公司);CD4-PE/CD3-FITC/CD45-Per-CP混合抗体(BD公司);人总T细胞分选试剂盒(Miltenyibiotec公司)。
1.2 方法
1.2.1 标准物质的制备和纯度验证 首先将人工制备的T淋巴细胞进行磁珠分选纯化,将2.5×108个外周血单个核细胞(peripheral blood mononuclear cell,PBMC)重悬后按照人总T细胞分选试剂盒说明书进行分选纯化。将收集到的纯化后细胞用流式细胞术进行纯度验证。样品中加入CD-PE/CD3-FITC/CD45-PerCP混合抗体染色后上机流式细胞仪进行检测,门内至少收集10 000个细胞。然后分装制备一批T淋巴细胞亚群CD4+比例标准物质候选物,共计200瓶,每瓶200µL。
1.2.2 标准物质的均匀性检验 按照文件JJF1006-1994《一级标准物质技术规范》[11]中标准物质的均匀性考察的单元样品抽取原则,T淋巴细胞亚群CD4+比例标准物质候选物制备单元为200瓶,本项目随机抽取15瓶进行检测,每瓶样品重复检测3次,共15组45个数据,采用单因素方差分析法(F检验)检验均匀性。
1.2.3 标准物质的稳定性考察方法 为了评估标准物质样品在运输过程中是否需要特殊条件,要对不同温度下放置不同时间后的样品进行短期稳定性统计评估。实验模拟样品在运输中可能遇到的条件,将制备的T淋巴细胞亚群CD4+比例标准物质候选物放置在20℃(模拟室温)、4℃(模拟冰袋)和-20℃(模拟干冰)条件下,在0、1、3、5、7、10、15天随机选取3个单元进行检验,每个单元重复测3次(N=3,n=3),以平均值作为检测结果。为了评估样品在客户端的储存条件和使用有效期,将制备的T淋巴细胞亚群CD4+比例标准物质候选物放置在-20℃冰箱储存,分别在样品第0、1、2、3、4、5、6、9、12个月对制备的标准物质进行长期稳定性考察,每个时间点随机选取3个单元进行检验,每个单元重复测3次(N=3,n=3),以平均值作为检测结果。根据T淋巴细胞亚群CD4+比例标准物质在不同温度下其CD4+细胞比例随时间的变化描绘出CD4+百分比Y与保存时间X的关系,拟合成的直线通过公式(1)计算直线斜率b1,通过公式(2)计算直线的斜率b1不确定度s(b1)。
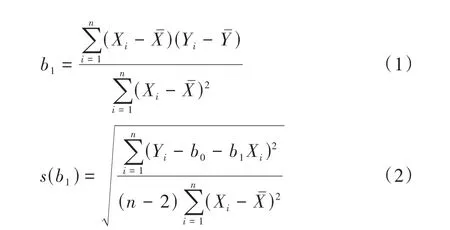
1.2.4 标准物质定值 采用流式细胞微球计数法进行定值。取100µL处理好的细胞样品和100µL标物微球均匀混合,然后上机检测,圈门得到获取微球数、获取CD4+细胞数及获取总淋巴细胞数,根据荧光微球标准物质的标准个数和样品体积计算出微球数,并根据公式(3)计算出CD4+细胞的绝对个数,并用公式(4)计算出淋巴细胞个数。
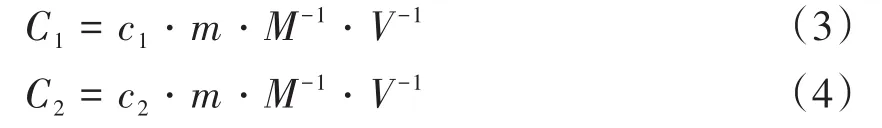
式中,C1表示CD4+细胞个数;c1表示获取CD4+细胞数;C2表示淋巴细胞个数;c2表示获取淋巴细胞数;m表示获取微球数;M表示标准微球数;V表示样品体积。因此,淋巴细胞样品中CD4+细胞个数的百分比见公式(5)。

通过将已知个数的微球标准物质作为计数淋巴细胞的参比,流式细胞仪检测的CD4+细胞的个数和其比例的检测结果可以得到很好的量值溯源。本文按照JJF 1343-2012《标准物质定值的通用原则及统计学原理》[12]的文件要求,联合8家实验室进行T淋巴细胞CD4+比例标准物质候选物的定值。通过将已知个数的微球标准物质作为计数淋巴细胞的参比,采用流式细胞仪检测CD4+细胞比例的结果可以得到很好的量值溯源。
1.2.5 不确定度评定 T淋巴细胞亚群CD4+比例标准物质的不确定度组成包括:不均匀性引起的不确定度和标准物质的特性量值在长期稳定性内的变化性引起的不确定度和特性量值的定值过程引起的不确定度。①均匀性引入的不确定度。均匀性分析结果表明,T淋巴细胞亚群CD4+比例标准物质的瓶间差异极小,均匀性引入的不确定度见公式(6)。

②稳定性引入的不确定度。在12个月的稳定性检测中,有效期t=12月长期稳定性引起的不确定度见公式(7)。

③定值过程引入的不确定度。标准物质定值过程引入的不确定度包括:数据统计引入的不确定度和通过对定值方法中测量影响因素进行分析评定的不确定度。T淋巴细胞CD4+比例标准物质由数据统计引入的不确定度为由8组测量结果计算的A类不确定度。合成A类标准不确定度见公式(8)。

通过对测量过程的分析,以非统计分析的方法评定合成B类标准不确定度,定值方法的数学模型见公式(5)。
式中,c1表示获取CD4+细胞数;m表示获取微球数;M表示标准微球数;V表示样品体积;c2表示获取淋巴细胞数。则由此得到的相对标准不确定度传播率公式(9)。
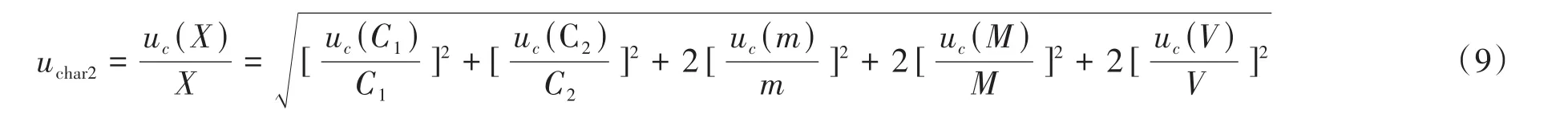
其中CD4+细胞占淋巴细胞比例X的标准不确定度用uc(X)表示,CD4+细胞获取个数的不确定度为uc(C1);淋巴细胞获取个数的不确定度为uc(C2);微球获取个数的不确定度为uc(m);微球标准物质引入的不确定度为uc(M);样品体积引入的不确定度为uc(V)。
④相对扩展不确定度。标准物质的合成相对标准不确定度见公式(10)。
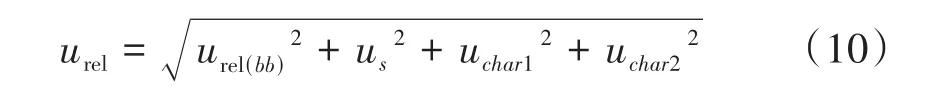
按惯例,若取包含因子k=2(95%的置信区间),则标准物质的相对扩展不确定度见公式(11)。

2 结果与分析
2.1 纯度验证
纯化后的细胞样品浓度减少为10%,去除了90%的非目标杂质细胞,细胞样品中FITC-CD4+比例增加2.6倍。纯化后的细胞样品经过多色流式细胞检测(图1)后确认其T淋巴细胞纯度为99.7%。
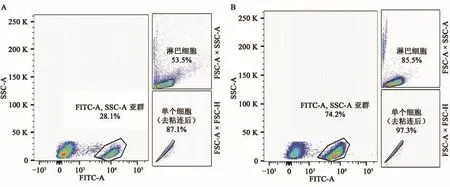
图1 细胞分选纯化前后的流式细胞检测散点图Fig.1 Flow cytometry scatter plot before and after cell sorting and purification
2.2 均匀性考察
本文采用方差分析法对T淋巴细胞亚群CD4+比例标准物质候选物进行均匀性评价。在研制的200瓶标准物质候选物中随机抽取15个样本,不改变测量条件,将测得的数据用方差分析法检验,检测的数据组间方差和组内方差没有显著性差异。统计结果符合JJF1006-1994《一级标准物质技术规范》[11]中对标准物质的均匀检验合格要求,证明研制的T淋巴细胞亚群CD4+比例标准物质是均匀的。
2.3 稳定性考察
依据公式(1)(2),采用线性模型作为该标准物质的经验模型进行短期稳定性评价,本文研制的淋巴细胞标准物质在4℃和-20℃下保存10 d是稳定的。综合上述,我们规定运输条件为:使用冰袋,全程保证冷链运输,运输时间不超过10 d。
依据公式(1)(2),采用线性模型作为该标准物质的经验模型进行长期稳定性评价,标准物质的长期稳定性结果统计(表1)表明,淋巴细胞标准物质在12个月内-20℃的保存条件下稳定,然而在4℃保存3个月后的标准物质CD4+百分比检测结果SD变大,且流式细胞仪检测散点图显示CD4+和阴性信号区分度变差(图2),说明样品表面的抗原不稳定。因此,我们规定标准物质的长期储存条件为-20℃冷冻储存。
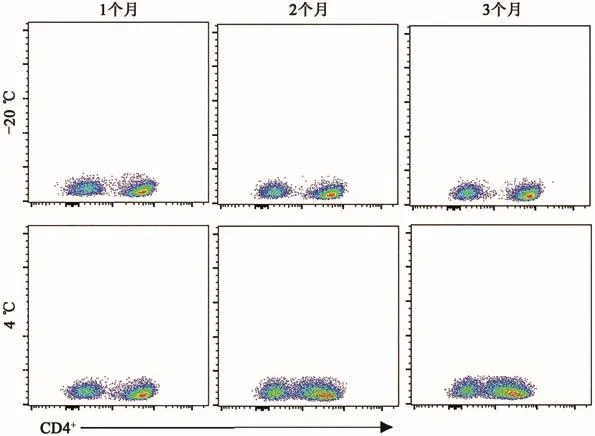
图2 标准物质在-20℃和4℃温度下保存3个月的流式细胞仪检测结果Fig.2 Flow cytometry results of standard materials stored at-20℃and 4℃for 3 months
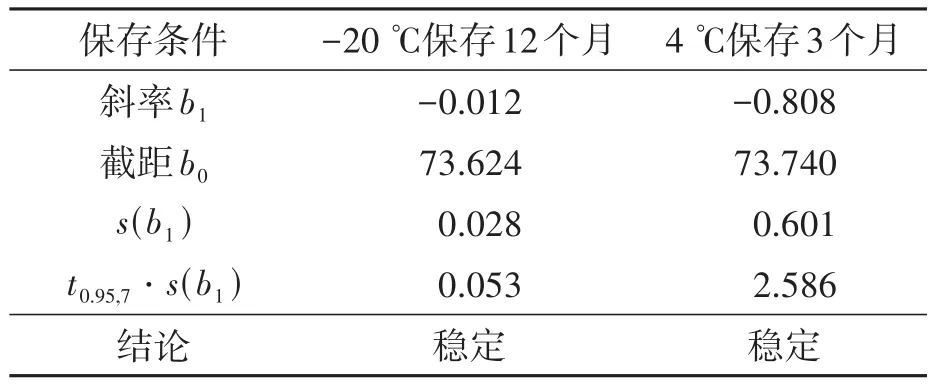
表1 标准物质的长期稳定性统计结果Table 1 Long-term stability test results of reference materials
2.4 联合定值
标准物质中CD4+占总淋巴细胞的比例,量值单位是百分比(%)。通过将已知个数的微球标准物质作为计数淋巴细胞的参比,确保流式细胞仪检测的CD4+细胞占总淋巴细胞的比例的检测结果准确。本研究选择了8家实验室,参与定值的实验室均通过了由定值负责实验室组织的盲样考核。每个单位分别随机抽取4瓶标准物质,每瓶样品平行测定2次,进行定值分析。
依据JJF1343-2012《标准样品定值的通用原则及统计学原理》[12],T淋巴细胞亚群CD4+比例标准物质候选物采用8家实验室联合定值的方法。汇总全部原始数据(表2),对所有数据按如下程序处理:利用格拉布斯(Grubbs)法和狄克逊(Dixon)法判断各组内数据无可疑值,利用柯克伦(Cochran)法判断这8组数据等精度;利用狄克逊(Dixon)法对每组数据的平均值进行检验,无统计学差异。然后求出所有数据的平均值即为标准物质的特性量值,为74.0%。

表2 标准物质的8家单位定值数据Table 2 Quantified test results of reference materials by 8 laboratories
2.5 不确定度评定
T淋巴细胞亚群CD4+比例标准物质的不确定度组成包括:不均匀性引起的不确定度和标准物质的特性量值在长期稳定性内的变化性引起的不确定度和特性量值的定值过程引起的不确定度。各项不确定度的具体数据见表3。标准物质的合成相对标准不确定度urel=0.045,则标准物质的相对扩展不确定度uCRM=k·urel=2×0.045=0.09。标准物质的标准值为CD4+细胞比例C=74.0%,则其扩展不确定度为U=uCRM·C=0.09×74.0%=6.7%。

表3 标准物质的不确定度分量Table.3 Uncertainty component of reference materials
3 讨论
目前,WS/T 360-2011《流式细胞术检测外周血淋巴细胞亚群指南》[8]中要求实验室开展室内质量控制工作,采用的细胞质控品是全血质控品,由于质控品的储藏条件苛刻且处理方法复杂,特性量值无法有效溯源,不适用于仪器计量校准。本研究分析了T淋巴细胞亚群CD4+比例标准物质的研制方法,采用流式细胞微球计数法多家实验室合作定值,量值可靠,准确性和均匀性良好。本文研制的T淋巴细胞亚群CD4+比例标准物质在规定时间内保存在-20℃无明显的上升或下降趋势,然而在4℃保存3个月后的标准物质CD4+百分比检测结果SD变大,且流式细胞仪检测散点图显示CD4+和阴性信号区分度变差,说明样品表面的抗原不稳定,不适宜在4℃长期保存。因此,本文研制的标准物质可以稳定保存12个月。标准物质候选物由8家实验室进行流式细胞微球计数法协同定值,并经过不确定度评估,研制的T淋巴细胞亚群CD4+比例标准物质中CD4+细胞比例的量值为74.0%±6.7%(k=2)。该项目的成果可以适用于流式细胞仪的计量校准,以及流式细胞术检测过程的方法验证和检测结果的质量控制,提高流式细胞检测结果的可靠性和准确性。

