RGS12蛋白通过负向调节MAPK信号通路抑制脑胶质瘤转归的研究进展
李 媛,魏 静,谢 敏,应小平
脑胶质瘤(Glioma)是常见的原发于中枢神经系统的高度异质性肿瘤,起源于神经胶质细胞或前体细胞,发病率占所有中枢神经系统肿瘤的26.6%,包括以下组织学类型:星形细胞瘤、少突胶质细胞瘤、少突星形细胞瘤和其它罕见组织学类型[1]。WHO(2021)中枢神经系统肿瘤分类将脑胶质瘤分为四大类:成人型弥漫性胶质瘤、儿童型弥漫性低级别胶质瘤、儿童型弥漫性高级别胶质瘤、局限性星形细胞胶质瘤。胶质母细胞瘤(glioblastoma, GBM)属于成人型弥漫性胶质瘤,是高度恶性胶质瘤,GBM患者中位生存期仅15个月。脑胶质瘤显示出大量的微血管增生、坏死和浸润性生长,故不易切除干净[2]。虽然目前可以采用手术切除、放疗、化疗、免疫治疗、中医药治疗等针对脑胶质瘤的临床治疗手段,治疗效果有所改善,但患者术后易复发,其预后和生存率仍不理想[3-4]。因此,探索脑胶质瘤的发生发展机制及新的治疗途径势在必行。
大量研究表明G蛋白信号转导调节蛋白(regulator of G protein signaling protein, RGS)可以抑制G蛋白信号传导,因为RGS蛋白的RGS结构域具有GTP酶活化蛋白(GTPase activating protein, GAP)活性,可以加速三磷酸鸟苷(Guanosine Triphosphate, GTP)的水解[5];且RGS12蛋白的GoLoco序列能减缓G蛋白核苷酸交换,发挥鸟嘌呤核苷酸解离抑制剂(guanine nucleotide dissociation inhibitor, GDI)作用[6],让信号传递速率大幅下降,减少G蛋白下游有丝分裂原活化蛋白激酶(mitogen activated protein kinase, MAPK)通路的活化,使脑胶质瘤的发展变慢,从而达到治疗目的。
1 MAPK信号通路
MAPK信号通路的基本组成是一种从酵母到人类都通用的三级酶促级联反应,包括MAPK激酶激酶(MAPKKK)、MAPK激酶(MAPKK)和MAPK[7]。MAPK级联反应在整合多种来自细胞外的信号刺激到细胞核内这一过程中发挥着核心作用。在未受刺激的细胞内,MAPK信号通路处于静息状态;而当细胞受到刺激后,接收到活化信号的上游MAPKKK和MAPKK呈现逐级磷酸化,MAPKK会对C端T-X-Y基元进行双重磷酸化来激活下游MAPK[8],最终完成调节细胞的增殖、分化、应激适应、炎症反应等多种重要的细胞生理及病理活动。
MAPK不同亚族具有不同的底物作用特异性,并且被不同的胞外刺激调节[9]。目前在哺乳动物细胞中,MAPK家族至少分为以下四类:细胞外信号调节激酶ERK1/2、c-Jun氨基末端激酶(JNK1、JNK2和JNK3)、p38激酶同工酶(p38α、p38β、p38γ和p38δ)以及大丝裂原活化蛋白激酶ERK5[10]。
MAPK/ERK信号通路是调控细胞增殖和分化的基本信号通路。异三聚体G蛋白偶联受体(G protein-coupled receptors, GPCR)在收到细胞外信号刺激后,将信号传递给细胞核内的配体异三聚体G蛋白,并诱导其解离成Gα亚基和Gβγ二聚体。然后Gαi、Gαs、Gα12、Gαq四种亚基和Gβγ二聚体能通过不同通路级联激活MAPK/ERK信号通路。文献报道,亚基Gαi和Gβγ二聚体对ERK的激活依赖磷酸肌醇3激酶(phosphoinositide-3-kinase,PI3K),而与Gαs亚基偶联的受体GPCR的兴奋,激发腺苷酸环化酶(adenylate cyclase,AC)活性,活化的AC可以催化环腺苷酸(cyclic adenosine monophosphate, cAMP)产生,cAMP在有些细胞中会特殊负调控ERK活性,这取决于下游不同的效应因子[11](图1)。Gα12亚基的激活使Ras相关蛋白1(Ras-related protein 1, Rap1)失活,接着导致Rap1介导的Ras磷酸化蛋白(Raf1)隔离失效,进而阻止ERK的激活,亚基Gαq可以通过PK和Ca2+两条不同的级联反应途径激活MAPK/ERK信号通路。
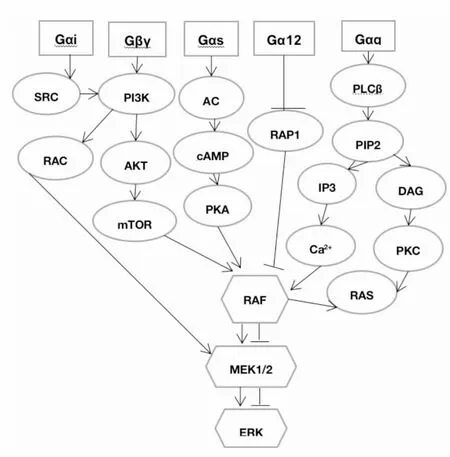
图1 GPCR激活MAPK/ERK信号通路
ERK异常表达在细胞恶性进展过程中起重要作用。ERK1/2信号通路可以调节Cyclin D1的表达,Cyclin D1是细胞周期进程与生长因子信号转导之间的纽带,负责G1-S期的过渡[10]。MAPK/ERK信号通路通过诱导许多调节细胞侵略的关键基因的转录,在癌症的发展期间编排一些关键的生物过程。在体外和体内生长实验中,发现该通路在神经球体形成和GBM的肿瘤形成中发挥促进作用[12]。
JNKs是苏氨酸蛋白激酶,在辐射、渗透压、温度变化、生长因子、炎症因子等胞外刺激下,MAPK激酶4(MKK4)和MAPK激酶7(MKK7)激活JNKs[13],用以调控细胞的增殖、分化和凋亡。有研究发现,JNKs不仅抗癌细胞凋亡,还促进癌细胞的存活和肿瘤发生[14]。
p38是酪氨酸蛋白激酶,目前已知p38有四种异构体(p38α、p38β、p38γ、p38δ)[15]。p38在炎性细胞因子、渗透压、DNA损伤和超氧化物等刺激下,会被MEK3/6激活,在炎症与细胞凋亡等应激反应中发挥重要作用。
ERK5即细胞外信号调节激酶5,能够被VEGF、EGF、脑源性神经营养因子(BDNF)等激活[8],ERK5仅能被激酶MEK5磷酸化并激活,而MEK5直接被MEKK2/3激活。已有研究表明,ERK1/2和ERK5信号通路被激活后,可通过磷酸化转录因子的方式改变核内基因表达,这些改变促进细胞增殖以及细胞周期的进展。已证明ERK5是G1-S过渡所必须的,ERK5显性阴性突变体的表达抑制了上皮细胞G1期的增殖[8]。
以上研究均表明MAPK信号通路可调控细胞的增殖、分化等活动。因此,肿瘤细胞的发生与发展过程也一定与MAPK信号通路有密切关系。
2 MAPK信号通路与肿瘤
MAPK信号通路作为调控细胞增殖、分化和凋亡的经典信号通路,其异常激活与多种肿瘤的增殖、侵袭和转移等密切相关。有研究表明,ERK、p38、JNKs在肝癌组织中均呈强阳性,其中ERK和JNKs负责细胞增殖,两者表达呈正相关,p38影响细胞凋亡,p38表达与ERK表达呈负相关[16]。此外,干扰素诱导的跨膜蛋白3(IFITM3)通过激活MAPK/p38途径促进MMP-9的表达[17],进而促进肝癌的侵袭转移。
JNKs调节癌细胞的凋亡与存活表现为:活化的JNK能通过限制活性氧(ROS)的累积来保护前庭神经鞘瘤细胞和淋巴瘤细胞免于凋亡;还可调节葡萄糖调节蛋白78(GRP78)促进人胰腺癌细胞的增殖[14]。
以上研究表明,MAPK的四条信号通路在大多数情况下都可以促进肿瘤增殖并抑制其凋亡,与肿瘤恶性发展呈正相关,仅部分研究表明p38抑制肝癌组织发展。
3 MAPK信号通路与脑胶质瘤
赵麟等[18]发现,具有良好抗血管生成活性的融合半胱氨酸C的融合肽Tat-C-RP7,通过下调ERK的磷酸化水平抑制原位脑胶质瘤的生长。肿瘤入侵的关键酶MMP-9和MMP-2的表达水平随着脑胶质瘤的进展而增加[19],激活的ERK参与这一过程,MMP-2在早期肿瘤的发生阶段表达,支持胶质瘤的侵袭和血管生成;MMP-9在肿瘤恶性进展的后期表达,维持肿瘤血管系统[20]。
JNKs家族在小胶质细胞、少突胶质细胞、星形胶质细胞中均有表达;小胶质细胞的激活和炎症因子的释放可使JNKs磷酸化,导致转录因子c-Jun的激活,pJNK表达增加。有研究表明,Celastrol可以通过激活MAPK/JNK信号通路引起脑胶质瘤细胞(包括U251、U87-MG和C6细胞系)增殖过程G2-M期的阻滞,触发细胞凋亡和自噬[21]。通过ERK和JNKs途径增加MMP-7的表达[22],进而能促进GBM的侵袭和迁移。
通过特异性抑制MAPK/p38后,发现能部分逆转由TGF-β介导的Lnc RNA-ATB诱导的脑胶质瘤侵袭,表明可通过MAPK/p38信号通路诱导脑胶质瘤侵袭[23]。Xu等[24]发现,小GTPase RND2高表达抑制了MAPK/p38的信号传导,在体外抑制了GBM细胞的凋亡,在体内诱导了人胶质瘤细胞移植小鼠的肿瘤生长。
弥漫性内在性脑桥胶质瘤(diffuse intrinsic pontine glioma, DIPG)细胞大多存在H3K27突变,而这种突变体中RAS选择ERK5信号通路传递信号,而且抑制ERK5显著增加了颅内植入DIPG细胞的小鼠存活率[25]。研究发现ERK5会增加神经胶质细胞对替莫唑胺(TMZ)的抗性[26];而敲低ERK5会使得原本有抗性的胶质瘤细胞对TMZ敏感。
有研究发现,非受体型蛋白酪氨酸磷酸酶12基因(PTPN12)的表达对脑胶质瘤患者的生存期有重要影响,而与PTPN12表达量呈正相关的基因大多集中在MAPK通路及与肿瘤相关的通路等[27]。
以上研究表明活化的MAPK信号通路对脑胶质瘤的进展有促进作用,而下调MAPK表达可抑制脑胶质瘤细胞的增殖。
4 RGS12蛋白可能通过MAPK通路抑制脑胶质瘤
现今已发现的RGS蛋白有至少20种,RGS家族成员拥有共同的RGS结构域。RGS结构域与异三聚体G蛋白αi亚基结合可以产生GAP(GTPase activating protein)活性,然后加速Gαi-GTP的水解(加快达1 000倍),RGS蛋白的GAP活性是负调控GPCR信号传导的主要机制[5]。不同的RGS蛋白对不同α亚基的作用有特异性,在调节由GPCR触发的信号通路方面,靶向特定RGS蛋白比靶向上游GPCR能提供更多特异性[28]。
RGS12蛋白是分子量最大的RGS家族成员,除共有的RGS结构域以外,还包含GoLoco序列(第二个αi亚基作用位点)、串联RAS结合域(RBD)、PDZ域以及PTB域;RGS12蛋白GoLoco序列与G蛋白αi亚基中ras样结构域的α3螺旋结合,充当鸟嘌呤核苷酸解离抑制剂(GDI),减缓GDP和GTP之间的交换,并阻止Gαi亚基与βγ二聚体的结合[6],最终使RGS12蛋白负调控G蛋白信号传导。
MAPK作为G蛋白跨膜传递信号的下游效应器,当RGS12利用RGS结构域和GoLoco序列减弱G蛋白信号传导后,可在一定程度上减少MAPK信号通路的活化(图2)。
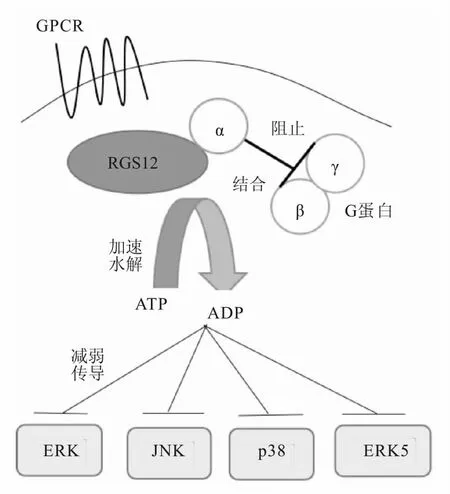
图2 RGS12蛋白与MAPK信号通路关系示意图
在RGS12介导下,MAPK信号通路的活化减少,即RGS12可负向调节通过MAPK信号通路进行的脑胶质瘤增殖活动。RGS12通过其PDZ结构域负向调节YAP/TEAD1复合物的转录活性,进而抑制骨肉瘤Ezrin的表达[29]。有研究用RGS蛋白调节GPCR信号,进而调节血小板源性生长因子(PDGF)受体介导的信号传输的可能性[30],结果发现RGS12 PTB域的过度表达降低了PDGF诱导的ERK1/2激活。
MAPK信号通路在胶质瘤的发展过程中存在调节作用,促进其生长与侵袭,因此,也可利用RGS12蛋白减弱MAPK信号通路的活化,将RGS12蛋白作为治疗靶点,抑制脑胶质瘤的发生发展。
5 结语
活化的MAPK通路在多种肿瘤包括脑胶质瘤的发展进程中发挥促癌作用,其表达水平与肿瘤增殖、迁移、侵袭等活动呈正相关。而MAPK的上游受体GPCR是胞外向胞内传递信号的重要枢纽,哺乳动物体内的RGS蛋白可以抑制G蛋白信号传导,利用RGS12蛋白高效且特异性的减弱G蛋白信号传导,可以抑制下游MAPK通路的活化,并负向调节脑胶质瘤的发生发展进程。这种方法与以往的外科切除、放化疗以及中西药治疗不同,从根本上解决了脑胶质瘤的高侵袭性和血管生成等棘手问题,且副作用小,这可以作为未来脑胶质瘤治疗的一个新方向和新思路。

