PERK/ATF4/CHOP通路对BCG诱导THP-1细胞NLRP3炎性小体活化的调控作用
马伯利,聂雪伊,刘悦阳,苗申奥,陈 通,杨 易,徐金瑞
(宁夏大学西部特色生物资源保护与利用教育部重点实验室,银川 750021)
结核病(tuberculosis,TB)是世界范围内的慢性致死传染病。2019年,TB导致全球140万人死亡,其中包括20.8万名艾滋病毒阳性者。结核分枝杆菌(,)是TB的主要致病菌,是一种典型的胞内寄生菌。巨噬细胞是寄生的主要场所,也是感染早期免疫应答的重要物质基础,一方面它可以对抗和消灭,在宿主抗感染免疫中起到关键作用,另一方面也可通过阻止吞噬溶酶体的形成逃避巨噬细胞的清除。当巨噬细胞受到攻击时,会引起内质网应激(endoplasmic reticulum stress,ERS),促使蛋白激酶R样内质网激酶(PRKR-like endoplasmic reticulum kinase,PERK)同免疫球蛋白结合蛋白(immunoglobulin binding protein,Bip)解离,使 PERK 暴露并发生自身二聚化与磷酸化,进而导致真核起始因子2α(eukaryotic initiation factor 2α,eIF2α)磷酸化,促使转录激活因子4(activating transcription factor 4,ATF4)的表达上调,特异性地提高C/Ebp-同源蛋白质(C/EBP-homologous protein,CHOP)等的转录水平
NLRP3炎性小体是目前研究最多的炎性小体,许多病原微生物都能激活NLRP3炎性小体。研究表明,ERS能够激活NLRP3炎性小体介导的炎症反应的发生,从而影响炎症性疾病的发生和发展,但其调控机制尚未明确。
本研究采用PERK抑制剂和PERK小干扰RNA预处理并经BCG感染THP-1细胞后,对PERK/ATF4/CHOP通路相关分子的表达、NLRP3炎性小体活化相关指标进行检测,旨在揭示BCG感染THP-1细胞后PERK/ATF4/CHOP通路对NLRP3炎性小体活化的调控作用,为进一步阐明巨噬细胞抗结核分枝杆菌感染的免疫调节机制提供理论依据。
1 材料与方法
1.1 主要试剂和仪器
RPMI Medium 1640培养基、胎牛血清(Gibco,美国),GSK2656157(MedChemExpress,美国),佛波酯(Sigma-Aldrich,美国),反转录试剂盒(诺唯赞,中国),Green qPCR SuperMix检测试剂盒(全式金,中国),Trizol(Ambion,美国),PERK干扰序列(生工,中国),BCA蛋白定量检测试剂盒(凯基,中国),M-PER、Lipofectamine RNAiMAX试剂(赛默飞,美国),Protease inhibitor Cocktail(Sigma-Aldrich,美国),β-巯基乙醇(索莱宝,中国),Beta Actin兔源多克隆一抗、PERK/EIF2K3兔源多克隆一抗、ATF4兔源多克隆一抗、ASC兔源多克隆一抗、FITC偶联的羊抗兔IgG (H+L) 二抗、HRP偶联的羊抗兔IgG (H+L) 二抗(Proteintech,美国),ASC兔源单克隆一抗、Caspase-1兔源单克隆一抗、NLRP3兔源单克隆一抗、CHOP兔源单克隆一抗(Cell Signaling Technology,美国),Cleaved-Caspase-1 (Asp296, p20 Ab) 兔源单克隆一抗(Affinity,美国),NLRP3鼠源多克隆一抗和AF594偶联的羊抗鼠IgG (H+L)二抗(Abmart,中国),人 IL-1β、IL-18 ELISA试剂盒(博士德,中国);CCK-8试剂盒(爱必信,中国)。
细胞计数仪(BioRAD公司,美国),光学显微镜(Motic公司,中国),Quantity Studio 5实时荧光定量PCR仪、NanoDrop-8000超微量分光光度计(赛默飞,美国),Amersham Imager600自动化学发光成像仪(General Electric公司,美国),Enspire荧光酶标仪(PerkinElmer公司,美国),荧光共聚焦显微镜(赛默飞,美国)。
1.2 BCG培养
BCG购于成都生物制品研究所,培养步骤:配制含0.2%Tween-80的7H9培养液,高压灭菌后,加入10% ADC Enrichment增菌液混匀。将BCG接种于已配制好的7H9培养液中,于37 ℃,5% CO细胞培养箱中静置培养,通过测定OD值确定BCG浓度。
1.3 THP-1细胞培养
人单核巨噬细胞THP-1细胞购于中国科学院细胞库,培养步骤:THP-1细胞培养于含有10%胎牛血清和0.05 mmol·Lβ-巯基乙醇的RPMI Medium 1640培养基中,当细胞密度达到80%~90%时,采用半换液法进行传代,传代后静置于37 ℃,5% CO细胞培养箱中培养。将含有50 ng·mL佛波酯的THP-1细胞按每孔1×10个接种在6孔板中,于37 ℃,5%CO细胞培养箱中培养48 h后,将其诱导贴壁,更换新鲜的培养液,继续培养24 h,用于后续试验。
1.4 BCG感染
以感染复数为10:1的BCG感染THP-1细胞0、2、6、12、24 h。在此基础上,采用5 mmol·L的PERK抑制剂GSK2656157预处理细胞2 h,BCG感染24 h,设置4个组:对照组(C)、BCG感染组(BCG)、PERK抑制剂组(GSK2656157)和PERK抑制剂+BCG感染组(BCG +GSK2656157)。
1.5 qRT-PCR
按照试验设计组处理细胞后,用Trizol法提取总mRNA,按照逆转录试剂盒说明书逆转录合成cDNA;按照qRT-PCR试剂盒说明书添加各种试剂,置于PCR仪进行cDNA扩增试验,检测目的基因mRNA水平的表达,用2-ΔΔ法计算各基因mRNA的相对表达量。所用引物相关信息见表1。

表1 qRT-PCR所用引物信息Table 1 The primers information of qRT -PCR
1.6 Western bolt检测
按照“1.3”和“1.4”中的方法处理细胞后,提取各组蛋白,用BCA蛋白定量检测试剂盒测定蛋白浓度,进行SDS-PAGE凝胶电泳,湿转至已用甲醇激活的PVDF膜上,用含5%脱脂奶粉的TBS室温封闭1 h,分别过夜孵育β-actin(1∶3 000稀释)、NLRP3 (1∶1 000稀释)、ASC(1∶1 000稀释)、Caspase-1(1∶1 000稀释)、PERK(1∶1 000稀释)、ATF4(1∶1 000稀释)、CHOP(1∶1 000稀释)等蛋白抗体,TBST洗涤6次,每次5 min,加荧光素偶联的羊抗兔IgG抗体(1∶3 000稀释)室温孵育1 h, TBST洗涤3次,每次5 min,TBS洗涤3次,每次5 min, 对蛋白表达量进行上机检测。
1.7 干扰PERK
将接种好的THP-1细胞分别转染siPERK和阴性对照siNC。siPERK序列为sense:5′-GUGGAAAGGUGAGGUAUAUTT-3′;antisense:5′-AUAUACCUCACCUUUCCACTT-3′。按照Lipofectamine2000说明书的操作要求配制质粒和脂质体复合物,转染后转入37 ℃、5% CO培养箱中培养24 h。设置4个组:对照组(siNC)、BCG感染组(siNC+BCG)、siPERK干扰组(siPERK)和siPERK+BCG感染组(siPERK+BCG)。
1.8 CCK-8检测细胞活率
取对数生长期THP-1细胞,按1×10·mL细胞密度接种于96孔培养板中,每孔100 μL。培养24 h待细胞贴壁后吸弃培养液,空白孔加入完全培养液100 μL,每组设置6个复孔。在BCG感染24 h后,每孔加10 μL CCK-8溶液,于4 h后使用荧光酶标仪在450 nm波长下测定各孔吸光度值(OD)并记录其数据。细胞活率(%)=(试验组OD值-空白组OD值)/对照组OD值×100%。
1.9 ELISA检测
将各处理组细胞培养上清收集于1.5 mL EP管中,每管500 μL;按试剂盒说明书的操作步骤进行处理,用荧光酶标仪在OD测定吸光值,计算结果。
1.10 免疫荧光检测方法
将C组、BCG组、BCG+GSK2656157组细胞以每孔1.0×10个细胞密度分别接种于加有玻片的12孔板PMA诱导贴壁24 h,换新鲜培养液后细胞培养24 h, 抑制剂预处理细胞2 h, 用BCG处理细胞24 h,弃培养基,4%多聚甲醛固定30 min,PBS漂洗3次,0.5% triton-X 100通透20 min,PBS漂洗3次;一抗(鼠源NLRP抗体、兔源ASC抗体)孵育过夜,PBS漂洗3次,加入荧光二抗(AF488标记山羊抗小鼠IgG抗体、FITC标记山羊抗兔IgG抗体)后暗盒37 ℃孵育1 h;PBS漂洗3次,加入DAPI 染料染核,PBS漂洗3次,封片,荧光显微镜下观察并拍照。
1.11 统计学分析
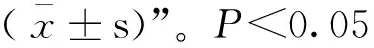
2 结 果
2.1 BCG感染THP-1细胞后对细胞活率的影响
为探究BCG感染THP-1细胞后对细胞活率的影响,采用CCK-8检测BCG感染THP-1细胞不同时间的细胞活率,检测结果如图1所示,细胞活率随感染时间逐渐降低,24 h达到最低,且差异极显著(<0.001)。确定BCG最佳感染时间为24 h。
***. P<0.001图1 BCG感染THP-1细胞不同时间后细胞活率检测Fig.1 The viability of THP-1 cells infected with BCG at different time
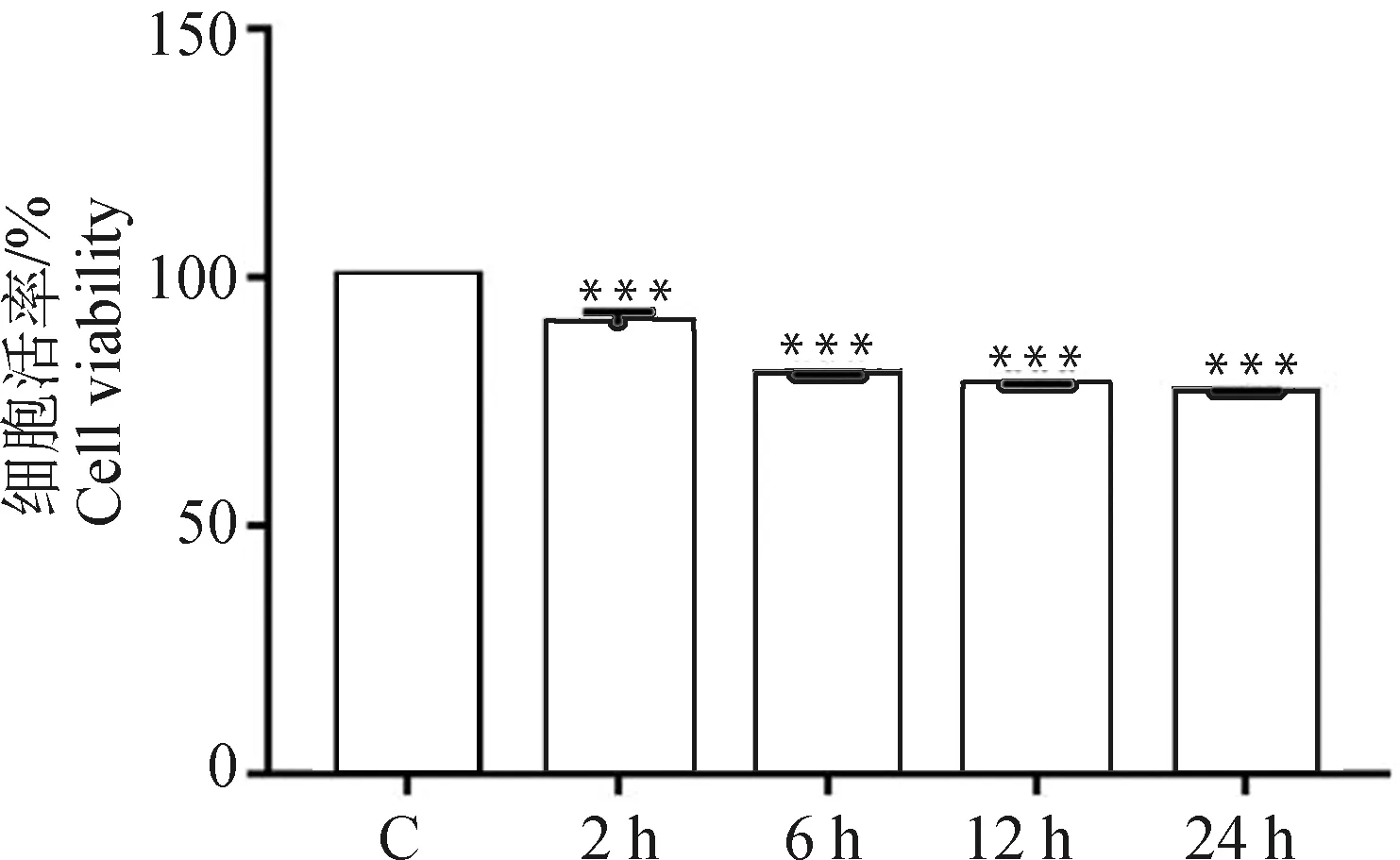
2.2 BCG感染THP-1细胞后对NLRP3炎性小体相关分子和PERK蛋白表达的影响
在BCG感染THP-1细胞2、6、12、24 h,并设置未感染对照组,采用Western blot方法检测PERK、p-PERK 蛋白及NLRP3炎性小体组成蛋白NLRP3、Caspase-1、ASC的表达。由图2可见,与未感染对照组相比,BCG感染组NLRP3、ASC、Caspase-1、Cleaved-Caspase-1、PERK及p-PERK蛋白的表达在24 h 均上调,且差异极显著(<0.001)。因此,选择BCG感染THP-1细胞24 h开展后续试验。
NS. P>0.05;*. P<0.05;**. P<0.01;***. P<0.001图2 BCG感染THP-1细胞不同时间后NLRP3炎性小体相关蛋白和PERK蛋白表达的Western blot 检测结果Fig.2 The western blot results of the expressions of NLRP3 inflammasome related proteins and PERK protein in THP-1 cells infected with BCG at different times
2.3 BCG感染THP-1细胞后对IL-1β和IL-18释放的影响
在NLRP3炎性小体活化时,Pro-IL-1β和Pro-IL-18会被NLRP3、凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和半胱氨酸蛋白酶1(Cysteine aspartic acid specific protease 1,Caspase-1)复合物切割成成熟IL-1β和IL-18。为此,作者采用ELISA方法对IL-1β和IL-18的释放量进行检测。结果如图3所示,IL-1β和IL-18的释放量随感染时间逐渐升高,24 h达到最高,且差异极显著(<0.001)。

ns. P>0.05;*. P<0.05;**. P<0.01;***. P<0.001图3 BCG感染THP-1细胞不同时间后IL-1β(a)和IL-18(b)的释放Fig.3 Release of IL-1β (a) and IL-18 (b) in THP-1 cells infected with BCG at different times
2.4 干扰PERK对BCG感染THP-1细胞NLRP3炎性小体相关蛋白表达的作用
为验证PERK/ATF4/CHOP通路对BCG感染THP-1细胞NLRP3炎性小体活化的调控作用,使用PERK的小干扰处理细胞并经BCG感染后,采用qRT-PCR(图4)和Western blot(图5)检测NLRP3炎性小体相关分子和PERK/ATF4/CHOP通路相关分子mRNA转录水平和蛋白表达水平。

*. P<0.05;**. P<0.01;***. P<0.001图4 干扰PERK经BCG感染的THP-1细胞NLRP3炎性小体相关分子mRNA的表达检测结果Fig.4 The mRNA expression of NLRP3 inflammasome associated molecule in THP-1 cells infected by BCG with Small interfering RNA of PERK
由图4可见,siNC+BCG感染组、4、、3、、-1分子的mRNA表达水平极显著高于未感染对照组(<0.001),siPERK+BCG组较siNC+BCG感染组上述分子的mRNA表达显著下调(<0.05)或极显著下调(<0.01)。
由图5结果显示,siNC+BCG感染组蛋白PERK、p-PERK、ATF4、CHOP、NLRP3、ASC、Caspase-1、Cleaved-Caspase-1的蛋白表达水平极显著(<0.000 1)或显著(<0.05)高于未感染组,但siPERK+BCG组较siNC+BCG感染组关键蛋白如p-PERK和Cleaved-Caspase-1蛋白的表达极显著下调(<0.001)。
2.5 抑制PERK对BCG感染THP-1细胞活性的影响
CCK-8细胞活率检测结果如图6所示,与对照组相比,BCG感染引起THP-1细胞活率下降,且差异极显著(<0.001);BCG+GSK2656157组与BCG组相比,细胞活率上升,差异显著(<0.05),表明GSK2656157能够抑制BCG感染引起的THP-1细胞死亡。

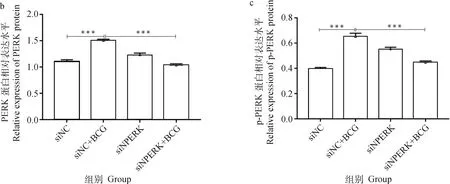
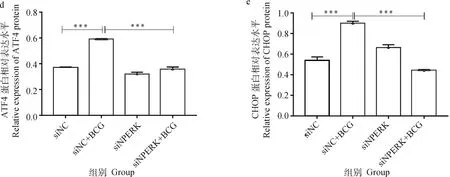
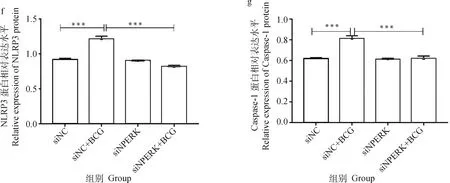
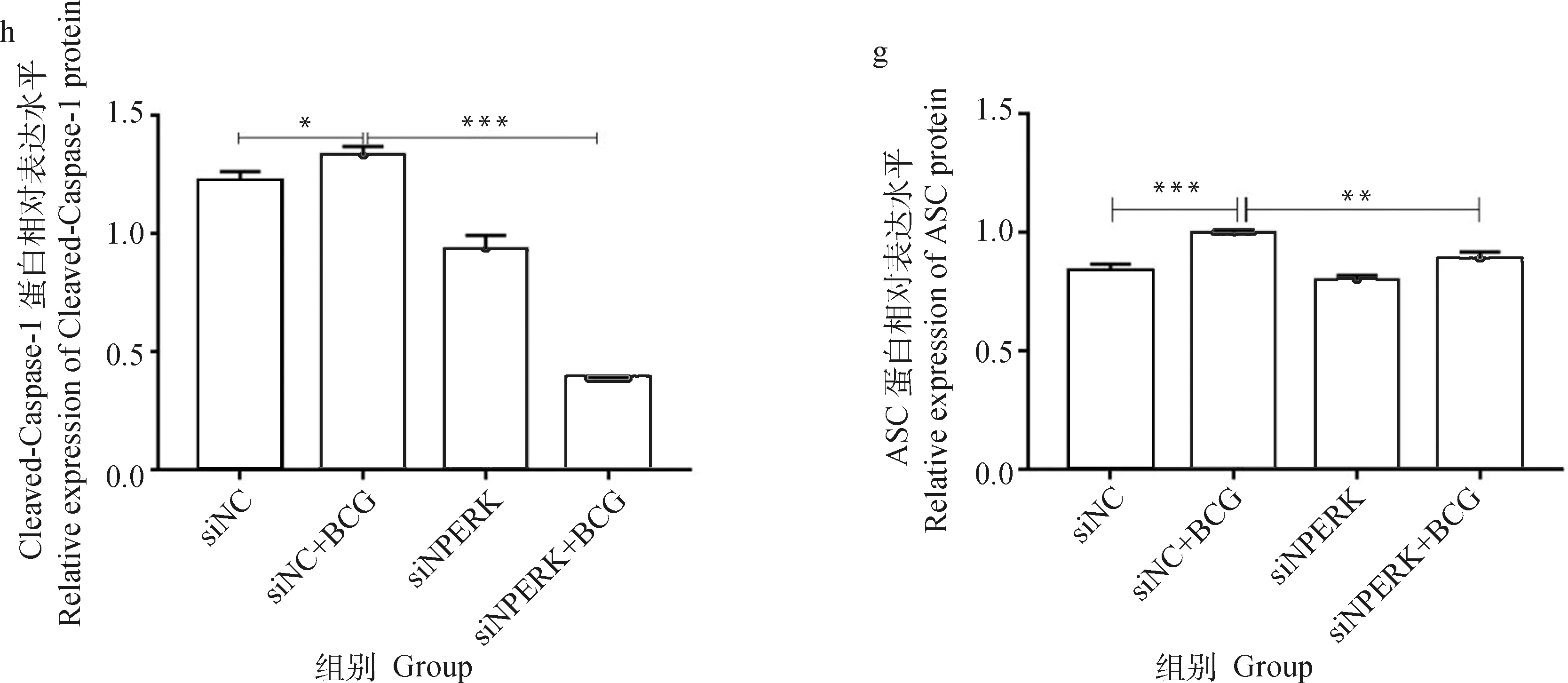
a.相关蛋白的Western blot结果;b~i. 蛋白表达的灰度值分析。*. P<0.05;**. P<0.01;***. P<0.001a.The Western blot result of related proteins;b-i. Gray value analysis of proteins. *. P<0.05;**. P<0.01;***. P<0.001图5 干扰PERK经BCG感染的THP-1细胞PERK/ATF4/CHOP通路及NLRP3炎性小体相关蛋白表达的检测结果Fig.5 The expressions of PERK / ATF4 / CHOP pathway and NLRP3 inflammasome related proteins in THP-1 cells infected by BCG with Small interfering RNA of PERK
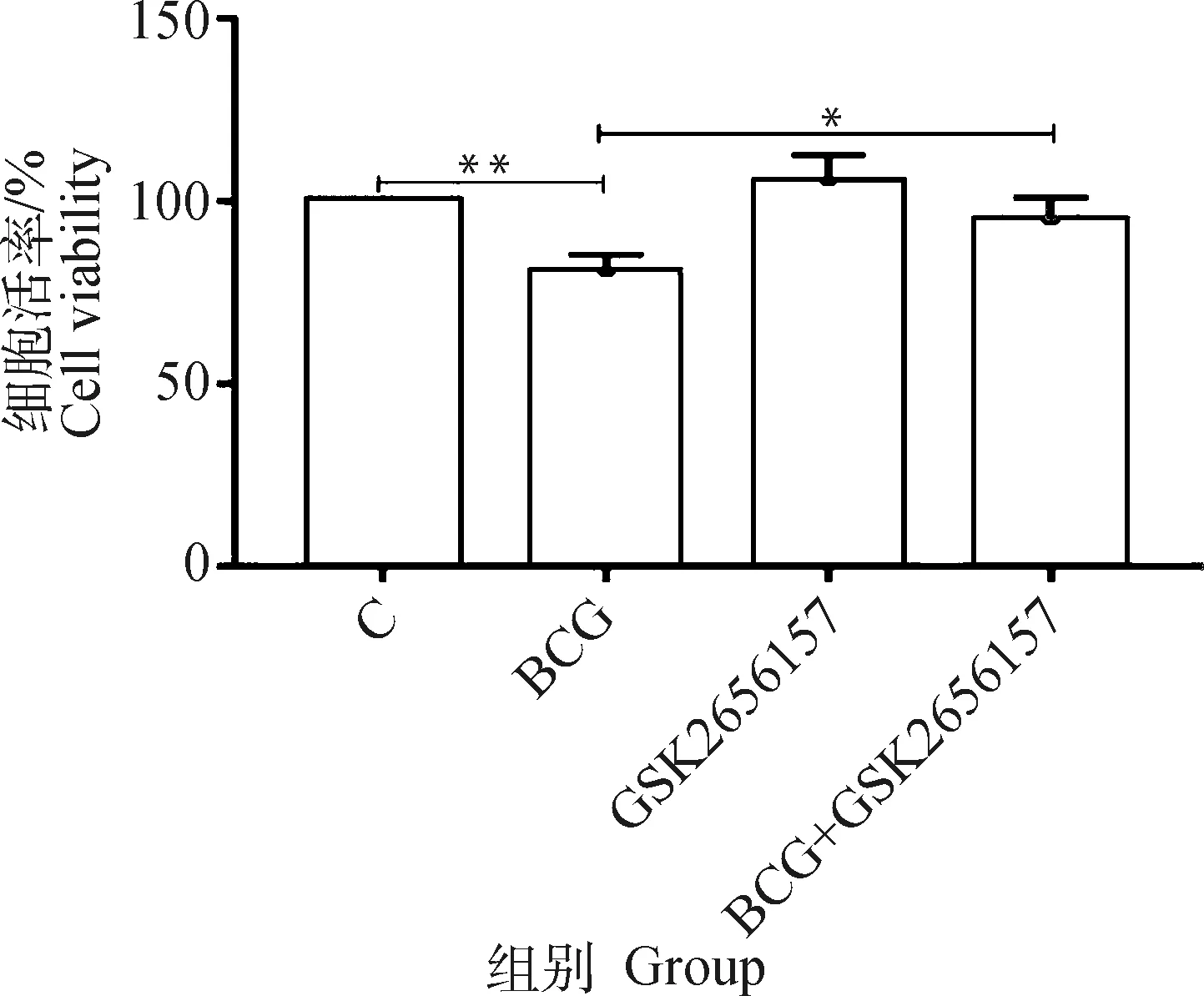
*. P<0.05;**. P<0.01图6 抑制PERK对BCG感染的THP-1细胞活性的影响Fig.6 The activity of THP-1 cells infected by BCG with inhibition of GSK2656157
2.6 抑制PERK对BCG感染THP-1细胞NLRP3炎性小体相关蛋白表达的作用
为进一步揭示PERK/ATF4/CHOP通路对BCG感染THP-1细胞NLRP3炎性小体活化的调控作用,使用PERK抑制剂GSK2656157预处理THP-1细胞并经BCG感染后,采用qRT-PCR和Western blot检测NLRP3炎性小体相关分子和PERK/ATF4/CHOP通路相关分子mRNA转录水平和蛋白表达水平。
由图7可见,BCG感染组、4、、3、-1及的mRNA表达水平极显著高于未感染对照组(<0.001),BCG+GSK2656157组较BCG感染组上述分子的mRNA表达极显著下调(<0.01)。
由图8可见,BCG感染组PERK、ATF4、CHOP、NLRP3、Caspase-1及ASC的蛋白表达水平显著高于未感染组(<0.05),而BCG+GSK2656157组较BCG感染组上述蛋白的表达显著下调(<0.05)。

*. P<0.05;**. P<0.01;***. P<0.001图7 抑制PERK经BCG感染的THP-1细胞NLRP3炎性小体相关分子mRNA的表达检测结果Fig.7 The mRNA expression of NLRP3 inflammasome associated molecule in THP-1 cells infected by BCG with inhibition of GSK2656157
2.7 PERK抑制剂与BCG共处理的THP-1细胞NLRP3和ASC共定位检测
荧光显微镜观察C、BCG和BCG+GSK2656157组中的NLRP3和ASC表达结果如图9所示。BCG组NLRP3和ASC表达较C组极显著增加(<0.001),BCG+GSK2656157组较BCG组NLRP3和ASC表达极显著下调(<0.001),NLRP3和ASC存在共定位。

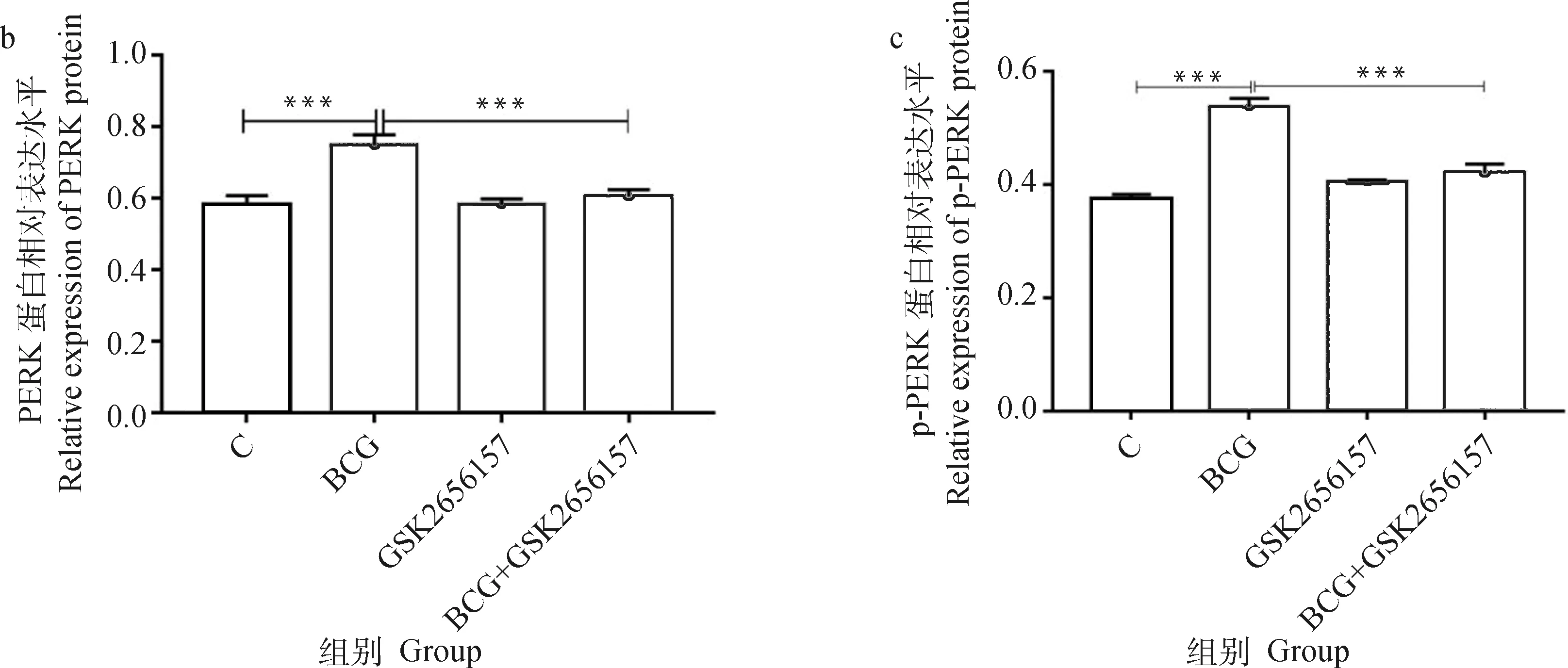

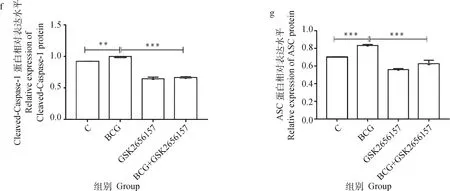
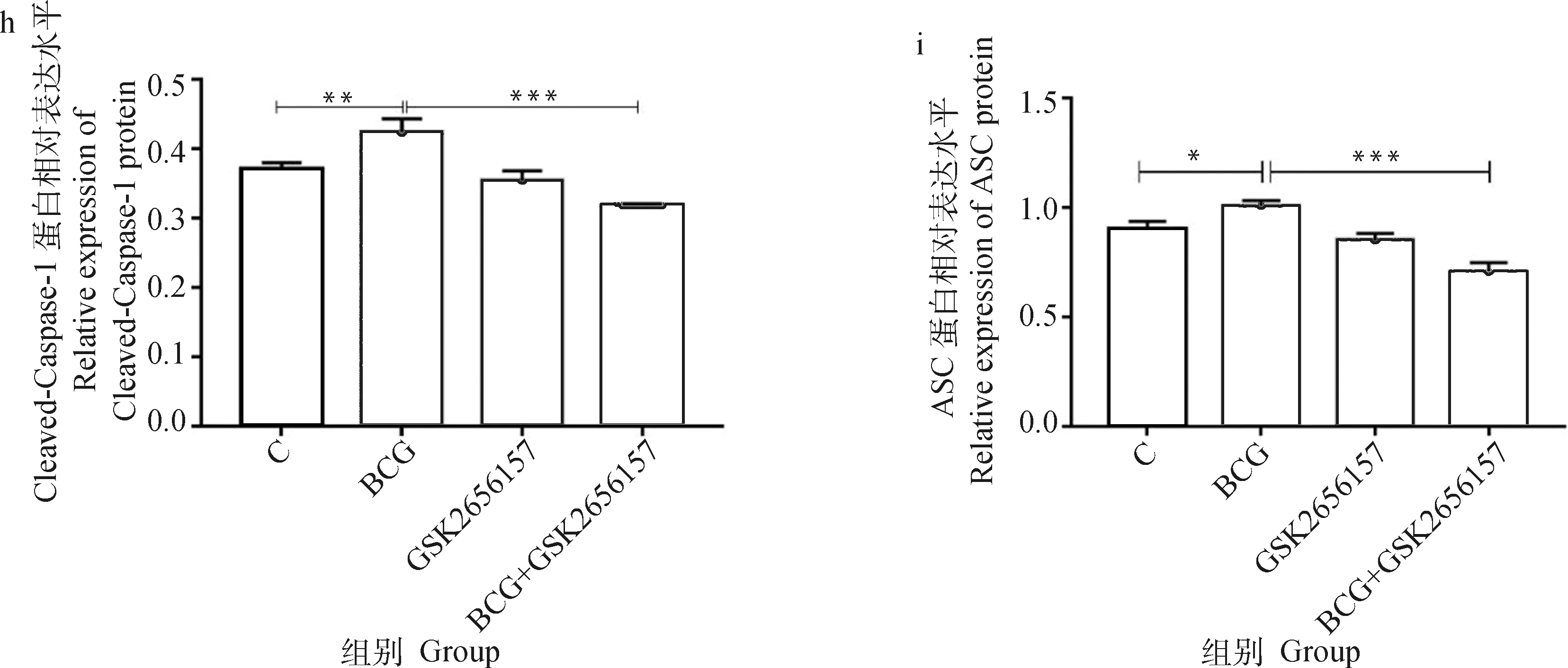
a. 相关蛋白的Western blot结果;b~i. 蛋白表达的灰度值分析。*. P<0.05;**. P<0.01;***. P<0.001a. The Western blot result of related proteins;b-i. Gray value analysis of proteins. *. P<0.05;**. P<0.01;***. P<0.001图8 抑制PERK经BCG感染的THP-1细胞PERK/ATF4/CHOP通路及NLRP3炎性小体相关蛋白表达的检测结果Fig.8 The expressions of PERK / ATF4 / CHOP pathway and NLRP3 inflammasome related proteins in THP-1 cells infected by BCG with inhibition of GSK2656157

a.NLRP3与ASC蛋白荧光共定位,绿色荧光抗体标记ASC;红色荧光抗体标记NLRP3,标尺=20 μm;b. NLRP3蛋白荧光强度分析;c. ASC蛋白荧光强度分析。*. P<0.05;**. P<0.01;***. P<0.001a.Fluorescent co localization of NLRP3 and ASC protein, and ASC was labeled with green fluorescent antibody; Red fluorescent antibody labeled NLRP3, Scale=20 μm; b. NLRP3 protein fluorescence intensity analysis; c. Fluorescence intensity analysis of ASC protein. *. P<0.05;**. P<0.01;***. P<0.001图9 抑制PERK经BCG感染的THP-1细胞NLRP3和ASC的共定位表达Fig.9 Co-localization of NLRP3 and ASC proteins in THP-1 cells infected by BCG infection with PERK inhibitor
2.8 抑制PERK对BCG感染THP-1细胞IL-1β和IL-18释放的作用
当宿主细胞受到外界病原体刺激时,宿主细胞能够分泌多种炎症因子协助宿主清理病原体。为了探究PERK/ATF4/CHOP通路是否会影响BCG感染的THP-1细胞炎症因子的分泌,采用ELISA方法抑制PERK并经BCG感染的THP-1细胞IL-1β 和IL-18的释放水平进行检测。由图10可见,BCG感染组的IL-1β和IL-18的释放水平极显著高于未感染组(<0.001),BCG+GSK2656157组较BCG感染组IL-1β和IL-18释放显著下调(<0.05)。 表明抑制PERK/ATF4/CHOP通路降低了BCG感染巨噬细胞后IL-1β和IL-18的释放水平。
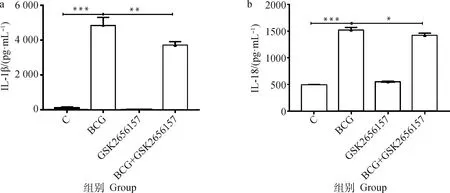
*. P<0.05;**. P<0.01;***. P<0.001图10 抑制PERK经BCG感染的THP-1细胞IL-1β(a)和IL-18(b)释放水平的ELISA检测结果Fig.10 ELISA results of IL-1β(a) and IL-18(b) release in THP-1 cells infected by BCG with inhibition of GSK2656157
3 讨 论
结核病是由致病性结核分枝杆菌引起的传染病,结核分枝杆菌可经过呼吸道和消化道等途径进入机体,感染肺部形成肺结核。结核分枝杆菌除了感染人之外,还可使不同动物患病,比如:鱼类、奶牛。随着对利福平和异烟肼等抗结核一线药物的耐药性逐渐增加,让结核病的防治变得更加困难。所以,明确与其靶细胞巨噬细胞间的相互作用机制对于治疗结核病具有积极意义。
当细胞出现大量未折叠或错误折叠的蛋白质聚集于内质网形成ERS,最终启动未折叠蛋白反应(unfolded protein response,UPR),PERK/ATF4/CHOP通路作为UPR最关键的通路发挥重要的调节作用。有研究表明,PERK/ATF4/CHOP通路在调控ERS、炎症和细胞凋亡方面具有重要作用。NLRP3作为目前研究比较清楚的炎症小体类型,参与了不同类型疾病的发生,如痛风、动脉粥样硬化及糖尿病等。NLRP3参与免疫调控一般需要启动和激活两个过程,启动阶段需要通过核因子-κB(nuclear factor kappa-B,NF-κB)信号通路来启动NLRP3的转录。而细胞内外K、Ca等离子的流动、溶酶体的损伤、线粒体的功能障碍引起ROS的增加等因素会激活NLRP3。还有研究还表明,Caspase-11直接识别胞内的脂多糖(lipopolysaccharide,LPS)激活NLRP3,引发ERS。
本研究结果表明,随BCG感染时间延长,PERK、NLRP3、ASC及Caspase-1蛋白的表达及促炎因子IL-1β及IL-18的释放呈时间依赖性。为阐明PERK/ATF4/CHOP通路激活与BCG感染后NLRP3炎性小体活化之间的关系,分别采用PERK的小干扰RNA或抑制剂处理,并经BCG感染THP-1细胞后,对NLRP3炎性小体活化水平进行了检测,结果显示,BCG感染后PERK/ATF4/CHOP通路和NLRP3炎性小体的mRNA和蛋白表达水平均上调,IL-1β及IL-18的释放水平增加,免疫荧光结果显示NLRP3与ASC的表达水平升高,表明BCG感染激活了NLRP3炎性小体的活化,而加入PERK抑制剂再经BCG感染后,上述分子的表达及炎性因子的释放水平均显著下降。
综上所述,PERK/ATF4/CHOP通路参与了BCG感染THP-1细胞后NLRP3炎性小体的活化,为深入开展ERS在结核分枝杆菌感染宿主细胞中的作用奠定了理论依据。
4 结 论
BCG感染巨噬细胞后引起PERK/ATF4/CHOP通路的激活,进而促进了NLRP3炎性小体活化,并释放促炎细胞因子IL-1β和IL-18。

