地西他滨联合CAG方案治疗复发急性髓细胞白血病患者的疗效及对miR-34b、USP22表达的影响
朱 斌,王素丽,潘韶英,丁志勇,肖林林,赵文理
0 引言
急性髓系白血病(Acute myeloid leukemia,AML)是急性白血病中发病率最高、生存率最低的异质性疾病,且年龄越大,化疗缓解率越低,预后往往不佳[1]。异基因造血干细胞移植是AML的有效治疗方法,但AML复发是导致治疗失败的重要原因[2]。AML的复发机制与复发后靶向治疗的研究一直是该领域学者关注的焦点和面临的巨大挑战。前期研究发现,甲基化介导的microRNA-34b(miR-34b)及其下游、特异性泛素蛋白酶22(Ubiquitin protease 22,USP22)在初诊及复发AML中均有异常表达,参与了AML的发生发展[3]。地西他滨作为一种特异性DNA甲基化转移酶(DNA methyltransferas,DNMT)抑制剂,可能参与了逆转DNA甲基化过程,激活沉默失活的抑癌基因,促进肿瘤细胞正常分化,在骨髓增生异常综合征中取得明确疗效,但其对复发AML的应用效果仍缺乏足够证据[4]。本研究对复发AML患者采用地西他滨联合CAG方案进行治疗,探讨该方案对miR-34b及其靶基因USP22表达、预后的影响。
1 临床资料
1.1 一般资料 收集2016年6月至2018年6月上海市奉贤区中心医院收治入院的复发AML患者。入选标准:①符合中华医学会血液学分会白血病淋巴瘤学组制定的《急性髓系白血病(复发难治性)中国诊疗指南(2017年版)》[5]的诊断标准,即完全缓解后外周血白细胞或骨髓原始细胞>5%,髓外可见白细胞细胞浸润;②55~75岁,能够配合随访。排除标准:①初治AML病例;②合并其他恶性肿瘤;③对化疗药物不耐受;④严重心肝肾功能障碍者。共入选30例患者,其中男16例,女14例,年龄55~74岁,平均(61.4±4.5)岁;FAB分型:M1 2例,M2 5例,M4 11例,M5 12例。按照随机数字表法,将30例患者分为治疗组和对照组,每组各15例。两组的性别、年龄、FAB分型等基本资料比较,差异无统计学意义(P>0.05)。本研究通过医院伦理委员会批准(伦理批号:2018-KY-01),患者或家属均知情同意。
1.2 方法 治疗组采用地西他滨联合CAG方案,对照组采用CAG方案。地西他滨联合CAG方案为地西他滨10 mg/m2,d1~d5:粒细胞集落刺激因子(G-CSF)(杭州九源,国药准字S10980030,规格:100 μg)300 μg,d2起(WBC>20×109/L时停药);阿克拉霉素(Acla)(深圳万乐,国药准字H10910093,规格:10 mg)20 mg/d,d3~d6;阿糖胞苷(Ara-C)(辉瑞制药有限公司,国药准字H20080412,规格:100 mg)10 mg/m2,每12 h皮下注射1次,d1~d7。对照组CAG方案,具体为G-CSF 300 μg d0起(WBC>20×109/L时停药),Acla 20 mg/d,d1~d4,Ara-C 10 mg/m2,每12 h皮下注射1次,d1~d14。患者至少接受2个疗程的治疗。
1.3 观察指标
1.3.1 化疗疗效 按照《血液病诊断及疗效标准(第三版)》[6]对化疗疗效进行评价,分为完全缓解(CR)、部分缓解(PR)、未缓解(NR)。总缓解率(ORR)=(CR+PR)/总病例×100%。
1.3.2 miR-34b、USP22检测 分别于化疗前、化疗后42 d行骨髓穿刺,抽取骨髓液3 ml,加入Ficoll分离液分离单核细胞,采用RIPA细胞裂解液提取蛋白,采用Western印迹检测miR-34b、USP22蛋白表达。以GAPHD为内参,利用Image J软件分析靶基因灰度值/β-actin灰度值,作为miR-34b、USP22蛋白相对表达量。
1.3.3 随访 采用电话、门诊或上门等方式对患者进行随访,前半年每2个月1次,记录患者生存情况及总生存(OS)期,OS期定义为确诊复发至死亡(任何原因)或随访截止日期。

2 结果
2.1 两组患者化疗疗效比较 治疗组ORR为66.67%,显著高于对照组的26.67%,差异有统计学意义(χ2=4.82,P<0.05)。见表1。
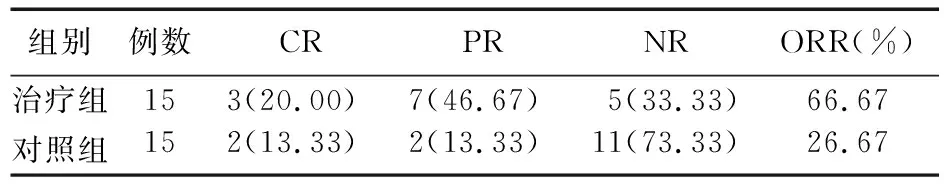
表1 两组患者化疗疗效比较[例(%)]
2.2 两组患者外周血单核细胞miR-34b、USP22蛋白表达水平比较 化疗前,两组miR-34b、USP22蛋白表达比较,差异均无统计学意义(P>0.05)。化疗后,治疗组miR-34b蛋白表达升高,USP22蛋白表达降低,且与对照组比较,差异均有统计学意义(P<0.05)。见表2。

表2 两组患者外周血单核细胞miR-34b、USP22蛋白表达水平比较
2.3 两组患者预后分析 对患者随访24~48个月,中位随访时间29.6个月,治疗组存活8例,生存率为53.3%,对照组存活5例,生存率为33.3%,差异无统计学意义(χ2=1.22,P>0.05)。Kaplan-Meier法分析显示,复发AML患者中位OS期为8.45个月(95%CI:7.65~9.25),其中治疗组中位OS期为9.53个月(95%CI:7.94~11.11),显著高于对照组6.57个月(95%CI:5.21~7.92),差异有统计学意义(χ2=5.52,P<0.05)。见图1。

图1 两组患者生存曲线比较
2.4 两组患者miR-34b、USP22蛋白表达与预后的相关性 与存活组比较,死亡组化疗后miR-34b蛋白表达明显降低,USP22蛋白表达明显升高,差异有统计学意义(P<0.05)。见表3。

表3 miR-34b、USP22蛋白表达与预后的相关性
3 讨论
目前,CAG方案是AML临床治疗中广泛应用的一种化疗方案,可通过综合化疗、诱导分化及诱导凋亡充分发挥协同效应,提升化疗药物对肿瘤细胞的杀灭作用[7]。研究显示,CAG早期诱导方案可有效提高初治AML患者的CR,但30%~40%的患者存在原发耐药性,且50岁以上患者易复发[8]。受个体差异、合并疾病、骨髓造血能力、分子遗传学等因素的影响,CAG方案对于复发AML患者的临床疗效并不理想,多数患者往往无法耐受强化诱导的毒副作用,即使应用减低剂量预处理方案与辅助支持技术,异基因造血干细胞移植也难以使之获益,最终导致患者死于AML各种相关并发症。
随着测序技术的发展,AML患者编码参与转录表观调节蛋白的基因频发突变已得到证实。DNA甲基化、miRNA等表观遗传学机制可在不改变DNA序列的情况下对基因表达和细胞表型进行调控,其在AML发生发展中的作用愈发引人关注[9]。生理情况下,与DNA启动子区CpG岛相关的CpG一般处于非甲基化状态,基因启动子区CpG岛高甲基化修饰是导致基因沉默的重要机制,而miR-34b可通过调节下游特定靶基因USP22的表达,影响AML细胞的抑制活性,miR-34b、USP22表达水平高低又直接影响其启动子区DNA甲基化[10]。地西他滨主要通过抑制DNMT,使基因组中高甲基化CpG岛去甲基化,重新活化抑癌基因,但基本不影响已处于低甲基化状态的其他基因[11]。此外,有研究证实,低浓度地西他滨具有去甲基化作用,使沉默基因恢复表达,而当浓度升高时还可发挥细胞毒作用[12]。
本研究结果显示,治疗组化疗后ORR、miR-34b及USP22蛋白表达均显著优于对照组,与Khan等[13]研究结果一致,表明地西他滨联合CAG方案可明显提高化疗敏感性和缓解率,使复发AML获益。郭健欣等[14]研究显示,经地西他滨处理后,HL-60、K562细胞株miR-34b蛋白表达水平显著增加,甲基化明显抑制,细胞增殖率显著降低(P<0.05)。Zhou等[15]研究报道,USP22 mRNA在初诊、缓解AML中的表达量较正常人群均上调,且USP22高表达患者的诱导缓解率明显低于低表达者。
随访发现,两种方案患者的3年生存率差异无统计学意义,考虑与纳入的样本量较小有关,但治疗组中位OS期显著高于对照组,进一步证实了地西他滨联合CAG方案有助于延长生存期,改善患者预后。此外,与存活组比较,死亡组化疗后miR-34b蛋白表达明显降低,USP22蛋白表达明显升高,提示miR-34b、USP22表达与患者预后可能存在相关性,由此推测过表达miR-34b或抑制USP22表达,调控异常的高甲基化水平可能成为复发AML治疗的新靶点,可作为判断复发AML预后的标志基因之一[16]。
综上所述,地西他滨联合CAG方案治疗复发AML患者可能通过调控miR-34b及其下游靶基因USP 22的表达,逆转AML相关基因启动子区的正常甲基化,有效提高缓解率,延长生存期,改善预后。

