子午岭野生猪苓中微皮伞菌分离鉴定
段建锋 刘亚亚 秦一统 张秀丽
(庆阳市农业科学研究院,甘肃庆阳 745000)
子午岭坐落于甘肃省东部,地处陕、甘交界处,属温带半湿润气候,年平均气温7.4~8.5 ℃;年无霜期110~150 d;年降水500~620 mm;年平均相对湿度63%~68%。子午岭森林湿润的气候环境和丰富的腐殖质土层,孕育了丰富的药用植物和真菌种质资源。该地区初步鉴定统计药用植物共有101科、298种,其中猪苓、羊肚菌、猴头菌、双孢蘑菇、木耳等真菌最为常见[1]。微皮伞Marasmiellus是担子菌门,层菌纲,伞菌目,小皮伞科,微皮伞属真菌的总称[2]。微皮伞属约含250 个种,其中模式种为桧微皮伞Marasmiellus juniperinusMurrill[3-4]。该属担子果皮伞状、脐菇状或侧耳状,孢子印白色,世界各地均有分布。我国目前有白盖微皮伞M.albiceps、白褐微皮伞M.albofuscus、白微皮伞M.candidus等 45 个记录[5-7]。皮伞的药用较多,众多研究表明枝生微皮伞Marasmiellus ramealis和硬柄小皮伞Marasmius oreades具有抗肿瘤、抗菌、调节免疫和抗衰老等功效[8],安络小皮伞Marasmius androsaceus具有止痛、治疗偏头痛、风湿关节炎等作用[9]。猪苓作为药用真菌,以菌核入药,是我国著名的传统中药材。研究分离子午岭野生猪苓菌核组织,得到菌株Z1j2,运用形态学观察及rDNA-ITS 分子生物学鉴定的方法鉴定该菌株(GenBank 登录号为OL351833),并对其生物学特性进行研究,对丰富当地真菌种质资源及后续开发利用具有十分重要的意义。
1 材料与方法
1.1 试验材料
供试猪苓菌种:2019 年9 月于甘肃省庆阳市连家砭子午岭林区,坐标北纬 36°02',东经 108°28',海拔1 260 m,选择单株产量高、新鲜、有光泽、弹性好的猪苓菌核,低温处理后带回实验室用PDA 培养基[10]进行组织分离而得。
1.2 试验仪器与试剂
(1)仪器:立式高压灭菌锅、恒温培养箱、电子天平、生物安全柜、水浴锅等。
(2)试剂:75%乙醇、无水乙醇、葡萄糖、琼脂粉、无菌水、盐酸金霉素溶液。
1.3 试验方法
1.3.1 组织分离
首先将猪苓菌核清洗干净,放入0.2%的金霉素溶液中浸一下,立即取出,用无菌棉擦干净,然后按无菌环境操作要求,用无菌刀片从猪苓菌核中间切开,用无菌镊子在菌核中央挑取0.5 cm 大小的菌肉若干块,迅速将其放于制备好的PDA 培养基上,每个培养基上放4 块[11],放入恒温培养箱内,25 ℃黑暗条件下恒温培养[12]。每天观测分离得到的菌落形态与培养性状,若发现有菌丝长出,初步分类并待产孢后进行纯化,单孢分离纯化采用平板稀释画线分离法[13]。
1.3.2 形态观察
采用传统鉴定方法,宏观特征肉眼观察、游标卡尺测量等方法,测量菌落直径,观察菌丝颜色。查阅文献进行检索、比对、初步定种;将分离纯化的菌株接种到PDA 培养基上,25 ℃恒温培养7 d 后取出,用透明胶带的胶面轻轻接触菌落表面,粘取一定量的菌丝体。在载玻片中央滴一滴乳酸酚棉兰染液,将粘有菌丝体的透明胶带完全浸入载玻片的染液内,并固定胶带,自然风干后,在光学显微镜下观察和测量孢子、菌丝形态及大小[14]。
1.4 ITS鉴定
1.4.1 DNA的提取
将原始菌株扩大培养后利用TIANGEN DNA KIT提取原始菌基因组DNA。
1.4.2 PCR扩增、纯化及测序
配置PCR 反应液(表1)混匀后在PCR 扩增仪(ABI9700)上进行PCR,反应程序如表2。DNA 的提取、扩增产物的纯化与测序均由通用生物系统(安徽)有限公司完成。

表1 PCR反应体系

表2 PCR反应程序
ITS1:5'-TCCGTAGGTGAACCTGCGG-3'
ITS4:5'-TCCTCCGCTTATTGATATGC-3'
1.4.3 ITS序列比对分析
基于测序结果的ITS 序列,通过Chromas 软件拼接,在NCBI 数据库中进行ITS 序列的Blast 比对,从GenBank 下载的ITS 序列(表3),依据最大似然率从检索的结果里挑选出同源性比较高的ITS 序列,先利用ClustalX 在线软件进行多序列比对,然后利用MEGA7.0 软件构建系统发育树,发育树的每个分支的统计学显著性分析以最大似然法进行检验,重复次数为1000 次,根据ident(百分比)最终确定菌株的分类地位。RensKeLandeweer 等[15]认为通过ITS 区域比对,序列相似性大于99%,鉴别为相同种;序列相似性大于95%且小于99%,鉴别为相同属。

表3 从GenBank下载的ITS序列来源信息
1.5 菌株Z1j2生物学特性研究
1.5.1 培养温度试验
试验设定 5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃等7 个温度处理,将纯化培养7 d 的菌种,用无菌打孔器制成直径为0.5 cm 菌饼,接种于PDA 培养基中央,置于以上7 个温度处理的恒温培养箱。逐日观察并采用十字交叉法分别测定菌落的直径,计算菌丝平均生长速度。
1.5.2 pH试验
PDA 培 养 基用 0.1 mo1/L HCl 或 NaOH 调 成 pH为5.0、6.0、7.0、8.0、9.0、10.0等6个梯度后灭菌,制平板,将菌饼接在不同pH 的PDA平板中央,于25 ℃条件下黑暗培养。数据测定及计算方法同1.5.1。
1.5.3 菌株Z1j2致死温度的测定
在刻度试管中加蒸馏水2 mL,封口并高压灭菌,冷却后于无菌环境中接入直径为0.5 cm的菌饼,置于 25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃的水浴锅加热15 min,立即置凉水中冷却至室温。将处理后的菌饼接种到PDA平板上。数据测定等同1.5.1。
1.5.4 供试碳源试验
用蔗糖、可溶性淀粉、麦芽糖、甘露醇、果糖代替基础培养基等量的葡萄糖,配制含不同碳源培养基,接入直径0.5 cm 的菌饼,置于25 ℃黑暗条件下培养。数据测定等同1.5.1。
1.5.5 供试氮源试验
用酵母膏、尿素、硝酸铵、氯化铵、硫酸铵代替基础培养基等量的蛋白胨,配制含不同氮源培养基,接入直径0.5 cm 的菌饼,置于25 ℃黑暗条件下培养。数据测定等同1.5.1。
2 结果与分析
2.1 Z1j2菌株的菌落形态特征
在PDA 培养基上,Z1j2 菌株的菌落为白色,絮状,气生菌丝发达,蓬松,菌丝具有较强的爬壁能力(图1、图2)。25 ℃条件下PDA 培养基上培养7 d后,菌落直径达81 mm,基本长满培养皿。在光学显微镜和电镜扫描下观察到微皮伞菌菌丝形态如图3、图4所示。
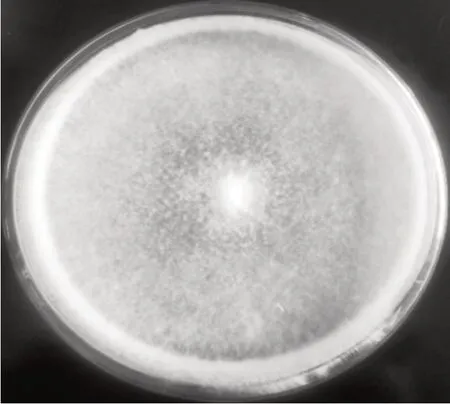
图1 菌丝培养7 d形态(正面)

图2 菌丝培养7 d形态(反面)

图3 菌丝光学显微镜照片(10×40)

图4 菌丝扫描电镜照片(×2 000)
2.2 Z1j2菌株的ITS鉴定
为鉴定试验中分离获得的Z1j2 菌株与已知真菌的近缘关系,并确定其科学分类地位,利用PCR技术对分离获得Z1j2 菌株的ITS 序列进行扩增(图5)并测序,序列的大小为748 bp。与GenBank中已登录的序列进行比对分析,菌株Z1j2 与微伞菌属真菌的ITS 序列相似性达99%以上,利用最大似然率构建微皮伞属系统发育树,从系统发育树上看到菌株Z1j2 与参照序列Marasmiellussp.(KJ609164.1)聚在同一小分支中(图6),支持率为40%,结合菌落形态和ITS 序列分析,分离获得的Z1j2 菌株为担子菌门Basidiomycota、伞菌目Agaricales、小皮伞科Marasmiaceae、微皮伞属Marasmiellus真菌。

图5 Z1j2菌株的PCR产物

图6 基于ITS序列(ITS1,5.8S rDNA and ITS4)构建的系统发育树(最大似然率)
2.3 温度试验结果
由图7 可以看出,随着培养温度升高,Z1j2 菌株菌丝平均生长速度逐渐加快,当温度为25 ℃时菌丝平均生长速度达最大值,且与其他温度差异显著。培养温度在25~30 ℃时菌丝生长较快,但培养温度进一步升高,菌丝的生长受到抑制。

图7 不同培养温度下Z1j2菌株菌丝生长情况
Z1j2 菌株菌丝在 50 ℃,处理 15 min 就不能生长,可见菌丝致死温度为50 ℃(图8)。

图8 Z1j2菌株菌丝致死温度
2.4 pH试验结果
由图9 可以看出,Z1j2 菌株在试验pH 的培养基上生长表现出差异,随着pH 升高,菌丝的平均生长速度有下降的趋势,可见Z1j2 菌株的菌丝生长适宜偏酸性。

图9 不同pH下Z1j2菌株菌丝生长情况
2.5 碳源试验结果
由表4 可知,供试6 种碳源中,以可溶性淀粉为碳源时,微皮伞菌Z1j2 菌丝生长最快,菌丝浓密,菌落边缘规则,日平均生长速度为0.82 cm/d,显著快于其他碳源,果糖、甘露醇、蔗糖、葡萄糖次之,麦芽糖菌丝日均长速最慢,为0.74 cm/d。综合菌丝日平均生长速度及长势,Z1j2 菌株固体培养基中的最佳碳源为可溶性淀粉。

表4 不同碳源对Z1j2菌株菌丝生长的影响
2.6 氮源试验结果
由表5 可知,以尿素为氮源时Z1j2 菌株菌丝平均生长速度最快,日均长速为0.74 cm/d,显著快于其他氮源,且菌丝生长粗壮浓密,边缘规则,爬壁力强;以蛋白胨、酵母膏、硝酸铵、硫酸铵为氮源时,Z1j2 菌丝生长速度无显著性差异,氯化铵为氮源时菌丝生长最慢。综合菌丝平均生长速度及长势,确定尿素为微皮伞菌Z1j2菌株菌丝生长的最佳氮源。

表5 不同氮源对Z1j2菌株菌丝生长的影响
3 小结
对子午岭野生猪苓菌核中分离出的菌株形态学观察和分子生物学鉴定结果表明,该菌株(Z1j2)为微皮伞属Marasmiellus真菌。对Z1j2 菌株的生物学特性研究结果表明,Z1j2 的最适宜生长温度为25 ℃,极端低温和高温都抑制其生长,菌丝致死温度为50 ℃。该菌株菌丝生长适宜偏酸性的培养基,最适碳源为可溶性淀粉,最适氮源为尿素。目前关于南方小皮伞科物种的报道居多,北方微皮伞属物种的报道较少。子午岭作为天然氧吧,动物、植物、微生物等种质资源都极为丰富[16],希望通过笔者的研究,吸引更多专家学者关注子午岭野生中药材和微皮伞属等真菌物种,以便于今后开发利用更有价值的真菌资源。

