参芪调体方治疗多囊卵巢综合征胰岛素抵抗脾虚痰湿型的疗效及对炎症微环境状态的影响※
郝松莉 张春兰△ 孟小钰 孙 淼 侯丽辉
(1.黑龙江中医药大学附属第一医院妇三科,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院妇二科,黑龙江 哈尔滨 150040)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期女性较为多见的一种内分泌紊乱性疾病,患者可出现生殖功能障碍和代谢异常表现,如不孕、肥胖、排卵障碍、多毛、月经紊乱等[1]。胰岛素抵抗(insulin resistance,IR)是PCOS发病的主要病理机制,研究表明,PCOS患者中大约有64.4%存在IR[2]。IR的存在可增加PCOS患者并发2型糖尿病、原发性高血压等疾病的风险,使临床治疗难度增加,不利于患者预后。因此,改善IR对于PCOS的治疗方式具有重要临床意义。中医学认为,PCOS的发生与血瘀和痰湿密切相关,IR的发生则如同体内痰瘀阻滞,因而多囊卵巢综合征胰岛素抵抗(polycystic ovary syndrome insulin resistance,PCOS-IR)患者的治疗应侧重化瘀血,祛痰湿[3]。既往小样本临床观察表明,参芪调体方有改善生殖障碍和代谢异常的疗效[4]。2018年5月至2019年12月,我们在地屈孕酮片治疗基础上应用参芪调体方治疗PCOS-IR脾虚痰湿型48例,并与单纯应用地屈孕酮片治疗48例对照,观察临床疗效及对炎症微环境状态的影响,结果如下。
1 资料与方法
1.1 病例选择
1.1.1 诊断标准 西医诊断参照《多囊卵巢综合征诊断标准和诊疗指南介绍》[5],①稀发排卵和(或)无排卵;②临床和(或)实验室指标提示存在高雄激素血症;③超声检查有至少一侧卵巢呈多囊样改变:单侧卵巢有或超过12个直径在2~8 mm的小卵泡,和(或)卵巢体积>10 cm3;④排除先天性肾上腺增生、分泌雄激素肿瘤和库欣综合征等相关致病因素。符合以上诊断标准中的3项即可诊断,其中第④项必须满足。中医诊断参照《中医妇科学》[6]中不孕的诊断标准。辨证分型标准参照《24个专业105个病种中医诊疗方案(试行)》[7]中脾虚痰湿型,主症:形体肥胖,不孕,月经后期或闭经,月经量少,色淡;兼症:倦怠乏力,肢体困重,胸腹痞满,大便黏腻或不成形,带下量多,色白质黏;舌脉:舌淡胖或有齿痕,苔白或白腻,脉滑或沉涩、沉缓、沉浮。具备主症1项、兼症3项,参照舌脉,即可诊断。
1.1.2 纳入标准 符合以上西医、中医诊断标准及辨证标准;年龄18~35岁;体质量指数(BMI)24~28,胰岛素抵抗指数(HOMA-IR)>2.14;精神及意识正常,且治疗依从性良好者;6个月内无生育要求者;月经稀发或闭经,月经周期>35 d者;自愿参加本研究并签署知情同意书。
1.1.3 排除标准 合并严重肝、肾、心脏器质性疾病者;精神及意识障碍者;合并盆腔炎性包块、生殖系统感染者;合并严重凝血功能障碍、急性感染性疾病、恶性肿瘤者;子宫肌瘤、子宫内膜息肉等妇科疾病者;入组前近3个月内使用激素类药物者。
1.2 一般资料 全部96例均为我院妇科门诊患者,按照随机数字表法分为2组。治疗组48例,年龄23~35岁,平均(33.57±4.12)岁;病程1~6年,平均(3.48±0.51)年;超重20例,多毛18例,痤疮13例;已婚33例。对照组48例,年龄25~45岁,平均(33.76±4.04)岁;病程1~7年,平均(3.65±0.67)年;超重22例,多毛19例,痤疮12例;已婚31例。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.3 治疗方法
1.3.1 对照组 予饮食和运动指导,同时保持情绪舒畅,作息规律。地屈孕酮片(Abbott Biologicals B.V.,进口药品注册证号H20130110)10 mg,每日2次口服,于月经周期第22 d服用,连用7 d,无月经周期的选择某1天开始口服,连用7 d。治疗3个月经周期。
1.3.2 治疗组 在对照组治疗基础上应用参芪调体方。药物组成:黄芪30 g,西洋参10 g,白术20 g,丹参20 g,茯苓15 g,山楂20 g,陈皮10 g。日1剂,水煎2次取汁300 mL,从月经第1天开始,每日分早、晚2次温服,连续用药3个月,经期停服。
1.4 观察指标及方法 ①性激素指标检测。治疗前后采集患者月经第2~4天外周静脉血,使用全自动免疫分析仪(Vitros 5600型,强生公司)及配套试剂检测卵泡刺激素(FSH)、黄体生成激素(LH)、雌二醇(E2)和总睾酮(T)水平,检测方法为免疫发光法。②血糖及胰岛素指标。治疗前后采集患者清晨空腹肘静脉血,测定空腹血糖(FPG)水平,采用电化学发光法检测空腹胰岛素(FINS)水平,稳态模型评估法对患者胰岛素抵抗指数(HOMA-IR)进行评估,HOMA-IR=FPG×FINS/22.5。③血脂指标。治疗前后采用全自动生化分析仪(OLYMPUS AU640型,美国贝克曼公司)检测患者血脂指标。甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)水平。④炎症因子指标。治疗前后采集患者清晨空腹肘静脉血3 mL,经离心后取上清液,放置于-80 ℃条件下冻存。取患者冻存血清标本,经解冻后采用酶联免疫吸附法(ELISA)检测血清炎症因子可溶性糖基化终产物受体(sRAGE)、白细胞介素8(IL-8)和肿瘤坏死因子α(TNF-α)水平。⑤卵巢检查。治疗前后采用四维彩色超声诊断仪(Voluson E8型,美国GE公司)检测患者卵巢内卵泡数量,并测量卵巢长径、前后径及横径,卵巢体积=0.5×长径×前后径×横径。⑥安全性评价。观察2组患者治疗期间出现的恶心呕吐、皮疹等不良反应情况,计算总发生率。

2 结果
2.1 2组治疗前后性激素指标比较 2组治疗后LH水平均较本组治疗前降低(P<0.05),且治疗组低于对照组(P<0.05)。2组治疗前后及治疗后T、FSH、E2比较差异均无统计学意义(P>0.05)。见表1。
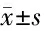
表1 2组治疗前后性激素指标比较
2.2 2组治疗前后血糖及胰岛素指标比较 2组治疗后FPG、FINS、HOMA-IR均较本组治疗前降低(P<0.05),治疗后治疗组FINS、HOMA-IR均低于对照组(P<0.05),FPG比较差异无统计学意义(P>0.05)。见表2。
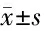
表2 2组治疗前后血糖及胰岛素指标比较
2.3 2组治疗前后血脂指标比较 2组治疗后TC、TG、LDL-C均较本组治疗前降低(P<0.05);2组治疗后TC、TG、LDL-C、HDL-C比较差异均无统计学意义(P>0.05)。见表3。
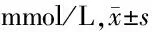
表3 2组治疗前后血脂指标比较
2.4 2组治疗前后血清炎症因子水平比较 2组治疗后血清sRAGE、IL-8、TNF-α水平均较治疗前降低(P<0.05),且治疗组降低更明显(P<0.05)。见表4。

表4 2组治疗前后血清炎症因子水平比较
2.5 2组治疗前后卵巢体积、卵巢内部卵泡数目比较 2组治疗前后左、右侧卵巢体积及卵巢内部卵泡数目比较差异均无统计学意义(P>0.05)。见表5。
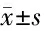
表5 2组治疗前后卵巢体积、卵巢内部卵泡数目比较
2.6 2组安全性评价 2组治疗期间均未出现明显不良反应。
3 讨论
PCOS-IR的病理机制较PCOS更为复杂,具有异质性、难治性及高发性等特点[8]。PCOS-IR患者体内胰岛素含量处于异常状态,高浓度的胰岛素会引起颗粒细胞及卵泡膜细胞过度增殖,导致LH/FSH比例失调,LH水平异常升高,使机体处于稀发排卵或无排卵状态[9]。PCOS-IR患者LH分泌量异常增加,导致机体雄激素水平明显升高,易诱发高雄激素血症,而雄激素水平过高会影响卵巢内早期卵泡发育,刺激卵泡生长,引起卵巢多囊样变化,同时加重IR,导致恶性循环,此外雄激素分泌异常还可通过间接或直接途径引起葡萄糖代谢异常,导致机体血糖水平异常,加重IR[10]。现阶段临床治疗PCOS主要通过口服孕激素、雌激素治疗,可纠正高雄激素血症,改善IR,促进卵巢功能恢复。地屈孕酮与天然孕激素相似,是临床治疗POCS常用的孕激素,能调节内分泌,改善性激素分泌紊乱[11]。但长期服用地屈孕酮的副作用较多,可能增加卵巢过度刺激综合征等并发症的发生风险。
PCOS-IR属中医学“癥瘕”“闭经”“不孕症”等范畴,其病因病机与先天因素的肾、后天因素的脾及情志因素的肝的功能失调关系密切[12-13]。肾主生殖,藏先天之精,内寓元阴元阳,为癸水之源;脾主运化,为后天之本,脾虚则精不散,不能上承则口渴,即表现为“上消”;肝气郁结,脾虚运血无力而致血瘀,终将导致痰瘀互结。肾、脾、肝等三脏腑功能失调,痰湿阻滞,冲任受损,脉道壅塞,故胞宫中经血不得下行。此外,脾内生湿,湿邪日久成痰,脾土恶湿,久病不愈,浸润胞宫,胞宫膏脂增多,胞宫难以种精受孕。针对上述病因病机,中医学认为治疗PCOS-IR应遵循益气健脾、化痰除湿、活血祛瘀的基本原则。参芪调体方由《太平惠民和剂局方》中的参苓白术散加减而成,在原方益气健脾、和胃渗湿基础上增加了化痰活血、利湿祛瘀之品,方中黄芪补中益气,利水消肿[14];白术健脾益气,燥湿利水,并具有消除疲倦的效果;西洋参益气养阴,清热生津;丹参活血祛瘀,消肿止痛,通经调经;茯苓祛痰利水,健脾和胃,宁心安神[15];陈皮燥湿化痰,调理脾胃;山楂消食健胃。诸药合用,共奏益气健脾、化痰除湿、活血调经之效。现代药理研究表明,黄芪能发挥改善物质代谢、增强性腺功能、抗应激作用[16];西洋参有调节内分泌和增强人体免疫力的作用[17];白术能抗氧化[18];山楂降压降脂[19];陈皮调节消化系统,促进排痰[20]。本研究结果显示,治疗组治疗后LH、FINS、HOMA-IR水平均低于对照组(P<0.05),提示参芪调体方治疗PCOS-IR脾虚痰湿型,可明显调节患者性激素水平,改善IR。分析原因为治疗组在地屈孕酮治疗基础上使用参芪调体方可起到协同促进作用,帮助调节患者“痰湿”和“血瘀”体质,控制PCOS病情,促进糖脂代谢,减轻机体IR,提高临床效果。
有研究指出,PCOS的发生与IR和慢性炎性反应密切相关,其中机体炎症微环境在PCOS和IR的形成和发展中发挥着重要作用[21]。既往研究表明,炎症微环境是诱导脂肪细胞产生IR、血脂异常进而造成PCOS发生和发展的病理因素之一,血清促炎因子还可通过诱导IR等多种途径促进雄激素合成和分泌,加重病情[22]。sRAGE是一种与糖尿病IR密切相关的细胞因子,可参与炎性反应、动脉粥样硬化等多种疾病,sRAGE已被研究表明可促进PCOS患者IR进展,其机制可能与其介导和扩大炎性反应,促进IR进程有关[23]。IL-8和TNF-α是常见的炎症细胞因子,其中IL-8是趋化因子家族的一种细胞因子,可促进炎症细胞趋化和诱导细胞增殖,与LH、游离睾酮呈正相关。IL-8可能在白细胞浸润脂肪组织过程中作为炎性递质参与了PCOS合并IR患者的慢性炎症过程,并促进了促性腺激素及雄激素的生物合成[24-25]。本研究结果发现,治疗组治疗后血清sRAGE、IL-8和TNF-α水平均低于对照组(P<0.05),表明参芪调体方能改善PCOS-IR患者炎症微环境状态,这可能是因为参芪调体方中发挥益气健脾、化痰除湿、活血调经功效,对于改善机体炎症微环境状态具有明显的促进作用。
综上所述,参芪调体方治疗PCOS-IR脾虚痰湿型,可明显改善患者IR和炎症微环境状态,值得临床推广应用。

