5-FU节拍化疗策略优化及调节胃癌免疫微环境的体内实验研究
蒋金玲,周尘飞,2,奚文崎,施敏,耿梅,赵丽琴,蔡劬,蒋劲松,张俊,2
1.上海交通大学医学院附属瑞金医院肿瘤科,上海 200025;
2.上海交通大学医学院附属瑞金医院无锡分院肿瘤科,江苏 无锡 214021
全球近半数的新发胃癌患者和死亡病例在中国,尽管经过多年努力,其发病率略有下降,但中国胃癌整体疗效仍未得到明显改善。究其原因可能在于:①早期诊断率低,大多数患者确诊时已处于晚期,丧失了手术根治机会[1];② 长疗程、大剂量的细胞毒性药物治疗导致的不良反应难以耐受,并由此导致治疗中断、治疗减量和治疗延迟[2];③亟待建立更为有效的全程管理的多学科综合治疗模式;④ 在不断研发新药的基础上,进一步优化现有细胞毒性药物的临床应用模式,以保障疗效和减少毒性。化疗仍是目前大多数进展期胃癌患者的主要治疗手段,常规的胃癌化疗给药模式是大剂量、间隔给药,采用此类模式的主要原因是药物毒性使患者难以接受持续性治疗,而化疗间歇期可能也给肿瘤细胞带来喘息机会并导致耐药。世界卫生组织已将恶性肿瘤定义为慢性疾病,但目前的大剂量、间隔性给予化疗药物的模式,显然已不适应“慢性疾病”的治疗需求。
节拍化疗是通过相对低剂量、高频度、持续应用细胞毒药物的给药方式,使药物能够长时间维持在相对较低、有效的血药浓度,以达到延长疾病控制时间,同时降低不良反应的目的。经20余年的反复探索与改进,多个临床研究已证实其在肿瘤治疗中的作用,且因其给药方便(口服为主)、不良反应轻、疗效不减及不易耐药等优点,逐渐成为老年肿瘤患者或晚期肿瘤患者维持治疗的首选[3]。已有研究[4-6]证实,节拍化疗主要通过抗血管生成发挥抑瘤效应,本课题组前期通过胃癌[7]和结肠癌[8]裸小鼠模型也验证了这一理论。就临床实践而言,针对不同瘤种、不同作用机制药物的节拍化疗给药模式等,以及除抑制肿瘤增殖及调控血管生成外,节拍给药抑制肿瘤的其他作用机制尚有待深入研究。有鉴于此,本研究通过建立胃癌裸小鼠模型,以5-氟尿嘧啶(5-fluorouracil,5-FU)为研究药物,以优化节拍化疗的不同给药频率和模式为目的,采用多种分子生物学技术手段,探索5-FU对裸小鼠胃癌的最佳节拍化疗模式及相关作用机制,进而探索最佳的胃癌节拍化疗模式,为进一步推动节拍化疗的临床实践提供支持数据。
1 材料和方法
1.1 材料
人SGC-7901胃癌细胞系购自中国科学院典型培养物保藏委员会细胞库,使用含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养基培养;4~6周龄雌性BALB/c裸小鼠12只[无特定病原体(specific pathogen free,SPF)级],体重18~20 g,购自中国科学院上海生命科学研究院上海实验动物中心,动物实验经过上海交通大学医学院伦理委员会批准;5-FU(0.25 g/10 mL)购自上海旭东海普药业有限公司;酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒购自美国R&D公司;CD117、Flk-1及Sca-1单抗购自美国eBioscience公司;胶原酶、脱氧核糖核酸酶Ⅰ和透明质酸酶购自美国Sigma公司;B细胞(CD45+CD11b+)、自然杀伤(natural killer,NK)细胞(CD49B+NK1.1+)、肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)(F4_80+CD86+、F4_80+CD206+)和髓源性抑制细胞(myeloid-derived suppressor cell,MDSC)(Ly6C+Ly6G+)流式细胞术检测抗体购自美国BD公司;CD11c、CD163抗体购自英国Abcam公司。
1.2 方法
1.2.1 胃癌裸小鼠移植瘤模型建立
将处于对数生长期的SGC-7901胃癌细胞株调整至(2~3)h 107/mL的浓度,于每只BALB/c裸小鼠的右前肢腋下皮下接种0.2 mL。
待移植瘤体积达到约200 mm3时,将12只裸小鼠随机分成4组:最大耐受剂量(maximum tolerated dose,MTD)组(52.5 mg/kg,每周给药2次,连续2周,停1周)、每日节拍化疗(daily metronomic chemotherapy,MET-qd)组(10 mg/kg,每天1次,连续6周)、隔日节拍化疗(every other day metronomic chemotherapy,MET-qod)组(20 mg/kg,隔日1次,连续6周)和每周2次节拍化疗(twice-weekly metronomic chemotherapy,MET-biw)组(30 mg/kg,隔2 d给药1次,连续6周)。以每21天为1个疗程,共2个疗程。具体实验分组及给药方法见图1。开始用药后每周测量裸小鼠体重、肿瘤最大径(a)和与之相垂直的横径(b),肿瘤体积按照公式V(mm3)=1/2ab2计算,绘制肿瘤生长曲线。

图1 裸小鼠移植瘤实验分组及给药模式图Fig.1 Experimental groups and administration methods of xenograft tumor in BALB/c nude mice
1.2.3 流式细胞术检测
外周血内皮祖细胞(circulating endothelial progenitors,CEP)数量检测:6周后处死裸小鼠,眼眶取血,每只取100 μL外周全血,按照实验分组,每只裸小鼠均取100μL外周全血至流式管中,加入相应量的CD117、Flk-1、Sca-1单抗,MTD组加入混合血清,再加入同型阴性对照抗体,采用流式细胞术检测各组CEP数。
脾脏和瘤体内浸润的免疫细胞检测:6周后处死裸小鼠,取脾脏及瘤体,用生理盐水冲净后,分别加入胶原酶、脱氧核糖核酸酶Ⅰ和透明质酸酶,在摇床上37 ℃消化1~2 h,70 mm过滤器过滤消化液,制备成单细胞悬液,加入B细胞(CD45+CD11b+)、NK细胞(CD49B+NK1.1+)、TAM(F4_80+CD86+、F4_80+CD206+)和MDSC(Ly6C+Ly6G+)相对应的抗体,上流式细胞仪检测各组相应的免疫细胞量。
1.2.4 ELISA检测
收集裸小鼠外周血,12000×g离心10 min后留取血浆,按ELISA操作说明书,分别检测各组血浆标本的血管生成相关因子 [血管内皮生长因子(vascular endothelial growth factor,VEGF)和血小板源性生长因子(platelet derived growth factor,PDGF)]、M1型TAM细胞因子 [白细胞介素(interleukin,IL)-12]和M2型TAM细胞因子(IL-10)等。
1.2.5 免疫组织化学染色
①苏华、徐新宇:《英国药业反垄断执法经验借鉴(二):辉瑞案的再思考》,载《中国价格监管与反垄断》2017年第1期。
用药6周后处死裸小鼠,将剥离的瘤体组织常温下以10%中性甲醛溶液固定24 h,常温石蜡包埋后4 μm连续切片,使用CD11c(1∶100)和CD163(1∶200)一抗温育,在光学显微镜下每张玻片随机选取5个视野拍照。使用Image-Pro软件对染色强度及密度进行半定量分析(表 1)。

表1 免疫组织化学染色半定量分析法Tab.1 Immunohistochemical staining for semi-quantitative analysis
1.2.6 不良反应评价
一般状况:用药后每周观察裸小鼠饮食、活力、精神状态并测量体重。
血液学毒性:6周后处死裸小鼠时眼眶取血,行血细胞计数。
脏器毒性:6周后处死裸小鼠,留取肺、肝、心和肾脏组织进行H-E染色,由2名病理科医师独立进行切片、读片和评判。
1.3 统计学处理
采用SPSS 22.0软件对数据进行统计分析,描述性数据采用xfs表示,组间差异比较采用单因素方差分析(ANOVA),两两比较平均次数采用Tamhane’sT2检验。P<0.05为差异有统计学意义。
2 结果
2.1 低剂量5-FU MET-qod可达最佳抑瘤效应
在各用药组中,MET-qod 组裸小鼠移植瘤从给药第5 周开始,生长速度明显慢于MTD组[(1211.57f 132.47)mm3vs(1402.29f 105.33)mm3,P=0.041],至第6周时两组差距进一步增大[(1567.30f 157.28)mm3vs(1789.81f 116.75)mm3,P=0.036)],且两组瘤重差异明显[(1.09f 0.25)gvs(1.62f 0.13)g,P=0.038,图2]。其他各组之间,无论是肿瘤生长趋势还是瘤重均未见明显差异。

图2 低剂量5-FU MET-qod节拍化疗抑制裸小鼠移植瘤生长Fig.2 Low dose 5-FU MET-qod metronomic chemotherapy inhibits the growth of xenograft tumors in BALB/c nude mice
2.2 5-FU节拍化疗通过减少肿瘤血管生成抑制肿瘤
为探索5-FU不同节拍化疗模式对肿瘤血管生成的影响,通过流式细胞术检测各药物处理组裸小鼠外周血CEP。与MTD组(45.3f 4.3%)相比,节拍化疗可显著减低外周血C E P(P<0.001),但3种节拍化疗模式间则无显著差异(MET-qd组为14.8f 3.8%,MET-qod组为19.9f 6.2%,MET-biw组为17.8f 3.9%,图3A、3B)。进一步通过ELISA检测外周血VEGF和PDGF浓度,结果显示,节拍化疗组VEGF浓度明显低于MTD组(228.36f 9.97 pg/mL,P<0.001,图3C、3D),但MET-qod组的VEGF浓度(63.39f 4.21pg/mL)下降并不显著;MTD组与MET-qod组的PDGF浓度差异无统计学意义(P> 0.05)。以上结果提示,抑制血管生成参与了5-FU节拍化疗的抗肿瘤效应。
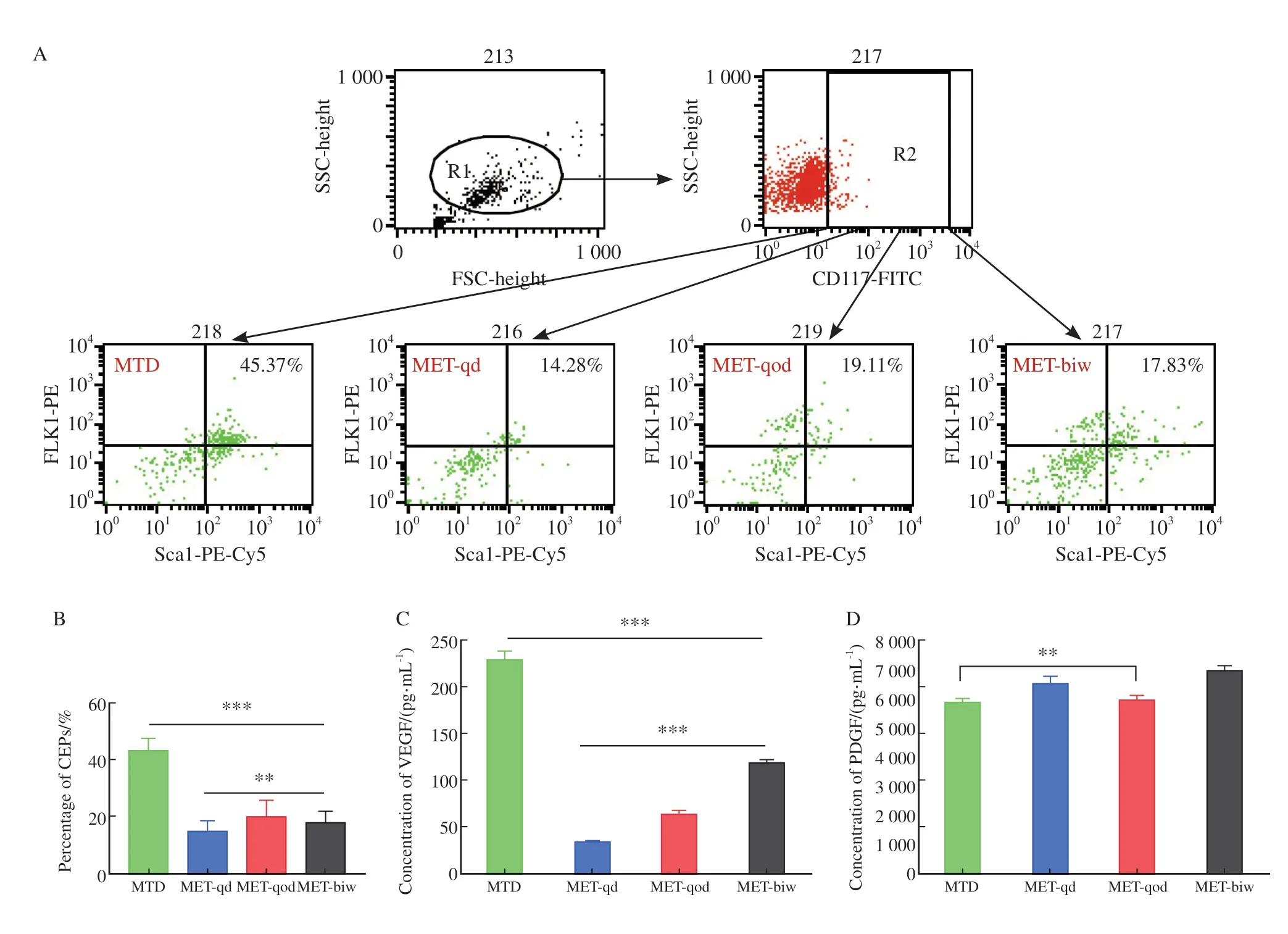
图3 血管生成参与5-FU节拍化疗的抗肿瘤作用Fig.3 Angiogenesis participates in the antitumor effect of 5-FU metronome chemotherapy
2.3 TAM极化参与5-FU节拍化疗的抗肿瘤作用
为探索节拍化疗对肿瘤免疫微环境的影响,通过流式细胞术检测裸小鼠脾脏和移植瘤体内浸润的免疫细胞。结果显示,与MTD组相比,MET-qod组脾脏和瘤体内浸润的TAM极化(M1∶M2)差异明显,抑制肿瘤生长的M1型TAM的比例明显升高(脾脏:1.78f 0.21vs1.19f 0.07;瘤体:0.57f 0.11vs0.14f 0.09;P<0.001,图4A、4B)。各组间的B细胞、NK细胞和MDSC等其他免疫细胞数量无显著差异。
外周血TAM极化相关趋化因子检测结果显示,MET-qod组的M1型TAM细胞因子IL-12明显高于MTD组(45.62f 0.95vs35.55f 1.50,P=0.031),而M2型TAM细胞因子IL-10数量则明显减少(12.56f 1.52vs32.03f 0.89,P<0.001,图4C、4D)。免疫组织化学染色结果显示,MET-qod组裸小鼠移植瘤内M1型TAM标志物CD11c的表达明显增多,而M2型TAM标志物CD163的表达较其它组减少(图4E)。以上结果提示,MET-qod组瘤体内浸润的TAM以抑癌的M1型为主,可协同5-FU的抑制肿瘤生长效应。
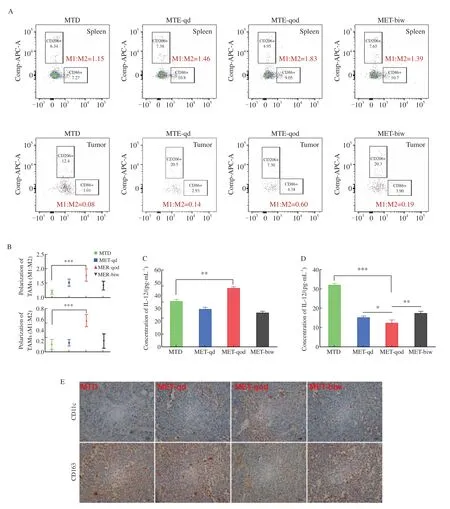
图4 TAM的极化参与5-FU节拍化疗的抗肿瘤效应Fig.4 Polarization of TAM is involved in the antitumor effect of 5-FU metronomic chemotherapy
2.4 接受5-FU节拍化疗裸小鼠耐受性良好
为评估不同药物处理方式对裸小鼠的毒性,在处死裸小鼠时同步收集肺、肝、心、肾和外周血进行H-E染色和细胞计数,结合裸小鼠体重动态监测,结果显示,各组裸小鼠体重变化无明显差异(图5A)。节拍化疗组的血液学毒性明显轻于MTD组(图5B),白细胞计数在MTD和MET-qod组中分别为(6.3f 0.89)h 103/μL和(21.7f 1.21)h 103/μL,差异有统计学意义(P<0.001),血小板计数分别为(304f 11.5)h 103/μL和(1044f 12.87)h 103/μL,差异有统计学意义(P<0.001)。H-E染色发现MTD组裸小鼠肺组织表现为慢性炎症和间质增厚(图5C),而节拍化疗模式处理各组裸小鼠的肝、心和肾脏组织无明显改变,且组间无差异(图5D~5F)。
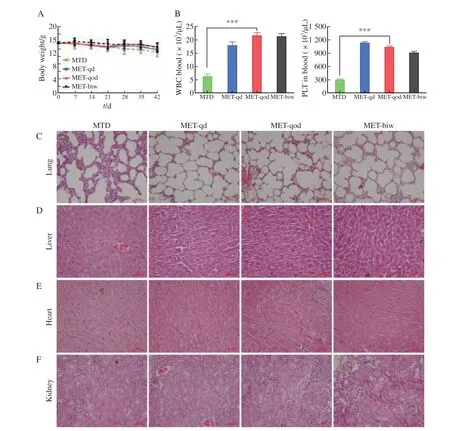
图5 5-FU节拍化疗裸小鼠耐受性良好Fig.5 5-FU metronomic chemotherapy was well tolerated in mice
3 讨论
本课题组前期研究[7]结果显示,氟尿嘧啶类药物节拍化疗可通过抗肿瘤血管生成抑制胃癌细胞体内外的增殖。本研究再次验证了以上现象,除抑制肿瘤血管生成参与5-FU节拍化疗的抗肿瘤作用外,免疫激活也作为重要环节参与其中。随着免疫治疗的快速发展,已有若干研究证实节拍化疗与免疫细胞之间的相互作用。Ghiringhelli等[9]报道,单剂量环磷酰胺节拍化疗可导致CD4/CD25调节性T细胞的耗损。在3LL细胞的Lewis肿瘤模型中,低剂量紫杉醇通过下调Bcl-2选择性抑制调节性T细胞数量和功能,而不影响效应T细胞[10]。环磷酰胺诱导生化性复发前列腺癌患者的调节性T细胞减少和前列腺特异性抗原(prostate-specific antigen,PSA)特异性T细胞活化[11]。奥沙利铂节拍化疗通过诱导钙网蛋白的表达和HMGB1的释放刺激结肠癌细胞的免疫原性细胞死亡[12]。节拍疗法靶向PARP-1调节MDSC的抑制功能,增强程序性死亡[蛋白]-1(programmed death-1,PD-1)抗体免疫治疗结肠癌[13]。低剂量环磷酰胺可消耗恶性胸膜间皮瘤患者循环naïve T细胞,激活调节性T细胞,协同以树突状细胞为基础的免疫治疗[14]。
本研究建立胃癌裸小鼠皮下移植瘤模型,通过流式细胞术、ELISA和免疫组织化学等,发现TAM的极化参与了5-FU MET-qod节拍化疗的抗肿瘤作用。与MTD组相比,MET-qod组裸小鼠无论是外周还是瘤体内杀伤肿瘤细胞的M1型TAM比例均明显升高。目前关于节拍化疗与TAM在肿瘤中的研究较少,仅在三阴性乳腺癌小鼠模型中发现,新型唑来膦酸脂质体可消耗瘤体内TAM,从而提高其抗肿瘤作用[15]。本研究结果进一步验证了TAM参与节拍化疗的抗肿瘤作用机制。
5-FU属于抗代谢类化疗药物,半衰期极短,因此经典给药方法是长时间静脉持续输注,主要不良反应为胃肠道反应和骨髓抑制。本研究发现,5-FU节拍化疗组小鼠体重无明显降低,且血液学毒性明显低于MTD组。H-E染色发现,MTD组裸小鼠肺间质增厚,呈慢性炎症表现,而节拍化疗组裸小鼠的重要脏器功能均无明显改变。以上结果提示,在给药总剂量相同的情况下,改变给药策略可在保证疗效的前提下显著减轻不良反应,若可转化应用于临床,有望更好地保护癌症患者的重要脏器功能。
改良传统化疗药物的给药模式,是在目前胃癌等实体瘤的有效药物数量有限前提下的有益探索,以克服耐药、减轻不良反应。节拍化疗是在不延长治疗间隔时间的情况下,以相对较低且毒性较小的剂量、较高频次来给予化疗药物[16]。目前,节拍化疗在胃癌中显示出良好的应用前景。对老年晚期胃癌患者采用口服氟尿嘧啶类药物(卡培他滨)节拍化疗(1000 mg/d,第1~28天,每5周1次)耐受性良好,且有效率不低于传统MTD给药[17]。每周紫杉醇节拍化疗(80~100 mg/m2)可使晚期或复发的胃食管恶性肿瘤患者生存获益[18]。低剂量卡培他滨节拍给药(1100 mg/m2/d)联合阿柏西普对于难治性胃癌患者较MTD卡培他滨联合阿柏西普的客观缓解率明显增加(15.4%vs7.7%)[19]。
节拍化疗现已成为晚期或难治性肿瘤的有效治疗策略。当肿瘤治疗进入精准治疗时代,节拍化疗如何实现精准治疗尚有待探索。就氟尿嘧啶等时间依赖性药物而言,有效药物浓度的暴露时间远比根据体表面积或体重计算出的剂量重要,而目前如何精准把握节拍化疗的给药节拍尚处于探索阶段。基于以上临床治疗难点,本研究对胃癌移植瘤裸小鼠模型采用相同总剂量、不同5-FU节拍给药模式,初步探索不同治疗模式的抗肿瘤作用。结果显示,在给药剂量相同的情况下,改变给药节拍可达到最佳抗肿瘤效应,5-FU METqod模式可明显抑制裸小鼠胃癌移植瘤生长。
癌细胞的生长具有周期性,因此临床给药充分利用其周期性特点择时(每2~3周)给药可以达到最佳抗肿瘤作用。节拍化疗的抗肿瘤作用并不是针对癌细胞,而是针对血管内皮细胞和(或)免疫间质细胞,因此其给药节拍与常规给药截然不同。目前节拍化疗给药节拍的确定尚缺少相关研究。本研究在裸小鼠胃癌移植瘤模型上发现,低剂量5-FU MET-qod具有最佳的抑瘤作用,但其抑制血管的效应并不是最强,可能与该给药节拍能更好地抑制TAM由M1向M2的转化有关。
综上所述,5-FU MET-qod可达到最佳的抑制胃癌裸小鼠移植瘤生长的作用,且耐受性良好,其作用机制一方面通过抗肿瘤血管生成,另一方面通过调节TAM的极化。上述结果可能有助于设计相关临床研究,以探索氟尿嘧啶类药物的最佳抗肿瘤给药模式,提升胃癌总体疗效,以及进一步提高患者的生活质量。
利益冲突声明:所有作者均声明不存在利益冲突。

