紫草素通过抑制氧化应激和神经炎症在脑外伤后发挥神经保护作用
朱海燕,赵晓晶,2,宋晶晶,张志远*,王晓亮
1南京医科大学基础医学院病理学系,江苏 南京 211166;2南京医科大学附属江宁医院病理科,江苏 南京 211166;3南京医科大学附属南京医院麻醉科,江苏 南京 210006
创伤性脑损伤(traumatic brain injury,TBI)是全球导致残疾和死亡的主要原因之一。全球每年有超过5 000万人患有TBI,由于中国以及其他发展中国家近年来工业化进程的高速发展,TBI 的发病率仍在每年上升[1]。TBI 的病理过程主要分为两个阶段:原发性脑损伤以及随后的继发性脑损伤。原发性脑损伤主要由机械外力引起脑组织直接损伤。最初的机械损伤可导致神经元轴突损伤、神经胶质细胞活化以及血脑屏障(blood brain barrier,BBB)破坏。继发性脑损伤的主要机制则涉及氧化应激、炎症、细胞凋亡、内质网应激(endoplasmic reticulum stress,ER stress)和线粒体功能障碍等。机械损伤造成的细胞死亡无法真正避免,而由多种机制驱动的继发性脑损伤则可以通过后期治疗进行干预。因此现阶段改善TBI预后的尝试主要集中在减轻导致继发性损伤恶化的分子级联反应[2]。虽然TBI的病理生理学已经得到了大量的研究[3-4],但目前仍然缺乏有效的针对TBI的治疗药物。
TBI 后活性氧(reactive oxygen species,ROS)过量产生导致的氧化应激参与神经元的凋亡。TBI后花生四烯酸的环氧酶途径可产生大量的ROS,而由ROS引起的兴奋性毒性作用导致钙离子内流,从而引起谷氨酸受体激活导致神经元的凋亡[5]。因此,抗氧化应激和控制神经炎症在治疗TBI 也具有相当的潜力[6]。不仅如此,小胶质细胞作为中枢神经最重要的固有免疫细胞和主要的效应细胞,在TBI后继发性炎症反应中发挥关键性作用。脑外伤后,小胶质细胞迅速活化,早期有助于清除坏死的细胞和促进组织的修复,但是在TBI 后小胶质持续的过度激活,释放大量的炎性细胞因子并不利于TBI 的修复[7]。
中医药临床疗效确切、用药相对安全、治疗方式灵活,近年来得到了越来越广泛的认可[8]。紫草是一种临床常用的中药材,其广泛的药理与临床作用备受关注。例如,紫草对肺结核合并血小板减少性紫癜效果明显,紫草注射液可以治疗急慢性肝炎[9]。除此之外,其在抗免疫缺陷以及清除活性氧等方面也有重要作用[10]。而紫草素是一种从紫草植物根中提取的萘醌化合物,其药理作用如抗肿瘤、抗氧化、抗炎、抗凋亡、促进伤口愈合等,其临床作用得到了深入的研究。先前的研究表明,紫草素通过抑制核因子(NF)⁃κB信号通路对脂多糖诱导的乳腺炎发挥抗炎作用[11]。在心肌缺血再灌注损伤小鼠中,紫草素可提高超氧化物歧化酶(superoxide Dis⁃mutase,SOD)和谷胱甘肽过氧化物酶(glutathione per⁃oxidase,GPx)水平,降低丙二醛(malondialdehyde,MDA)水平,减轻氧化应激发挥保护作用[12]。在脑缺血再灌注损伤的动物模型中,紫草素可通过抑制NF⁃κB的活性及降低p38MAPK的磷酸化负向调控肿瘤坏死因子⁃α(tumor necrosis factor⁃α,TNF⁃α)及基质金属蛋白酶9(matrix metallopeptidase 9,MMP9)的表达,发挥抑制神经炎症和保护血脑屏障的作用[13]。综上所述,紫草素可能针对神经系统的炎性反应,氧化应激损伤等有很好的保护作用。然而,紫草素在以上述神经病理改变为特征的TBI中的作用并无相关的研究。因此,本研究旨在阐明紫草素在TBI中的保护机制,为临床治疗TBI提供新思路。
1 材料和方法
1.1 材料
从南京医科大学实验动物中心购买8 周龄的C57/B6的雌性小鼠,保证小鼠适宜温度和湿度的生存环境,光照明暗各12 h。小鼠可以自由获得食物和水。所有动物实验均经南京医科大学动物护理和使用委员会批准(伦理批文编号:IACUC⁃2011010)。紫草素(Shikonin,上海陶素生化有限公司);戊巴比妥钠(Sigma⁃Aldrich公司,美国);BCA蛋白定量试剂盒(上海碧云天生物科技有限公司);NLRP3 抗体,NeuN 抗体(Novus Biologicals 公司,美国);Caspase1抗体,IL⁃1β抗体,ASC 抗体(Cell signaling technology公司,美国);GAPDH 抗体,兔二抗,鼠二抗(南京Bioworld 公司);Bax 抗体,Bcl2 抗体,Caspase3 抗体(北京Protein tech 公司);伊文思蓝染液(Sigma⁃Al⁃drich 公司,美国);小鼠脂质过氧化物(lipid perox⁃ides,LPO)ELISA试剂盒,小鼠SOD活性ELISA试剂盒,GSH⁃Px/GPx 活性检测试剂盒,小鼠ROS ELISA试剂盒(南京翼飞雪生物科技公司);脂质过氧化检测试剂盒,细胞凋亡与坏死检测试剂盒(上海碧云天生物科技有限公司)。
1.2 方法
1.2.1 动物模型构建以及实验分组
将小鼠随机分组为假手术组(Sham组),TBI模型组(TBI组),TBI+1 mg/kg紫草素组(TBI+SK 1 mg/kg组),TBI+5 mg/kg 紫草素组(TBI+SK 5 mg/kg 组)。对于脑外伤模型,基于先前的研究[14],采取控制性皮质撞击程序。将小鼠置于立体定位仪上,剪开头皮后,选用便携式钻机和3.5 mm的环钻在右侧顶颞皮层进行开颅,并保证硬脑膜的完整性。紧接着,用直径为3 mm 的凸起尖端以4.5 m/s 的速度产生1.2 mm 的凹陷,停留时间为20 ms,造成中度损伤。迅速缝合头皮后将小鼠放回笼子。假手术进行除不进行撞击外,接受了同样的手术。所有小鼠均在接受手术后1 h 内恢复意识。模型成功后,紫草素腹腔注射,连续给药7 d。
1.2.2 行为学检测
采用Beamwalk 平衡木实验检测小鼠的运动功能,滑足次数越多,表示运动功能损害越严重。
采用神经功能缺损评分(modified neurological severity score,mNSS)来评估小鼠的神经行为缺陷的严重程度。在小鼠脑外伤后24 h 检测,总分18分。从运动、感觉、平衡和反射能力四个方面进行评估。mNSS得分越高,说明神经损伤越严重。
1.2.3 伊文思蓝染色
通过伊文思蓝外渗实验检测小鼠血脑屏障的完整性和脑水肿程度。在小鼠造模后第7天进行,尾静脉注射100 μL的2%的伊文思蓝溶液(4 mL/kg),2 h后观察到小鼠的四肢及眼球结膜变蓝,即注射成功。再用1%戊巴比妥钠将小鼠麻醉,经心脏灌注约20 mL的磷酸盐缓冲液。取脑称重,拍照,避光置于甲酰胺溶液中匀浆,然后置于60 ℃恒温水浴孵育24 h,16 000g离心30 min,取上清。使用分光光度计检测上清在620 nm处的光密度值。
1.2.4 免疫荧光和TUNEL染色
用上述同样方式灌注取脑,置于福尔马林溶液(90%水,10%甲醛)中24 h。在4 ℃30%的蔗糖溶液连续脱水3 d,每24 h 更换新的蔗糖溶液,保证脑组织充分脱水。包埋后将标本切成10 μm厚度的冰冻切片。使用含有5%BSA(胎牛血清)的PBST 封闭1 h,加入一抗4 ℃过夜孵育,二抗室温避光孵育2 h 后,滴加DAPI 封片剂封片,立即拍片或者置于4 ℃避光保存。TUNEL 染色先选用Tunel Bright⁃Green 凋亡检测试剂盒(A112⁃01,南京诺维赞公司)检测小鼠神经元的凋亡水平,按照试剂盒说明书先进行TUNEL染色后再进行同上操作的神经元染色。切片使用共聚焦显微镜(Zeiss,LSM800)拍摄。
1.2.5 Western blot检测相关蛋白表达
取小鼠大脑损伤皮质区周围水肿带组织,约15 mg,置于1.5 mL 离心管后置于液氮中低温速冻。用RIPA 裂解液裂解匀浆,再用BCA 蛋白定量后,用10%和15%的聚丙烯酰胺凝胶(SDS⁃PAGE)进行电泳,转膜,含5%脱脂奶粉溶液的封闭液封闭,孵育一抗、二抗后,用化学发光(ECL)试剂检测蛋白质条带。GAPDH作为内参,用Image J进行分析。
1.2.6 实时荧光定量PCR(RT⁃PCR)检测
取小鼠大脑损伤皮质区周围水肿带组织,置于1.5 mL 离心管后置于液氮中低温速冻。用TRIzol试剂(TaKaRa 公司,日本)对样本进行总RNA提取,再用逆转录试剂盒(南京诺维赞公司)在42 ℃60 min,85 ℃5 s 条件下进行cDNA 合成,用Light Cycler 96实时荧光定量仪器(Roche公司,瑞士)进行cDNA扩增。总反应采用20 μL 体系:2 μL 引物、3 μL 超纯水、5 μLcDNA、10 μL qPCR Master Mix(Without ROX)(南京诺维赞公司)在95 ℃10 s,60 ℃10 s,72 ℃20 s 条件下进行40 个循环。同样,GAPDH 作为内参基因,mRNA的水平用相对表达量2-ΔΔCT进行比较。引物如下:突触素(SYP),上游5′⁃TTCAAG⁃GAGCTAACTAACGA⁃3′,下游3′⁃ CGTCACGAAGT⁃CCAGCAAGA⁃5′;Bax,上游5′⁃TGAAGACAGGG⁃GCCTTTTTG⁃3′,下游3′⁃AATTCGCCGGAGACAC⁃TCG⁃5′;Bcl2,上游5′⁃GTCGCTACCGTCGTGACTTC⁃3′,下游3′⁃CAGACATGCACCTACCCAGC⁃5′;Cas⁃pase3 上游5′⁃ATGGAGAACAACAAAACCTCAGT⁃3′,下游3′⁃TTGCTCCCATGTATGGTCTTTAC⁃5′;GAPDH 上游5′⁃AGGTCGGTGTGAACGGATTTG⁃3′,下游3′⁃TGTAGACCATGTAGTTGAGGTCA⁃5′。
1.2.7 小鼠ROS、LPO和SOD活性检测
取小鼠大脑损伤皮质区周围水肿带组织,并置于100 μL的PBS溶液种。将组织充分匀浆后,参照小鼠ROS ELISA试剂盒、小鼠LPO ELISA试剂盒、小鼠SOD 活性ELISA 试剂盒说明书进行标准曲线的绘制以及实验操作。在酶标仪450 nm 波长下测定吸光度(OD 值),样品中ROS、LPO 和SOD 活性的浓度由标准曲线计算得出。
1.2.8 脂质氧化检测
采用脂质过氧化检测试剂盒测定小鼠脑中MDA 含量。取小鼠组织上清液100 μL,与MDA 检测工作液200 μL混匀,并于100 ℃加热15 min,冷却至室温后,取200 μL上清加入到96孔板中,在酶标仪532 nm 波长处测定吸光度(OD 值),根据标准曲线计算MDA含量。
1.2.9 Neuro⁃2a细胞系和BV2细胞系培养以及干预
Neuro⁃2a 细胞系是小鼠来源神经瘤母细胞,BV2细胞系是小鼠源性永生化的小胶质细胞。细胞选用含10 %的胎牛血清和100 U/mL 的青霉素,0.1 mg/mL 的链霉素的DMEM 培养基在T75 细胞培养瓶中进行培养。按照12 孔板每孔1×105,6 孔板1×106的密度进行铺板。铺板后,随机分为Control组,脂多糖(lipopolysaccharide,LPS)1 μg/mL 组,LPS+SK(0.3、1.0、3.0、10.0 μmol/L)组。LPS组:LPS刺激12 h;LPS+SK 组:在LPS 刺激12 h 后再给予不同浓度的紫草素(0.3、1.0、3.0、10.0 μmol/L)孵育30 min。处理结束后收细胞,进行后续实验。
1.2.10 凋亡检测
采用细胞凋亡与坏死检测试剂盒检测神经元细胞Neuro⁃2a 细胞的凋亡情况。首先,将状态良好的神经元细胞Neuro⁃2a细胞系铺板至12孔板,分为Control 组,LPS 1 μg/mL 组,LPS+SK 3 μmol/L 组,LPS+SK 10 μmol/L组,处理完成后,收集细胞至流式管中,1 000 r/min,5 min离心,弃上清,再用PBS清洗2 遍,避光加入1 mL Annexin Ⅴ⁃FITC 检测工作液,室温孵育10 min后,立即用流式细胞仪检测。
1.3 统计学方法
每组实验均为3次以上独立实验。所有数据采用Graphpad prism 8.0软件进行统计学分析,数据均以均值±标准差()表示,组间比较采用单因素方差分析,两两比较采用独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 紫草素可改善小鼠脑外伤后神经功能缺陷
如图1A所示,采用控制性皮质撞击程序构建小鼠脑损伤模型。采用激光多普勒监测脑微循环系统的血液灌注量。打击后,小鼠损伤区域立即出现血液灌注量减少(图1B),提示造模成功。后续动物实验流程如图1C 所示。我们发现,TBI 后1、3、7、14 d,小鼠滑足次数都明显增多。而紫草素处理7 d 以及14 d 后,低剂量(1 mg/kg)的改善效果不显著,高剂量(5 mg/kg)下可以显著减少滑足的次数,提示紫草素可以改善小鼠TBI 后的运动功能(P<0.05,图1D~E)。此外,对小鼠进行mNSS评分,相对于1 mg/kg 低剂量的轻微改善效果,5 mg/kg 高剂量的紫草素显著地改善了小鼠的神经行为缺陷(P<0.05,图1F)。既往研究表明,TBI 后神经元大量丢失是造成脑外伤后认知和运动功能障碍的主要原因,所以我们进一步检测了神经元丢失的情况。与对照组相比,TBI组损伤皮质周围水肿带的神经元数量显著减少。同样,高剂量紫草素(5 mg/kg)处理可以显著逆转这一现象(P<0.05,图1G~H)。基于此,以下对组织的进一步检测和分析,均采用5 mg/kg高剂量组的动物。SYP 作为脑内突触的特异性标记,在TBI 后其mRNA 水平显著降低,而紫草素处理后升高,提示了紫草素可以促进神经元的结构完整性(P<0.05,图1I)。为进一步探究紫草素针对血脑屏障损伤的保护作用,采用伊文思蓝渗透实验评估血脑屏障的完整性,结果发现,紫草素处理可以显著改善TBI 后导致的血脑屏障的破坏(P<0.05,图1J~K)。
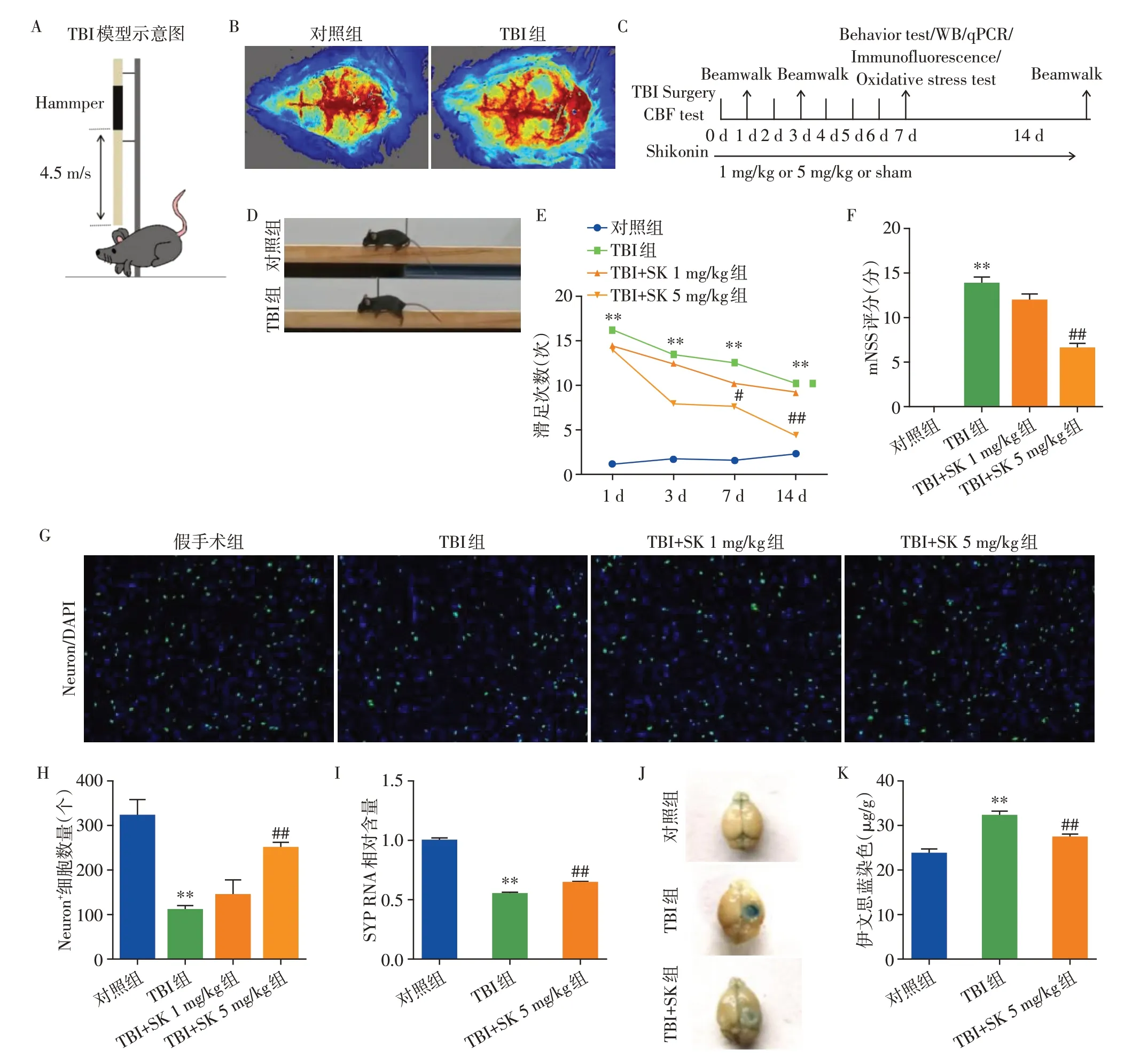
图1 紫草素对小鼠脑外伤后神经功能的影响Figure 1 The effect of shikonin on neurological function after traumatic brain injury in mice
2.2 紫草素抑制小鼠脑外伤后的神经元凋亡
进一步研究发现,TBI 后小鼠皮质损伤周围水肿带凋亡的神经元数量显著增加,而紫草素治疗后可以改善这一现象(图2A、B)。为了进一步探究紫草素对于脑外伤神经元凋亡的改善作用,我们检测了2 种重要的凋亡相关蛋白,即Bax 和Bcl2 的表达情况。TBI后Bax的表达显著上调,Bcl2的表达显著下调,而紫草素可以促进Bcl2的表达,并抑制Bax的表达(P<0.05,图2C~E)。同时,TBI 后促进了凋亡关键调控蛋白Caspase3以及剪切体p⁃Caspase3的表达,而紫草素处理后显著抑制TBI 诱导的Caspase3的增加(P<0.05,图2C、F)。平行的mRNA 水平的检测也验证了上述的结果(P<0.05,图2G~I)。依据已有的实验研究,TBI 后持续的炎症反应是继发性损伤的重要因素,我们采用LPS 刺激广泛使用的神经元细胞系N2a模拟TBI后的脑内炎症环境。体外实验结果显示,LPS 处理可以诱导N2a 细胞的凋亡增加,但是紫草素处理可以显著抑制LPS 诱导的细胞凋亡,促进细胞的存活(P<0.05,图2J~K),提示紫草素在体外实验中可以发挥保护神经元的作用。综上,紫草素在脑外伤后对于神经凋亡具有保护作用。

图2 紫草素对小鼠脑外伤后神经元凋亡的影响Figure 2 The effect of shikonin on neuronal apoptosis after traumatic brain injury in mice
2.3 紫草素改善脑外伤后的氧化应激
氧化应激指标中,MDA是氧自由基水平的可靠指标,而SOD 及GPx 是机体抵抗氧化应激的能力及清除活性氧的重要指标。我们发现,TBI 后脑中的ROS 含量增多,紫草素处理可以逆转这一改变(P<0.05,图3A)。进一步检测氧化应激标志物MDA、LPO 和抗氧化酶活性SOD、GPx 的水平,如图3B~C所示,TBI 后MDA、LPO 的水平显著升高,抗氧化物酶水平降低,经过紫草素处理后,这些过氧化物的升高得到显著抑制(P<0.05)。相反,在经过紫草素治疗后,抗氧化酶的活性得到显著的升高(P<0.05,图3D~E)。SOD、硫氧还原蛋白2(Thioredoxin 2,TRX2)蛋白水平的表达也验证了上述结果(P<0.05,图3F~H)。以上结果表明,紫草素可以促进抗氧化剂的表达,中和升高的ROS,发挥抗氧化应激的作用,从而对神经元凋亡具有保护作用。

图3 紫草素对小鼠脑外伤后氧化应激水平的影响Figure 3 The effect of shikonin on the level of oxidative stress after traumatic brain injury in mice
2.4 紫草素抑制脑外伤后NF⁃κB/NLRP3 炎症通路的激活
本研究结果发现,TBI后炎症水平显著升高,损伤水肿带小胶质细胞激活并大量增殖,经紫草素处理后,TBI 诱导的小胶质细胞活化被显著抑制(P<0.05,图4A~B)。此外,紫草素可以显著抑制TBI 后NF⁃κB 的升高,不仅如此,NLRP3/ASC/Caspase1/IL⁃1β炎症信号通路也得到显著的抑制(P<0.05,图4C~D)。在中枢神经系统中,小胶质细胞作为TBI后参与免疫炎症反应的主要效应细胞,并且BV2细胞系作为研究中常用的小胶质细胞系,在体外试验中我们选用LPS 作为第一信号,ATP 作为第二信号,刺激BV2 细胞系NLRP3 通路的激活,模拟TBI 体内炎症环境。结果显示,紫草素可以显著抑制BV2 细胞系的NLRP3 以及Caspase1 的表达,并有效地抑制炎症反应。以上证明紫草素可以通过抑制NF⁃κB/NLRP3 通路的激活,缓解TBI 后的神经炎症。

图4 紫草素对小鼠脑外伤后NF⁃κB/NLRP3通路的影响Figure 4 The effect of shikonin on NF⁃κB/NLRP3 pathway after brain trauma in mice
3 讨论
综上所述,我们发现紫草素可抑制氧化应激,神经炎症和减少神经元凋亡,从而显著改善创伤性脑损伤后神经功能损伤。机制上,我们的研究结果提示,紫草素可能通过抑制氧化应激及NF⁃κB/NL⁃RP3 的激活,进而改善创伤性脑损伤后的神经炎症及凋亡。
紫草素是紫草根中提取的主要生物活性成分,此前研究表明其具有抗癌、抗炎、促进伤口愈合等多重药理作用。在多种急性炎症动物模型中,紫草素被证实可通过减少炎症因子的合成及分泌发挥抗炎作用。最新研究表明,紫草素可通过抗氧化应激和抑制线粒体途径介导的细胞凋亡减轻H2O2诱导的HT29细胞氧化损伤[15]。但目前尚无研究指出紫草素在创伤性颅脑损伤的保护作用及相关机制。
氧化应激作为TBI 后主要的继发性损伤机制,可以引起多种级联反应,如炎症和细胞凋亡,进一步加速脑损伤[16]。脑外伤后ROS 过量产生导致的氧化应激参与神经元的凋亡[16]。氧化应激是由ROS(如单线态氧、过氧化氢、羟基自由基和超氧化物)产生和降解引起的,进而导致氧化⁃抗氧化的失衡。在脑外伤发生后,抗氧化能力受限,无法及时清除产生的ROS,导致蛋白质氧化,抑制线粒体电子传递链,并切割DNA,导致神经元细胞死亡[17]。因此,脑组织可能因过度氧化应激而受损。MDA和LPO被认为是脂质过氧化的指标[18]。其水平在脑外伤后增加,紫草素处理后可以抑制MDA、LPO 水平的上调。此外,重要的抗氧化酶,包括SOD 和GPx,可以防止大脑氧化损伤[19],其在脑损伤后表达降低,紫草素处理后升高。我们的研究结果提示,紫草素治疗可提高TBI 后的SOD 和GPx 水平,降低MDA、LPO 水平,减轻脑外伤后的氧化应激,对TBI具有保护作用。
NF⁃κB信号通路通过诱导促炎细胞因子基因转录,在炎症相关疾病中发挥着重要作用[20]。在脑外伤后24 h内,血脑屏障功能失调,循环中性粒细胞、单核细胞和淋巴细胞浸润受损的脑实质,快速产生炎症反应[21]。有证据表明,早期炎症会导致神经元损伤并加重脑外伤[22],这表明炎症是继发性脑外伤的重要介质。研究发现,紫草素可以抑制TBI 诱导的NF⁃κB 的活化和促炎细胞因子的分泌,减轻TBI后的炎症反应。
TBI后持续的炎症反应会在脑中形成炎性微环境,并伴随小胶质细胞活化和增殖,加重TBI的病理进程[23]。有研究报道紫草素具有抑制NF⁃κB 的作用[24],而NF⁃κB/NLRP3 通路是炎症反应的主要途径。因此,本文猜测紫草素是否可以抑制TBI后NF⁃κB/NLRP3 通路激活。NLRP3 炎性小体作为NF⁃κB的下游介质,以Caspase1 依赖性方式激活促炎细胞因子,包括IL⁃1β,诱导炎性细胞死亡[25],并在TBI后发挥重要作用。NLRP3 炎性小体是由多个蛋白组合而成的复合物,参与先天免疫反应的识别受体家族的组成[26],是炎症反应中的重要组成部分。研究发现,紫草素处理后可以抑制TBI 后的NLRP3 通路的激活。提示紫草素可以抑制NF⁃κB/NLRP3 通路激活,缓解炎症,对TBI发挥神经保护作用。
众所周知,细胞凋亡作为脑损伤后迟发性细胞死亡的主要方式[27],继发性脑损伤表现出特征性的神经元凋亡[28]。而细胞凋亡依赖于Caspase3,通过外源性死亡受体或内源性线粒体途径的激活。Bax和Bcl2 等促凋亡和抗凋亡因子也参与细胞凋亡。研究证实,NLRP3炎性小体的激活,可促进IL⁃1β和IL⁃18 的分泌[29]。这些细胞因子通过激活Bax 诱导细胞凋亡。因此,NF⁃κB的激活及其对NLRP3炎性小体的激活,炎性细胞因子的大量释放,可以通过激活Bax,导致TBI小鼠的神经元的凋亡。本研究发现,在TBI 模型中Bax 表达明显上调,Bcl2 表达下调,紫草素处理可以抑制Bax的上调,促进Bcl2的表达。并且,紫草素也可以抑制TBI 后Caspase3 剪切体水平的升高。提示紫草素可以抑制TBI后的神经元凋亡,发挥神经保护作用。
综上所述,紫草素可以通过抗氧化应激和抑制NF⁃κB/NLRP3 信号通路激活,以及减少神经元的凋亡,在TBI 后发挥神经保护作用。为临床上创伤性脑损伤的治疗提供了新的潜在治疗靶点。但本研究仍然存在一些不足,如紫草素改善创伤性颅脑损伤的确切分子机制和特异性靶点还有待进一步研究。

