大动物AD模型研究进展
钟伟聪,张然,皮荣标*
(1.中山大学医学院,广东 深圳 518107;2.中国农业大学生物学院,北京 100193)
阿尔茨海默病(Alzheimer′s disease,AD)是一种神经退行性疾病,影响着全世界2 500多万人。同时,随着老龄化的加剧,这个数字仍在不断扩大,AD逐渐成为中国乃至全球最严重的社会危机。AD主要发生在老年人,特别是65岁及以上人群,是一种与年龄有关的中枢神经系统疾病。随着年龄的增加,AD的患病风险成比例地增加。患有AD的患者通常呈现出神经精神症状(neuropsychiatric symptom,NPS),表现为认知障碍、躁动、冷漠、焦虑等[1]。根据2020年世界阿尔茨海默病报告,三分之一的老年人死于AD或其他痴呆症。对于患有AD的人来说,医疗保健和长期护理的费用相当大,造成了极大的经济和社会损失。AD已经成为影响社会稳定发展和人类健康的严重问题[2]。AD的发病机制十分复杂,目前并没有得到良好的阐明[3],其主要特征是脑组织的淀粉样多肽沉积Aβ和由Tau蛋白聚集形成的神经原纤维缠结(neurofibrillary tangles,NFTs)。因此目前主流的发病机制以Aβ级联、异常Tau为中心。在药物研发中,Aβ和Tau蛋白也是AD药物设计的重要分子靶点。除此之外,线粒体功能紊乱、氧化应激、胆碱能和自由基损伤等也在AD的发展起着不可或缺的作用[4]。
在2021年6月,FDA批准Aβ抗体Aducanumab的上市,打破了近20年来没有任何一款新药在AD治疗领域获得批准的困局[5]。Aducanumab与我国自主研发的GV-971类似,在临床研究中存在部分争议,还需要进一步探究其治疗机制和效果。最近,越来越多的研究表明神经退行性疾病和神经炎症有密切的关系。小胶质细胞聚集在Aβ周围,吞噬清除Aβ斑块,提供保护作用[6],但是过度激活的小胶质细胞分泌多种炎症因子,并诱导产生神经元损伤,加剧Aβ和Tau病理变化等[7]。类似地,星形胶质细胞也被发现参与加速AD的病理进程[8],这提示神经炎症在AD中具有重要作用。开发多靶点的小分子药物是目前的一个趋势。血脑屏障对中枢神经系统内稳态进行调控,允许适当的神经元功能,也保护神经组织免受毒素和病原体的侵害,这些屏障对于机体来说具有重要作用[9]。小分子药物相比于其他药物,比如抗体类药物,具有分子量小,容易穿过血脑屏障等优势,更容易进入到大脑中。此外,许多小分子药物原本并不是用于治疗AD,而是抗癌药、抗抑郁药等,但在研究中发现,也能够改善AD的症状,因而也被列入治疗AD的范畴,这种方法可以极大降低治疗费用[10-11]。
AD分为家族型AD(familial Alzheimer′s disease,FAD)和散发性AD(sporadic Alzheimer′s disease,SAD),家族型AD是由与AD相关的基因突变导致,如APP、PS1、PS2基因;散发性AD则主要是由环境风险因素造成的,是后天产生的。在临床前研究中通常采用的小鼠模型是家族型的小鼠模型,如转基因小鼠等,但现实中遗传型AD患者只占不到5%,大部分的AD患者是散发型的,因此转基因小鼠模型不能代表普遍的AD患者。在AD领域也出现了一些与SAD有关的模型,这些模型主要是通过外源性的物质干扰小鼠体内代谢过程,最终引起相关病变,例如,腹腔注射脂多糖[12];口服或腹腔给丙烯醛[13];利用D-gal诱导的小鼠发生类似自然衰老的变化[14];通过链脲佐菌素破坏葡萄糖运输,导致AD样病变[15];除此之外还有利用东莨菪碱[16]、创伤性脑损伤[17]、叠氮化钠[18]以及它们复合诱导[19]等方式构建散发性AD模型。然而目前关于AD相关研究的小鼠模型绝大多数都是用转基因小鼠,如3×Tg、5×FAD等[20]。
小鼠和人类之间的许多解剖差异,在进行临床应用时的转换可能会出现困难[21]。除了常见的实验室小鼠模型外,也有一些实验室以猪、狗、兔子、猫和非人灵长类动物(non-human primates,NHP)等作为动物模型[22],来进一步考虑疾病发病机制和药物评估。相比小鼠,非啮齿类动物在形态学和生存环境更接近人类,在疾病机理方面可能更为接近。猪、狗和NHP,它们脑部结构和功能特征与人类相似[23-25],具备发展成为良好AD模型的潜力[26],并且与兔子、猫型动物相比,它们的脑部结构更为大型,对实验操作和实验成本来说具有明显的优势。在本篇综述中,简要回顾了AD动物模型,特别聚焦于大动物模型,包括猪、狗、NHP的建立、病理特征(见表1)和潜在机制以及局限性(见表2)等,以期望后续能有突破性进展。
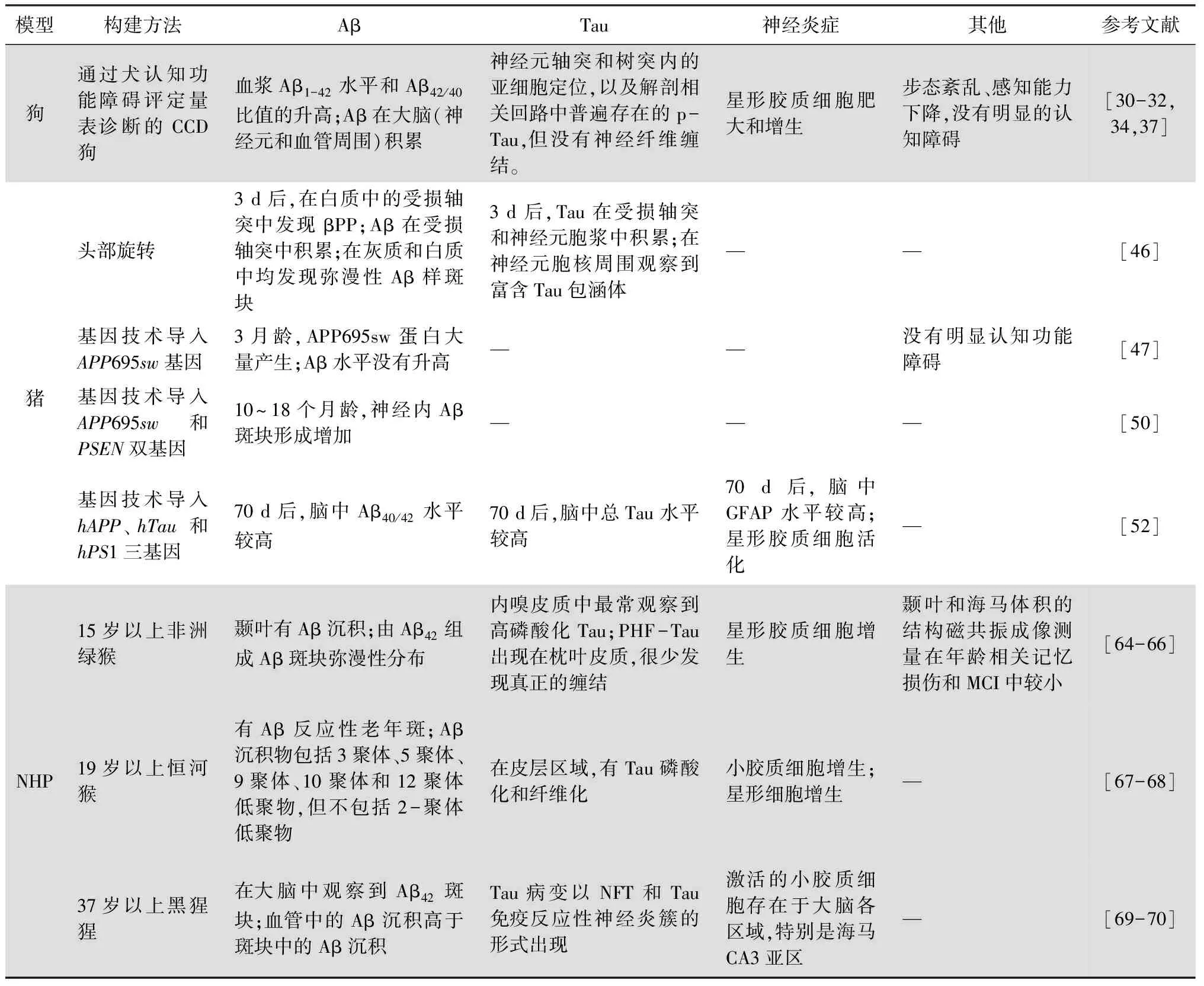
表1 模型的构建方法以及相关病理变化

表2 模型的优势和不足
1 狗的AD模型
狗的基因组与人类有很强的相似性,狗脑的大小和复杂性与人脑也相似,是合适的大型神经动物模型[27]。狗是评估新型治疗药物的宝贵大型动物模型,现在许多药物研究都已经在狗的身上开展[28]。狗与人类具有共同的生活环境,狗的某些疾病,与人类具有相同的机制,如癫痫,这提示狗的神经系统与人类具有高度的相似性[29]。类似人类AD,狗具有犬类认知障碍(canine cognitive dysfunction,CCD),其发病机制尚不清晰,主要发生在8岁及以上的老龄狗,这些狗会出现步态紊乱、迷失方向、睡眠-觉醒周期紊乱、感知能力下降等症状[30]。通过从各地向狗主人招募实验所用狗,并且利用犬认知功能障碍评定量表对实验狗进行诊断。其中,总分低于39分的狗属于正常认知状态(非CCD),总分为40~49分的狗属于CCD风险,总分高于50分的狗属于CCD。发现在不同品种的狗中都具有脑部出现Aβ积累这一重要特征[31-32]。这些Aβ的氨基酸序列与人类完全相同,常见的单体形式也是Aβ42。与CCD组(8~17岁)和年轻组(0~4岁)相比,4~8岁的狗的脑脊液中Aβ42浓度最高。此外,老年狗(8~17岁)的Aβ42浓度高于MCI组。进一步暗示狗的Aβ沉积与认知障碍具有正相关性。狗的Aβ似乎起始积累于前额叶皮质(发病时约8岁),并随着年龄的增长继续发展,包括颞叶和枕叶皮质等其他区域。CCD与人类AD的早期阶段非常相似,并且由于是自然发生的,更接近于散发性AD,因此CCD狗也被作为一种AD模型[33]。
免疫组化分析表明,根据评分表诊断为CCD狗的大脑额叶皮质各层一氧化氮合酶显著增高,Prpar等[34]推测CCD狗中也存在严重的神经炎症和亚硝化应激变化。但另有文献表明,在CCD狗中,与神经炎症有关的细胞因子,IL-2、IL-6、TNF-α等并没有显著性差异[33],狗脑中的神经炎症变化似乎不是很明显,推测可能是实验条件不同所引起的差异,还需要更多的研究才能确定CCD中的炎症变化;一项核磁共振报道显示CCD狗的海马体积显著减少,但与正常老年狗无明显差异[35];与此相反,Tapp等[36]发现狗的海马萎缩越严重,认知缺陷越明显。考虑可能是实验动物数量限制以及实验设备精准度的误差引起的,提示不能完全将海马作为观测CCD狗的指标,应当结合其他病理特征综合考虑;另有一项报道称,通过免疫荧光证实p-Tau在狗的神经元轴突、体细胞积聚,并且还在少突胶质细胞内积聚,这与人类AD似乎有所不同,说明CCD狗的Tau病理与人类有所差异[37]。Opii等[38]发现,对8岁以上的比格老年犬进行抗氧化剂饮食干预和定期运动处理可以防止氧化损伤并有效干预CCD的发生。尽管Aβ和Tau病理都在CCD狗中发现,但是却没有发现由pTau聚集形成的NFTs[39]。对此有人提出了缠结前的病理学,并解释患有CCD的狗没有NFT的可能原因[40]:①人在患有AD前,大脑中的Aβ就开始了聚集现象,而Tau的聚集与认知障碍更为紧密。狗的寿命相对较短,而AD随着时间愈发严重,因此时间不足以使Tau聚集形成NFTs。同时这个解释合理之处还在于,目前有研究认为认知障碍主要归结于Tau,而狗中没有足够的NFTs,因而狗的认知障碍不是十分明显;②狗的Aβ基因与人类完全相同,但Tau蛋白基因略有差异,因此可能影响Tau蛋白的聚集。目前,以狗作为研究模型的一个主要的缺点是培养成本较高,所需要的实验周期也较长,并且大多数研究都是通过募集获得,缺少系统性。同时,实验数据通常是在已发生病理改变后测得的,一些病理改变难以被测量,缺乏从正常到病发的渐进变化过程。尽管如此,Aβ、Tau病理、神经元丢失、认知障碍等都在CCD狗中发现;同时,药物在狗身上也表现出类似人的药代动力学;另外,和人类似,狗具有一定的社会性。因此将狗作为临床前模型来进行预防研究可能是有效的。
2 猪的AD模型
与狗模型可作为同伴相比,可食用的猪在研究模型上受到社会的关注度较低。人类和猪的基因组相似,特别是APP基因[41],同时发育和组织结构也同人类高度相似。另外,猪脑在脑损伤后,Aβ也会发生积累现象[42],提示猪作为神经退行性疾病,特别是AD模型的可行性。实际上,将猪作为疾病模型已经得到很多应用,包括心血管疾病、癌症、脑疾病等。在某种程度上,猪是转化医学的首选物种[43-45]。
创伤性脑损伤是人类AD的一个易感因素,Smith等[46]通过头部旋转处理小型猪,模拟脑损伤。汉福德系(Hanford)小型猪在造模后1 d,轴突就发生肿胀;造模后3 d,Aβ和Tau在受损轴突中的积累,Aβ斑块沉积于白质中。目前将猪作为模型进行AD研究的仅少数几家实验室,并且是以转基因的方式进行模型构建。研究者将与AD有关的基因导入猪中,以期望能构建出一种优良的临床前转基因猪模型来研究AD。Kragh等[47]首次将由sPDGFβ启动子驱动的APP695sw基因导入哥廷根系(Göttingen)小型猪的基因组中。3个月处死后,发现引起了该基因水平的上升,内源性APP695蛋白水平是对照组的10倍以上,但并没有导致Aβ水平的变化。与人和小鼠类比,作者推测需要达到30个月后,猪才会出现Aβ的积累。与Kragh同一个实验室的Jakobsen则尝试将PSEN1M146I基因插入到Göttingen小型猪的基因组中,但只验证了其插入的成功性,并未对AD的症状进行相关验证[48]。另有研究报道了在雌性Göttingen小型猪中转入APPSW单基因,2年后检测,并没有观察到AD的病理蛋白,包括Aβ和Tau的积累。同时也没有造成模型猪的记忆损伤[49]。2016年,Jakobsen等[50]培育了双转基因Göttingen小型猪,该小型猪同时携带人类PSEN和APPSW基因。在双转基因的参与下,猪在10至18个月大时,神经内的Aβ斑块形成增加,但并没有与时间成正相关。至此,以猪作为模型研究AD获得了开创性的新进展。2017年,Lee等[51]开发了含有hAPP、hTau和hPS1三转基因的黑猪(Jeju black pig),并获得不错的结果。造模后70 d,在转基因猪脑中发现了高表达的Aβ和Tau,同时还注意到了神经炎症症状。与此同时,Wang等[52]用CRISPR/Cas9系统生成DJ-1/parkin/PINK1三基因修饰的巴马小型猪,但是在10个月大的活突变猪中并未观察到帕金森病的典型症状。尽管如此,CRISPR/Cas9技术的成功应用,也为其他疾病模型提供新的思考方向。猪作为疾病模型,具有前景性,但仍有一些局限性需要解决。比如需要大面积的空间进行饲养,需要更多的饲养资源,需要专门的动物知识来确保适当的健康生活方式,并且目前并没有一种良好的行为学的检测手段等[53]。猪的神经退行性疾病的建模目前尚处于起步阶段,因此对当前模型的深入描述和长期跟踪非常重要,为以后的动物实验模型提供了宝贵经验。同时为类似于ALS等其他神经退行疾病的研究创造一个前所未有的良机。
3 NHP AD模型
NHP与人类高度相似,包括基因组、形态结构、以及发育等,对某些疾病也具有相似的易感性。结构与功能的相似性使其成为研究人类的良好工具[54]。NHP已经被开发出了许多疾病模型,包括代谢、血管和神经退行性疾病等。NHP与人类最长形式的Tau蛋白的基因序列的相似性大于98%,而与Aβ序列完全一致,提示NHP可能是研究AD的重要模型[55]。前期研究表明在猕猴、黑猩猩、狨猴等NHP中存在AD的一些病理特征,包括Aβ沉积、代谢紊乱等[56-60]。NHP的Aβ发展与人类高度相似,并且与人类一样,随着年龄的增加而逐渐积累,最终导致认知功能发生障碍,提示将NHP发展为AD疾病模型的合理性。尽管多篇文献都表明NHP不会出现AD另一个显著特征——NFTs,但是也有报道指出NHP中存在Tau的磷酸化现象[61],表明NHP也可能具备Tau病理学。将NHP作为AD疾病模型已经得到鉴定,并且在近几年得到了广泛的关注[62],特别是在散发性AD的研究中。早期的研究表明灰鼠狐猴在幼年时就形成了Aβ斑块,表现出一些Tau病理学的迹象,并出现与年龄相关的认知缺陷[63]。近年来,其他品种的NHP也得到许多关注。
据报道,老年的,特别是大于15岁非洲绿猴,可能会呈现出一系列的AD症状。它们在衰老过程中容易患上与人类相似的疾病,因此越来越多地被用作模型。研究发现,19岁以上的雌性非洲绿猴在颞叶中出现以弥漫性斑块为主的Aβ沉积,这些Aβ是由被认为是最具毒性的单体Aβ42所构成的;在皮质中可以检测出高磷酸的Tau,并且存在成对螺旋样结构(paired helical filaments,PHF),但鲜有NFTs;同时,星形胶质细胞的增生也提示了神经炎症的发生;通过MRI测量颞叶以及海马,发现发生萎缩现象,这也与老年非洲绿猴的认知障碍的发生有关[64-65]。同时,Cramer等[66]在雄性非洲绿猴中也发现类似病理性现象,并比较了非洲绿猴与人类转录组变化,衰老的非洲绿猴能够很好的模拟人类的转录变化。恒河猴是NHP的另一个主要品种,老年恒河猴在大脑中自然形成Aβ沉积,与老年人的大脑具有惊人的相似性。研究表明,19岁以上的正常老年恒河猴,脑组织会出现Aβ反应性老年斑,并且这些老年斑具有多种聚集形式,包括三聚体、五聚体等,但缺乏毒性Aβ二聚体、p-Tau、胶质增生和突触损伤等[67]。另一文献证实,老年恒河猴表现出与人类类似的Aβ皮质病理。但是提出了恒河猴具有Tau病理的观点。他们发现Tau蛋白在恒河猴7~9岁时有磷酸化现象(pSer214tau),并在31岁的恒河猴中发现了典型的NFT和PHF结构,证实了Tau病理的存在[68]。Tau检测的差异也被提及,他们在灌注的恒河猴大脑中检测到早期种类的磷酸化Tau,但在死后丢失,作者推测这种丢失可能是阐明发病机制的关键。Edler等[69]在37岁以上的黑猩猩中大脑发现Aβ42斑块分布在皮层区;在CA1和CA3的锥体层中发现了Tau病理标记物和神经丝。除此之外,在血管中也检测到Aβ阳性等。同时,该小组还表明老年黑猩猩在各脑区,特别是皮质海马区存在活化的小胶质细胞,与较高水平的Aβ42斑块有关[70]。
自然老化的NHP在病理发生上与人类相似,对于研究AD风险因素具有优势,但是实验周期太长,少则10年,多则30年,而且老年的NHP不一定都患上AD样症状,因此对于实验室团队来说十分不利。研究者开始在NHP中通过人工的方法快速构建出一种AD样的模型。据报道,目前在NHP中构建的方法包括注射胆碱能神经毒性药物、注射可溶性Aβ、注射或口服甲醇,以及通过转基因的方法等[71-74]。NHP是理想神经疾病的模型,但目前仍有许多问题需要解决,比如相较于药物毒理学和药理学方面较为成熟的小鼠模型来说,药物的剂量更加严格。其次所有的NHP都是濒危物种,出于伦理的要求,可用的动物量也十分有限[71]。同时NHP的培养成本极高,包括饲料、住宿条件以及实验周期等。虽然在NHP中取得一定的进展,但对于NHP的研究还是道阻且长。
4 结语与展望
AD是一种复杂的多因素诱导的疾病,目前对于其产生机制尚不清晰,对机制和治疗药物的探索十分紧迫。尽管在研究小鼠中得到较好的结果,阐明了部分AD病理过程,以及一些相关机制,包括Aβ和Tau病理等。但在进行临床转化时,效果往往不佳。现有的小鼠动物模型不能完全准确地反映人类AD[75]。猪、狗、NHP、兔子、猫等动物模型相较于小鼠来说,它们的病理分子序列更加同源,并且生存的环境与人类也十分相似,甚至饮食和易感性也高度相同。此外,猪、狗、NHP在体型上比兔子、猫、小鼠更大,在实验中更容易操作,能够减少和节约实验时间和实验成本等。猪、狗、NHP有类似人类的结构和功能特征,特别是脑部结构。这些大动物是研究衰老大脑中发生的分子和行为改变的重要模型。脑部结构的相似性也为药物的研发提供一定的借鉴性,可以作为啮齿动物和人类研究之间的中介,有利于我们更好的理解AD的发病机制。
NHP是目前模拟人类的最佳模型,但是其作为濒危物种,在实验上具有相当的限制性。最近,有研究者通过体细胞核移植技术在体外成功克隆了食蟹猴[76],这种克隆技术使得研究人员能够更好地利用灵长类动物进行实验研究。在未来,或许能够通过该技术打破在研究数量的局限性,并发展成对人类疾病机制和治疗研究中重要的动物模型。猪模型和狗模型在模拟疾病方面也具有一定的优势。或许进一步打破猪模型和狗模型在实验周期、检测手段的限制后能够有效地解放以NHP作为实验动物的现状,减少濒危物种的使用,同时也为其他疾病模型带来一些新启发。一项基因修饰猪的肾被移植到了人的事件广受传播。这是世界首例的,异种移植后的猪肾可以正常工作,并且有趣的是,移植后的猪肾并没有产生免疫排斥现象[77],这项巨大的突破也提示了猪和人器官的同质性,鼓舞了以猪作为研究对象所开展的研究。最近,有研究者开始着手构建人工智能(artificial intelligence,AI)驱动的数字动物仿真技术,力图通过AI技术模拟评估药物在动物体内的药效学、药代动力学和相关毒性等。利用这种模拟评估,可以有效地减少对于动物的伤害,减少实验相关成本和时间,减少对社会的负担,提高效率等,可能是目前较为先进和符合伦理的方法。但是其实际效果难以衡量,还是需要结合传统实验进行相关验证,进一步确认有效性。
药物研发离不开动物模型,动物模型验证药物的合理性。小分子容易穿透血脑屏障,小分子的再利用能够有效地减少研发时间以及成本,在近几年进展迅速。神经系统是个复杂的网络,在靶向AD之外的神经退行性疾病,如PD、抑郁症、自闭症的药物中,可能存在某些在AD中也有疗效的药物,而这些药物有些已通过相关临床实验,能够减少药物进入AD临床实验的时间。研究表明抗抑郁药西酞普兰,一种选择性的5-羟色胺再摄取抑制剂,能够在小鼠体内有效地抑制Aβ沉积[78],并且进入AD的临床实验中。同时,小分子具有优良的可塑性。有研究者试图将有功能性的官能团组合成一个小分子,形成了具有多靶点抗AD的药物,并通过体内和体外实验表明多靶点药物在AD的治疗中具有重要的作用[79],因此在药物的多功能性方面,还需要进行更多的研究。此外,通过计算机辅助运算,能够加快药物的筛选。最近有文献通过计算机模拟以及小鼠模型验证的方法,表明抗心力衰竭疾病的Bumetanide可能能够预防AD[80]。将AI应用到药物评估中,通过AI技术筛选出适合药物,动物仿真技术模拟评估,与传统的实验技术相结合加以验证,能够更快、更经济和有效地寻找新药[81]。不仅能提高效率,也减少盲目筛选药物的成本,提高费效比,更加符合现代伦理要求等。另外。存在一些药物在小鼠体内毒性明显,而在人体时毒性较低。在目前的以小鼠为主的研究中,这些药物将不被纳入考虑中,因此可能存在药物筛选不当。AI药物评估和丰富的动物模型可以有效减少这些漏洞,增加药物的研发可能。此外,在进入临床实验前,多样的动物模型所研究的毒性也有助于在临床试验的剂量评估。
综上所述,现存的AD疾病模型并不能很好的全面阐述AD的发病机制,也不能完全模拟出AD的所有症状,在药理评估方面还不够完全。本文回顾和总结了几种大动物模型的病理学特点。与人类基因序列高度同源的大动物显示出了其发展为AD模型的潜力。相较于小鼠模型,相似的结构以及疾病易感性的大动物可能更适合评估候选药物的抗AD作用。

