基于高通量测序技术对贵州山地野猪冬季盲肠细菌多样性分析
彭彩淳 杨雄威 曹和琴 穆 浪 王野影 胡灿实 张明明 粟海军*
(1.贵州大学林学院,贵阳,550025;2.贵州大学生物多样性与自然保护研究中心,贵阳,550025;3.贵州师范大学生命科学学院,贵阳,550025;4.贵州大学生命科学学院,贵阳,550025)
肠道微生物菌群是肠道黏膜上的一个复杂多样的生态系统,肠道微生态的相对稳定对于动物机体消化和吸收营养物质、调节宿主免疫功能、抵御有害微生物侵害等具有重要意义[1-2]。影响肠道菌群定植的因素有很多,主要包括宿主因素(性别、年龄和免疫系统)、环境因素(水源和食物)和微生物因素等[3]。动物肠道不仅是营养物质消化吸收的器官,还是机体最大的免疫器官,发挥营养物质代谢调控、肠道黏膜免疫激活、宿主行为调控和抵抗病原微生物等重要作用[4]。动物盲肠(cecum)的微生物菌群在宿主营养物质消化和肠道健康方面也扮演着极为关键的角色,如降解纤维素、半纤维素和不溶性蛋白质等为宿主提供能量,还是末端免疫器官发育和成熟所必需的组成部分[5]。
高通量测序技术作为一种全新的技术手段,能全面地反映样品微生物的结构与组成[6],具有准确性高、检测范围广、快速和结果可靠等优点,普遍应用于细菌菌群多样性分析的研究中[7]。近年来,在家猪[8-13]、野猪(Susscrofa)[14-16]、滇金丝猴(Rhinopithecusbieti)[17]、牛[18]和新疆驴[19]等动物肠道微生物的结构及组成、组间共性及独有特征和肠道微生物组成[20]等方面的研究中被广泛应用。
野猪系广泛分布于旧大陆森林、灌木丛中的大型偶蹄类动物,具有适应能力强、繁殖迅速、扩散能力强和亚种众多等特点[21],尤其在缺少天敌的地区种群增长迅速。野猪是家猪进化和驯化的主要来源,种群特征在进化的同时可能也会反映出肠道菌群的进化差异[15]。盲肠是消化道中十分特殊的器官,揭示野猪盲肠肠道菌群特征,对于进一步研究野猪生态适应性、生理生化特征等具有重要意义,也可为当前十分广泛和严重的野猪与人冲突的危害管理提供基础科学数据。关于野猪肠道菌群的研究已有报道[14],但揭示其盲肠菌群特征的研究并不多。为此,本研究采用16S rRNA高通量测序技术,分析揭示贵州山地野猪盲肠的细菌菌群结构及其特性,探究野猪肠道菌群如何与宿主相互作用,为野猪的疾病预防和免疫发育研究提供基础资料。
1 材料与方法
1.1 样品采集
由于野生动物肠道菌群组成及多样性可能与生境中的食物资源和地理环境(山脉、河流和地貌等)密切关联[14,22],根据贵州省地形地貌(黔北以喀斯特地貌为主,黔东南以非喀斯特常态地貌为主)、水系(采样地涉及贵州省长江流域和珠江流域)和植被(黔北以喀斯特典型植被为主,黔东南以常绿阔叶林和针叶林为主)等宏观环境因素差异(图1),于2019年11—12月在贵州省境内黔东南、黔北地区森林环境中共猎捕12头健康野猪个体(表1),平均体重(72.42±41.62)kg,并依此分组分析。


图1 野猪个体捕获点示意图

表1 贵州山地野猪个体信息
1.2 试验方法
按照E.Z.N.A.®试剂盒(OmegaBio-tek,Norcross,GA,USA)说明书提取总DNA,用1%琼脂糖凝胶电泳(电压5 V/cm,20 min)和NanoDrop 2000检测DNA的质量及DNA浓度和纯度。合格的DNA样品选用细菌通用引物338F/806R对16S rRNA基因V3—V4可变区进行PCR扩增,其中反应参数和体系参考Quast等[24]的研究。扩增后的产物使用2%琼脂糖凝胶电泳检测,利用AxyPrep DNA凝胶回收试剂盒(AXYGEN公司,USA)对大小约500 bp的目标片段进行回收和PCR产物纯化,用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司,USA)对回收产物检测定量[12]。在上海美吉生物医药科技有限公司利用Illumina公司研发的Miseq PE300系统进行高通量测序。
1.3 数据分析
对测序得到的原始序列质控和拼接[23],去冗余、过滤低丰度序列,去除嵌合体后按97%相似度的分类水平划分分类单元(operational taxonomic units,OTU),按最小样本序列数抽平后进行物种分类学分析[24],聚类结果通过绘制稀疏曲线反应样本的测序数据量的合理性。其次计算各样本的Alpha多样性指数(Shannon指数)[25],采取Wilcoxon秩和检验检测组间差异。PLS-DA分析,即偏最小二乘法判别分析,根据测量到的若干值,将检测样本按照类别分组,揭示不同地区、不同性别个体盲肠内细菌群落结构的相似性或差异性[26]。通过LEfSe多级物种差异判别分析筛选出样本间的关键差异菌群,使用非参数因子Kruskal-Wallis(KW)秩和检验检测样本组间具有显著丰度差异的细菌类群,将结果制成LDA(LDA≥4,P<0.05)可视化柱状图[27]。为探讨野猪盲肠细菌菌群在体内发挥的功能,利用PICRUSt软件标准化后的OTU丰度表与GreenGene数据库比对,获得相应的KEGG orthology(KO)信息,比对KEGG数据库解析到的Pathway level 2功能信息,再通过SPSS对2个地区、雌雄性别组间的代谢功能进行差异分析,本研究选取丰度排名前15的代谢功能类群进行可视化[28]。
2 结果与分析
2.1 测序结果
从12头野猪盲肠内容物样本中共获得原始序列710 949条,碱基总数为292 930 754,单个样本序列为41 628~71 043条,平均每个样品的有效序列59 246条,平均长度412 bp,以97%相似度聚类得到1 256个OTU。从稀疏曲线可以看出,野猪肠道细菌群落丰富度(图2A、C)和多样性(图2B、D)已基本饱和,表明增加测序深度只会增加少量OTU数目,而细菌多样性不再继续增加,测序深度已基本覆盖样品中所有细菌。

图2 野猪盲肠细菌观测值稀疏曲线
2.2 野猪盲肠细菌菌群多样性
2.2.1 不同地区野猪盲肠细菌菌群Alpha多样性
通过对不同地区样本的Shannon指数(图3A)分析可知,两地区组间细菌菌群多样性无显著差异(P>0.05),黔东南地区部分个体样本的细菌菌群多样性高于黔北地区,黔东南地区的组内差异较大。ACE指数(图3B)显示,两地区细菌群落丰富度无显著差异,均值相近,但黔东南地区总体趋势低于黔北地区,部分个体样本的丰富度远低于组内均值,该地区个体样本间离散程度较大。

图3 不同地区野猪盲肠细菌Alpha多样性指数
2.2.2 不同性别野猪盲肠细菌菌群Alpha多样性
针对雌雄不同个体样本的Shannon指数(图4A)分析,雄性样本组盲肠细菌菌群多样性显著高于雌性样本组(P<0.05),两组均值相近。雄性样本组菌群组成更为复杂多样,雌性样本组内差异较为显著。ACE指数(图4B)显示,雌雄性别间细菌群落丰富度无显著差异,雄性组较雌性组更为丰富。

图4 不同性别野猪盲肠细菌Alpha多样性指数
2.2.3 野猪盲肠细菌菌群PLS-DA分析
PLS-DA分析表明,黔东南和黔北地区野猪盲肠细菌可以明显区分并聚成2个类群(图5A),说明两地区样本菌群具有显著差异(P<0.05),此外,通过PLS-DA分布点可以看出两组内均有菌群组成差异较大的个体样本;由图5B可知,雌雄野猪盲肠细菌可明显区分并聚类成2个类群,雌雄样本组间差异显著(P<0.05),不同雌性个体样本菌群组成差异较大。
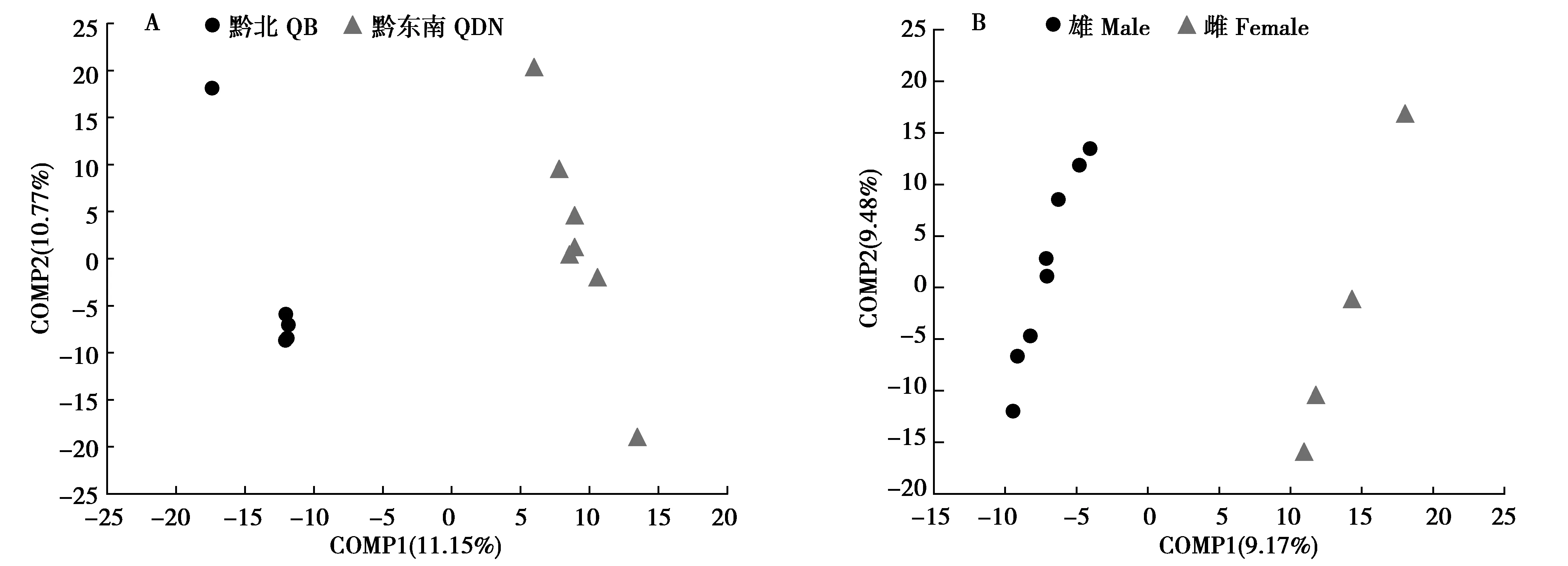
图5 野猪盲肠菌群组间PLS-DA分析
2.3 野猪盲肠细菌菌群组成及结构特征
12头野猪个体的盲肠中,共鉴定得到细菌18门107科278属464种。总体上,优势菌门(丰度总值≥95%)为厚壁菌门(Firmicutes,62.37%)、拟杆菌门(Bacteroidetes,23.63%)、放线菌门(Actinobacteria,5.66%)、变形菌门(Proteobacteria,2.28%)、疣微菌门(Verrucomicrobia,2.27%)和梭杆菌门(Fusobacteria,2.10%);优势菌属(至少在一组丰度≥1%)主要有Ruminococcaceae_UCG-005(10.36%)、norank_f_Bacteroidales_$24-7_group(7.70%)和Christensenellaceae_R-7_group(6.27%)等16个。
2.3.1 不同地区野猪盲肠细菌菌群组成及相对丰度
厚壁菌门为两地区中最大优势菌群门类(QB 65.91%,QDN 59.84%)(图6A);第2丰度菌群为拟杆菌门(QB 14.52%,QDN 29.68%),黔东南地区拟杆菌门较黔北地区丰富,菌群富集程度更高;再则为放线菌门(QB 11.85%,QDN 1.24%),两组放线菌门的丰度存在显著差异(P<0.05)。菌群中丰度≤0.01%的纤维杆菌门(Fibrobacteres)、黏胶球形菌门(Lentisphaerae)和Saccharibacteria菌群仅在黔东南地区的野猪盲肠中有少量分布,在黔北地区的野猪盲肠中尚未检测到;衣原体门(Chlamydiae,0.53%)及丰度≤0.01%的酸杆菌门(Acidobacteria)、迷踪菌门(Elusimicrobia)和俭菌总门(Parcubacteria)的菌群仅在黔北地区的野猪盲肠中有少量分布,在黔东南地区的野猪盲肠中尚未发现。
在属水平上,图6B展示了两地区的主要优势菌群,共16个属(QB 64.67%,QDN 65.09%)。黔北地区野猪盲肠细菌丰度最高的3个优势菌属分别是Ruminococcaceae_UCG-005(11.69%)、双歧杆菌属(Bifidobacterium,9.49%)和Christensenellaceae_R-7_group(8.43%);黔东南地区丰度最高的3个优势菌属分别是norank_f_Bacteroidales_$24-7_group(10.74%)、Ruminococcaceae_UCG-005(9.40%)和拟普雷沃菌属(Alloprevotella,6.50%)。黔北地区优势菌群之一的双歧杆菌属在黔东南地区的相对丰度仅有0.12%;拟普雷沃菌属在黔东南地区属于优势菌群之一,但在黔北地区丰度仅有0.33%,其他属细菌在两地区的丰度也有所不同,说明两地区野猪盲肠细菌组成结构存在一定差异。
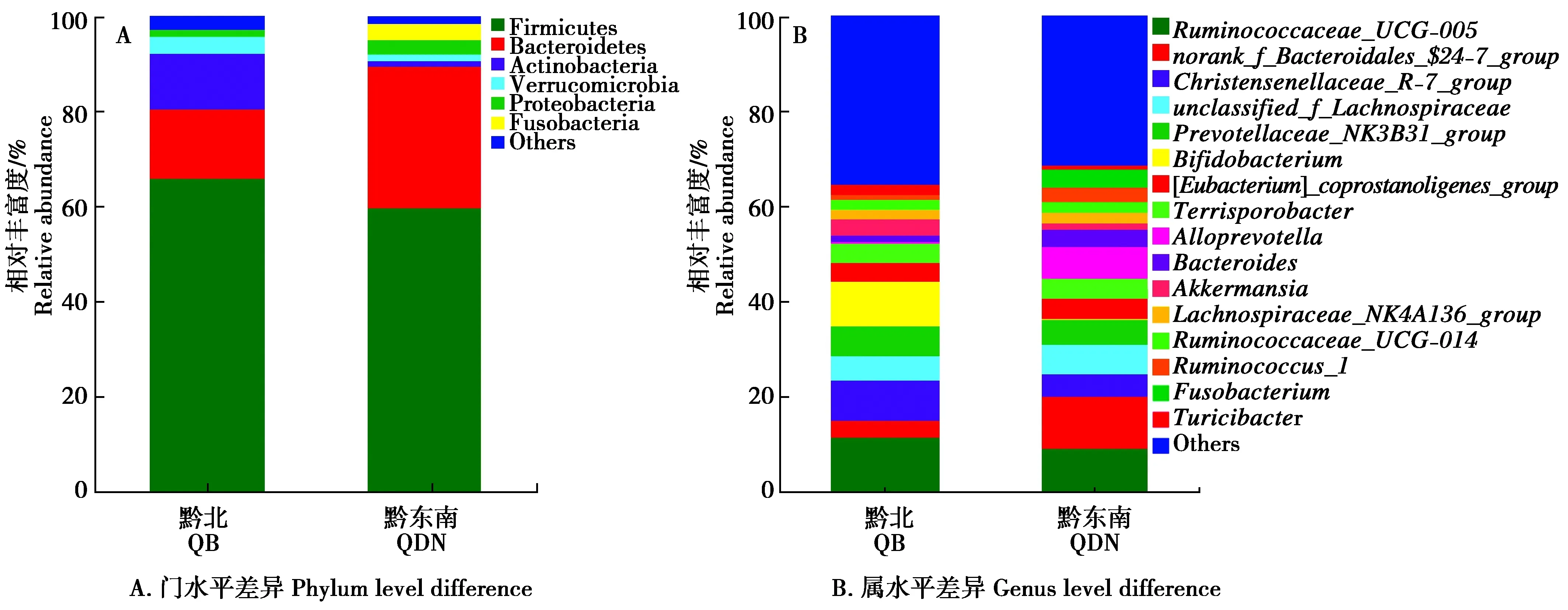
图6 不同地区野猪盲肠菌群组成及相对丰度
2.3.2 不同性别野猪盲肠细菌菌群组成及相对丰度


图7 不同性别野猪盲肠菌群组成及相对丰度
2.4 野猪盲肠细菌菌群差异
2.4.1 不同地区野猪盲肠细菌菌群差异
基于门水平至属水平的相对丰度矩阵对两地区分别进行LEfSe分析(图8)发现,黔北地区的放线菌门、软壁菌门(Tenericutes)和unclassified_k_norank的丰度显著高于(P<0.05)黔东南地区。黔北地区菌属丰度显著高于(P<0.05)黔东南地区的有双歧杆菌属、瘤胃球菌属和乳杆菌属等11个;黔东南地区菌属显著高于(P<0.05)黔北地区的有拟普雷沃菌属、Terrisporobacter、颤杆菌克属(Oscillibacter)和颤螺旋菌属(Oscillospira)等6个。

图8 不同地区野猪盲肠细菌多样性门水平至属水平的LDA判别
2.4.2 不同性别野猪肠道细菌菌群差异
在性别差异分析上(图9),雄性样本厌氧原体属(Anaeroplasma)显著高于雌性(P<0.05);雌性样本Tyzzerella、房间芽胞杆菌属(Domibacillus)和氨基酸球菌属(Acidaminococcus)等6个菌属丰度显著高于雄性(P<0.05)。

图9 不同性别野猪盲肠细菌多样性门水平至属水平的LDA判别
2.5 PICRUSt功能预测分析
PICRUSt基因预测表明,样本体内检测出的所有细菌基因主要调控野猪个体盲肠样本富集的44条代谢途径,图10、图11分别展示了两地区、雌雄样本组间相对丰度>2%的15条代谢途径。
2.5.1 不同地区野猪盲肠PICRUSt功能预测
总体上看(图10),两地区野猪盲肠细菌均以新陈代谢途径为主(QDN 57.91%,QB 57.35%),两地区样本代谢途径中相对丰富度最高的均为碳水化合物代谢途径(QDN 16.44%,QB 16.23%)的功能基因,其次依次为氨基酸代谢途径、辅助因子和维生素代谢、能量代谢等途径的功能基因。由此说明两地区个体盲肠细菌功能基因丰富度差异不显著,基本相同,功能性高度相似。

图10 不同地区野猪盲肠PICRUSt基因预测聚类热图
2.5.2 不同性别野猪盲肠PICRUSt功能预测
不同性别组间功能性细菌基因代谢途径的差异不显著(图11),雌雄样本均以新陈代谢途径的功能基因为主,其中雄性57.84%,雌性57.35%,代谢途径中均以碳水化合物代谢途径为主,其次依次为氨基酸代谢、能量代谢、辅助因子和维生素代谢等途径。

图11 不同性别野猪盲肠PICRUSt基因预测聚类热图
2.5.3 野猪盲肠PICRUSt功能差异
经非参数检验可知(图12),不同地区野猪盲肠细菌的循环系统(circulatory system,图12A)和寄生虫传染病(infectious disease parasitic,图12B)途径存在显著差异(P<0.05),雌雄性别间膜运输途径(membrane transport,图12C)存在显著差异(P<0.05),其他代谢途径存在一定的异同。

图12 野猪盲肠PICRUSt预测基因代谢途径差异
3 讨论
3.1 野猪盲肠细菌菌群多样性
近年来,利用高通量Illumina测序可检测不可人工培养的肠道细菌,测序快速且结果准确度高,可全面反映复杂样品的微生物群落的组成,是目前微生物多样性研究的重要技术手段之一[29]。本研究通过高通量技术检测贵州野猪盲肠,聚类分析共得到研究区域野猪盲肠细菌隶属18门278属,其菌群多样性和丰富度均显著高于西藏高原藏猪盲肠(13门56属)[11]和重庆圈养野猪(13门118属)[16],略高于河南省荥阳野猪肠道菌群(17门163属)[15],这可能是由于食物来源[22]、栖息环境的不同而导致菌群多样性的不同。研究结果略低于贵州苗岭地区野猪肠道细菌菌群(19门292属)[14],说明贵州地区野猪盲肠富含了野猪肠道的大部分细菌菌群(门占94.74%,属占95.21%),仅有少量种类未富集。Alpha多样性分析显示两地区及雌雄组间差异不大,可能是因相同(临近)地域的样本食物[22]、栖息环境相似导致肠道菌群差异不显著;各样本菌群组成结构存在一定差异,可能作为机会主义杂食动物的野猪[30]进食有所不同而导致各自肠道菌群不同。
3.2 不同地区野猪盲肠细菌菌群结构及其差异
从菌群结构看,野猪盲肠细菌的优势菌门依次为厚壁菌门(62.81%)、拟杆菌门(23.63%)、放线菌门(5.96%)、变形菌门(2.26%)、疣微菌门(1.72%)和梭杆菌门(1.57%),与前人研究的猪肠道中丰富度最高的菌门为厚壁菌门和拟杆菌门[31]的结论相同。贵州苗岭地区野猪其他肠段(胃、结肠和直肠)中也以厚壁菌门和拟杆菌门为优势菌群[14],这一观点在西藏高原藏猪[11]、中国特有的丫杈猪、青裕猪和乌金猪[32]及其他家猪研究中[33-35]也得到了证实,这表明厚壁菌门和拟杆菌门的富集对食草和杂食性动物具有重要的意义。
研究发现,厚壁菌门与拟杆菌门的相对比例能够反映宿主对能量吸收和储藏的能力[36],从而能在一定程度上决定机体的肥瘦情况。作为野猪盲肠主要优势菌门之一的厚壁菌门最主要的功能是降解纤维类物质,将纤维素分解成宿主可利用的挥发性脂肪酸,提高宿主的营养利用率,还可以调节T细胞提高宿主免疫能力,预防肠道炎症,维持肠道微生物生态平衡[37];而拟杆菌门主要降解非纤维类物质[38-39],尤其在降解和吸收多糖、碳水化合物和蛋白质等物质方面具有关键作用[18]。本研究还发现放线菌门、变形菌门与河南省荥阳县研究的野猪盲肠菌群丰富度(放线菌门为31.22%~46.66%,变形菌门为0.29%~32.39%)[15]差异较大,这可能是放线菌门和变形菌门的菌群是主要的纤维素降解菌,而研究区野猪主要降解纤维素的后壁菌门丰度较高,且野外自然生存和圈养环境不同,导致两地野猪的放线菌门和变形菌门菌群不同。放线菌门种类在动物肠道中占有一定的优势地位,它们可以产生对宿主健康和体内平衡至关重要的关键抗生素、免疫调节化合物和代谢物[40],放线菌作为抗菌药物的抗性促进剂作用得到了充分的证明[15],这与野外生存的野猪具有较强的抗病和免疫能力、无需人工进行免疫防治的情况相符合。因此,对于在野外自然生长、以粗纤维为主要食物的野猪来说,在食物的降解、吸收和抗菌免疫等方面,厚壁菌门、拟杆菌门和放线菌门等主要核心菌群起着至关重要的作用。
在属水平上,Ruminococcaceae_UCG-005是盲肠中丰度最高的菌属,在以往研究中表明,瘤胃球菌科中许多菌属能够产生纤维素酶和淀粉酶等碳水化合物降解酶,有助于细胞吸收糖分和利于食物消化[41]。瘤胃球菌科真杆菌属(Eubacterium)含有多种能降解淀粉的基因,能够分解多糖产生丁酸等短链脂肪酸[42],因此Ruminococcaceae_UCG-005和Ruminococcaceae_UCG-014在动物肠道中应该也具有降解纤维素的功能。毛螺菌科(Lachnospiraceae)多个属[43]、Christensenellaceae_R-7_group[11]和瘤胃球菌属[44]等菌属参与纤维素的降解,产生挥发性脂肪酸为机体及肠道微生物提供能量。拟杆菌门的拟普雷沃菌属、拟杆菌属(Bacteroides)和Prevotellaceae_NK3B31_group等菌群在促进动物降解不易消化的食物、吸收食物养分及增强机体免疫力等方面具有重要作用[10,45]。双歧杆菌属菌群属于典型的益生菌,双歧杆菌体内含有大量的消化酶能消化一些机体内不能依靠本身酶系消化的营养物质,促进个体营养物质的消化吸收,同时还能增强免疫力和抗癌能力[46],具有降血脂[46]和护肝等功能[47],多种菌属的共同协作才能提升野猪应对环境变化的风险。
3.3 不同性别野猪盲肠细菌菌群结构及差异
雌雄样本组间显著差异的菌群为软壁菌门厌氧原体科(Anaeroplasmataceae)的厌氧原体属和氨基酸球菌属、厚壁菌门毛螺菌科和变形菌门Roseiarcus。研究区域雌性野猪盲肠厚壁菌门丰度(64.11%)显著高于Wang等[12](53.65%)和Yang等[15](30.45%~52.35%)的研究结果,拟杆菌门(24.45%)则显著低于Wang等[12](38.22%)的研究结果,高于Yang等[15](0.40%~16.86%)的研究结果;雄性野猪在两菌门间则无显著差异,这可能与本研究个体的食物种类(冬季主要为植物,纤维素含量高)有关。雌性野猪放线菌门(6.86%)显著低于Yang等[15](31.22%~46.66%)在河南的研究结果,这可能是由于两研究地的食物、栖息环境以及个体的健康状况等不同而存在显著差异。本研究结果显示,雌性野猪双歧杆菌属(4.54%)丰度显著低于Yang等[15]的研究结果(22.48%),与谭占坤等[11]研究的放牧藏猪结果相似(4.67%),这说明菌群丰度可能与野猪该时间段的健康状态有关,存在一定的波动范围,与同样在野外自由生长的藏猪菌群丰度相似;乳酸菌属(Lactobacillus)丰度(0.92%)与Wang等[12]的研究结果相近(1.45%),乳酸菌与猪的生长阶段、健康状态和个体差异等有关,不同生活史阶段有一定差异[48]。
3.4 野猪盲肠PICRUSt功能预测
通过PICRUSt功能预测可知,研究区野猪盲肠细菌主要以碳水化合物代谢为主要途径,这与能产生碳水化合物降解酶的瘤胃球菌属[41]为优势菌属显著富集的结果相符;其次为氨基酸代谢途径,总体上在地区和性别组间差异不显著,相关研究表明膜转运和信号转导途径在较肥胖的猪盲肠中较丰富[49]。本研究结果与Yang等[15]和Wang等[12]研究的PICRUSt功能有所差异,这应该是由野猪生存环境、食性和个体状况等不同所导致。分析得知,不同地区野猪循环系统和寄生虫传染病代谢途径存在显著差异(P<0.05),雌雄性别间膜运输途径存在显著差异(P<0.05),其他代谢途径存在一定的异同。PICRUSt功能预测系与KEGG数据库进行比对,仅作为功能预测,具体生理生化功能还有待进一步研究。研究结果显示两地区、雌雄性别间的野猪盲肠细菌组成及丰度差异不显著,可能是因为两地区野猪喜食的食物、分布的微环境相似,盲肠中菌群相对稳定以及种群遗传分化不大等原因造成,具体因素有待进一步地探究。
研究表明,贵州黔北与黔东南地区不同性别间野猪盲肠细菌的组成、丰度和PICRUSt基因功能差异均不显著,但不同个体间有一定的异同,菌群多样性高于河南野猪、重庆圈养野猪和藏猪;PICRUSt基因预测功能以碳水化合物代谢途径为主,其次为氨基酸代谢途径。肠道微生物的组成结构多样性及其丰富度受多种因素的影响,从而也决定着菌群的功能多样性,掌握肠道菌群多样性可为研究其功能作用及其生理生化特性提供重要的基础信息。
致谢:感谢贵州省林业局、各地林业局(自然资源局)及自然保护区管理局的大力配合和帮助,在采样过程中也得到了贵州大学动物科学学院张飘、张天天及贵州师范大学生命科学院吕小燕、李斌强等多名同学帮助,在此一并致谢!

