不结球白菜耐热相关基因BcNAC036的克隆、亚细胞定位及功能分析
刘路平,刘高峰,蒋程,侯喜林
(南京农业大学作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室/园艺作物种质创新与利用教育部工程研究中心/南京苏曼等离子工程研究院,江苏 南京 210095)
不结球白菜(Brassicacampestrisssp.chinensis),起源于中国,属于十字花科(Cruciferae)芸薹属芸薹种的亚种之一[1]。不结球白菜因其适应性强、生长周期短、营养价值高且丰富、栽培方法简单和易于加工等特点,受到人们的青睐,特别适合长江流域地区种植[2]。不结球白菜喜冷凉气候,而我国南方地区夏季高温多雨,对其栽培造成一定的影响,例如限制生长速度、口感变苦变涩、病毒病严重、苗期的死亡率升高、纤维含量提高、叶片变黄腐烂等[3-4]。因此,为满足不结球白菜周年供应的需求,需要进行不结球白菜的耐高温性研究,选育优良耐高温品种。
温度是影响植物生长发育和形态建成过程中的最主要生态因子,在很大程度上影响植物的生长发育及其他代谢活动[5]。高温和低温胁迫均会影响植物的生长发育与形态建成及其他正常代谢活动。近年来,全球气温变动幅度普遍增大,夏秋季节温度日益增高,对不结球白菜的生长发育造成了不利影响[6]。研究表明,温度短时间升高10~15 ℃会导致不结球白菜停止生长发育[7-9]。1996年,Souer等[10]从矮牵牛中克隆获得世界上首个NAC(NAM/ATAF/CUC)基因。之后,相继在拟南芥[11]、小麦[12]、水稻[13]、大麦[14]、马铃薯[15]、油菜[16]、南瓜[17]以及甘蔗[18]等物种中发现NAC基因。研究表明,NAC基因功能具有多样性,参与调控植物的生长发育、形态建成、信号转导以及响应各种生物、非生物胁迫,而有关不结球白菜NAC基因的相关研究鲜见报道。因此,本研究通过同源克隆获得不结球白菜BcNAC036基因的cDNA全长片段;通过同源重组构建过表达载体pCAMBIA1302-BcNAC036-GFP;通过农杆菌介导法将过表达载体导入烟草叶片,通过激光共聚焦显微镜观察蛋白BcNAC036的亚细胞定位;通过RT-qPCR技术检测不结球白菜热敏感品种‘矮脚黄’和耐高温品种‘苏州青’以及拟南芥过表达植株中BcNAC036基因的表达量,旨在探索BcNAC036基因在耐高温处理中的响应机制,从而对不结球白菜的栽培和管理提供理论依据。
1 材料与方法
1.1 试验材料
不结球白菜耐高温品种‘苏州青’、热敏感品种‘矮脚黄’以及哥伦比亚拟南芥野生型品种由南京农业大学园艺学院白菜课题组提供。室温环境中,将无菌水清洗后的种子,放入培养皿中催芽24~48 h;将发芽种子移栽至穴盘中,置于人工气候室(光/暗时间为16 h/8 h、昼/夜温度为24 ℃/16 ℃、湿度为75%)中培养,待第2片真叶完全展开时取叶片,液氮速冻,于-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 叶片总RNA的提取和cDNA的合成取0.2 g‘苏州青’叶片(4叶期)充分研磨后,根据植物RNA抽提试剂盒(TaKaRa)中的说明书提取样品总RNA,参照Goldenstar TtMm RT6 cDNA synthesis Mix(gDNA)试剂盒(南京擎科生物科技有限公司)中的说明书将抽提的总RNA反转录成cDNA。
1.2.2 不结球白菜BcNAC036基因全长的克隆在不结球白菜数据库(http://nhccbase.njau.edu.cn/website/)中BLAST拟南芥NAC036的同源基因BcNAC036(CabbageG_a_f_g042163)序列,并通过SnapaGene软件设计该基因PCR扩增所需的特异性引物BcNAC036-F/R(表1)。以‘苏州青’RNA反转录获得的cDNA为模板进行PCR扩增,扩增体系(50 μL):模板cDNA 1 μL,上、下游引物各2 μL,I-5TM High-Fidelity Master Mix(2×)25 μL,ddH2O 20 μL。反应程序:98 ℃ 2 min;98 ℃ 10 s,55 ℃ 15 s,72 ℃ 15 s,共30个循环;72 ℃ 5 min;4 ℃ 保存。用琼脂糖凝胶(12 g·L-1)检测PCR产物,比对Marker判断条带大小正确后切下,并按照胶回收试剂盒(南京擎科生物科技有限公司)的说明书进行回收纯化。将纯化之后得到的产物连接到平末端的pClone007 Blunt载体(南京擎科生物科技有限公司)上,随后转大肠杆菌感受态DH5α,挑选单个阳性菌落PCR检测之后送南京擎科生物科技有限公司测序,测序正确的记为BcNAC036-pClone007。

表1 本文所用引物序列Table 1 Primer sequences in this study
1.2.3 序列分析在NCBI数据库中BLAST并下载与不结球白菜BcNAC036同源性高的其他物种的NAC036基因及氨基酸序列;采用DNAMAN 9.0软件[19]分析NCBI上所下载的序列;采用MEGA X软件[20]进行系统进化树分析。NAC036蛋白的理化性质分析通过Online工具中ProtParam(http://www.expasy.org/tools/protparam.html)进行。
1.2.4BcNAC036基因片段的PCR扩增以pClone007 Blunt作为入门载体,并设计特异性引物BcNAC036-F1/R1,使用I-5TM High-Fidelity Master Mix(南京擎科生物科技有限公司)进行PCR扩增,模板为BcNAC036-pClone007质粒,反应体系及程序同1.2.2节。PCR产物纯化回收方法同1.2.2节。
1.2.5 构建亚细胞定位表达载体表达载体pCAMBIA1302用限制性内切酶(SacⅠ、SalⅠ)进行双酶切(37 ℃,30 min),同源重组法构建过表达载体总体系(10 μL):pCAMBIA1302 3.5 μL,基因片段胶回收产物 0.5 μL,SoSoo Mix(2×)5 μL,ddH2O 1 μL。反应程序:50 ℃ 15 min。反应产物转大肠杆菌感受态DH5α,并涂布于含卡那霉素(50 mg·L-1)的固体LB培养基上,37 ℃倒置培养12~14 h,菌落(单克隆)PCR检测,鉴定阳性克隆并送至南京擎科生物科技有限公司测序。
1.2.6 BcNAC036的亚细胞定位将同源重组法构建的表达载体pCAMBIA1302-BcNAC036-GFP导入GV3101农杆菌感受态(液氮转化法),涂布方法同1.2.5节,28 ℃倒置培养2 d,菌落检测方法见1.2.5节。将菌检正确的菌液置于含卡那霉素(50 mg·L-1)的液体LB培养基中:28 ℃、200 r·min-1培养20 h,之后在含有相同浓度抗生素的培养基中进行菌液扩大培养。当D600值约为1.0时,4 000 r·min-1离心5 min,用注射缓冲液[MgCl210 mmol·L-1、MES(pH5.7)10 mmol·L-1、乙酰丁香酮150 μmol·L-1]重悬管底菌斑,并调节D600值约为0.8,静置 5 h,用1 mL针管注射器在本氏烟草叶片的背面缓慢注入菌液,以H2B-RFP作为对照(显示细胞核位置)。将注入菌液后的烟草重新放回人工气候室(光/暗时间为16 h/8 h,昼/夜温度为 22 ℃/18 ℃)恢复培养72 h,通过激(荧)光共聚焦显微镜来观察和分析蛋白BcNAC036的亚细胞定位。
1.2.7 不结球白菜幼苗的高温处理将种子室温催芽1~2 d,移植于小花盆(移栽时芽朝上)并置于人工气候室(光/暗时间为16 h/8 h,昼/夜温度为22 ℃/17 ℃,环境湿度为 60%)中培养。待植株生长至25 d,约第6片叶完全展开时,对其进行高温(43 ℃)处理,光照、湿度均按正常设置,并于处理0、2、5 h时取叶片样品。每个样品3个生物学重复。
1.2.8BcNAC036基因导入拟南芥植株将含有pCAMBIA1302-BcNAC036-GFP农杆菌接种于含抗生素利福平(50 μg·mL-1)和卡那霉素(50 μg·mL-1)的双抗LB液体培养基,28 ℃、200 r·min-1培养16 h,5 000 r·min-1离心20 min后弃上清液,并用渗透缓冲液(25 g蔗糖、1/2MS、100 μL siluetl-77、170 μL NaOH)悬浮沉淀菌液。侵染盛花期拟南芥80 s,侵染2次后等待收种。将消毒处理后的种子播种于含抗生素(潮霉素10 μg·mL-1+特美汀16 μg·mL-1)的MS固体培养基中,放置在人工气候室,15 d后观察筛选出的植株并移植于穴盘中,15 d后取样,按照植物基因组DNA提取试剂盒(南京擎科生物科技有限公司)说明书提取样品的DNA,作为PCR检测的模板筛选阳性植株,收取成熟种子记为T1代种子,同理将T1代种子继续筛种,所收取种子即为T2代,同样方法筛选出T3代种子。
1.2.9BcNAC036转基因拟南芥植株耐热性分析将T3代种子播种于MS固体培养基上,以野生哥伦比亚型拟南芥为对照,于光照培养箱中培养10 d,然后进行43 ℃、6 h高温处理,最后置于人工气候室恢复3 d后拍照并计算其存活率。
1.2.10BcNAC036基因的RT-qPCR分析按照RNA Simple Total RNA Kit(Tiangen)中的说明步骤提取叶片中的总RNA,参照Goldenstar TtMm RT6 cDNA synthesis Mix(gDNA)试剂盒说明书进行操作并将提取的总RNA反转录合成 cDNA(反转录时按照1∶1的浓度添加样品)。使用NCBI在线工具设计荧光定量特异性引物(表1)。试验反应液按照SYBRPremixExTaq试剂盒(TaKaRa)中的说明书添加。RT-qPCR程序分为2个步骤:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环;熔解曲线65 ℃ 10 s,61个循环。基因的相对表达量采用2-ΔΔCT法分析与计算[21],所有数据通过SPSSAU在线软件工具和WPS中Excel 2003文件程序分析显著性差异。
2 结果与分析
2.1 不结球白菜BcNAC036基因的克隆及序列分析
以不结球白菜‘苏州青’的cDNA为模板,设计扩增特异性引物BcNAC036-F/R,扩增出的条带大小约为840 bp(图1)。经过序列分析,BcNAC036基因的开放阅读框(ORF)为840 bp,编码的氨基酸数为279(图2)。测序结果显示,PCR扩增的产物片段大小与BcNAC036基因完全相同。
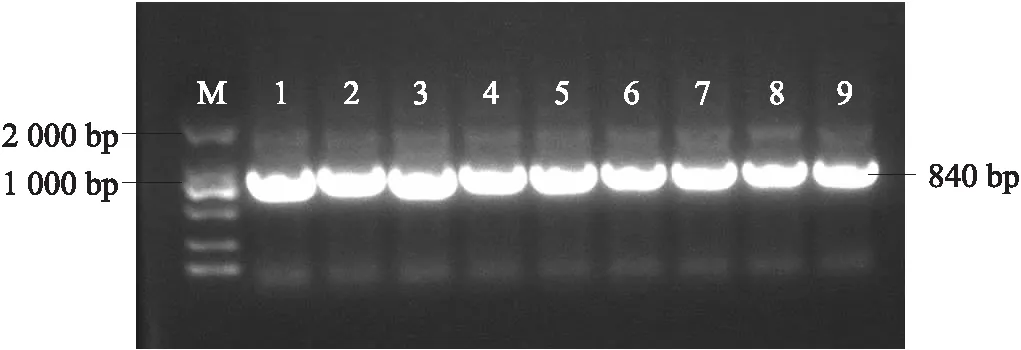
图1 不结球白菜BcNAC036基因的克隆Fig.1 Cloning of the BcNAC036 gene in non-heading Chinese cabbageM. DL2000 marker;1~9. BcNAC036扩增产物 BcNAC036 amplification product.

图2 BcNAC036基因的核苷酸序列及所编码的氨基酸序列Fig.2 Nucleotide sequence of BcNAC036 gene and its encoded amino acid sequence*表示终止密码子。*represents stop codon.
2.2 BcNAC036的氨基酸理化性质
ProtParam在线软件分析结果显示:BcNAC036基因所编码蛋白的化学分子式为C1437H2250N392O420S13,该蛋白包含279个氨基酸,相对分子质量为32 154.83,理论等电点为8.96,包含正电残基(Asp+Glu)和负电残基(Arg+Lys)数量分别为是34和39,基本断定其为酸性蛋白;不稳定系数为46.18,表明该蛋白稳定性较低;脂肪系数和平均相对亲水系数分别为70.90和-0.668,表明其亲水性较高。
2.3 BcNAC036系统进化分析
BLASTp检索[22]结果显示,BcNAC036与同属的一些物种例如芜菁(B.rapa)、甘蓝型油菜(B.napus)和甘蓝(B.oleraceavar.oleracea)的同源性分别为100%、98%和97%。因此判断出BcNAC036和BraNAC036在结构、序列和功能上呈现出一定程度的相似性。从BLAST结果中下载10个与BcNAC036同源性不低于80%且同属于十字花科物种如萝卜(Raphanussativas)、小花南芥(Arabisalpina)、拟南芥(Arabidopsisthalinan)、芥菜(Capsellarubella)等的氨基酸序列,用氨基酸序列比对软件DNAMAN 9.0对下载的11个序列进行比对分析,结果(图3)表明,不结球白菜BcNAC036保守性较高。用进化树构建软件MEGA X对下载的11个序列进行系统进化分析,结果(图4)表明NAC036进化符合植物分类学地位,BcNAC036蛋白与同为芸薹属的芜菁BraNAC036蛋白同源关系最近。

图3 不结球白菜和其他十字花科物种NAC036蛋白的氨基酸序列比对Fig.3 Comparison of the amino acid sequence of NAC036 protein of non-heading Chinese cabbage and other Cruciferae species Ⅰ.不结球白菜Brassica campestris ssp. chinese;Ⅱ.芜菁Brassica rapa XP_009112413.1;Ⅲ.甘蓝型油菜Brassica napus CDY47486.1;Ⅳ.甘蓝Brassica oleracea var. oleracea XP_013609230.1;Ⅴ.萝卜Raphanus sativus XP_018457954.1;Ⅵ.山萮菜Eutrema salsugineum XP_006409356.1;Ⅶ.小花南芥Arabis alpine KFK_40091.1;Ⅷ.亚麻荠Camelina sativa XP_010515693.1;Ⅸ.玉山筷子芥Arabidopsis lyrata subsp. lyrata XP_002884035.1;Ⅹ.芥菜Capsella rubella XP_006298285.1;Ⅺ.拟南芥Arabidopsis thaliana OAP11171.1.

图4 不结球白菜与其他十字花科物种的NAC036蛋白的进化树分析Fig.4 Phylogenetic tree analysis of NAC036 proteins in non-heading Chinese cabbage and other Cruciferae species
2.4 BcNAC036的亚细胞定位分析
由图5可见:在GFP激发光通道下,表达载体pCAMBIA1302-BcNAC036-GFP显示绿色荧光信号,在RFP激发光通道细胞核显示红色荧光信号,表明是烟草的细胞核位置;叠加图中显示的黄色荧光信号(红色与绿色荧光重合)位置是在细胞核,说明BcNAC036蛋白定位在细胞核。
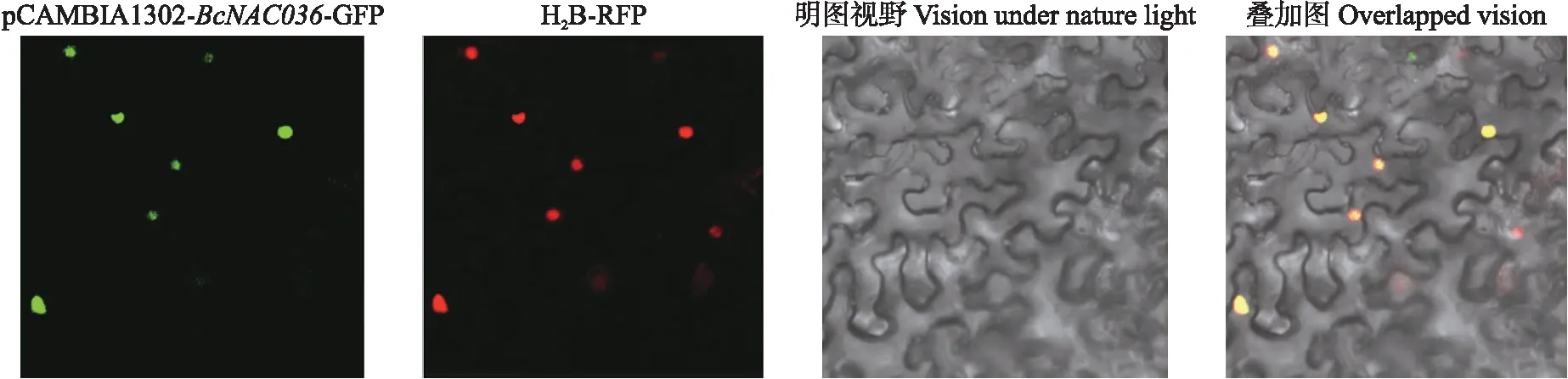
图5 BcNAC036在本氏烟草叶片中的亚细胞定位Fig.5 Subcellular localization of BcNAC036 in leaves of Nicotinan benthamiana荧光信号:绿色来自于GFP;红色来自于RFP;黄色是绿色和红色重合叠加而来。Fluorescence signal:Green comes from GFP;Red comes from RFP;Yellow is the result of overlapping of green and red.
2.5 不结球白菜高温处理后表型变化及基因BcNAC036的表达分析
由图6可见:热敏感品种‘矮脚黄’与耐高温品种‘苏州青’相比,其叶卷曲程度严重,伴随出现植株萎蔫现象。由图7可见:BcNAC036基因在‘矮脚黄’中表达量明显高于‘苏州青’,且高温处理后2个品种的表达量均呈急剧下降的趋势,表明该基因与不结球白菜耐热性呈负相关,即耐热性越高其相对表达量越低。

图6 高温处理后‘苏州青’(左)和‘矮脚黄’(右)表型变化Fig.6 Phenotypic changes of ‘Suzhouqing’(left)and‘Aijiaohuang’(right) after high temperature treatment
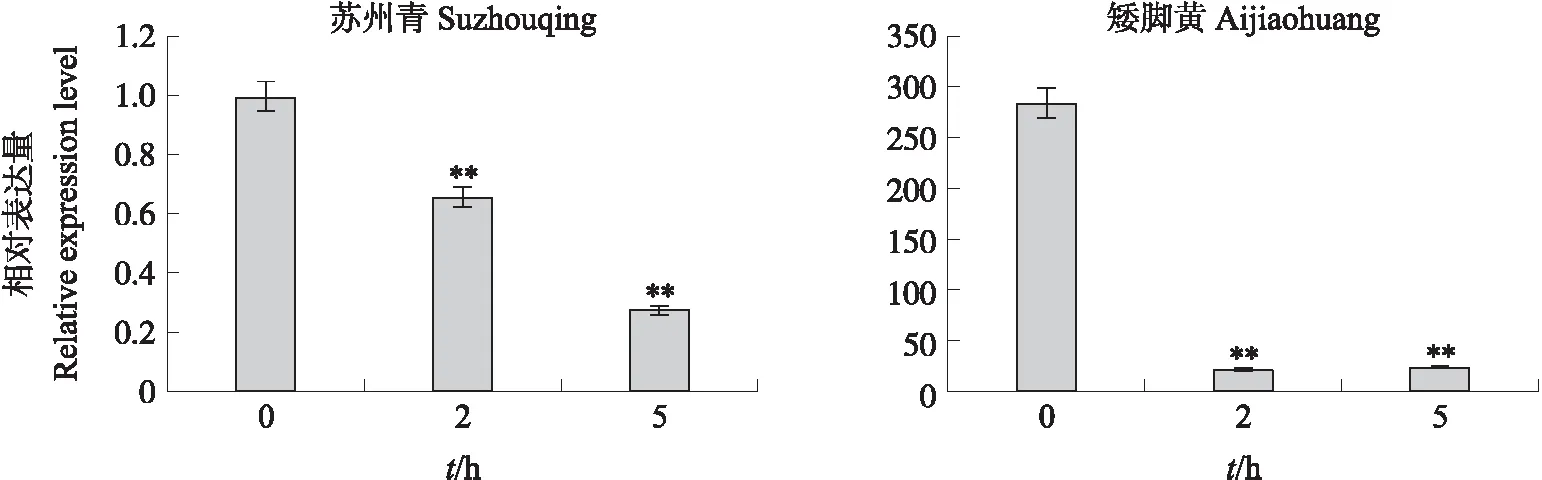
图7 高温处理后‘苏州青’和‘矮脚黄’BcNAC036基因表达量Fig.7 Expression level of BcNAC036 gene of ‘Suzhouqing’and ‘Aijiaohuang’ after high temperature treatment**P<0.01. The same as follows.
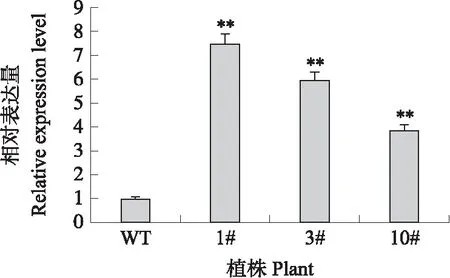
图8 转基因拟南芥BcNAC036过表达分析Fig.8 Overexpression analysis of BcNAC036 in transgenic Arabidopsis thaliana WT:野生型 Wild-type;1#、3#、10#:转基因株系Transgenic plant. 下同。The same as follows.
2.6 转基因拟南芥植株的鉴定
PCR扩增筛选出6个拟南芥的转基因株系,T3代种群中选择3个株系记为1#、3#、10#,对其进行高温处理,其相对表达量分析结果(图8)显示,野生型的表达量要远远低于3个转基因株系的,证实BcNAC036基因转拟南芥成功。
2.7 BcNAC036基因过表达拟南芥植株耐热性分析
由图9-A可见:转基因株系与野生型的生长情况基本一致。高温处理后野生型基本都存活,而转基因株系存活较少(图9-B)。分别统计过表达的转基因和野生型拟南芥的成活率,结果显示:野生型成活率为90%,而1#、3#、10#的成活率分别是40%、45%、46%(图9-C)。

图9 转基因与野生型拟南芥幼苗耐热性鉴定(A、B)及成活率(C)Fig.9 Identification of high temperature resistance of transgenic and wild-type A. thaliana seedlings(A,B)and survival rate(C)
3 讨论
在植物生长发育过程中都会受到热害、寒害、冻害、干旱和盐胁迫的影响,严重情况下会导致植物死亡。NAC转录因子在植物生长发育、形态建成以及响应各种生物、非生物胁迫的过程中发挥着不可或缺的作用。本研究结果显示,BcNAC036蛋白表达部位仅存在于细胞核,推测BcNAC036具备转录因子的功能,是参与调控植物耐热途径调控机制的关键基因。
本研究克隆得到BcNAC036基因,通过对其进行生物信息学分析,在该蛋白7~134个氨基酸残基存在1个NAM蛋白结构域,是DNA结合区域。Duval等[23]从拟南芥cDNA文库中分离到1个NAC结构域基因AtNAM。AtNAM的转录激活域,位于蛋白质的C端区域,在含NAC域的基因中,是1个高度分化的区域。不结球白菜NAC蛋白在NAM区域与ANAC036的氨基酸序列具有高度同源性。Nakashima等[24]对水稻NAC转录因子OsNAC6的功能进行研究,结果表明,在寒冷、干旱、高盐等非生物胁迫条件下,OsNAC6基因表达上调,且OsNAC6具有转录激活的功能;过表达OsNAC6水稻植株中,与非生物和生物胁迫相关的基因表达上调。在拟南芥中,响应水杨酸或茉莉酸途径的各种NAC基因突变体,延缓拟南芥生长[25]。研究显示,拟南芥ONAC022亚群中2个NAC蛋白成员的功能被验证,ANAC034和ANAC035参与调控花期和冷应激反应[26];ANAC009控制根帽干细胞有限区域内的细胞分裂[27]。综上,NAC转录因子参与调控植物生长发育,响应生物和非生物胁迫。
NAC转录因子ANAC046是拟南芥叶片中叶绿素降解和衰老的正调控因子,并且拟南芥AtNAC036基因主要在叶片中表达[28]。Kato等[29]研究表明,NAC036转基因植株叶片小、叶柄和叶茎均比野生型短,并且细胞形状大小也比野生型小。这些差异使植物遭遇高温胁迫时不利于蒸腾散热,不利于吸水降温,表明拟南芥AtNAC036基因与其耐热性呈负相关。本研究中,不结球白菜BcNAC036基因与拟南芥高度同源,推测其耐热性与拟南芥NAC036相似,即不结球白菜BcNAC036基因与耐热性呈负相关。
本研究结果显示,BcNAC036基因在热敏感品种‘矮脚黄’中表达量明显高于耐高温品种‘苏州青’,并且高温处理后2个品种基因表达量均急剧下降,且拟南芥转基因幼苗死亡率显著高于野生型,表明该基因与不结球白菜耐热性呈负相关。同时,本研究对不结球白菜文库进行筛选,筛选出了与BcNAC036互作的蛋白BcMYB30。Liao等[30]的研究表明,拟南芥MYB30基因负调控高温和氧化胁迫。不结球白菜BcMYB30与拟南芥高度同源,是否是BcNAC036基因激活了BcMYB30基因的大量表达,从而导致BcNAC036基因与不结球白菜耐热性呈负相关,亦或是存在其他未知与BcNAC036互作的基因共同参与调控不结球白菜的耐高温路径,还有待进一步研究。

