小干扰RNA技术沉默HLA-E基因表达对人乳腺癌细胞增殖与凋亡及裸鼠移植瘤生长的影响*
吴振村, 周艳
1张家口市妇幼保健院检验科(河北张家口 075000);2河北北方学院免疫教研室(河北张家口 075000)
乳腺癌(breast cancer,BC)是最常见的危害女性健康的恶性肿瘤,是全世界妇女癌症死亡的第二大原因[1]。据统计,全球每年约有160多万妇女被诊断患有乳腺癌,虽然乳腺癌的早期诊断和早期治疗取得了显著进展,但每年仍有约52万人死于该疾病,约占所有癌症死亡人数的25%[2]。可能原因包括发现晚、易复发转移[3-5]等。研究发现,乳腺癌的发生、发展及转移与多种基因的调控密切相关[6]。目前,乳腺癌高危人群的基因检测和靶向基因治疗正在迅速出现[7],是除常规疗法之外又一新的重要治疗方法。近年来,采用RNA干扰技术沉默特定基因在乳腺癌治疗研究中取得了良好的效果。郭智慧等[8]采用小干扰RNA(small interfering RNA,siRNA)技术沉默乳腺癌细胞DEK基因、管海涛等[9]利用siRNA技术沉默survivin的表达均可显著抑制乳腺癌细胞增殖和诱导凋亡。我们前期研究发现人类白细胞抗原-E(human leukocyte antigen-E,HLA-E)基因多态性与乳腺癌发生相关[10-12],基于前期研究,2021年1—12月本研究设计并合成了HLA-E siRNA序列,探讨siRNA技术沉默人乳腺癌细胞HLA-E基因表达对乳腺癌细胞增殖与凋亡及对裸鼠移植瘤生长的影响,为乳腺癌靶向治疗奠定理论基础。本研究得到张家口市妇幼保健院实验动物伦理委员会批准(编号:KYLL-2020-001)。
1 材料与方法
1.1 材料 Vigofect转染试剂(北京威格拉斯生物技术有限公司); DMEM干粉(Gibco公司); SuperRT cDNA Synthesis Kit(北京康为世纪生物有限公司);UltraSYBR Mixture(Low ROX) (北京康为世纪生物有限公司);鼠抗人HLA-E单克隆抗体(ab11821,Abcam公司);CCK-8试剂盒(碧云天);ECL化学发光试剂盒(碧云天);乳腺癌MDA-MB-231细胞(本室保存),常规培养于含10%胎牛血清的DMEM培养液(DMEM-10),5%CO2、37℃饱和湿度培养箱中培养;雌性BALB/c 裸鼠20只,4~6周龄(中国食品药品检定研究院)。
1.2 方法
1.2.1 siRNA的设计 从ncbi数据库中获取人HLA-E mRNA序列(GenBank:X56841.1),利用siRNA在线设计软件及RNA二级结构分析软件,设计并筛选与预测HLA-E mRNA容易结合的siRNA序列,作为HLA-E siRNA,采用随机打乱的方法设计阴性对照siRNA序列。
1.2.2 转染siRNA至乳腺癌细胞 实验分3组,空白对照组不加任何试剂;阴性对照组转染阴性对照siRNA;HLA-E siRNA组转染HLA-E siRNA。取对数生长期乳腺癌细胞MDA-MB-231,接种于6孔板,培养细胞达60%~80%融合度。取5 μg HLA-E siRNA序列或阴性对照siRNA序列分别与2 μL VigoFect 转染试剂混匀于100 mL生理盐水,室温静置15 min后逐滴加入培养细胞液中,轻轻混匀,继续培养至48 h。
1.2.3 Real-time PCR检测HLA-E mRNA水平 收集转染48 h各组细胞,TRIZOL裂解法提取细胞总RNA,Eppendorf核酸定量测定仪检测RNA浓度和纯度,行1.5%琼脂糖凝胶电泳鉴定RNA完整性。取1 μg总RNA,反转录合成cDNA,采用UltraSYBR Mixture(Low ROX)进行 Real-time PCR检测HLA-E mRNA表达。
1.2.4 Western blot分析HLA-E 蛋白水平 收集转染48 h各组细胞,用预冷的RIPA裂解液提取细胞总蛋白,BCA法测定蛋白浓度。按80 μg/孔上样量进行12%SDS-PAGE凝胶电泳,分离后蛋白转移至PVDF膜,5%脱脂奶粉封闭2 h,鼠抗人HLA-E单抗(1∶2 000)4℃孵育过夜,PBS-T洗涤后,加入羊抗鼠二抗(1∶5 000)室温孵育2 h,PBS-T洗涤后,加入ECL底物显色。
1.2.5 CCK-8法检测转染后细胞生长抑制率 取对数生长期细胞,调整密度为2×104个/mL,取100 μL悬液接种于96孔板内,设立空白对照组、阴性对照组和HLA-E siRNA组,每组设6个平行孔。转染48 h后,每孔细胞加入10 μL CCK-8溶液,继续培养2 h,酶标仪测定450 nm处吸光度值(OD450)。
1.2.6 流式细胞术检测转染后细胞凋亡 取对数生长期细胞按4×105个/mL接种于6孔板,设立空白对照组、阴性对照组和HLA-E siRNA组,转染48 h,收集各组细胞,调整细胞浓度为1×106·mL-1,Annexin V-FITC/PI(碘化丙啶)双染色后,流式细胞仪检测各组细胞凋亡情况。
1.2.7 裸鼠移植瘤实验 取对数生长期MDA-MB-231细胞,消化成单细胞悬液,生理盐水稀释至2×107·mL-1,取0.2 mL接种于裸鼠右腋皮下,待触摸到接种部位有瘤组织形成时,将裸鼠随机分为空白对照组、阴性对照组和HLA-E siRNA组,每组6只,分别瘤内注射生理盐水、阴性对照siRNA(1 mg/kg)和HLA-E siRNA(1 mg/kg)。每隔1 d观察记录瘤体大小。
1.3 统计学方法 采用SPSS 19.0统计软件,单因素方差分析进行数据分析,两组之间比较采用LSD法。以P<0.05为差异有统计学意义。
2 结果
2.1 HLA-E siRNA的设计合成 根据HLA-E mRNA序列,利用siRNA在线设计软件(http://biodev.extra.cea.fr/DSIR/DSIR.html)及RNA二级结构分析软件,筛出一条与HLA-E mRNA预测结构容易结合的HLA-E siRNA,序列为:5′-CACUCAUGUUGAGACUUAAUC-3′(正义链),5′-UUAAGUCUCAACAUGAGUGUU-3′(反义链);阴性对照siRNA序列为:5′-UCAGUCGUATTUUGCCAGGCCGG-3′(正义链),5′-GCCGUGAUCAGGUGCUCACAGC-3′ (反义链)。两种siRNA序列由上海生工合成。
2.2 转染后细胞HLA-E mRNA表达水平 细胞总RNA进行琼脂糖凝胶电泳发现,电泳图有3条清晰带,即是28 s、18 s和5 s,说明提取的每组细胞总RNA完整性较好(图1)。Real-time PCR结果显示,HLA-E siRNA组细胞HLA-E mRNA水平(0.53±0.07)显著低于空白对照组(1.03±0.08)和阴性对照组(0.90±0.04)(P<0.01),空白对照组和阴性对照组HLA-E mRNA水平没有明显差异。转染课题组设计的HLA-E siRNA序列可显著沉默乳腺癌细胞HLA-E表达。

图1 琼脂糖凝胶电泳鉴定提取的细胞总RNA完整性
2.3 转染后细胞HLA-E蛋白表达水平 Western blot 检测发现,转染48 h后,HLA-E siRNA组未检测到HLA-E蛋白表达,空白对照组和阴性对照组HLA-E 表达没有明显差异(图2)。转染HLA-E siRNA可沉默乳腺癌细胞HLA-E蛋白表达。
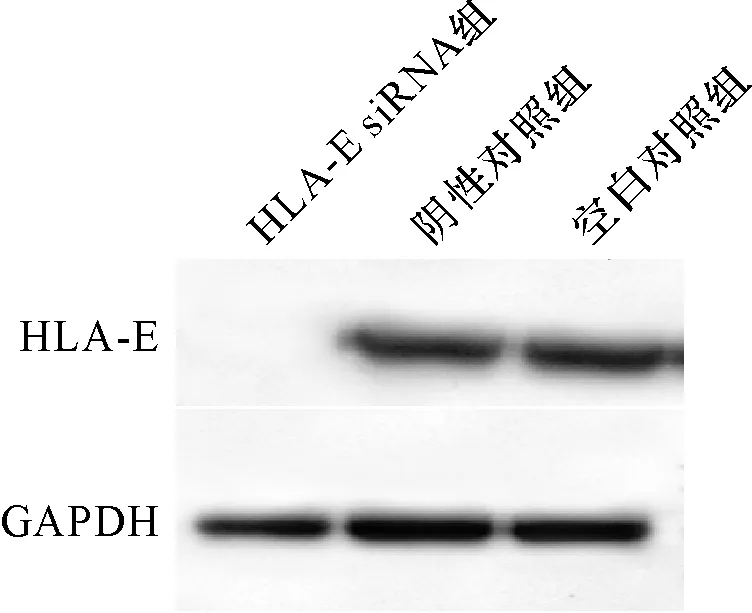
图2 Western blot 检测转染后乳腺癌细胞HLA-E 蛋白表达水平
2.4 转染后细胞生长抑制率 CCK-8法检测结果显示,阴性对照组细胞生长抑制率是(8.18±0.83)%,HLA-E siRNA转染组的细胞生长抑制率为(50.84±5.60)%,显著高于阴性对照组,差异有统计学意义(P<0.01)。转染HLA-E siRNA可明显抑制乳腺癌细胞增殖。
2.5 转染后细胞凋亡率 流式细胞术检测转染HLA-E siRNA后MDA-MB-231细胞凋亡率,发现空白对照组细胞凋亡率为(2.14±0.98)%,阴性对照组细胞凋亡率为(3.21±1.05)%,转染组细胞凋亡率为(12.63±1.50)%,显著高于空白对照组和阴性对照组。转染HLA-E siRNA可诱发乳腺癌细胞凋亡。
2.6 裸鼠移植瘤生长情况 裸鼠体内实验结果显示,至接种30 d时,空白对照组、阴性对照组和HLA-E siRNA组小鼠瘤组织体积分别为(423±18)mm3、(393±18)mm3、(156±9)mm3。HLA-E siRNA组小鼠瘤组织体积显著小于空白对照组和阴性对照组,差异有统计学意义(P<0.01)。
3 讨论
HLA-E是非经典的HLA-I类基因(HLA-Ib),其多态性有限、组织分布广泛、正常细胞表面低表达、但病理条件如肿瘤或自身免疫病细胞表面高表达[13]。Huang等[14]研究发现,结直肠癌组织HLA-E表达显著高于结直肠正常和腺瘤组织,且认为HLA-E高表达促进了早期结直肠癌的免疫逃逸;Özgül Özdemir等[15]也发现结直肠瘤组织非经典HLA-G和HLA-E表达显著高于非癌性组织,HLA-G和HLA-E表达增加可能是肿瘤免疫逃逸的一种方式, 因此HLA-G和HLA-E可能是结直肠瘤免疫治疗的潜在靶点;Gooden等[16]分析卵巢癌和宫颈癌组织HLA-E表达发现,HLA-E在这些肿瘤中高表达,HLA-E的存在可中和卵巢癌内浸润的细胞毒性T细胞(CTL)的保护作用;非小细胞肺癌的一项研究也发现[17],HLA-E高表达阻碍了肺腺癌内浸润CD8+T细胞的有益作用,HLA-E高表达是肺腺癌总体生存期的一个独立的负预后因素。目前HLA-E在乳腺癌组织表达的相关研究发现,约27%乳腺浸润性导管癌组织高表达HLA-E,且约21%高异型性核病变中高表达HLA-E[18-19];de Kruijf等[20]研究认为,瘤组织HLA-E高表达可显著影响乳腺癌的预后,乳腺癌可通过上调或下调经典HLA-Ia类基因和非经典HLA-Ib类基因逃避宿主免疫系统对肿瘤的清除。我们前期分析也发现HLA-E等位基因可能是乳腺癌的易感基因[10-11]。这一系列的研究表明,HLA-E基因参与了多种肿瘤的发展,与肿瘤逃逸相关,可能是肿瘤免疫治疗潜在靶点。因此,我们首次选用HLA-E基因,探讨抑制HLA-E基因对乳腺癌细胞增殖与凋亡的影响,以期为乳腺癌免疫治疗提供新的靶点。
siRNA是由外源或内源性双链RNA(double strand RNA,dsRNA)导入细胞而引起的与dsRNA同源的mRNA降解,进而高效、特异地阻断体内相应基因的表达[21]。目前siRNA技术治疗的主要目标之一是癌症。因为癌基因、突变的抑癌基因和许多不同基因参与了肿瘤的发展,是潜在的siRNA沉默的靶目标,通过siRNA下调突变基因或沉默不需要的基因正成为一种抑制肿瘤细胞生长和侵袭的非常有吸引力的方法[21]。研究发现,siRNA技术同时沉默HER2基因和uPAR基因显著抑制乳腺癌细胞增殖并诱导凋亡,可能为乳腺癌治疗提供了有效的方法[22];靶向沉默趋化因子受体CXCR4基因可显著阻碍乳腺癌细胞的侵袭性和黏附性[23-24];靶向p-糖蛋白的siRNA技术可下调乳腺癌细胞p-糖蛋白表达,并提高乳腺癌对化疗的敏感度,显著抑制瘤细胞生长[25]。
因此,我们采用siRNA技术靶向沉默乳腺癌细胞HLA-E基因表达,探讨了乳腺癌细胞的增殖和凋亡。研究设计并合成了HLA-E siRNA序列,转染至人乳腺癌细胞系MDA-MB-231,发现可显著沉默乳腺癌细胞HLA-E表达,且研究发现HLA-E siRNA转染MDA-MB-231细胞后可明显抑制乳腺癌细胞增殖,诱导细胞凋亡,并能够抑制裸鼠移植瘤的生长。因此,靶向HLA-E siRNA技术能有效抑制靶基因的表达和乳腺癌细胞增殖及诱导乳腺癌细胞凋亡,可能是潜在乳腺癌免疫治疗的新方法。
我们研究的不足之处是未能分析siRNA技术沉默HLA-E,抑制乳腺癌细胞生长的机制,Li等[22]研究发现siRNA技术沉默乳腺癌细胞HER2和uPAR表达引起了MAPK信号通路的抑制,导致ERK活性降低及p38/ERK活性比值升高,从而抑制了癌细胞生长和诱导细胞凋亡。因此后续需将siRNA靶向沉默HLA-E分子机制作为研究重点。
利益相关声明:文中所有作者认同无任何利益冲突。
作者贡献说明:吴振村参与了实验设计和论文撰写,周艳参与了实验操作。

