硅素分期施用对镉污染水稻光合特性及物质积累的影响
潘伯桂,刘丙权,蔡昆争,王 维,田纪辉,吕稳稳, 蔡一霞,*
1 华南农业大学资源环境学院,广州 510642 2 农业农村部华南热带农业环境重点实验室,广州 510642 3 广东省生态循环农业重点实验室,广州 510642 4 华南农业大学农学院,广州 510642
随着工业化及城市化的快速推进,“三废”不合理排放及农业投入品超量施用,使得环境问题频频出现,其中农业土壤重金属污染尤为突出[1]。当前我国有超过2.786×109m2的农田土壤存在着不同程度的镉(Cd)污染[2]。Cd是一种具有潜在生物毒性的重金属元素,在土壤中极具移动性,易通过植物吸收并经食物链富集,给人体健康带来巨大危害[3]。此外,化肥不科学施用加重土壤酸化,活化土壤微域Cd组分,易造成盐基离子(如钙、镁、钾、钠等)[4]和硅(Si)[5]的淋失,导致土壤养分有效性降低。
世界上有超半数以上的人以水稻(OryzasativaL.)为主食,特别是亚洲国家[6]。研究表明,遭受Cd胁迫后,水稻的生长发育严重受阻[7]。特别是Cd2+通过干扰叶绿素合成相关酶活性和破坏叶绿细胞结构,严重影响光合功能,导致物质积累受阻而造成产量和品质下降[8]。为此,基于边生产边修复的理论,常见的修复手段有施用土壤调理剂、喷施叶面抑制剂和微生物修复技术等[9]。出于对成本及实际效益等因素的考虑,经济便捷和环境友好的农艺管理措施备受青睐。据潘伯桂等[10]研究表明,2.0 mmol/L的Si处理能显著提高水稻幼苗对Cd的耐性。张丽娜等[11]研究发现,在Cd胁迫下,移栽期施Si能增加水稻幼苗叶绿素含量及降低Cd积累。也有研究发现水稻对Si的吸收利用不只在苗期,营养生长旺盛的拔节期亦是重要的Si供给期,然而Cd2+亦能随之进入稻株[12]。
当前的研究大多关注土壤-植物耦合系统中Cd的固存与迁移[13]及Si提高水稻对Cd的抗性[14],但对光合代谢的调控及物质积累方面的研究较少。此外,大田生产上Si的施用大多采用基肥土施[15]或叶面喷施[16],但幼苗对Si的吸收率不高,且叶面喷施Si的同化率较低[17]。再者,施Si过量或过早均可能会影响幼苗对矿质元素的吸收[18]。因此,常规的硅肥模式缺乏针对性且易造成浪费。Cai等[17]研究认为Cd胁迫下移栽期施Si有利于水稻幼苗生长及实现Cd在根中的固定,而拔节期施Si更有利于灌浆及减少Cd向籽粒的转移。据贺敏杰等[19]发现硅素于移栽期和拔节期1:1分期施用更有利于降低成熟期土壤Cd有效性。值得注意的是,营养生长期叶片新陈代谢旺盛,能充当蓄积Cd的“库”器官;而生殖生长后期叶片逐渐衰老则充当向籽粒净转移Cd的“源”器官[20]。因此,从Cd胁迫下水稻Si最佳吸收效率的角度出发,结合其在水稻拔节期能有效地提高光合效率及产量的效应[21],优化硅肥施用对水稻耐Cd性、光合及物质积累的响应值得进一步探讨。本试验在施Si总量不变的基础上于移栽期和拔节期这两个关键生育期进行等量硅素分期施用,研究Cd污染下硅素分期施用对水稻光合特性、Cd转运与积累等影响,通过叶片Cd亚细胞分布及其化学形态变化来阐明硅素分期施用调节Cd污染下水稻光合及物质积累响应机制。采用主成分分析进行综合评价,优化Cd污染下调节水稻耐Cd性及光合特性的施Si方式,为探索出一种新型且简便的施Si方式提供理论依据。
1 材料与方法
1.1 试验设计
试验于2019年8月10日—11月25日和2020年8月16日—11月28日在华南农业大学生态学试验基地(23.21°N, 113.42°E)的温室大棚内进行。供试土壤采自广东省某段(24.69°N, 113.55°E)毗邻某钢铁冶炼厂下游的农田耕作层土壤,经人工过3 mm孔径筛并混匀,采用杨剑虹等[22]方法分析其基本理化性质:土壤pH 5.72、电导率4.98 mS/cm、阳离子交换量6.51 cmol(+)/kg、有机质53.78 g/kg、总镉4.21 mg/kg、有效镉2.00 mg/kg、总氮2.75 g/kg、总磷0.88 g/kg、总钾6.85 g/kg和有效硅52.48 mg/kg。供试水稻品种为当地主栽的美香占2号(OryzasativaL.)。在20 cm×28 cm×17 cm(下口径×上口径×盆高)黑色塑料盆钵中装入5 kg过筛供试土,于移栽前3 d加水浸泡。以硅酸钾(K2SiO3)为Si源,充分溶于一定体积的去离子水中,用量筒精准量取硅酸钾水溶液施入种植盆土壤中。在总施Si量(2 mmol/kg K2SiO3)一致的基础上,设置3种Si施用处理:移栽期施Si(T)、移栽期与拔节期等量分期施Si(TJ)、拔节期施硅(J),以不施Si为对照(CK),每个水平设置6个重复。用含等量K+的KCl于移栽期施入CK盆中以抵消因施Si带入的额外K+。在生长期中始终保持淹有1—3 cm的水层至收获前一周不再浇水,使水分自然落干。试验期间盆钵随机排列,且每周随机调换位置。其余农艺管理措施如肥料施用和病虫鼠害防治等按照当地常规习惯。
1.2 测定项目与方法
1.2.1光合指标的测定
在水稻移栽后35(分蘖盛期)、57(拔节期施Si后7 d)、75(抽穗期)、107 d(成熟期)9: 00—11: 00对水稻主茎倒数第三片完全展开叶进行光合分析。测定时随机选取整张叶片的中间部分且避开主叶脉,各处理重复测定5次。用Li-6400XT便携式光合仪(Li-COR, Lincoln Inc., USA)测定光合参数;用叶绿素荧光仪(Dual-PAM-Ⅱ, Walz., Germany)测定荧光参数;用手持式叶绿素计(SPAD-502 Plus, Konica Minolta Inc., Japan)测定叶片相对叶绿素含量(SPAD值)。仪器的参数设定及使用均依据操作手册进行。
1.2.2水稻组织Cd、Si的测定及产量分析
对水稻成熟期(移栽后107 d)的剑叶和籽粒进行测试分析。参照Fu等[23]方法提取叶片细胞壁(CW)、叶绿体(Chp)、线粒体(MC)、细胞质(Cyp)等亚细胞组分及叶片无机态Cd(F1)、有机态Cd(F2)、果胶和蛋白质结合态Cd(F3)、不溶解性磷酸Cd(F4)、草酸Cd(F5)、残渣态Cd(F6)六种Cd的化学形态。用微波消解仪(CEM Mars6, USA)对叶片和籽粒进行混酸(HNO3∶HClO4=4∶1)消解。上述Cd提取液及消解液均使用华南理工大学医疗器械研究检验中心的电感耦合等离子体质谱仪(Thermo Fisher Scientic, USA)检测。采用硅钼蓝分光光度法[24]测定Si浓度。对收获籽粒进行产量及构成因素分析。
1.3 数据处理
通过Excel 2019进行数据整理,经SPSS 24.0软件进行统计分析,用SigmaPlot 14.0绘图。数据采用单因素法(One-way ANOVA)进行方差分析,邓肯新复极差法(DMRT)进行多重比较(P=0.05),皮尔逊法(Pearson)进行(双尾)相关性检验。在R×64 3.6.3中导入ADE-4软件包进行主成分分析(Principal component analyses, PCA),利用二维空间载荷图和得分图来直观地展现多元数据分析结果。用籽粒Cd浓度(mg/kg)与叶片Cd浓度(mg/kg)之比来表示单位质量的叶片Cd转移系数[25]。统一采用平均值±标准偏差(Mean±SD,n=3)的形式表示数据。
2 结果与分析
2.1 水稻叶片和籽粒Si、Cd浓度及叶片Cd转移系数
从表1可知,施Si后叶片和籽粒Si浓度均有所增加,拔节期施Si(TJ、J处理)使其积累更为显著。但Si对叶片和籽粒Cd浓度影响却表现不同。施Si能增加叶片Cd浓度,2019年TJ处理的叶片Cd浓度明显比CK高出54.55%,2020年TJ和J处理的叶片Cd浓度分别比T处理高11.46%和5.67%。然而,施Si却使籽粒Cd浓度显著降低,导致Cd由叶片向籽粒的转移减少,T、TJ和J处理叶片Cd转移系数较CK分别平均降低33.92%、56.67%和52.16%。
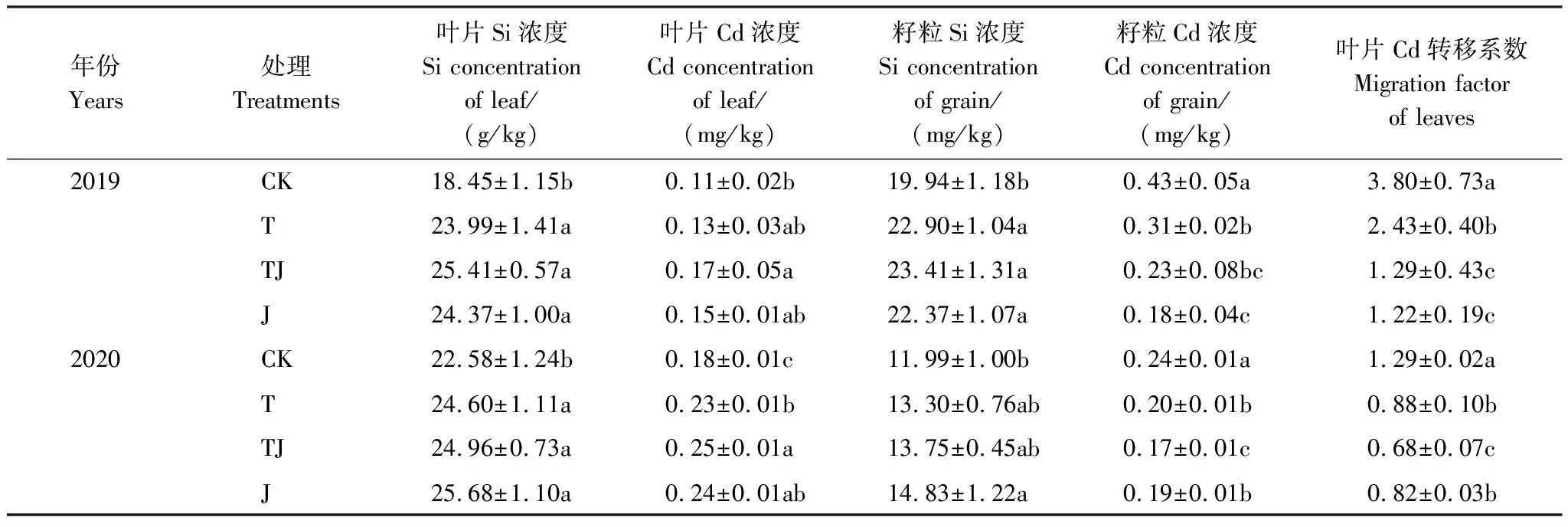
表1 施Si对Cd胁迫下叶片和籽粒Si、Cd浓度及叶片Cd转移系数的影响
2.2 水稻叶片Cd亚细胞分布及其化学形态
Cd在叶片组织中的亚细胞分配及各形态浓度如图1所示。CK组叶片的细胞质Cd占整个细胞结构Cd含量比重较高(达53.01%—54.15%),施硅后细胞质Cd含量显著降低,而细胞壁Cd含量则显著增加,2019年T、TJ、J处理细胞壁较CK分别增加了16.75%、21.18%和42.26%的Cd固持量;2020年则增加了6.14%、27.14%和18.04%。两季水稻叶片线粒体组分中Cd含量受Si处理后显著降低;而叶绿体组分中Cd含量在Si处理下呈现年际间的差异,2019年降低叶绿体Cd组分浓度,而2020年则增加该组分Cd浓度。
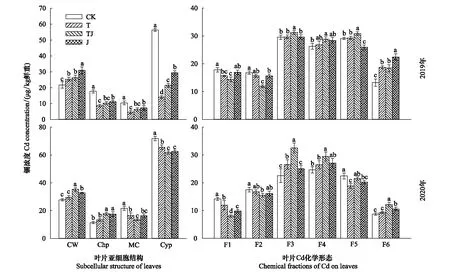
图1 施Si对Cd胁迫下叶片亚细胞结构及Cd化学形态的影响
Cd在叶片组织中更多的是保留在F3—F5中(图1)。两季结果均表明,TJ处理能够增加F3、F4及F6等不活泼组分Cd浓度,降低F1、F2易移动组分Cd浓度,2020年的降幅更显著,其中TJ处理对F1、F2组分的Cd浓度降低尤为明显。而F5组分(草酸结合态Cd)在Si处理下年际间存在差异,2019年T处理F5组分Cd浓度与CK无显著差异,TJ处理显著增加,J处理明显降低;而2020年各施Si处理F5组分Cd浓度均降低。
2.3 水稻光合参数
由图2可见,Si对水稻叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间二氧化碳浓度(Ci)有一定的影响。分蘖盛期,T和TJ处理的Pn要明显高于CK和J处理,两季水稻叶片的Pn均在抽穗期达到峰值,其中TJ处理叶片在移栽后57 d至75 d具有较高的Pn。随着水稻生长发育的推进,Tr和Gs均呈下降趋势,而施Si能一定程度延缓其降低,Si处理下成熟期(移栽后107 d)水稻叶片Tr和Gs高于CK,其中TJ和J处理较明显,这说明拔节期施硅(TJ、J处理)可以通过提高叶片的Pn、Tr、Gs值来延长叶片的光合功能。Si对Ci的影响在移栽后75 d表现出年际间的差异,但在灌浆结实期间3种Si处理叶片Ci的变化趋势基本一致,与T、J两处理相比,TJ处理叶片Ci明显升高。

图2 施Si对Cd胁迫下水稻各生育期光合作用的影响
2.4 水稻荧光参数及相对叶绿素含量
从图3可知,不同Si处理对两季水稻叶片Fv/Fm值没有显著影响,但Si处理在一定程度上提高ΦPSⅡ、qP以及ETR,且年际间存在一些差异,2020年水稻叶片的ΦPSⅡ、qP以及ETR值在拔节期施硅后7 d(57 d)均明显低于2019年,其余时期的变化规律大体相同。2020年Si处理能够有效降低成熟期叶片NPQ,但2019年晚季效果不明显。此外,硅可以提高水稻抽穗前叶片SPAD值,2019年TJ和J处理在移栽后57—75 d有较高的SPAD值,但在灌浆结实期(移栽后75—107 d)各处理间差异不显著(P>0.05)。

图3 施Si对Cd胁迫下水稻荧光参数和相对叶绿素含量的影响
2.5 水稻产量及构成因素
从表2可知,施Si对水稻产量及其构成因素有显著影响。施Si后能显著提高水稻单株有效穗数,其中拔节期施硅(TJ、J处理)在2019年及2020年较CK组分别增加了15.80%—17.81%,12.00%—16.09%。同时,2020年中TJ处理能够极显著地提高每穗粒数(P<0.05),与对照相比增幅达28.05%,但在2019年处理间差异不显著。对于结实率而言,两季水稻中均显示硅处理后的促进优势,拔节期施硅处理(J处理)均能保持着较高的结实率。与2019年相比,2020年Si处理显著提高千粒重,与CK处理相比,T、TJ、J处理增幅分别为4.02%、11.73%以及11.17%。结合盆栽产量来看,硅处理在两季水稻产量均明显提高,其中TJ处理在两季水稻的增产效果最显著,且2019年实际产量整体高于2020年。

表2 施Si对Cd胁迫下水稻产量及构成因素的影响
2.6 水稻光合参数、Cd与Si浓度及产量的多元数据分析
利用主成分分析综合评价了不同Si处理对水稻Cd积累和光合特性的影响效果(图4)。第一主成分(PC1)和第2主成分(PC2)累计方差贡献率达到70.9%,可涵盖原始数据总量的70.9%。其中PC1方差贡献率为50.1%,主要与Pn、Gs、叶残渣态Cd、细胞质Cd、线粒体Cd、Fv/Fm的变化有关;PC2方差贡献度为20.8%,分别与叶片Cd转移系数(MF叶-籽粒)、Tr、不溶性磷酸Cd浓度有关。主成分得分图展现了各处理数据点的主成分得分情况,不同Si处理间的差异达到显著水平(P=0.016)。结合主成分荷载图来看,CK明显趋向于增加F1-Cd、F2-Cd以及叶片Cd转移系数。T和J处理的特征差异主要体现在PC1中,有利于介导气孔导度的开启,促进光合速率。而TJ处理的综合特征差异主要体现在PC2中,有利于增加叶片细胞壁Cd浓度以及F6-Cd浓度,提高蒸腾作用及增产,且要优于T和J处理。综合评价Si处理对水稻Cd抗性及光合、产量等影响,可推测TJ处理的效果要优于J和T处理。
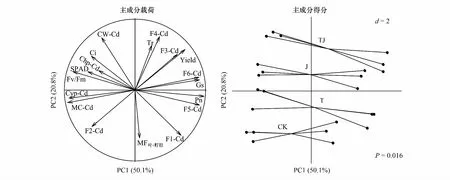
图4 处理间Cd浓度、光合参数及产量的主成分分析
此外,通过分析叶片Si含量与Cd浓度及光合参数相关性(表3),发现叶片Si含量与叶片Cd浓度、SPAD、qP、ΦPSⅡ和ETR表现为极显著或显著正相关,而与籽粒Cd浓度则呈极显著负相关。

表3 叶片Si含量与Cd浓度及光合参数的相关性分析
3 讨论
遭受Cd污染后,水稻叶片会产生一系列的毒害症状,如叶绿素合成受阻、光合作用受限及光能转化效率降低等,降低叶片对产量的贡献度,但施Si可有效缓解该毒害效应[26]。Si作为水稻生长发育所需的有益元素,可与Cd发生沉降反应来降低其毒性[27]。此外Si还能以“Si-细胞壁基质”复合体的形式集聚在细胞壁上,增加对Cd的固定作用,进而有效减轻叶片Cd毒性及保护叶片的生理机能[28—29]。本研究表明,Si处理后水稻叶片Cd浓度明显增加,叶片Si浓度与Cd含量呈极显著正相关(r=0.754,P<0.01),但增加的Cd更多地以难移动的形态(果胶和蛋白质结合态Cd、不溶解性磷酸Cd、残渣态Cd)钝化在细胞壁吸附位点以修饰和降低其孔隙度,占比达55.37%—62.18%(图1),这可防止Cd对叶片结构的损坏。究其原因可能是Si施用后调动细胞壁多糖与蛋白分子中的极性配位基团,如羧基、羟基、醛基等,使Cd2+在细胞内不能以游离态大量存在[30]。另外,也有可能与Si营养有关[20],Si沉积于蒸腾流末端,利于Cd在叶片中累积[31]。Shahid等[32]发现重金属更多地蓄积在新陈代谢旺盛的“库”器官(叶片),从而减少Cd在营养器官(籽粒)的蓄积。本研究结果也表明Si处理后可有效减少Cd在籽粒的积累,且籽粒中的Cd含量与其Si浓度呈极显著负相关关系(r=-0.854,P<0.01)。齐穗后叶片逐渐衰老而变成含Cd的“源”器官,其蓄积的Cd可再活化并随灌浆物质通过韧皮部筛管向籽粒转运,这是决定稻米Cd积累的关键过程[20,33—35]。与CK相比,施Si可显著降低叶片Cd转移系数,其中TJ处理降幅达47.29%—66.05%,从而有效地充当消减籽粒Cd的屏障。
据报道,Si能在水稻表皮细胞沉积形成“硅-角质”双层结构,使功能叶片增厚、挺立并改善其冠层的受光姿态[36],有助于捕获光能和提高光能利用率。此外,叶绿素含量、荧光与光合作用密切相关,任何逆境对光合作用产生的影响均可通过叶绿素荧光诱导动力学参数的变化来反映[37]。本研究Si处理尤其是TJ处理能够更显著地缓解稻叶因Cd胁迫而表现的光抑制现象(图3),表现在水稻营养生长阶段其SPAD值显著增加,与Si在叶片的积累发挥着正反馈作用(r=0.653,P<0.05)。此外,拔节期施硅(TJ、J处理)显著提高成熟期Pn、Tr、Gs以延缓功能叶片的早衰及促进光合产物积累,增加叶片对Cd的蓄积及籽粒的物质积累。尤其Tr的升高有利于水分和营养元素完成木质部装载并向籽粒转移[38]。另有研究[39—40]发现,Si随着蒸腾运输途中能硅化形成胶状硅,这能极大程度地与Cd2+产生竞争与拮抗反应,同时促进能吸附及螯合Cd2+的抗氧化物质生成,共同作用以实现稻株体内Cd2+毒性减弱,从而增强水稻对Cd的耐受性。张云等[41]通过激光扫描共聚焦显微镜观察Cd2+在叶片的分布,发现其更多地聚集在气孔处,这严重限制了气孔的开合从而影响植株的气体交换,而硅化后的细胞能够调节叶片的气孔运动[42]。本研究TJ处理能在孕穗灌浆乃至结实期持续有效地促进气孔的开启,保证光合原料(CO2)供给充足,有利于光合产物的制造。Cd进入植物细胞后首先对线粒体产生毒害作用,干扰光合电子的传递[43]。本实验TJ处理较T处理或J处理显著地降低线粒体Cd浓度,这能增强激发态电子的传递率(ETR),其与叶片Si浓度呈正相关关系(r=0.637,P<0.05),并提高PSⅡ实际光合效率,有效地增加非光化学淬灭系数。光合系统中能量转换靠电子传递完成,若PSII吸收的能量未能及时扩散,则过剩的光电子将诱导活性氧产生从而损坏叶绿体机构[44]。而本研究发现TJ处理对生殖生长期水稻的NPQ显著增加,这表明水稻的热耗散量增多,尤其硅素分期施用可更有效地缓解Cd对水稻光合作用的抑制,从而提高光能转化效率和促进产量形成。值得注意的是,本试验进行了年际验证分析,部分光合特性结果存在一定的年际差异,因光合指标受分析环境条件的影响较大,对于这一点,还有待进一步研究。
不同Si处理对水稻均有一定的增产作用,T、TJ、J较CK分别增产18.99%、38.81%和23.33%。据Cai等[17]研究认为拔节期施Si较CK增产10.52%,而基施Si肥增产7.02%。Si协调增产的直接原因在于提高每穗粒数和结实率,其次是千粒重的增加[45]。在本研究中,施Si利于水稻光合作用加强,TJ处理较CK显著增加每穗粒数(16.50%)和结实率(6.99%)。综合评价可以发现Si处理对水稻耐Cd性、光合特性及产量的影响作用大小为TJ>J>T。
4 结论
3种硅肥施用模式中,Si素于移栽期与拔节期分期施用(TJ处理)更利于提升水稻耐镉性、光合特性及物质积累。与T和J处理相比,TJ处理显著促进叶片Si素积累,增加Cd在叶片的固定,有效地缓解Cd对光合器官的损伤和降低Cd由叶片向籽粒的转移。此外,TJ处理显著提高水稻整个生育期的Pn、Tr、Gs,有效地提升光合功能;同时ETR和ΦPSⅡ得到显著提升,进一步促进光合产物合成与输送。结合光合特性、Cd积累及稻米安全性,本研究推荐在Cd污染稻田中于移栽期和拔节期分期施用硅素,以获得最佳的控镉增产效果。

