绿原酸-黄芩苷共载纳米粒鼻腔原位凝胶的制备及增强鼻黏膜免疫作用
梁达均,林宇建,时 军, 2*,吴欣颖,刘锐萍
绿原酸-黄芩苷共载纳米粒鼻腔原位凝胶的制备及增强鼻黏膜免疫作用
梁达均1,林宇建1,时 军1, 2*,吴欣颖1,刘锐萍1
1. 广东药科大学中药学院,广东 广州 510006 2. 广东省局部精准递药制剂工程技术研究中心,广东 广州 510006
制备绿原酸-黄芩苷共载纳米粒鼻腔原位凝胶(chlorogenic acid-baicalin co-loaded nanoparticlesnasal gel,CA&B-NPs/ISNG),初步考察其对上呼吸道黏膜免疫功能低下(upper airway immunity dysfunction,UAID)小鼠的影响。以包封率和胶凝温度为评价指标,制备出CA&B-NPs/ISNG,表征其形态、粒径分布、ζ电位、体外释药量及凝胶溶蚀量;采用牛蛙上颚离体法考察CA&B-NPs/ISNG对纤毛的毒性;建立UAID小鼠模型,测定小鼠唾液的分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)含量和溶菌酶活性,考察CA&B-NPs/ISNG增强鼻黏膜免疫的作用。优选处方:取绿原酸和黄芩苷各11.0 mg,加入10 mL聚乙二醇(PEG)400溶解成CGA-BC溶液,磁力搅拌下缓慢滴入到25 mL 2.72 mg/mL壳聚糖溶液中,调节pH至5.0,然后磁力搅拌下缓慢滴加10 mL 1.00 mg/mL三聚磷酸钠(tripolyphosphate,TPP)溶液,得CA&B-NPs混悬液;往CA&B-NPs混悬液中加入体系18.5%泊洛沙姆407(Poloxamer 407,P407),溶胀分散均匀后,加入体系1%泊洛沙姆188(Poloxamer 188,P188),待完全溶胀分散均匀,调节pH至5.5,得CA&B-NPs/ISNG。纳米粒形态规则,平均粒径(536.10±16.24)nm,粒子分散系数0.310±0.053,ζ电位(24.39±0.27)mV,绿原酸和黄芩苷包封率分别为(44.67±0.43)%和(55.25±0.61)%;胶凝温度为(32.03±0.31)℃。CA&B-NPs/ISNG表现出持续缓慢释药和无明显的纤毛毒性,且能显著提高SIgA的含量和溶菌酶的活性(<0.05)。制备的CA&B-NPs/ISNG均一稳定,包封率高,适用鼻用制剂要求,可提高UAID小鼠的鼻黏膜免疫功能。
绿原酸;黄芩苷;纳米粒;原位凝胶;鼻黏膜免疫
上呼吸道感染(upper respiratory tract infection,URTI),是临床常见的呼吸道传染病,大部分由病毒引起[1]。中医将URTI归于伤风范畴,认为外感六淫之邪,以风邪为主、入里化热、肺失宣降为伤风的主要病机[2]。同时,肺开窍于鼻,鼻黏膜可以介导黏膜及全身免疫反应[3-5]。鼻腔给药对防治URTI有较大应用价值。以金银花-黄芩2药相配为基础的制剂,具有良好的抗感染能力,被广泛用于治疗URTI[6-7]。绿原酸和黄芩苷分别是金银花和黄芩的主要有效成分,均具有抗菌、抗病毒[8-9]等作用。研究发现,两者均可促进分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)的合成及分泌,增强机体的免疫屏障[10-11],同时,提高溶菌酶的活力,增强其对细菌的杀灭作用[12-13]。绿原酸-黄芩苷2药联用,以期协同调节机体的免疫功能,增强机体的抗病原体能力。
壳聚糖纳米粒(chitosan nanoparticles)携带正电荷,易与带负电的鼻黏膜产生电荷吸引,可以促进药物的吸收[14]。温敏型原位凝胶(thermosensitivegels)液态时有助于精确的用药量,固态时可以减少鼻纤毛对药物的清除和提高药物在鼻腔内的滞留性[15],具有温度触变性。本研究将绿原酸-黄芩苷共载壳聚糖纳米粒中,并应用于温敏原位凝胶,制备绿原酸-黄芩苷共载纳米粒鼻腔原位凝胶(chlorogenic acid-baicalin co-loaded nanoparticlesnasal gel,CA&B-NPs/ ISNG),以期延长药物的鼻腔滞留时间,增强上呼吸道黏膜免疫功能,为绿原酸-黄芩苷鼻用制剂防治URTI提供新的思路。
1 仪器与材料
1.1 仪器
Dionex UltiMate 3000 HPLC系统,赛默飞世尔科技公司;JEM-1200EX型扫描电子显微镜(SEM),日本电子株式会社;85-2A型数显恒温磁力搅拌器,江苏金坛金城国胜实验仪器厂;Delso Nano C型激光粒度电位仪,美国Beckman Coulter公司;TGL-16型高速离心机,湖南湘仪实验室仪器开发有限公司;PHS-25型pH计,上仪电科学仪器股份有限公司;TP-6型透皮扩散仪,天津市精拓仪器科技有限公司;SHA-B型恒温振荡器,上海力辰邦西仪器科技有限公司;E100型正置光学显微镜,上海成贯仪器有限公司;Olympus CKX41型倒置式生物显微镜,北京中仪光科科技发展有限公司;RT-6100型自动酶标仪,雷杜生命科学股份有限公司。
1.2 试剂
绿原酸(批号PS0132-1000MG)、黄芩苷(批号PS010447),质量分数均≥98%,成都普思生物科技股份有限公司;壳聚糖(批号C105799)、三聚磷酸钠(批号S100099),阿拉丁试剂有限公司;聚乙二醇(PEG)400,批号20200515,天津市大茂化学试剂厂;波洛沙姆188(P188,批号GND17422B)、波洛沙姆407(P407,批号GND11321B),巴斯夫有限公司;脱氧胆酸钠,批号S31095,上海源叶生物科技有限公司;小鼠SIgA ELISA试剂盒、溶菌酶测试盒,江苏酶免实业有限公司;色谱纯(甲醇、乙腈),默克股份两合公司。
1.3 动物
牛蛙36只,体质量40~60 g,购于广州市白云区穗北实验动物养殖场;健康昆明小鼠40只,雌雄各半,体质量18~22 g,南方医科大学实验动物中心提供,许可证号SCXK(粤)2016-0041。所有动物实验遵循广东药科大学实验动物伦理委员会有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 CA&B-NPs的制备及包封率的测定
取绿原酸和黄芩苷各10.0 mg,加入10 mL PEG400溶解成绿原酸-黄芩苷溶液,磁力搅拌下缓慢滴入到25 mL含2%醋酸的2 mg/mL壳聚糖溶液中,继续搅拌10 min,1 mol/LNaOH溶液调节pH至5.0,然后磁力搅拌下以2滴/s的速率缓慢滴加10 mL 1 mg/mLTPP溶液,继续搅拌20 min,得CA&B-NPs混悬液(V1)[16]。取5 mL CA&B-NPs混悬液置离心管中,12 000 r/min离心(离心半径为9.98 cm)30 min后,收集上清液,经0.22 μm滤膜滤过。精密量取滤液1 mL,加入50%甲醇定容至10 mL,混匀,得含有未包封药物的混悬液(V2)。采用HPLC法测定V1和V2中药物的质量浓度(V1和V2)。按包封率=(V1-V2)/V1,分别计算绿原酸和黄芩苷的包封率。
2.2 单因素实验考察CA&B-NPs制备工艺
2.2.1 药物投料质量 按“2.1”项下方法制备CA&B-NPs,固定壳聚糖与TPP质量浓度比为5∶1、壳聚糖溶液pH值为5.0和磁力搅拌转速为1000 r/min(离心半径为6.30 cm),考察药物投料质量2.5、5.0、10.0、15.0 mg对包封率的影响。结果(表1)显示,当投放量较少时,包封率较低,当投放量10.0 mg时,包封率较高,但投放量15.0 mg时,包封率下降,说明投药量对包封率影响较大。
表1 药物投料质量对包封率的影响
Table 1 Effects of drug feeding quality on encapsulation efficiency
药物投料质量/mg包封率/% 绿原酸黄芩苷 2.514.33±0.5224.25±0.88 5.020.23±0.2536.26±0.90 10.032.04±0.8644.71±0.99 15.023.03±0.4035.33±0.49
2.2.2 壳聚糖与TPP质量浓度比 按“2.1”项下方法制备CA&B-NPs,固定药物投料质量为10.0 mg、壳聚糖溶液pH值为5.0和磁力搅拌转速为1000 r/min(离心半径为6.30 cm),考察壳聚糖与TPP质量浓度比3∶1、5∶1、7∶1、9∶1对包封率的影响。结果(表2)显示,5∶1和7∶1时,包封率较高。而9∶1时,观察到纳米粒不稳定,容易沉降,可能是TPP质量浓度过高,与壳聚糖形成的粒径较大且分布不均匀导致。
2.2.3 壳聚糖溶液pH值 按“2.1”项下方法制备CA&B-NPs,固定药物投料质量为10.0 mg、壳聚糖
表2 壳聚糖与TPP质量浓度比对包封率的影响
Table 2 Effects of mass concentration ratio of chitosan to TPP on encapsulation efficiency
壳聚糖与TPP质量浓度比包封率/% 绿原酸黄芩苷 3∶119.58±0.4227.99±0.77 5∶132.04±0.8644.71±0.99 7∶127.51±0.3341.90±1.34 9∶129.33±0.6939.82±0.18
与TPP质量浓度比为5∶1和磁力搅拌转速为1000 r/min(离心半径为6.30 cm),考察壳聚糖溶液pH值为3.0、4.0、5.0、6.0对包封率的影响。结果如表3所示,pH值为5.0和6.0时,包封率较为理想,而pH值为6.0时溶液较浑浊,pH值为3.0和4.0时包封率较低,说明pH值对包封率影响较大。
表3 壳聚糖溶液pH值对包封率的影响
Table 3 Effects of pH value of chitosan solution on encapsulation efficiency
壳聚糖溶液pH值包封率/% 绿原酸黄芩苷 317.44±0.5125.87±0.49 422.04±0.4334.71±0.45 532.04±0.8644.71±0.99 630.65±0.8443.89±0.98
2.2.4 搅拌速率 按“2.1”项下方法制备CA&B- NPs,固定药物投料质量为10.0 mg、壳聚糖与TPP质量浓度比为5∶1和壳聚糖溶液pH值为5.0,考察用磁力搅拌器调节滴入TPP时的转速分别为600、800、1000、1200 r/min(离心半径为6.30 cm)对包封率的影响。结果(表4)显示,搅拌速度对包封率影响不大,因此不把搅拌速度纳入考察范围,实验选用1000 r/min(离心半径为6.30 cm)转速。
表4 搅拌速率对包封率的影响
Table 4 Effects of stirring rate on encapsulation efficiency
搅拌速度/(r∙min−1)包封率/% 绿原酸黄芩苷 60031.57±0.5942.87±0.98 80031.84±0.4244.80±0.74 100032.04±0.8644.71±0.99 120032.11±1.1343.88±1.29
2.3 Box-Behnken响应面法优化CA&B-NPs制备工艺及最优处方验证
在单因素考察的基础上,选取药物投料质量(1)、壳聚糖与TPP质量浓度比(2)和壳聚糖溶液pH值(3)为考察因素,绿原酸包封率(1)和黄芩苷包封率(2)为考察指标,采用Box-Behnken响应面法对CA&B-NPs的制备进行处方优化,实验设计和结果见表5。
采用Design-Expert 10.0软件对结果进行分析见表6,得出绿原酸和黄芩苷2次多项回归方程模型为1=30.21+2.151+3.172+13.353+0.2212+3.0313-2.2023-10.0112-2.9722+2.0032,2=38.19+1.521+4.222+9.103-1.3312+0.6313-1.3623-4.5212+0.6622+4.1632,2个模型都有显著性差异(<0.05),失拟项都无显著性差异,且相关系数12=0.992 0和22=0.992 1,模型中3、12有极显著差异(<0.001)。表明该回归方程拟合度良好,符合本实验的要求,能够准确预测绿原酸和黄芩苷的包封率。
表5 响应面实验设计优化
Table 5 Optimization of response surface experiment design
序号X1/mgX2X3Y1/%Y2/%序号X1/mgX2X3Y1/%Y2/%序号X1/mgX2X3Y1/%Y2/% 115 (+1)5 (0)3 (−1)9.5629.987157422.5439.111357418.4538.34 25 (−1)55 (+1)28.7844.448105429.9739.681453412.3532.98 310 (0)54 (0)31.2336.669103 (−1)542.9849.9815153415.5826.89 455310.6528.571010339.3627.9916107544.7355.32 5107 (+1)319.8938.7811105428.8837.8817105430.6738.78 6155539.7948.3512105430.2837.97
表6 方差分析结果
Table 6 Results of variance analysis
方差来源自由度Y1Y2方差来源自由度Y1Y2 平方和F值P值平方和F值P值平方和F值P值平方和F值P值 模型92 079.8796.17<0.000 1991.5697.37<0.000 1X121421.83175.55<0.000 186.1076.09<0.000 1 X1137.0715.430.005 718.5716.420.004 9X22137.0615.420.005 71.841.620.243 3 X2180.2033.380.000 7142.13125.61<0.000 1X32116.907.030.032 972.9764.49<0.000 1 X311 426.05593.46<0.000 1661.93584.98<0.000 1残差716.82 7.92 X1X210.180.080.789 57.056.230.041 2失拟项313.745.940.059 02.870.760.573 8 X1X3136.7215.280.005 81.561.380.278 4纯误差43.08 5.05 X2X3119.328.040.025 27.436.560.037 5总回归162 096.69 999.48
根据模型绘制二维等高线和三维响应面图。二维等高线图的形状可反应2个因素的交互作用,等高线呈椭圆形则表示两因素交互作用较强,而圆形则表示2因素交互作用较弱;三维响应面图的倾斜度可反应各因素的交互作用,倾斜度越大则表示交互作用越强。结果见图1、2,均显示3与1、2两两因素的等高线图趋向椭圆形,以及响应面图倾斜度较高,故对载药工艺的影响显著;1与2交互作用不明显,故对载药工艺的影响不显著。
优选处方为1=11,2=6.8,3=5,预测值绿原酸包封率为44.72%,黄芩苷包封率为55.32%。重复测定3次,绿原酸包封率为(44.67±0.43)%,黄芩苷包封率为(55.25±0.61)%,和预测值接近,表明该处方对CA&B-NPs的包封率预测可靠,具有一定的指导意义。
2.4 CA&B-NPs的性状考察
取CA&B-NPs适量,加水稀释10倍,通过激光粒度电位仪测定其平均粒径、粒径分散指数和ζ电位。另取纳米粒稀释样品滴至铜网上,滴加2%磷钨酸溶液进行负染,在TEM下观察其形貌特征。结果如图3所示,所制备的纳米粒的平均粒径为(536.10±16.24)nm,粒径分散指数为0.310±0.053,ζ电位为(24.39±0.27)mV,表明纳米粒粒径较小且分布均匀,ζ电位稳定,不易发生絮凝。电镜下纳米粒呈类球形,形状规则,形态饱满。
2.5 CA&B-NPs/ISNG的制备
称取18.5% P407,加入到CA&B-NPs混悬液中,磁力搅拌使其分散均匀,4 ℃静置过夜,至P407充分溶胀分散均匀。在磁力搅拌下,缓慢加入1% P188,继续4 ℃静置过夜,至P188完全溶胀分散均匀。最后在磁力搅拌下逐滴滴加1 mol/L NaOH调节体系pH值至5.5左右,得CA&B-NPs/ ISNG[17]。
2.6 CA&B-NPs/ISNG的质量评价
2.6.1 胶凝效果 取凝胶适量加入试管中,并置于15 ℃的恒温水浴锅,以1.0 ℃/min的速度缓慢加热水浴,每升高0.1 ℃,将试管倾斜90°,观察液面直至其不再流动,记录此时的温度,重复3次结果为(32.0±0.3)℃,表明其符合鼻腔温度(32~35 ℃)的范围。取适量凝胶加入试管中,并置于32 ℃的恒温水浴锅,观察液面直至其不再流动,记录胶凝时间,重复6次结果为(5±1)s,表明其在32 ℃凝胶速度较快。将凝胶分别放置于25 ℃和34 ℃ 2周,取出,3000 r/min离心(离心半径为6.30 cm)10 min,观察凝胶均无分层,表明其性质稳定。
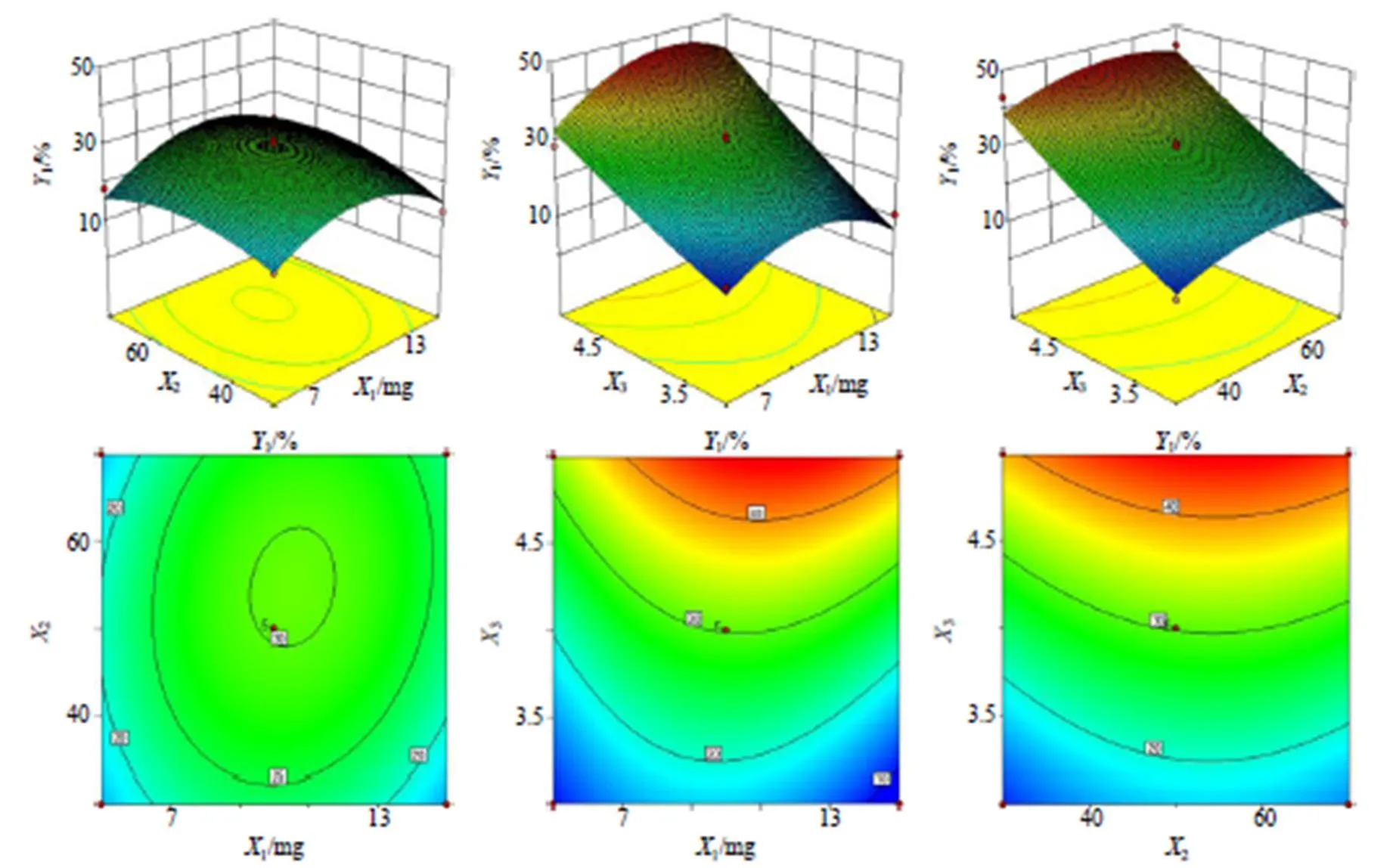
图1 药物投料质量、壳聚糖与TPP质量浓度比和壳聚糖溶液pH对绿原酸包封率的二维等高线和三维响应面图
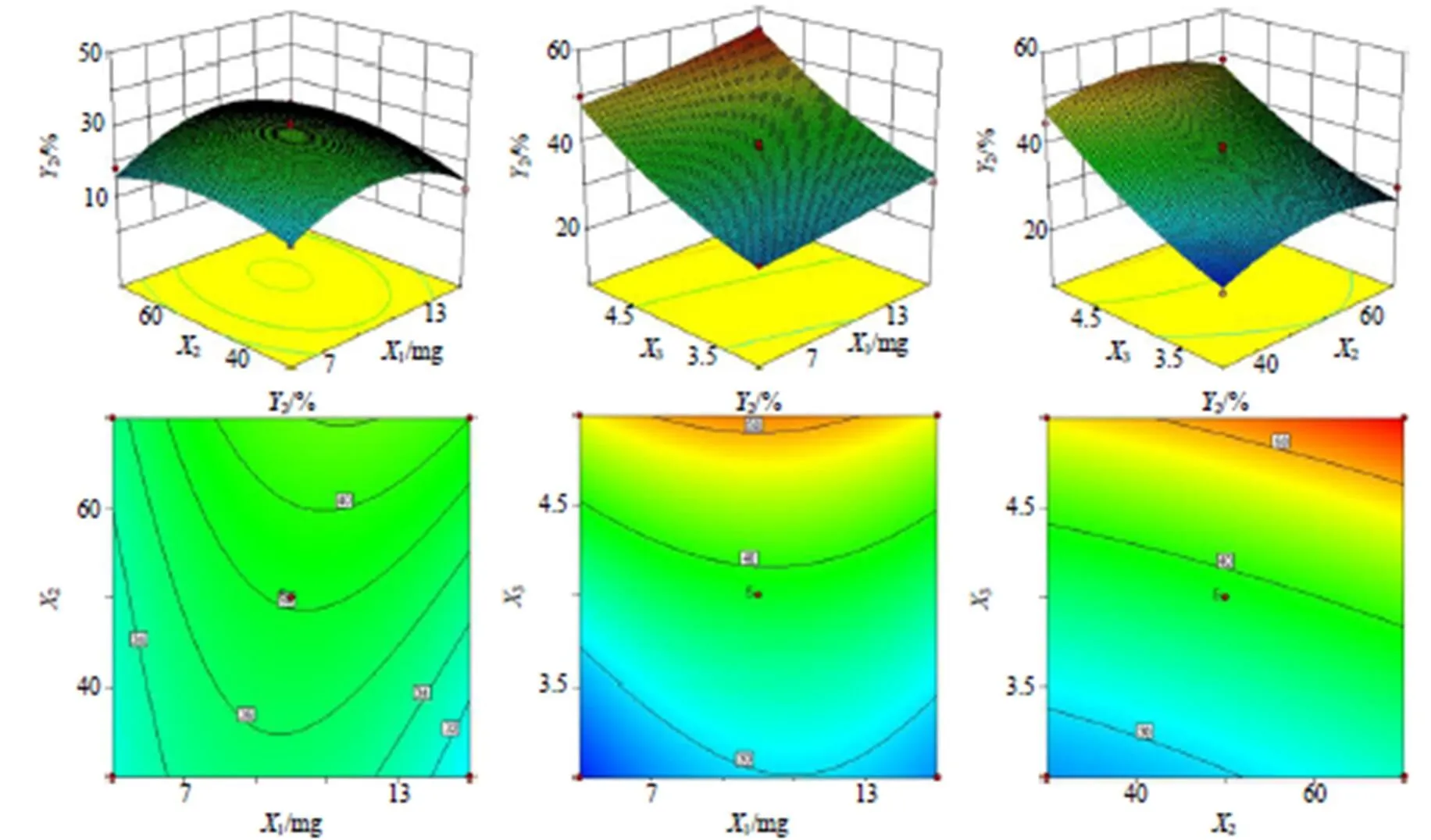
图2 药物投料质量、壳聚糖与TPP质量浓度比和壳聚糖溶液pH对黄芩苷包封率的二维等高线和三维响应面图
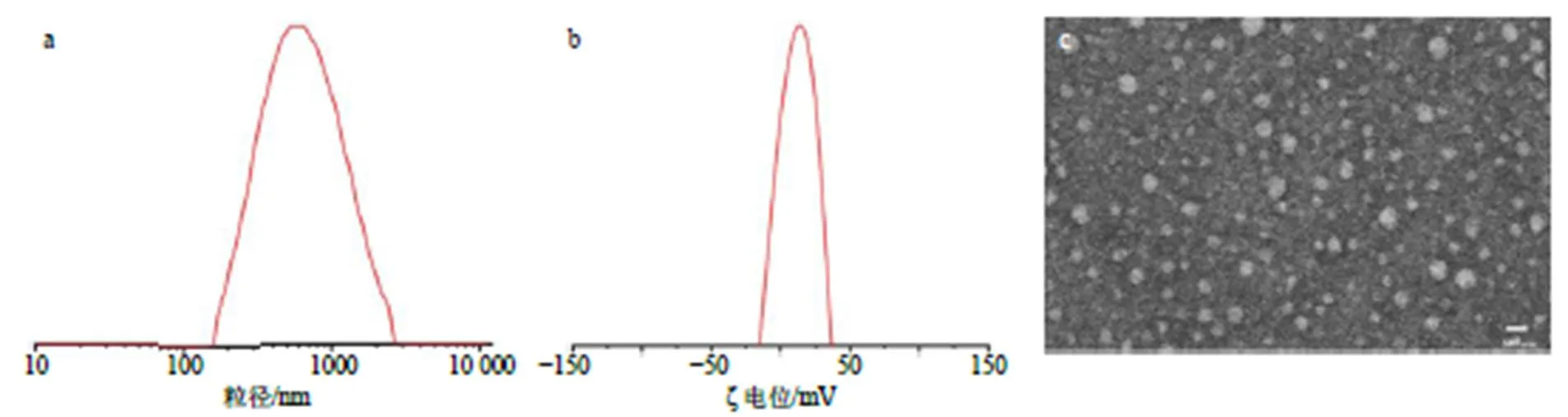
a-粒径 b-ζ电位 c-纳米微粒外观(透射电镜观察)
2.6.2 体外释药量的测定 精密称取2 g CA&B- NPs/ISNG置透析袋内,悬于200 mL释放介质中,于32 ℃水浴以150 r/min振摇,分别在0.5、1、1.5、2、3、6、10、12、24 h移取2 mL释放液()经0.22 µm滤过备用,并及时补充同温度的释放介质2 mL,HPLC法测定释放液中绿原酸和黄芩苷质量浓度(C),按公式计算体外累积释放率(绿原酸或黄芩苷)。结果如图4-a所示,前6 h释放较快,绿原酸和黄芩苷累积释放率分别为57%和41%,随后24 h持 续缓慢释药,具有良好的缓释作用。绿原酸释放曲线与一级方程拟合度最好,绿原酸=0.793 44 (1-e−0.266 49 t),2=0.950 1;黄芩苷释放曲线与Higuchi方程拟合度最好,黄芩苷=0.157 821/2-0.014 77,2=0.959 1。
绿原酸或黄芩苷=(CV+CV)/W
是凝胶中绿原酸或黄芩苷的总含量
2.6.3 凝胶溶蚀量的测定 称取CA&B-NPs/ISNG 1 g置于已精密称定质量的离心管(1)中,于32 ℃水浴以150 r/min振摇使其完全形成凝胶后,精密称定凝胶和离心管的总质量(0)。加入同温度的生理盐水1 mL,继续恒温振荡,分别于15、30、45、60、90、120、180 min将离心管中的溶液全部倾倒出,精密称定剩余质量(W),并及时补充同温度的生理盐水1 mL。2个时间点的质量差即为溶蚀量=(0-W)/(0-1)。
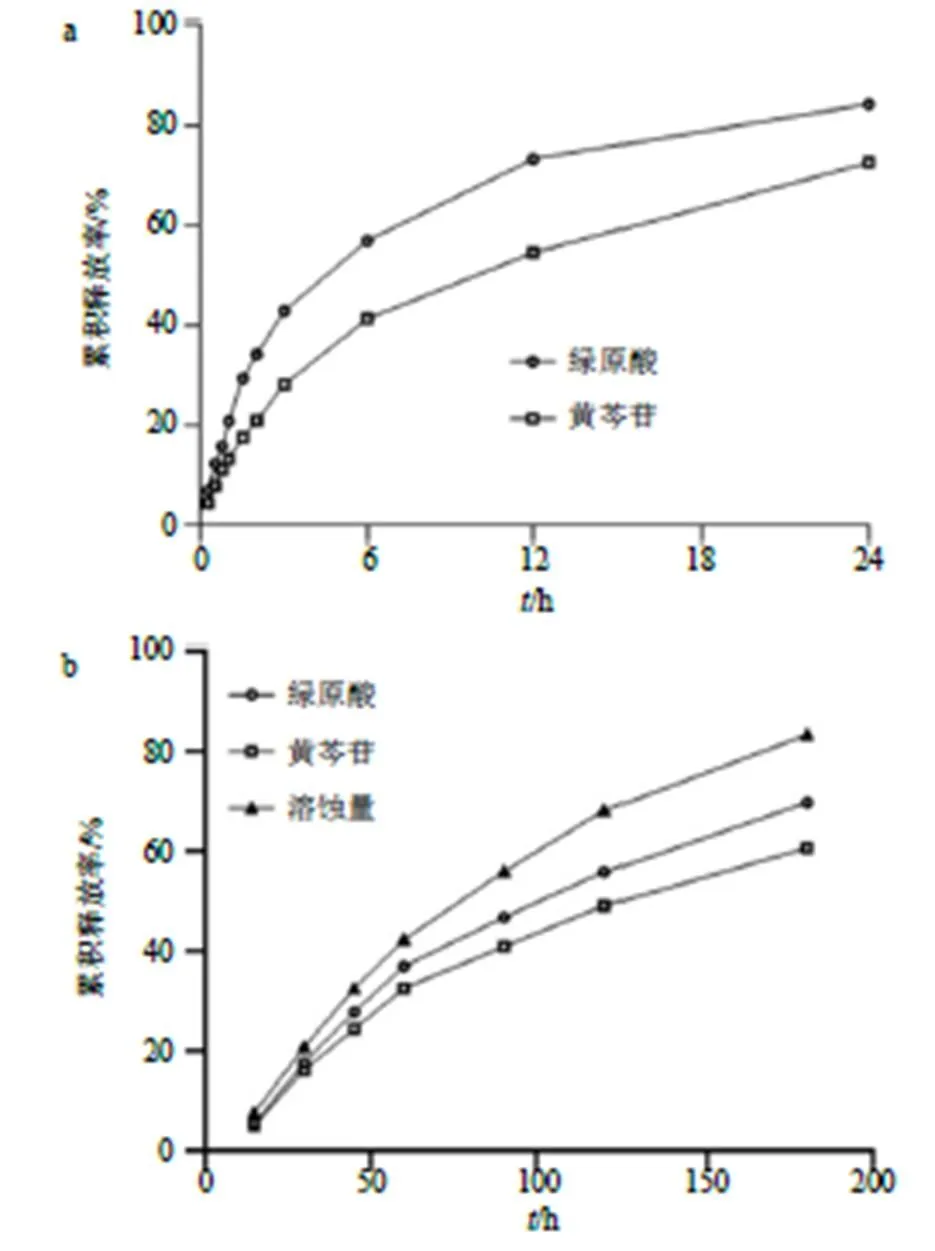
a-体外释药量 b-凝胶溶蚀量
分别吸取上述时间点倾倒出的溶液于5 mL量瓶中,加入甲醇稀释至刻度,经0.22 μm滤过备用,HPLC法测定释放液中绿原酸和黄芩苷质量浓度,即体外累积释放率(绿原酸或黄芩苷)[18]。结果如图4-b所示,绿原酸和黄芩苷的释放随凝胶的不断溶蚀同时进行,表明药物释放速率主要受到凝胶溶蚀速率的控制,180 min时绿原酸和黄芩苷累积释放率均超过60%。回归方程分别为溶蚀=0.004 5+0.097 8,2=0.964 6;绿原酸=0.003 6+0.084 6,2=0.937 8;黄芩苷=0.003 2+0.079 1,2=0.935 1。
2.7 CA&B-NPs/ISNG的鼻黏膜纤毛毒性评价
2.7.1 牛蛙上颚黏膜的直观考察 随机分为空白组、阳性组、空白凝胶组和CA&B-NPs/ISNG组,每组6只牛蛙。固定牛蛙,依次往每组牛蛙上颚黏膜处分别滴加0.5 mL生理盐水、1%脱氧胆酸钠、空白凝胶和CA&B-NPs/ISNG;30 min后,用生理盐水洗净,分离出黏膜约2 mm×2 mm;分离后立即洗净血迹等杂物,纤毛面朝上平铺于载玻片上,黏膜表面滴加适量生理盐水,盖上盖玻片,得样本玻片,于显微镜下观察黏膜形态[19]。
结果给予生理盐水的黏膜面齐整,纤毛保存完好及其有序运动(图5-a);给予1%脱氧胆酸钠30 min后观察到黏膜表面零碎残缺,纤毛完全脱落,已观察不到纤毛运动,说明其对黏膜组织纤毛运动有严重影响(图5-b);给予空白凝胶、CA&B-NPs/ ISNG的黏膜面较齐整,纤毛数量较多,个别纤毛运动略减弱,表明CA&B-NPs/ISNG在一定程度上减弱纤毛运动,但影响不大,具有良好的安全性(图5-c和图5-d)。
2.7.2 纤毛持续运动时间和输送速率的测定 将“2.7.1”项的样本玻片置于蒸馏水饱和的密闭层析缸中,温度20~25 ℃,每隔30 min取出载玻片在显微镜下观察,如纤毛继续运动则放回层析缸中,直至纤毛运动停止。记录从滴加药物开始至纤毛运动停止所持续的时间,即纤毛持续运动时间(persistent vibration duration,PVD),给药组PVD除以空白组PVD,即得纤毛持续运动百分率。按“2.7.1”项方法,将牛蛙分组给药,5 min后,在上颚靠前方位置用棉签轻沾甲基红颗粒以作标记,将刻度尺平行放置在旁观察,甲基红颗粒将在黏膜表面缓慢向咽部移动划下明显痕迹,记录颗粒移动1 cm所需时间,即纤毛输送速率(mucoiliary transport rate,MTR),给药组MTR除以空白组MTR,即得纤毛输送速率百分率。结果如表7所示,空白凝胶组和CA&B-NPs/ISNG组的PVD百分率小于90,说明凝胶对纤毛运动有一定影响,可能与P407、P108、壳聚糖等辅料具有黏度有关;空白凝胶组和CA&B- NPs/ISNG组的MTR百分率大于95,说明CA&B- NPs/ISNG无明显纤毛毒性,可用于鼻腔给药。

a-空白组 b-阳性组 c-空白凝胶组 d-CA&B-NPs/ISNG组
表7 牛蛙上颚黏膜纤毛持续运动及纤毛输送速率(, n = 6)
Table 7 Sustained movement and transport rate of cilia in bullfrog maxillary mucosa (, n = 6)
组别PVD/minPVD百分率MTR/(cm∙min−1)MTR百分率 空白552.5±31.6100.00.885±0.025100.0 阳性0000 空白凝胶491.7±18.289.00.850±0.03396.0 CA&B-NPs/ISNG485.8±23.387.90.843±0.03195.2
2.8 CA&B-NPs/ISNG的鼻黏膜免疫评价
2.8.1 UAID小鼠模型的建立 随机分为空白组、模型组、银翘组、CA&B-NPs/ISNG低剂量组和高剂量组,共5组,每组8只小鼠。除空白组外,其余各组小鼠置−20 ℃寒冷环境60 min,1次/d,连续冷刺激3 d,以小鼠唾液中SIgA含量及溶菌酶活性作为评价指标,建立UAID小鼠模型[20-21]。
2.8.2 鼻黏膜给药 寒冷刺激前1 h,按小鼠体质量进行给药,空白组和模型组滴鼻5.0 μL/g生理盐水,银翘组ig 21.84 g/kg银翘散,低剂量组及高剂量组分别滴鼻2.5 μL/g和5.0 μL/g CA&B-NPs/ISNG;第3天冷刺激后,室温适应60 min,每只小鼠ip 0.1%毛果芸香碱注射液0.5 mL,2 min后移取其唾液,ELISA试剂盒测定唾液中SIgA含量和溶菌酶活性。结果如表8所示,模型组与空白组小鼠相比,唾液中SIgA含量和溶菌酶活性显著降低,表明−20 ℃寒冷刺激可以建立小鼠上呼吸道黏膜免疫功能低下模型;CA&B-NPs/ISNG高剂量组和银翘组小鼠,与模型组小鼠相比,SIgA含量、溶菌酶活性均有显著性升高,而与空白组小鼠相比无显著差异,表明高剂量CA&B-NPs/ISNG和银翘散均能抵抗寒冷刺激致上呼吸道黏膜免疫功能的下降;CA&B-NPs/ ISNG高剂量组与低剂量组相比,SIgA含量、溶菌酶活性有升高趋势,但无显著差异,表明CA&B- NPs/ISNG发挥药效无显著剂量相关性。
表8 小鼠上呼吸道黏膜免疫功能(, n = 8)
Table 8 Mucosal immunity in the upper respiratory tract of mice (, n = 8)
组别剂量SIgA/(g∙L−1)溶菌酶/(μg∙L−1) 空白−4.89±0.467.67±1.50 模型−3.98±0.51##5.97±0.96# 银翘散21.84 g∙kg−14.85±0.71*7.70±1.19** CA&B-NPs/ISNG2.5 μL∙g−14.47±0.647.11±0.76* 5.0 μL∙g−14.89±0.63**7.46±1.49*
与空白组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01
#< 0.05##< 0.01blank group;*< 0.05**< 0.01model group
3 讨论
金银花-黄芩2药配伍被广泛用于治疗上呼吸道感染,如银黄、金花清感、清开灵、双黄连方等,具备优良的抗感染能力。2药常以整体使用,也有以其有效成分使用,在银黄注射液中,2药有效成分绿原酸和黄芩苷以1∶1~1∶2质量比进行配伍用药。与全身给药治疗上呼吸道感染相比,鼻腔给药方便并且作用可靠。鼻为肺之窍,鼻作为身体与外界空气相通的器官,是为肺把关的重要关卡,同时,成人近80%免疫细胞与黏膜表面相关,鼻腔给药能够诱导全身和黏膜免疫反应,增强机体抗感染能力。
人体鼻腔黏膜面积仅约150 cm3,加上普通滴鼻剂给药滞留时间较短,以及鼻腔黏膜纤毛清除作用,会极大地限制鼻腔给药的疗效。壳聚糖具备高生物相容性和促渗透性,其带正电荷的胺残基和带负电荷的鼻黏液层之间存在相互作用,使之具有一定的黏附能力,能够充当滴鼻制剂的优良载体材料;温敏原位凝胶给药系统有着独特的鼻腔给药优势,表现为在环境温度下呈流体状,作为滴鼻制剂可高剂量精度给药,在进入鼻腔后受鼻腔温度刺激迅速经历液体-凝胶转变,从而能够延长药物与黏膜的接触时间并能实现缓慢释放。因此本研究将绿原酸和黄芩苷共载于纳米粒,结合温敏凝胶,以期提高药物的鼻腔滞留能力。
鼻黏膜毒性评价是鼻腔给药安全性研究的重要内容。其中鼻黏膜毒性最常见的表现是鼻黏膜纤毛毒性,主要是影响纤毛运动,更甚者可导致纤毛脱落。牛蛙上腭的纤毛与哺乳动物的鼻腔黏膜纤毛相似,因此,常常用于代替哺乳动物的鼻腔黏膜纤毛毒性研究。SIgA和溶酶菌是机体免疫防御重要成分,前者可有效中和入侵病毒,后者可引起细菌溶解[22-23],两者是UAID小鼠鼻黏膜免疫的重要评价指标。预实验中,将制备好的CGA-BC纳米粒鼻腔原位凝胶以5.0 μL/g滴入UAID模型小鼠的鼻腔[24],观察发现其行为正常,无明显不适,试剂盒检测其唾液中SIgA含量和溶菌酶活性,相比未滴鼻给药的模型小鼠有显著升高,因此以5.0 μL/g作为鼻黏膜免疫评价实验的高剂量。
本研究所制备的CA&B-NPs/ISNG具有良好的生物相容性,可延长药物的作用时间,对寒冷刺激诱导小鼠上呼吸道黏膜免疫低下有提升的作用,为临床用于防治URTI提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中华医学会, 中华医学会杂志社, 中华医学会全科医学分会, 等. 急性上呼吸道感染基层诊疗指南(2018年) [J]. 中华全科医师杂志, 2019, 18(5): 422-426.
[2] 梅雪, 彭衡阳, 刘天强, 等. 上呼吸道感染研究综述 [J]. 亚太传统医药, 2012, 8(2): 187-188.
[3] 李立浩, 陈利娟, 吴勇, 等. 鼻腔冲洗辅助治疗儿童急性上呼吸道感染的效果 [J]. 广东医学, 2015, 36(2): 219-221.
[4] 栗昀, 赖艳妮, 李向阳, 等. 冰香散挥发油黏膜免疫抗流感病毒效果评价 [J]. 广州中医药大学学报, 2016, 33(4): 535-539.
[5] Shibuya M, Tamiya S, Kawai A,. Nasal- subcutaneous prime-boost regimen for inactivated whole- virus influenza vaccine efficiently protects mice against both upper and lower respiratory tract infections [J]., 2021, 554: 166-172.
[6] 冯群, 关永霞, 姚景春, 等. 银黄制剂抗感染作用与临床应用进展 [J]. 中国药物评价, 2020, 37(3): 211-214.
[7] Li M W, Wang Y X, Jin J,. Inhibitory activity of honeysuckle extracts against influenza A virusand[J]., 2021, 36(3): 490-500.
[8] 樊荣, 羿国娟, 鲁兰, 等. 绿原酸及其13种体内主要代谢物的体外抗菌作用研究 [J]. 中草药, 2020, 51(24): 6239-6245.
[9] 龙宇, 向燕, 谭裕君, 等. 黄芩苷药理作用及新剂型的研究进展 [J]. 中草药, 2019, 50(24): 6142-6148.
[10] Chen J L, Xie H M, Chen D W,. Chlorogenic acid improves intestinal development via suppressing mucosa inflammation and cell apoptosis in weaned pigs [J]., 2018, 3(2): 2211-2219.
[11] Cheng K B, Wu Z H, Gao B L,. Analysis of influence of baicalin joint resveratrol retention enema on the TNF-α, SIgA, IL-2, IFN-γ of rats with respiratory syncytial virus infection [J]., 2014, 70(2): 1305-1309.
[12] 王多伽, 畅丽芳, 迟玉杨, 等. 日粮中添加不同水平绿原酸对獭兔血清免疫指标的影响 [J]. 饲料研究, 2013(3): 33-36.
[13] Cheng X Y, Cao Z Y, Luo J R,. Baicalin ameliorates APEC-induced intestinal injury in chicks by inhibiting the PI3K/AKT-mediated NF-κB signaling pathway [J]., 2022, 101(1): 101572.
[14] 杨梦璐, 张娜, 王方远, 等. 壳聚糖在纳米药物递送载体领域的应用现状 [J]. 中国组织工程研究, 2021, 25(28): 4546-4552.
[15] 何朝星, 王欣, 高淑颖, 等. 白藜芦醇眼用纳米乳-离子敏感型原位凝胶的制备与质量评价 [J]. 中国药学杂志, 2022, 57(2): 124-131.
[16] 吴瑛, 李阳, 李凤琴, 等. 黄芩苷壳聚糖纳米粒的制备及表征 [J]. 中国实验方剂学杂志, 2014, 20(15): 15-19.
[17] 孙健. 壳聚糖纳米粒的复合法制备及其在温敏凝胶中的应用 [D]. 南京: 南京师范大学, 2015.
[18] 谢锦. 去氢骆驼蓬碱纳米晶体原位凝胶给药系统的构建及其鼻腔给药研究 [D]. 南昌: 江西中医药大学, 2020.
[19] 谢伟容. 黄连解毒鼻用温敏凝胶对蟾蜍上颚黏膜纤毛毒性作用的研究 [J]. 江西中医药大学学报, 2019, 31(2): 85-87.
[20] 李爽, 杨居崩, 廖陈, 等. 解表方对寒冷刺激致大鼠鼻黏膜免疫屏障功能低下模型的作用 [J]. 中成药, 2022, 44(1): 227-230.
[21] 李娴, 雷娜, 段小花, 等. 寒冷刺激致小鼠上呼吸道黏膜免疫功能低下模型的研究 [J]. 中国病理生理杂志, 2011, 27(8): 1662-1664.
[22] 关景平, 孔春燕, 李霞. 泻脾散加减对脾胃伏火型复发性阿弗他溃疡患者口腔菌群及唾液免疫指标的影响 [J]. 现代中西医结合杂志, 2020, 29(27): 3035-3039.
[23] 刘洪, 李海文, 刘凤斌. 唾液成分与消化道疾病相关性研究及中医药防治思路 [J]. 中药新药与临床药理, 2016, 27(3): 460-465.
[24] 陈秀秀, 周红霞, 亓文宝, 等. 甘草酸联合利巴韦林体内抗甲型H1N1流感病毒作用 [J]. 药学学报, 2015, 50(8): 966-972.
Preparation of chlorogenic acid-baicalin co-loaded nanoparticlesnasal gel and investigation on enhancing nasal mucosal immunity
LIANG Da-jun1, LIN Yu-jian1, SHI Jun1, 2, WU Xin-ying1, LIU Rui-ping1
1. Department of Traditional Chinese Medicine, Guangdong PharmaceuticalUniversity, Guangzhou 510006, China 2. Guangdong Engineering & Technology Research Center of Topical PreciseDrug Delivery System, Guangzhou 510006, China
To prepare for chlorogenic acid and baicalin co-loaded nanoparticlesnasal gel (CA&B-NPs/ISNG) and to investigate its effect on upper airway immunity dysfunction (UAID) mice.To use encapsulation rate and gelation temperature as evaluation index, CA&B-NPs/ISNG was prepared. Then it was characterized by morphology, particle size distribution, ζpotential, drug releaseand gel corrosion amount. The toxicity of CA&B-NPs/ISNG to cilia was investigated by using toad palate mucosa. The UAID mice was established and the enhancement effect of CA&B-NPs/ISNG on nasal mucosal immunity was detected by measuring the SIgA content and lysozyme activity in saliva of mice.The preferred prescription is to take 11.0 mg each of chlorogenic acid and baicalin, 10 mL PEG400 was added to dissolve intochlorogenic acid- baicalin solution and slowly dropped into 25 mL 2.72 mg/mL chitosan solution with magnetic stirring. Adjusted the pH to 5.0. Then 10 mL 1.00 mg/mL TPP solution was slowly added dropwise under magnetic stirring to obtain CA&B-NPs suspension; CA&B-NPs was added to system 18.5% P407, swollen and dispersed well, then added system 1% P188, completely swollen and dispersed well, and the pH was adjusted to 5.5 to obtain CA&B-NPs/ISNG. Nanoparticles showed regular morphology with particle size (536.10 ± 16.24) nm, ζ potential (24.39 ± 0.27) mV, particle dispersion coefficient 0.310 ± 0.053, chlorogenic acid and baicalin encapsulation rates of (44.67 ± 0.43)% and (55.25 ± 0.61)%, respectively. The gelling temperature was (32.03 ± 0.31) ℃. CA&B-NPs/ISNG showed sustained slow drug release and no obvious ciliary toxicity, and significantly increased SIgA content and lysozyme activity (< 0.05).The prepared CA&B-NPs/ISNG was stable and had high encapsulation rate. It was suitable for nasal preparation requirement and can improve nasal mucosal immune function in UAID mice.
chlorogenic acid; baicalin; nanoparticles;gel; nasal mucosal immunity
R283.6
A
0253 - 2670(2022)16 - 5001 - 09
10.7501/j.issn.0253-2670.2022.16.009
2022-04-08
全国中医药创新骨干人才培养对象项目[国中医药人教函(2019)128号]
梁达均(1996—),男,硕士研究生,研究方向为中药制剂研究与开发。Tel: 15913444215 E-mail: 15913444215@163.com
时 军(1980—),男,博士,副教授,研究方向为中药新剂型与制剂新技术研究。E-mail: shijun8008@163.com
[责任编辑 郑礼胜]
——评析绿原《幸福》

