蜈蚣败毒饮对银屑病模型鼠外周血中滤泡辅助性T细胞及其主导通路影响的机制研究
任宇坤,张 琼,张 晴,林 丽,杨素清,安月鹏*
(1.黑龙江中医药大学,哈尔滨 150040;2.黑龙江中医药大学附属第一医院,哈尔滨 150040)
课题组在既往对于T淋巴细胞亚群研究的基础之上[1],对滤泡辅助性T细胞(follicular helper T cell,Tfh)与其他T淋巴细胞亚群的交叉因子、B细胞淋巴因子(B cell lymphoma,Bcl)及信号传导及转录激活蛋白3(signal transducer and activator of transcription 3,STAT3)进行了研究并提示中药干预该通路及其靶点的可行性[2-3],通过进一步系统总结Tfh细胞的整体通路。本次实验拟在外周血的水平上,分析Tfh细胞的表达水平,同时对其上游刺激因子 IL-6(interleukin-6,IL-6)、IL-21,转录因子Bcl-6、STAT3,下游分泌因子趋化因子受体5(chemokine receptor 5,CXCR5)、可诱导共刺激分子(inducible co-stimulator,ICOS)、程序性死亡受体-1(programmed death receptor-1,PD-1)、血细胞簇分化抗原40 L(cluster of differentiation 40L,CD40L)进行链锁式研究,同时分析基于中医“毒”“瘀”理论的中药复方制剂蜈蚣败毒饮的干预机制,为中医药的现代化研究及临床治疗银屑病提供支持和佐证。
1 材料与方法
1.1 实验动物
清洁级C57BL/6小鼠30只,其中雌性小鼠15只、雄性小鼠15只,体质量在15~24 g之间,鼠龄在4~7周之间,所有小鼠均来源于上海斯莱克实验动物有限公司,合格证号为SCXK(沪)2017-0005。小鼠经常规单笼适应性饲养(温度在20~25 ℃之间,湿度在40%~65%之间,安静通风)3 d,自由饮水及采食。
1.2 主要试剂
红细胞裂解液(大连美仑生物技术有限公司,MA0207);PBS(北京索莱宝科技有限公司,P1022);Anti-CD4( 美 国 Biolegend公 司,100510);Anti-CXCR5( 美 国 Biolegend公 司,129804);IL-6试剂盒(上海酶联生物科技有限公司,ml002293);IL-21试剂盒(上海酶联生物科技有限公司,ml037878);Bcl-6试剂盒(上海酶联生物科技有限公司,ml028016);STAT3试剂盒(上海酶联生物科技有限公司,ml900517);CXCR5试剂盒(上海酶联生物科技有限公司,ml11179);ICOS试剂盒(上海酶联生物科技有限公司,ml600140);PD-1试剂盒(上海酶联生物科技有限公司,ml628616);CD40L试剂盒(上海酶联生物科技有限公司,ml202193);甲氨蝶呤片(上海上药信宜药厂有限公司,210512);咪喹莫特乳膏(四川明欣药业有限责任公司,210715);0.9%氯化钠注射液(哈尔滨三联药业股份有限公司,21051023);蜈蚣败毒饮中药组分(黑龙江中医药大学附属第一医院门诊中草药局)。
1.3 主要仪器
流式细胞仪(美国Agilent公司,NovoCyte 3110);低温离心机(美国Thermo Fisher公司,SORVALL ST8/8R);呼吸麻醉机(上海玉研科学仪器公司,Y1001410002);电子天平(瑞士METTLER TOLEDO公司,ME104E);振荡器(美国 Scientific Industries公司,Genie2)。
1.4 实验方法
1.4.1 小鼠分组 30只C57BL/6小鼠随机分为6组,分别为生理盐水空白对照组(空白组)、生理盐水模型对照组(模型组)、甲氨蝶呤西药对照组(西药组)、蜈蚣败毒饮中药低剂量组(低剂量组)、蜈蚣败毒饮中药中剂量组(中剂量组)、蜈蚣败毒饮中药高剂量组(高剂量组),每组5只。
1.4.2 小鼠建模 采用外用咪喹莫特诱导建模的方法进行银屑病模型鼠的建立。具体方法为对除空白组外的其余25只小鼠进行背部皮肤的备皮,备皮区域选择背部3 cm×3 cm的光滑平整区域,尽可能保证每只小鼠的备皮区面积相同。每日以5%的咪喹莫特乳膏62.5 mg进行局部涂擦1次,且于涂擦前剃除备皮区前日新生毛发,以相同的方法建模8 d。第9天时建模完成,观察此时小鼠的银屑病皮损指数并进行记录,再进行后续的灌胃处理。
1.4.3 药液灌胃 低剂量组、中剂量组、高剂量组药液配制时分别取蜈蚣败毒饮组分蜈蚣3 g,乌梢蛇20 g,紫草30 g,土茯苓30 g,鬼箭羽30 g,甘草10 g,按常规方法煎煮2次,经人与小鼠的单位体表面积等药量换算法,将其调配成浓度为0.08 g·mL-1、0.16 g·mL-1、0.32 g·mL-1的溶液,分别相当于人口服蜈蚣败毒饮药量的0.5倍、1倍、2倍。西药组的药液配制时取甲氨蝶呤片以相同的方法调配成浓度为0.003 mg·mL-1的混悬液,相当于人口服甲氨蝶呤片药量的1倍。空白组、模型组的灌胃药液则直接选择0.9%氯化钠注射液。
在第9天建模完成时即进行灌胃,除西药组外的其余5组均以对应的药液进行灌胃,灌胃剂量为每次1 mL·200 g-1,频次为每日2次,均在小鼠早晚进食后的30 min进行,共灌胃8 d。西药组亦在建模完成时进行灌胃8 d,前4 d选择甲氨蝶呤混悬液,后4 d选择0.9%氯化钠注射液,其灌胃的剂量、频次、方法同其余各组,因此种灌胃方法与临床银屑病患者口服甲氨蝶呤片治疗银屑病的方法相一致,以保证实验研究结果更加贴近于临床[4]。
1.4.4 皮损指数评价 采用课题组改良的鼠银屑病皮损面积和严重程度指数(MPASI)评分法对各小鼠的皮损指数进行量化评分。MPASI评分法较之PASI评分法,一方面增加了鼠特有的尾部结构,另一方面重新定义了鼠的各部位体表组织占总体表面积的百分比,依次为头部20%、上肢10%、躯干50%、下肢10%、尾部10%[5]。
因本实验银屑病鼠的皮损均存在于背部(躯干部),其余体表部位无诱导出现的皮损,因此在计算MPASI分值时单纯计算躯干部的分值即可。根据皮损严重程度情况,对红斑、浸润、鳞屑三个指标进行由轻至重的0~4分量化评分;根据皮损所占躯干部整体皮肤的面积情况,对皮损面积比例进行0~6分量化评分;MPASI=MPASI躯干=0.5×(红斑分值+浸润分值+鳞屑分值)×皮损面积比例分值,并计算出灌胃前后MPASI分值的变化量(△MPASI),△MPASI= MPASI灌胃前-MPASI灌胃后。
1.4.5 含药血清制备 在灌胃结束并进行皮损指数评价后,采用呼吸麻醉的方法对各小鼠进行麻醉,在无菌的环境下取腹主动脉血8 mL,经混匀和离心后制备成含药的外周血单个核细胞,取部分血液于2 h内进行流式细胞学检测,其余血液保存备用。
1.4.6 流式细胞法检测 血液经离心后去上清,应用无菌去离子水稀释红细胞裂解液,裂解2 min,再次离心去上清,经洗涤1~2次后使用500 μL的PBS溶液,重悬沉淀。按照1:200的比例加入稀释后的Anti-CD4、Anti-CXCR5,避光4℃孵育30 min,染色后的细胞经离心5 min,去上清,加入500 μL的PBS溶液,重悬沉淀。选择FITC、PE、APC、PE/Cyanine7通道,上机40 000个细胞,进行流式细胞检测分析,以CD4+CXCR5+标记的细胞表示外周血中Tfh细胞的表达量。
1.4.7 ELISA法检测 血液样本经离心收集上清,设置标准品孔和样本孔,除空白组外依次经加样、加酶、温育、洗涤、显色等步骤,最后终止反应(蓝色立转为黄色),在15 min内以450 nm波长依序测量各孔的吸光度,通过软件描绘标准曲线,并计算出各孔的浓度值。
1.4.8 相关性分析 除空白组外,整体分析其余5组共25只银屑病模型鼠灌胃前后皮损指数的变化量(△MPASI)与灌胃治疗后Tfh细胞表达量、Tfh细胞主导通路中的刺激因子(IL-6、IL-21)、转录因子(Bcl-6、STAT3)、分泌因子(CXCR5、ICOS、PD-1、CD40L)之间的相关性,从而分析经不同的药物干预后,银屑病小鼠皮损的改善与Tfh细胞及其主导通路之间的关联。分别求得回归方程,描绘回归曲线,计算相关系数(γ),并分析统计学意义。
1.5 统计学方法
采用SPSS 23.0统计学软件,所有数据均满足正态分布,计量资料采用均数±标准差(±s)的形式表示,计数资料采用频数或百分数的形式表示,计量资料采用配对或独立样本的t检验,相关性比较采用Pearson相关。以P<0.05为差异有统计学意义,以P<0.01为差异有显著统计学意义。
2 结果
2.1 各组皮损指数(MPASI)比较
见表1。
表1 各组皮损指数(MPASI)比较(±s,n = 5) 分

表1 各组皮损指数(MPASI)比较(±s,n = 5) 分
注:与模型组比较,# P<0.05,## P<0.01;与西药组比较,△P<0.05
组别 灌胃前MPASI 灌胃后MPASI △MPASI空白组 0.00±0.00 0.00±0.00 0.00±0.00模型组 10.20±1.13 9.80±1.02 0.40±0.02西药组 11.00±1.82 2.20±0.47## 8.20±2.32##低剂量组 10.60±2.01 7.80±3.08#△ 2.40±0.59#△中剂量组 9.60±1.76 5.60±1.59##△ 3.60±1.01##△高剂量组 10.40±1.85 2.40±0.55## 7.80±1.87##
2.2 各组外周血中Tfh细胞表达量比较
见表2。组别 Tfh细胞数/个 Tfh细胞比例/%
表2 各组外周血中Tfh细胞表达量比较(±s,n= 5)

表2 各组外周血中Tfh细胞表达量比较(±s,n= 5)
注:与空白组比较,## P<0.01;与模型组比较,△△P<0.01;与西药组比较,▲P<0.05
空白组 647.33±263.23 0.14±0.03模型组 2 773.00±350.66## 0.42±0.15西药组 1 200.67±259.39##△△ 0.20±0.02低剂量组 1 981.00±307.36##△△▲ 0.32±0.13中剂量组 1 768.33±201.16##△△▲ 0.22±0.02高剂量组 1 242.00±146.50##△△ 0.19±0.05
2.3 各组血清中Tfh细胞通路各因子含量比较
见表3、表4。
表3 各组Tfh细胞通路中刺激因子IL-6、IL-21及转录因子Bcl-6、STAT3含量比较(±s,n= 5)
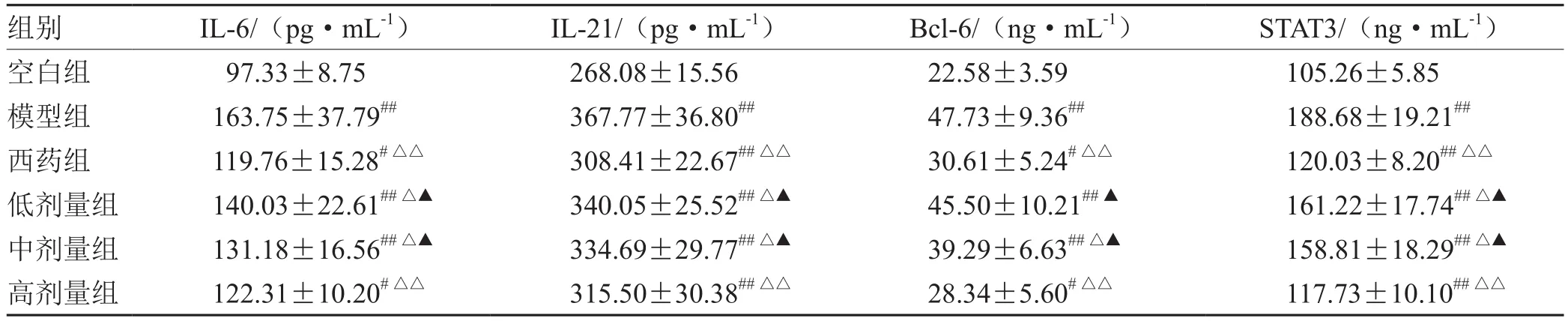
表3 各组Tfh细胞通路中刺激因子IL-6、IL-21及转录因子Bcl-6、STAT3含量比较(±s,n= 5)
注:与空白组比较,# P<0.05,## P<0.01;与模型组比较,△P<0.05,△△P<0.01;与西药组比较,▲P<0.05
组别 IL-6/(pg·mL-1) IL-21/(pg·mL-1) Bcl-6/(ng·mL-1) STAT3/(ng·mL-1)空白组 97.33±8.75 268.08±15.56 22.58±3.59 105.26±5.85模型组 163.75±37.79## 367.77±36.80## 47.73±9.36## 188.68±19.21##西药组 119.76±15.28#△△ 308.41±22.67##△△ 30.61±5.24#△△ 120.03±8.20##△△低剂量组 140.03±22.61##△▲ 340.05±25.52##△▲ 45.50±10.21##▲ 161.22±17.74##△▲中剂量组 131.18±16.56##△▲ 334.69±29.77##△▲ 39.29±6.63##△▲ 158.81±18.29##△▲高剂量组 122.31±10.20#△△ 315.50±30.38##△△ 28.34±5.60#△△ 117.73±10.10##△△
表4 各组Tfh细胞通路中分泌因子CXCR5、ICOS、PD-1、CD40L含量比较(±s,n= 5)
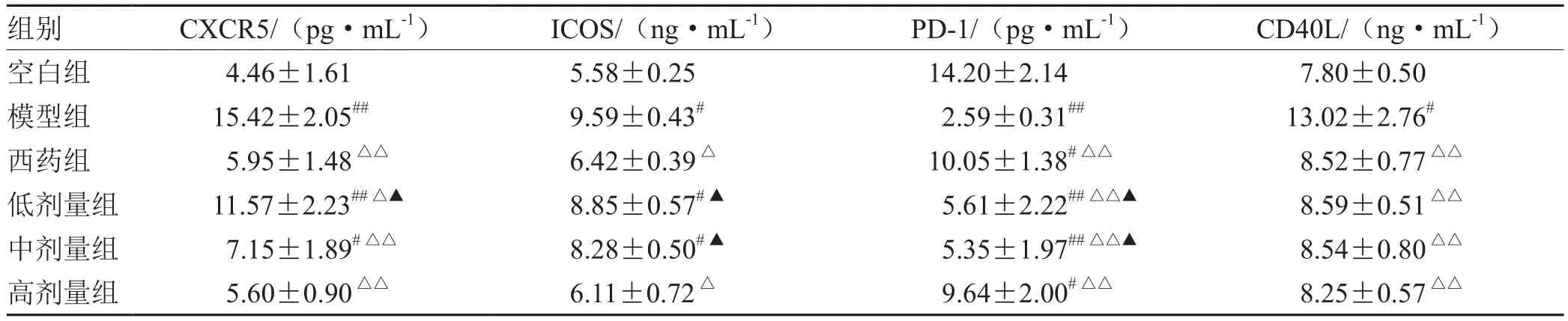
表4 各组Tfh细胞通路中分泌因子CXCR5、ICOS、PD-1、CD40L含量比较(±s,n= 5)
注:与空白组比较,# P<0.05,## P<0.01;与模型组比较,△P<0.05,△△P<0.01;与西药组比较,▲P<0.05
组别 CXCR5/(pg·mL-1) ICOS/(ng·mL-1) PD-1/(pg·mL-1) CD40L/(ng·mL-1)空白组 4.46±1.61 5.58±0.25 14.20±2.14 7.80±0.50模型组 15.42±2.05## 9.59±0.43# 2.59±0.31## 13.02±2.76#西药组 5.95±1.48△△ 6.42±0.39△ 10.05±1.38#△△ 8.52±0.77△△低剂量组 11.57±2.23##△▲ 8.85±0.57#▲ 5.61±2.22##△△▲ 8.59±0.51△△中剂量组 7.15±1.89#△△ 8.28±0.50#▲ 5.35±1.97##△△▲ 8.54±0.80△△高剂量组 5.60±0.90△△ 6.11±0.72△ 9.64±2.00#△△ 8.25±0.57△△
2.4 皮损指数变化量(△MPASI)与Tfh细胞及其主导通路的相关性分析
见表5、图1-9。
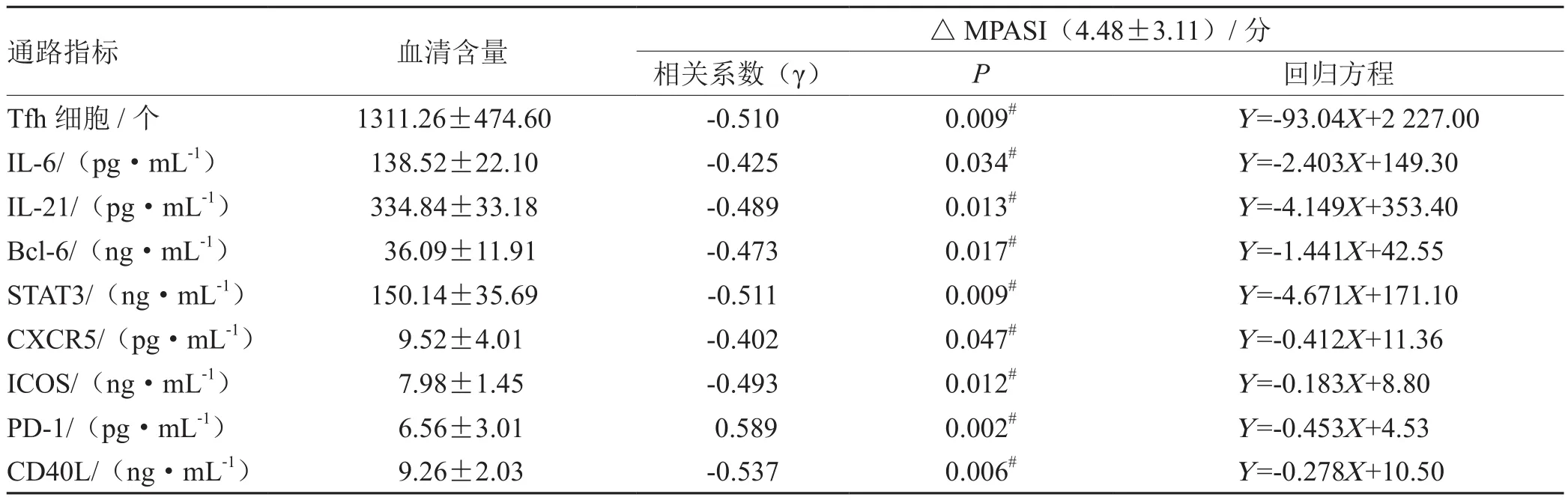
表5 皮损指数变化量(△MPASI)与Tfh细胞及其主导通路的相关性分析(n= 5)
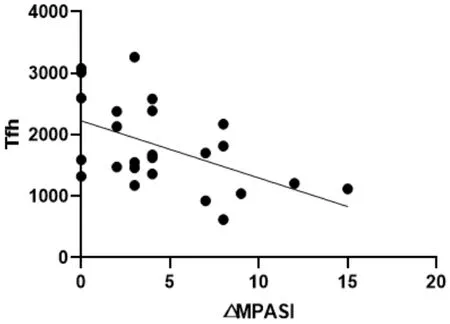
图1 △MPASI与Tfh回归曲线
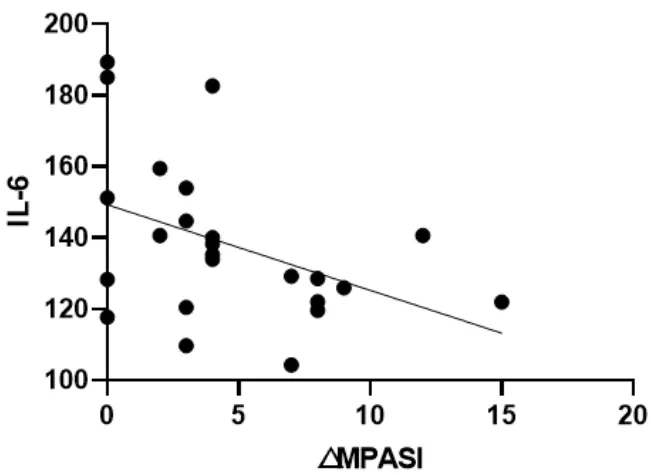
图2 △MPASI与IL-6回归曲线
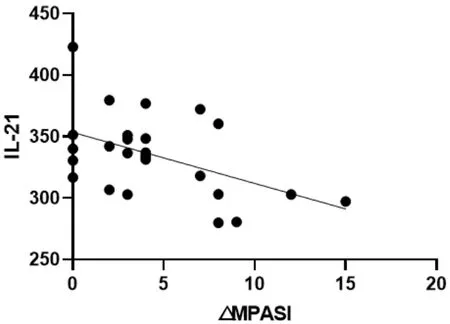
图3 △MPASI与IL-21回归曲线
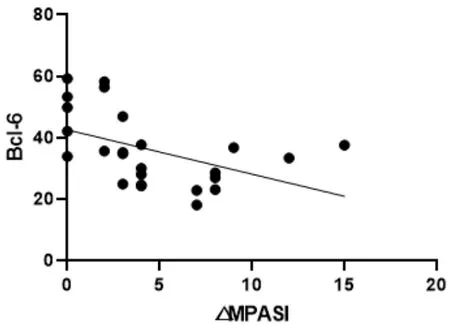
图4 △MPASI与Bcl-6回归曲线
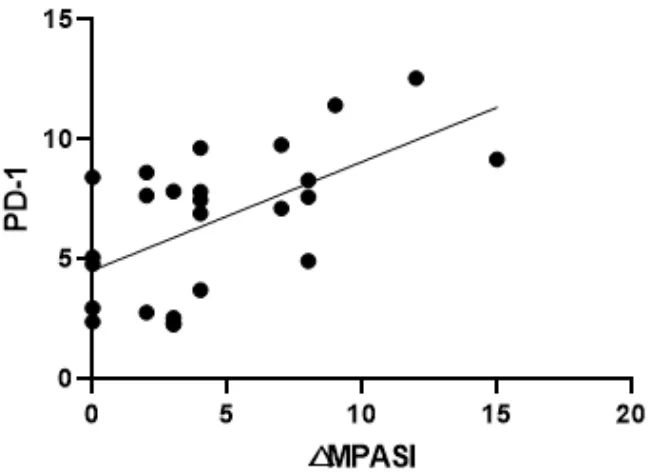
图5 △MPASI与STAT3回归曲线
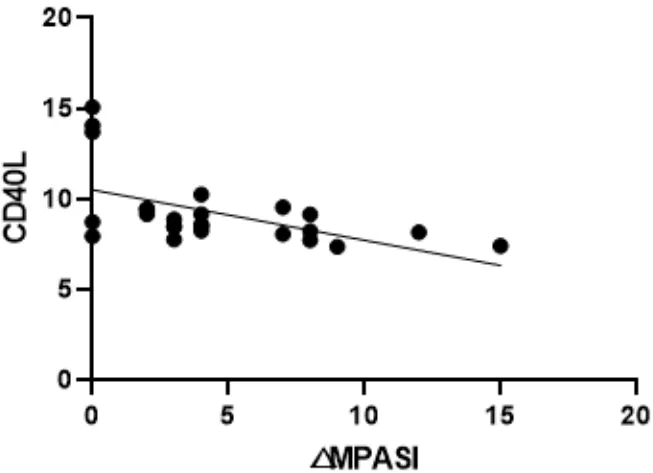
图6 △MPASI与CXCR5回归曲线
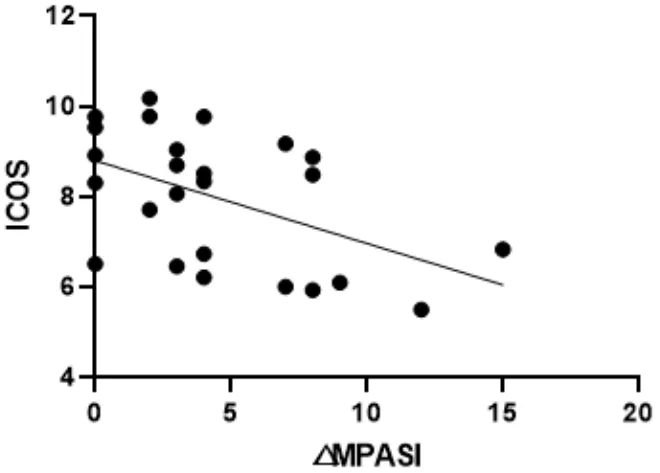
图7 △MPASI与ICOS回归曲线
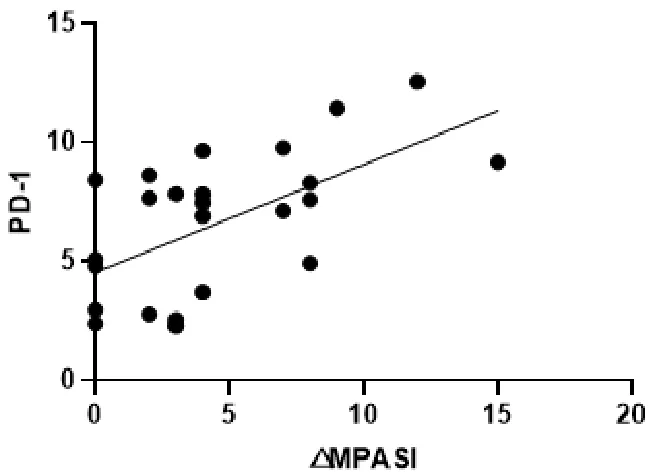
图8 △MPASI与PD-1回归曲线
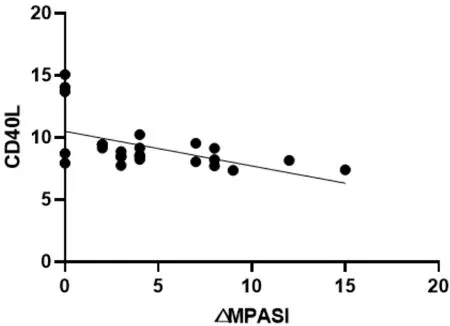
图9 △MPASI与CD40L回归曲线
3 讨论
基于对Tfh细胞复杂免疫学通路的认识,课题组以体现“毒”“瘀”致病理论的中药制剂蜈蚣败毒饮为干预药物,研究其针对于Tfh细胞及其主导通路的相关靶点,从中医的毒邪致病到银屑病皮损的瘀滞所成,有机的结合西医学Tfh通路的细胞因子紊乱到红斑鳞屑的病理状态,将中西医二者从病因、病机、临床表现等方面进行合理的整合。蜈蚣败毒饮是课题组多年来致力于银屑病治疗研究的经验方剂,其由蜈蚣、乌梢蛇、紫草、土茯苓、鬼箭羽、甘草组成,以蜈蚣、乌梢蛇为君,紫草、土茯苓、鬼箭羽为臣,甘草为佐使,在发挥虫类药物以毒攻毒、熄风散毒、走窜通路的“解毒”“化瘀”作用的同时,与臣药相互配合,发挥清热毒、除湿毒、化瘀毒的“祛毒”作用,以及活血瘀、除痹瘀、逐滞瘀的“祛瘀”功效,加之甘草的解百毒、和诸药之品,六药配伍,充分体现出中医学“毒”“瘀”理论在银屑病辨治中的特色和独到之处。
本次研究结果可以看出,在作用疗效方面,蜈蚣败毒饮各剂量组均能够降低银屑病模型鼠的皮损指数,其程度依次为高剂量组>中剂量组>低剂量组,且高剂量组的作用疗效与甲氨蝶呤相似。在影响Tfh细胞方面,建模后的银屑病小鼠表现出外周血中Tfh细胞数的显著升高,模型组Tfh细胞比例为空白组均数的3倍左右,药物干预后的外周血中Tfh细胞数均有不同程度的降低,干预程度依次为西药组≈高剂量组>中剂量组>低剂量组。在对Tfh细胞通路的检测方面,银屑病小鼠的Tfh细胞通路因子均呈现出异常表达,以刺激、转录因子高表达,CXCR5、ICOS、CD40L的分泌因子高表达,及PD-1的分泌因子低表达为主要变化趋势。在经药物的干预后,高剂量组和西药组均能够显著影响Tfh细胞通路的各关键因子,调控其恢复平衡状态,尤其对于CD40L的干预作用,不同浓度的蜈蚣败毒饮均表现出相似的调控功效,体现出药物干预的敏感性,对PD-1的干预呈现出上调趋势,这与文献[6]所述的PD-1具有反向抑制T细胞活化和增殖作用,PD-1的不足是银屑病发病的内在重要因素的阐述相互吻合。在相关性的研究方面,经过整体分析小鼠皮损指数的变化与药物干预后Tfh细胞及其通路中各因子表达量的相关程度,结果发现,皮损的缓解与Tfh细胞及其通路因子间均具有较为密切的关系,除与PD-1呈正相关外(皮损缓解程度越大,PD-1越高表达),△MPASI与Tfh、IL-6、IL-21、Bcl-6、STAT3、CXCR5、ICOS、CD40L均呈现负相关(皮损缓解程度越大,各细胞或因子越低表达),相关性的研究也是对本实验中皮损、通路研究内容的有机整合。
本研究初步对蜈蚣败毒饮干预下的Tfh细胞主导通路的靶点进行了探索,在深化中医学“毒”“瘀”理论辨治银屑病的同时,也为后续针对于T淋巴细胞机制网络的系统研究奠定了基础,将中医经典理论与西医微观机制相互融合,对中西医结合方法在银屑病临证中的科学应用具有重要的促进和推动作用。

