聚球藻PCC7002 藻蓝蛋白提取纯化及热致褪色机理研究
朱林清,曾名湧
(中国海洋大学食品科学与工程学院,青岛市海洋食品保鲜技术工程研究中心,山东青岛 266003)
聚球藻PCC7002(Synechococcussp.PCC7002,简称“聚球藻”)是一类海洋中分布广泛的单细胞蓝细菌,因结构简单且全基因组序列已被破译等优势,被认为是基因工程领域内外源基因表达的理想宿主[1]。除遗传背景清晰之外,广盐性的聚球藻对高温、强光均有一定的耐受性,被认为是细胞倍增速度最快的常见模式藻种[2]。近年来,藻体内嗜铁素[3]、多聚磷酸体[4]、类胡萝卜素[5]、多糖[6]等活性成分的研究使聚球藻逐渐为食品领域内的研究者所关注,使它有望成为工业领域中又一可供高值化开发的微藻资源。
藻蓝蛋白(Phycocyanin,PC)是存在于蓝藻、红藻等藻种内、由脱辅基蛋白通过硫醚键共价结合藻蓝胆素而形成的一类胞内水溶性蛋白,在叶绿素a 光吸收较差的范围内起着增强光吸收的作用。藻蓝蛋白是我国《GB 2760-2014 食品添加剂使用标准》中唯一被批准在食品中使用的天然蓝色色素[7],既可添加到果冻、奶酪、饮料、雪糕等食品中赋予食品新奇的蓝色色泽,又具有抗氧化、抗炎、抗肿瘤和免疫调节等生理活性[8],能发挥一定的保健功能。然而,当藻蓝蛋白配制成酸性食品或进行巴氏杀菌时,其胶体稳定性和颜色稳定性差,限制了藻蓝蛋白在食品领域的广泛使用[9]。据研究[10-11],藻蓝蛋白的蛋白结构在50 ℃以上就会变性,进而导致四吡咯发色团的失稳以及蓝色色泽的消褪。作为食品加工中必不可少的步骤,热杀菌对藻蓝蛋白呈色稳定性破坏极大且不可避免。因此,藻蓝蛋白热处理过程中的褪色机理研究对于其实际应用具有现实意义,也是藻蓝蛋白护色技术研究的重要理论依据。
由于螺旋藻已被产业化养殖且被批准在食品中应用,因此目前关于藻蓝蛋白的研究主要与螺旋藻相关,而聚球藻藻蓝蛋白的研究则相对匮乏。郭伟等[12]发现聚球藻的藻蓝蛋白含量高达15.81%,与螺旋藻中的含量相当,表明聚球藻可作为提取藻蓝蛋白的潜在原料。因此,本研究以聚球藻为原料提取纯化藻蓝蛋白,探究藻蓝蛋白在热处理过程中的褪色机理,以期为提高藻蓝蛋白热稳定性提供理论依据,促进对微藻资源的深度开发。
1 材料与方法
1.1 材料与仪器
聚球藻(Synechococcussp.PCC7002)干粉 实验室培养、收集及冻干获取,聚球藻PCC7002 由北京大学生命科学学院赵进东院士惠赠;氯化钙(分析级)、氯化钠(分析级)、硝酸钾(分析级)、硫酸铵(分析级)、溴化钾(光谱纯)国药集团化学试剂有限公司;壳聚糖(水溶性)食品级,浙江一诺生物科技有限公司;甘氨酸(生物技术级)、十二烷基硫酸钠(生物技术级)、三羟甲基氨基甲烷(生物技术级)、琼脂(生物技术级)、40% Acr/bis(29:1)、1 mol/L Tris-HCl(pH8.8)、1 mol/L Tris-HCl(pH6.8)、10% SDS、10%AP(过硫酸铵)、TEMED 北京索莱宝科技有限公司。
GL-2M 高速冷冻离心机 湖南湘仪离心机有限公司;GXZ-280 光照培养箱 宁波江南仪器厂;G154T 全自动高压灭菌锅 致微仪器有限公司;AH110B 高压均质机 ATS 工业系统有限公司;HJ-6CS 磁力搅拌水浴锅 常州普天仪器制造有限公司;3nh 高品质电脑色差仪 深圳市三恩驰科技有限公司;UV-2550 紫外可见分光光度计 日本岛津公司;F-4600 荧光分光光度计 日本日立公司;NicoletiS10傅里叶红外光谱仪 美国赛默飞公司;Nano-zs 90 激光粒度分析仪 英国马尔文仪器公司;Protean 凝胶电泳装置 美国Bio-Rad 公司。
1.2 实验方法
1.2.1 聚球藻干粉的获取 参照郭伟等[12]的培养方法,选取平板上生长良好的聚球藻接种于5 L 的Medium A 培养基中通入空气进行培养,环境温度设置为32 ℃;以照明日光灯为光源,光照强度达到100 μE/(m2·s)。聚球藻培养至稳定期后收获(12~13 d),离心所得的藻液(8000 r/min,10 min)收集藻泥。将藻泥重悬于去离子水中再离心,重复操作2~3 次进行脱盐,最后将藻泥冷冻干燥得到聚球藻干粉。
1.2.2 藻蓝蛋白提取条件优化 参考刘立闯等[13]的方法,并作部分修改。通过单因素实验,以藻蓝蛋白纯度和得率为指标分别探究提取介质、介质浓度、藻体浓度、均质压力、均质时间对高压均质破壁藻细胞溶出藻蓝蛋白的影响。
1.2.2.1 提取介质对藻蓝蛋白得率和纯度的影响固定提取介质浓度为0.01 mol/L,将冻干藻粉分别溶于NaCl、KNO3、CaCl2、PBS 溶液及去离子水中配制0.5 mg/mL 的藻液,60 MPa 下均质5 min 后离心收集上清液(8000 r/min,10 min),用紫外可见分光光度计测定上清液的A620、A650和A280。
1.2.2.2 介质浓度对藻蓝蛋白得率和纯度的影响固定提取介质为NaCl 溶液,将藻粉分别溶于0.01、0.02、0.04、0.08、0.16 mol/L 的NaCl 溶液中配制0.5 mg/mL 的藻液,60 MPa 下均质5 min 后离心收集上清液(8000 r/min,10 min),用紫外可见分光光度计测定上清液的A620、A650和A280。
1.2.2.3 藻体浓度对藻蓝蛋白得率和纯度的影响固定提取介质为0.04 mol/L NaCl 溶液,将藻粉溶于NaCl 溶液中配制藻体浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL 的藻液,60 MPa 下均质5 min 后离心收集上清液(8000 r/min,10 min),用紫外可见分光光度计测定上清液的A620、A650和A280。
1.2.2.4 均质压力对藻蓝蛋白得率和纯度的影响 固定提取介质为0.04 mol/L NaCl,藻体浓度为2 mg/mL,将藻液分别于20、40、60、80、100 MPa 下均质5 min后离心收集上清液(8000 r/min,10 min),用紫外可见分光光度计测定上清液的A620、A650和A280。
1.2.2.5 均质时间对藻蓝蛋白得率和纯度的影响 固定提取介质为0.04 mol/L NaCl,藻体浓度为2 mg/mL,均质压力为80 MPa,将藻液分别均质5、7、9、11、13、15 min 后离心收集上清液(8000 r/min,10 min),用紫外可见分光光度计测定上清液的A620、A650和A280。
1.2.3 藻蓝蛋白粗提液纯化 以藻蓝蛋白纯度和回收率为指标,通过壳聚糖絮凝、硫酸铵盐析纯化所得的藻蓝蛋白粗提液。
1.2.3.1 壳聚糖浓度对藻蓝蛋白纯度和回收率的影响 参考廖晓霞等[14]的方法,并作修改。向藻蓝蛋白粗提液中加入壳聚糖,使其浓度分别为0.05、0.1、0.15、0.2、0.25、0.3 mg/mL,混匀并静置5 min 后离心收集上清液(8000 r/min,10 min),用紫外可见分光光度计测定上清液的A620、A650和A280。
1.2.3.2 硫酸铵饱和度对藻蓝蛋白纯度和回收率的影响 参考于淑坤等[15]的方法,并作改动。向经终浓度为0.15 mg/mL 的壳聚糖纯化得到的上清液缓慢加入硫酸铵,使溶液中硫酸铵饱和度分别为45%、50%、55%、60%、65%、70%,混匀并在4 ℃过夜后离心取沉淀(8000 r/min,10 min),将沉淀复溶于同等体积的PBS 溶液中,用紫外可见分光光度计测定其A620、A650和A280。
1.2.4 藻蓝蛋白干粉的获取 将经0.15 mg/mL 壳聚糖溶液、50%饱和硫酸铵纯化后得到的藻蓝蛋白溶液装于截留分子量为8~10 kDa 的透析袋中脱盐3 d,透析后的溶液冷冻干燥获得藻蓝蛋白干粉。
1.2.5 藻蓝蛋白热致褪色机理研究 将藻蓝蛋白干粉溶于PBS 溶液配制浓度为0.5 mg/mL 的藻蓝蛋白溶液,将其分别于50、60、70、80、90 ℃水浴中热处理30 min 后立即冷却至常温,测定经热处理后藻蓝蛋白的色泽指标、UV-Vis 光谱、荧光发射光谱、FTIR 光谱、电位粒径及亚基分子量分布,未经热处理的藻蓝蛋白溶液作为空白对照。
1.2.5.1 色泽指标测定 将2 mL 藻蓝蛋白溶液加入24 孔板,孔板下面放空白A4 纸作为空白背景,在同一光源下用色度仪测定溶液的L*、a*、b*值。
1.2.5.2 UV-Vis 光谱测定 将1 mL 藻蓝蛋白溶液加入1 cm 石英比色皿,在200~800 nm 处扫描溶液的UV-Vis 光谱,并计算藻蓝蛋白溶液的色素保留率和Avis/Auv值,溶液测定前稀释3 倍。
1.2.5.3 荧光发射光谱测定 将1 mL 藻蓝蛋白溶液加入荧光比色皿,PMT 电压设置为700 V,激发波长和发射波长的狭缝宽度均为5 nm。其中测定藻蓝蛋白溶液内源荧光光谱的条件[16]为:Ex=295 nm,Em=310~400 nm;特征荧光发射光谱为:Ex=620 nm,Em=630~680 nm;溶液测定前稀释3 倍。
1.2.5.4 粒径和电位测定 样品测定前不稀释,溶质和溶剂折射率分别设为1.45 和1.33,在25 ℃的平衡温度下以自动模式测定藻蓝蛋白溶液的电位和粒径。
1.2.5.5 FTIR 光谱测定 将热处理后的藻蓝蛋白溶液冻干成粉,以质量比1:100 与KBr 混匀压片进行光谱测定。以溴化钾为采集背景,格式设置为%透过率,扫描次数为32,溴化钾使用前于120 ℃下烘干24 h。
1.2.5.6 SDS-PAGE 电泳测定 应用不连续电泳系统进行蛋白电泳,其中浓缩胶与分离胶的质量分数分别为5%和12%。样品上样20 μL,上样浓度1.5 mg/mL,开始电压恒定为80 V,Marker 分离后(约30 min)将电压调至120 V,样品跑到玻璃板接近底部时电泳结束。用铲子取胶放入平皿,倒入染色液染色2 h,脱色液过夜脱色。
1.2.6 藻蓝蛋白分析方法 藻蓝蛋白纯度级别的计算参照Herrera 等[17]的方法,藻蓝蛋白浓度以Soni 等[18]推荐的公式计算,而藻蓝蛋白色素保留率参考Jespersen 等[10]的方法计算,如下所示:


式中:P 为藻蓝蛋白纯度;[PC]为藻蓝蛋白浓度,mg/mL;V 为提取液体积,mL;k 为藻蓝蛋白提取液的稀释倍数;m 为藻粉质量,mg;ΔEab为相应温度下藻蓝蛋白溶液的总色差,为未经热处理的藻蓝蛋白溶液的色度值;A620(T)为经过相应温度处理30 min 后藻蓝蛋白溶液的A620,A620(0)为未经热处理的藻蓝蛋白溶液的A620。
1.3 数据处理
本研究中的所有实验均平行测定3 次,数值结果表示为平均值±标准偏差,所得数据用SPSS 22.0进行统计分析。
2 结果与分析
2.1 藻蓝蛋白提取条件优化
2.1.1 提取介质及介质浓度对藻蓝蛋白得率和纯度的影响 高压均质是一类通过高速剪切、碰撞及压力骤减等手段破环细胞壁以释放胞内分子的工业技术[19]。与反复冻融、超声破碎等传统破壁方法相比,高压均质具有效率高、易控制、便于工业扩大化等优势。提取介质及其浓度的大小关系到高压均质破壁效果,甚至与目标溶出物的稳定性相关。如图1 所示,尽管NaCl 溶液所提取的藻蓝蛋白纯度比氯化钙溶液低,但得率却是所有提取介质中最高的。刘立闯等[13]研究提取介质对于超声破碎溶出藻胆蛋白的影响时,发现NaCl 溶液在所用溶剂中也具有最高的蛋白溶出率,因此选择NaCl 溶液作为藻蓝蛋白的提取溶剂。

图1 提取介质对藻蓝蛋白得率和纯度的影响Fig.1 Effects of extraction medium on the yield and purity of phycocyanin
相对于其他提取介质而言,NaCl 溶液不但利于藻蓝蛋白的提取且能提高它在溶液中的稳定性,因此对于藻蓝蛋白的提取效率最高。但从图2 的结果可知,藻蓝蛋白得率随NaCl 浓度先升高后降低,与刘立闯等[13]所得到的趋势相一致。因此,NaCl 溶液的浓度不易过高,应选择0.04 mol/L 为宜。

图2 介质浓度对藻蓝蛋白得率和纯度的影响Fig.2 Effects of medium concentration on the yield and purity of phycocyanin
2.1.2 藻体浓度对藻蓝蛋白得率和纯度的影响 如图3 所示,藻蓝蛋白得率随藻体浓度的增加而缓慢增加,在2.0 mg/mL 时达到稳定。而藻蓝蛋白纯度随着藻体浓度的升高则明显增大,在2.0 mg/mL 时达到最大后呈现下降趋势,说明说明单位藻细胞可利用溶剂的减少能减少杂蛋白的溶出从而提高藻蓝蛋白纯度[20],但藻体浓度过大时同样会因此不利于藻蓝蛋白的溶出。因此,综合考虑藻蓝蛋白得率和纯度,2.0 mg/mL 为高压均质最适的藻体浓度。

图3 藻体浓度对藻蓝蛋白得率和纯度的影响Fig.3 Effects of algal concentration on the yield and purity of phycocyanin
2.1.3 均质压力对藻蓝蛋白得率和纯度的影响 均质压力直接影响着藻细胞破壁效果的好坏,压力过小会使藻细胞破壁效果差,压力过大则可能破坏目标蛋白的结构而使得率下降。由图4 可得,随着均质压力的升高,藻蓝蛋白的得率和纯度逐步增大,到80 MPa后趋于平缓。以上结果与陈裕[21]的研究结果较为一致,但藻蓝蛋白得率和纯度趋于稳定时的压力值不同,这可能是由于藻种及所用仪器差异引起的。因此,综合考虑藻蓝蛋白的纯度和得率,均质压力以80 MPa 为宜。

图4 均质压力对藻蓝蛋白得率和纯度的影响Fig.4 Effects of homogeneous pressure on the yield and purity of phycocyanin
2.1.4 均质时间对藻蓝蛋白得率和纯度的影响 如图5 所示,随着高压均质时间的延长,藻蓝蛋白纯度和得率逐渐趋于稳定。综合得率、纯度及操作成本考虑,高压均质的最适时间为7 min,所得的藻蓝蛋白纯度和得率分别可达到0.6950±0.0043 和10.5081%±0.0936%。

图5 均质时间对藻蓝蛋白得率和纯度的影响Fig.5 Effects of homogenization time on the yield and purity of phycocyanin
2.2 藻蓝蛋白粗提液纯化
2.2.1 壳聚糖浓度对藻蓝蛋白纯度和回收率的影响 壳聚糖是带有大量氨基基团的阳离子多糖,可以絮凝带负电的藻细胞及杂蛋白,从而达到蛋白纯化的目的[22]。从图6 可以看出,藻蓝蛋白回收率随着壳聚糖浓度的升高而逐步下降到24.96%,而藻蓝蛋白纯度则呈现先升后降的趋势且0.15 mg/mL 的壳聚糖下达到最高。当壳聚糖浓度大于0.20 mg/mL 时,壳聚糖分子数的增加使静电吸附增强而选择吸附性减弱[23],沉淀杂蛋白的同时也会大量沉淀藻蓝蛋白,导致藻蓝蛋白回收率和纯度均下降。因此,兼顾藻蓝蛋白纯度与得率,选择0.15 mg/mL 作为壳聚糖絮凝的合适浓度,此时藻蓝蛋白纯度可提高到1.2616±0.0183,回收率为88.2811%±1.2027%。

图6 壳聚糖浓度对藻蓝蛋白纯度和回收率的影响Fig.6 Effects of chitosan concentration on the purity and recovery of phycocyanin
2.2.2 硫酸铵饱和度对藻蓝蛋白纯度和回收率的影响 高浓度的中性盐能破坏蛋白质表面的水化层,从而使目标蛋白失稳从溶液中析出,达到纯化的目的。由图7 可得,当硫酸铵饱和度≥50%时,藻蓝蛋白回收率已逐步趋于稳定,而硫酸铵饱和度为50%时藻蓝蛋白纯度达到最大,因此综合考虑纯度和回收率,选择50%饱和硫酸铵用于藻蓝蛋白纯化,所得的藻蓝蛋白纯度和回收率分别可达到1.9084±0.2621 和80.66%±4.41%。
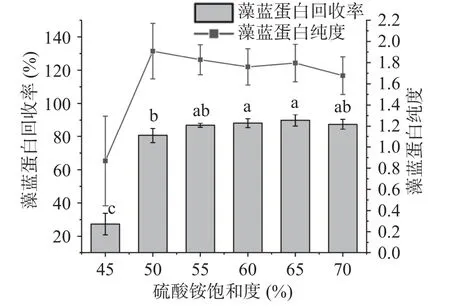
图7 硫酸铵饱和度对藻蓝蛋白纯度和回收率的影响Fig.7 Effects of ammonium sulfate saturation on the purity and recovery of phycocyanin
2.3 藻蓝蛋白热致褪色机理研究
2.3.1 色泽指标分析 如图8 的结果所示,随着加热温度升高,L*值、b*值逐步变大,即溶液颜色逐步由暗变亮、由蓝变黄,说明藻蓝蛋白的深蓝色泽随温度的升高而逐步消褪。在处理温度为50 ℃时,藻蓝蛋白溶液的b*值与未经热处理的无显著差异(P>0.05),且ΔEab很小。然而,当温度到达60 ℃时,b*值和ΔEab便开始显著增大,说明60 ℃可能是藻蓝蛋白溶液的蓝色大幅消褪的分界点。

图8 不同处理温度对藻蓝蛋白溶液L*,a*,b*值的影响Fig.8 Influence of different heating temperature on L*,a*,b *value of phycocyanin solution
2.3.2 UV-Vis 光谱分析 藻蓝蛋白的特征吸收峰波长在620 nm 左右,是蛋白质及其所连接的发色团所处状态的外在光谱性质体现,因此A620的变化可以用于表示色素保留率以及发色团结构的破坏程度[24-25]。如图9 所示,藻蓝蛋白色素保留率由50 ℃时的90.17%下降到60 ℃时的27.21%,导致藻蓝蛋白溶液在60 ℃时的b*值和ΔEab显著(P<0.05)增大。另外,当温度升至80 ℃时,藻蓝蛋白溶液的色素保留率相对于60 ℃时的保留率出现显著下降(P<0.05),说明80 ℃下藻蓝蛋白色泽消褪的程度可能进一步加深。

图9 不同处理温度对藻蓝蛋白色素保留率的影响Fig.9 Influence of different treatment temperatures on the retention rate of phycocyanin pigment
大部分蛋白质含有色氨酸、酪氨酸等芳香族氨基酸,因而在280 nm 处有特征吸收峰。如图10 所示,随着处理温度增加到60 ℃,280 nm 处的蛋白吸收峰消失,说明藻蓝蛋白有序三维结构在60 ℃下被破坏,从而将芳香族氨基酸埋藏得更深[26]。与此同时,游离藻蓝胆素发色团的360 nm 处特征吸收峰随280 nm 处吸收峰的消失而出现,这是因蛋白高级结构变性四吡咯发色团重排而引起的[27]。

图10 不同处理温度对藻蓝蛋白紫外可见光光谱的影响Fig.10 Influence of different treatment temperatures on the ultraviolet visible light spectra of phycocyanin
Avis/Auv是可见光区(~600 nm)最大吸收峰值与紫外区(~360 nm)最大吸收峰值之比,可作为四吡咯发色团构象的粗略度量[28]。由图11 的结果可知,当处理温度达到60 ℃时,Avis/Auv值由3.09(>>1,天然的线性构象)变为0.86(<1,游离的螺旋构象),说明发色团发生构象转变,即上述因蛋白结构变性引起的重排。区别于有序的化学变性,热处理同时影响藻蓝蛋白的发色团和蛋白质结构而引起褪色[29]。另外,从80 ℃起发色团的Avis/Auv值趋于稳定(P>0.05)且360 nm 处的吸收峰消失,这可能是80 ℃下形成的蛋白聚集体将四吡咯发色团包埋于其内的结果。

图11 不同处理温度对藻蓝蛋白溶液Avis/Auv 值的影响Fig.11 Influence of different heating temperature on Avis/Auv value of phycocyanin solution
2.3.3 荧光发射光谱分析 内源荧光的产生是由于藻蓝蛋白中色氨酸的荧光发射所引起的,与蛋白质的折叠结构状态密切相关[30]。内源荧光的蓝移或强度减小表明体系环境(含色氨酸)非极性增强,而色氨酸荧光的红移或强度增大则是氨基酸暴露于极性环境中的结果[31]。如图12 结果所示,随着温度升高,色氨酸的内源荧光强度下降且吸收峰波长蓝移,说明色氨酸所处环境非极性增强,藻蓝蛋白在60 ℃起由于有序三维结构的破坏而开始发生聚集。
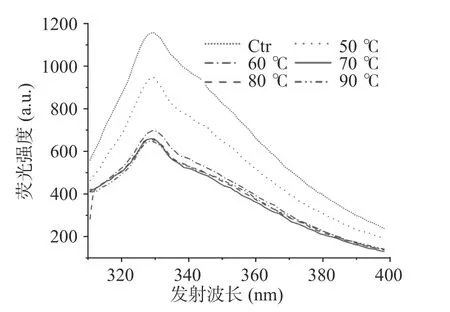
图12 不同处理温度对藻蓝蛋白内源性荧光发射光谱的影响Fig.12 Influence of different treatment temperatures on the endogenous fluorescence emission spectra of phycocyanin
藻蓝蛋白由于四吡咯发色团的存在,在620 nm处被激发后能发射出自身的特征性荧光。由图13可知,藻蓝蛋白特征荧光随温度的升高发生明显的蓝移和强度下降,60 ℃下以脱辅基蛋白有序三维结构为重要基础的藻蓝胆素荧光特性大幅减少,这与梁霄等[32]的结果一致。综合之前的结果,可以得出:在热处理时间为30 min 的前提下,60 ℃作为藻蓝蛋白蓝色色泽消褪的关键温度点;在此温度下,热处理引起的脱辅基蛋白有序的三维结构破坏导致依托于蛋白骨架的藻蓝胆素天然构象及光学性质遭到破坏,从而使溶液中有呈色活性的藻蓝蛋白分子大幅减少,藻蓝蛋白溶液的蓝色色泽因此大幅消褪。

图13 不同处理温度对藻蓝蛋白特征性荧光发射光谱的影响Fig.13 Influence of different treatment temperatures on the characteristic fluorescence emission spectra of phycocyanin
2.3.4 粒径和电位分析 如表1 所示,未经热处理的藻蓝蛋白无法测定出其平均粒径,与先前研究结果相一致[33-34],可能是藻蓝蛋白的水溶性大或是自身颜色干扰所引起的。50 ℃下的粒径同样无法测出,说明50 ℃下处理30 min 能较好保持藻蓝蛋白的天然状态;60 ℃下藻蓝蛋白由于蛋白结构破坏而趋于聚集,可以用于解释280 nm 左右吸收峰的消失;而80 ℃下藻蓝蛋白粒径显著增大(P<0.05),藻蓝蛋白进一步的聚集可能将游离四吡咯发色团包埋于蛋白质内部,使溶液的蓝色再度变浅,与2.3.2 的结果相印证。

表1 不同处理温度对藻蓝蛋白粒径及电位的影响Table 1 Influence of different treatment temperatures on particle size and potential of phycocyanin
2.3.5 FTIR 光谱分析 如图14 所示,藻蓝蛋白的红外特征吸收峰分别在3413、1654.47、1541.79、1399.25、1078.35 cm-1处,与文献[35]中报导的基本一致。未经热处理的藻蓝蛋白红外光谱上3413.43 cm-1的峰对应O-H 和N-H 基团的伸缩振动及带有氢键结合的仲胺基,该吸收峰在50 ℃下出现蓝移并随着热处理温度升高峰形逐步尖锐,与蛋白质分子相关的氢键作用加强有关[36]。而出现氢键作用加强的原因可能是蛋白质与水之间的氢键相互作用被蛋白质之间的氢键相互作用代替,表明蛋白质水化能力的降低及蛋白质聚集程度的增大[37]。1654.47 和1541.79 cm-1分别代表着蛋白质的酰胺Ⅰ带和酰胺Ⅱ带,对于蛋白质二级结构的变化十分敏感。代表α螺旋的1654.47 cm-1处尖锐峰在60 ℃后逐键变宽,表明藻蓝蛋白分子中主要二级结构的破坏。

图14 不同处理温度对藻蓝蛋白红外光谱的影响Fig.14 Influence of different treatment temperatures on the infrared spectra of phycocyanin
2.3.6 SDS-PAGE 电泳分析 如图15 所示,纯化后的聚球藻7002 的藻蓝蛋白由α、β两种亚基构成,这与之前的研究结果一致[38]。随着热处理温度的升高,α亚基的条带仍清晰可见,但β亚基的条带颜色却逐渐变淡,说明β亚基对于高温的热稳定性可能远不及α亚基。藻蓝蛋白单体(αβ)分子上共价结合着3 个四吡咯发色团,其中1 个结合在α亚基的84 位半胱氨酸残基上,而另外两个结合在β亚基的84、155 位半胱氨酸残基上[39],因此β亚基的破坏可能是藻蓝蛋白蓝色色泽严重消褪的主要原因之一。

图15 不同处理温度对藻蓝蛋白亚基分子量的影响Fig.15 Influence of different treatment temperatures on the molecular weight of phycocyanin subunits
3 结论
本研究以聚球藻 PCC7002 为原料,通过高压均质得到纯度为0.6950±0.0043 的藻蓝蛋白,得率为10.5081%±0.0936%;通过壳聚糖絮凝和硫酸铵盐析藻蓝蛋白纯度可提高到1.9084±0.2621,接近于工业级(A620/A280≥2.0)。本研究中藻蓝蛋白的提取纯化可为聚球藻藻蓝蛋白的开发提供一定的理论基础,促进对微藻资源的开发。
进一步地,本研究对聚球藻藻蓝蛋白在热处理过程中的褪色机理进行研究。从60 ℃起,热处理引起的脱辅基蛋白有序空间结构的破坏导致依托于蛋白骨架的藻蓝胆素天然构象发生转变、藻蓝蛋白紫外吸收和特征荧光明显下降,溶液中具备呈色活性的藻蓝蛋白分子因此大幅减少,藻蓝蛋白溶液的蓝色色泽大幅消褪;粒径分析结果进一步表明,藻蓝蛋白分子在60 ℃下开始聚集,80 ℃下更大程度的聚集可能使蛋白聚集体将四吡咯发色团包埋于其内,藻蓝蛋白色泽消褪的程度加深。另外,FTIR 光谱和SDSPAGE 揭示,热处理对藻蓝蛋白分子中β亚基的破坏程度远高于α亚基,且主要破坏的是藻蓝蛋白的主要二级结构α-螺旋。因此,保持藻蓝蛋白脱辅基蛋白结构的稳定或者至少保持藻蓝胆素发色团依托蛋白结构的稳定,是保证藻蓝蛋白在热处理过程中保持稳定蓝色色泽的关键因素所在。本研究对藻蓝蛋白护色措施的研究、藻蓝蛋白在食品工业中的应用提供了一定的理论基础,然而本研究对于热处理过程中藻蓝蛋白三聚体-单体水平的变化以及这种变化是否是藻蓝蛋白褪色的主要原因之一仍存在疑问,需要后续进一步的探讨。

