2个重组海带a-碳酸酐酶(CA)的酶活性比较研究
王 震, 毕燕会, 周志刚, 2
2个重组海带a-碳酸酐酶(CA)的酶活性比较研究
王 震1, 毕燕会1, 周志刚1, 2
(1. 上海海洋大学 水产遗传资源开发利用教育部重点实验室, 上海 201306; 2. 上海海洋大学 国家海洋生物科学国际联合研究中心, 上海 201306)
为了探究海带()a-CA1和a-CA2是否具有催化CO2的可逆水合反应和酯酶活性, 作者通过原核表达得到这两种a-CA的可溶性的异源重组蛋白。分别用电极法和酯酶活性检测法来检测重组a-CA1(ra-CA1)和ra-CA2的水合酶活性和酯酶活性, 结果发现, ra-CA1的水合酶活性(1.52±0.120 U/mg)几乎是ra-CA2(0.54±0.046 U/mg)的3倍, 表明ra-CA1催化CO2的水合能力明显大于ra-CA2。而两者的酯酶活性并没有显著的差别(ra-CA1比活力: 0.697±0.176 U/g, ra-CA2比活力: 0.743±0.129 U/g), 说明催化乙酸对硝基苯酯(-NPA)生成对硝基苯酚(-NP)的能力是没有显著差别的。实验结果证实这2个a-CA为功能蛋白, 可能参与海带无机碳吸收和储存过程, 因此, 本研究为海带无机碳吸收和储存机制的解析提供了生物化学依据。
海带();a-碳酸酐酶(CA); 原核表达; 水合酶活性; 酯酶活性
碳酸酐酶(carbonic anhydrase, CA; EC 4.2.1.1)是一种金属酶, 绝大多数是以锌(Zn)原子作为金属配合物, 催化CO2的可逆水合反应, 实现CO2与HCO3–之间的快速转化[1-3]。CA普遍存在于包括具有光合作用的所有生物中[4], 基于保守的核苷酸序列, CA目前被分为a、b、g、d、e、z、h、q和i9个亚型[5-11]。不同亚型CA序列没有相似性, 属于催化功能的趋同进化。
早在1967年, 在孔石莼()中首次检测到大型海藻的CA活性[12]。随后, 对不同海域150种海藻进行CA活性检测, 发现CA普遍存在于这些受检的海藻中[13]。但这些均是对藻体CA总活性或胞内及胞外CA总活性的报道, 尚无法完成CA家族单个成员在藻体内的活性检测。海带()是一种大型褐藻, 具有重要的经济和生态价值。通过对海带全长转录组分析, 目前认为海带CA家族具有11个成员, 分属a-、b-和g-CA亚型[14]。类似地, BI等[15]成功测得海带配子体的胞内及胞外CA总活性, 岳国峰等[16]报道胞外CA在海带孢子体无机碳吸收中起着主要作用。为深入研究各CA成员在海带无机碳吸收和储存中的作用, 通过分子细胞学手段, 余贞等[17]自海带配子体细胞中, 率先报道了第1个CA的基因特征; 随后, 利用胶体金免疫电镜手段, YE等[18]确定了a-CA1于海带配子体细胞的叶绿体中发挥作用; BI等[19]明确了a-CA2位于海带配子体细胞壁中; BI等[20]证实了γ-CA位于线粒体中。这些研究为海带无机碳富集机制解析提供了分子细胞学证据, 但具体各CA在海带内是否发挥功能, 还需对其活性进行鉴定。
基于YE等[18]和BI等[19]的研究结果, 本研究首先通过原核表达获得a-CA1和a-CA2的可溶性重组蛋白; 然后分离纯化可溶性的重组a-CA1和a-CA2, 利用电极法检测它们水合反应活性。鉴于a-CA还能催化羧酸酯[21]的水解反应, 利用分光光度法检测了它们的酯酶活性, 并探讨抑制剂AZ对重组a-CA酯酶活性的半抑制浓度(half maximal inhibitory concentration, IC50)。本研究的结果不仅从功能上鉴定了这2个海带a-CA基因, 也有助于进一步比较分析两者的生化特性, 为海带无机碳利用途径的解析奠定扎实的生物化学基础。
1 材料与方法
1.1 生物材料
在温度(17±1) ℃、光强40mmol photons/(m2·s)和光周期16 h/8 h(光照/黑暗)条件下[22], 将海带雌、雄配子体培养于PES培养基[23]中; 每2个星期更换1次培养基。将大肠杆菌()的DH5a感受态细胞及BL21(DE3)感受态细胞(天根生化科技(北京)有限公司)接种于Luria-Bertani(LB)培养基中。
1.2 RNA提取及cDNA合成
采用TRIzol试剂法(Clontech公司)抽提海带配子体总RNA, 利用反转录试剂盒(TaKaRa公司)对RNA进行反转录, 合成cDNA。具体操作参照各试剂盒的说明书进行。-20 ℃保存cDNA备用。
1.3 海带a-CA2原核表达载体的构建与转化
将BI等[19]已经建立并携带pET28a-aCA2表达载体的大肠杆菌, 通过目的基因的诱导表达和SDS- PAGE检测, 发现绝大部分重组的(recombinant)a- CA2(ra-CA2)是以包涵体的形式表达, 不利于后续的酶活性检测。因而, 本研究选择了表达载体pET- 32a(上海友科生物科技有限公司)来构建pET32a-aCA2。
根据pET-32a多克隆位点的碱基序列及a-CA2基因切去信号肽所对应的cDNA序列, 设计上游引物HEP-F(ggatccCAACGGCAGCGTGGACCCA, 小写字母为BamHI酶切识别位点)和下游引物HEP-R (ctcgagTCACACTATGTAAACGGCGCGCCCG, 小写字母为XhoI酶切识别位点)。用这对引物以合成的cDNA为模板进行PCR以扩增目的基因。反应程序为: 94 ℃预变性4 min; 94 ℃变性30 s, 66.7 ℃退火30 s, 72 ℃延伸2 min, 35个循环; 72 ℃延伸10 min。
PCR扩增结束后, 取20mL样品进行琼脂糖凝胶电泳检测。按照PCR产物纯化试剂盒(Aidlab公司)说明书纯化PCR产物, 将其连接至pMD19-T克隆载体(TaKaRa公司); 然后利用热激法转化入大肠杆菌DH5a感受态细胞, 用蓝白斑方法筛选阳性克隆; 通过菌液PCR进行重组子的鉴定, 并将挑取的阳性重组子送至生工生物工程(上海)股份有限公司进行基因的序列分析。
利用质粒提取试剂盒(天根生化科技(北京)有限公司)提取pMD19T-aCA2和表达质粒pET-32a, 并用限制性核酸内切酶BamHI和XhoI(TaKaRa公司)将这两种质粒于37 ℃分别进行双酶切反应4 h, 再将纯化的目的产物用T4连接酶连接, 得到含目的片段的重组表达质粒pET32a-aCA2。按上述同样方法经蓝白斑筛选和测序后, 利用热激法将测序正确并经双酶切验证的pET32a-aCA2转化大肠杆菌BL21 (DE3)感受态宿主细胞, 得到转基因株ET32a-aCA2/ BL21。将测序正确的菌液与20%的甘油以1︰1(v/v)的比例混匀, 冻存于-80 ℃冰箱备用。用pET-32a空载作阴性对照。
1.4 a-CA2重组蛋白的诱导表达与电泳检测
采用Ye等[18]的方法, 将携带重组表达质粒pET32a-aCA2和空载pET-32a的菌液分别接种于含Amp的LB液体培养基中, 先后进行活化、放大培养至菌液的OD600值为0.6~0.8, 添加终浓度为1.0 mmol/L的异丙基-b-D-硫代半乳糖苷(IPTG), 在37 ℃下、以180 r/min的转速诱导表达4 h后收集菌体, 用25 mL的1´磷酸缓冲液(PBS)(pH 8.0)重悬菌体。取50 μL重悬的全菌与2×蛋白上样缓冲液以1︰1的比例混合, 在液氮和30 ℃水浴锅中反复冻融3次并超声破碎至溶液透亮; 在4 ℃下、以14 000 r/min的转速离心5 min; 收集上清并用1´PBS按10︰1(菌液: 1´PBS)的比例重悬沉淀, 分别留样以用于十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶电泳(PAGE)的检测。
1.5 a-CA2重组蛋白的免疫印迹
鉴于ra-CA2是与表达质粒pET-32a中的聚His标签融合表达的, 因此可以利用商用的抗聚His标签的特异性抗体来进行Western印迹分析。按照陈晶等[24]的方法, 将全菌经SDS-PAGE后的蛋白转移至硝酸纤维素膜上, 以抗聚His标签抗体(上海友科生物科技有限公司)作为一抗, HRP标记的羊抗兔二抗作为二抗, 对融合表达的目的蛋白进行免疫印迹检测。最后按增强型HRP-DAB底物显色试剂盒(天根生化科技(北京)有限公司)的说明书显影, 并拍照记录。
1.6 a-CA2重组蛋白的纯化
收集转基因菌株pET32a-aCA2/BL21的沉淀和上清液, 经SDS-PAGE检测, 发现上清液和沉淀中都出现目的蛋白表达的条带。将上清液抽滤后, 按照Bio-ScaleTMMini ProfinityTMIMAC Cartridges蛋白亲和层析纯化预装柱(Bio-Rad公司)的说明书, 用含不同浓度咪唑的缓冲液(50 mmol/L KH2PO4、300 mmol/L KCl, pH 8.0)洗脱以纯化ra-CA2。
洗脱液经SDS-PAGE检测后, 收集含目的蛋白的部分。先用50倍体积的20 mmol/L Tris-HCl(pH=8.0) 4 ℃透析12 h; 再用50倍体积的去离子水透析12 h; 最后, 在4 ℃下用PEG-20000对样品进行浓缩并利用BRADFORD方法[25]测定其浓度, 4 ℃保存备用。
1.7 海带a-CA1重组蛋白的诱导表达和纯化
将YE等[18]已经建立并携带pET28a-aCA1表达载体的大肠杆菌, 按上述步骤经菌株活化、扩培、破碎和SDS-PAGE检测, 发现ra-CA1大部分以可溶性蛋白的形式表达在上清液中。因此, 可按上述亲和层析法, 从该转基因菌株的上清液中直接纯化目的蛋白, 用于后续酶活性的检测。
1.8 重组a-CA的CO2水合反应酶活性检测
根据Wilbur等[26]的电极法原理测定纯化后ra-CA的CO2水合酶活性。在预冷的4 mL巴比妥缓冲液(pH 8.4)中加入1 mL纯化后的重组蛋白溶液(1.216 mg/mL), 待pH计读数稳定在8.3后, 立即加入3 mL饱和的CO2水(将CO2通入到0 ℃的去离子H2O中, 持续通气1 h以上), 记录pH下降1个单位所需的时间, 整个反应过程的温度控制在0 ℃左右。以不加重组蛋白的为对照组, 测定下降一个pH单位所需要的时间, 每组3个重复, 将1个酶活性单位(U)定义为(0–)/[26]; 其中,0和代表分别代表不加酶液和加入酶液后pH下降1个单位所用的时间(min); 这样, ra-CA的比活力则以“(0-)//mg蛋白质”来计算。
1.9 重组a-CA酯酶活性的测定
a-CA能将乙酸对硝基苯酯(-NPA)水解成对硝基苯酚(-NP)[27]。本研究将0.2 mL 1×PBS溶液、0.6 mL的重组蛋白(0.533 mg/mL)与0.1 mL的-NPA迅速混合以构建酯酶反应体系, 并利用分光光度法立即记录下此时的OD405, 随后每隔3 min测1次OD405。以Tris-HCl缓冲液为对照, 根据对照组和实验组的OD405数值变化来检测ra-CA的酯酶活性, 每组3个重复。若1个酶活性单位(U)定义为在0 ℃下、每min产生1mmol的-NP[28], 那么, ra-CA的比活力即可用“(–0)×//g蛋白质”来计算; 其中、0分别代表加酶组和对照组产生的-NP浓度(mmol/mL),为总反应体积(mL),为反应时间(min)。反应体系中所产生的-NP可根据-NP浓度与OD405之间的标准曲线求得。
1.10 抑制剂AZ对重组a-CA酯酶活性的影响
在预实验的基础上, 本研究在上述酯酶反应体系中, 添加10、30、50、100、200、250及500mmol/L等不同梯度浓度的AZ, 然后每隔3 min记录在405 nm下的吸光度。最后按上述酯酶比活力的公式计算不同梯度浓度AZ处理后的ra-CA酶活性, 并计算相应的抑制率, 从而推算出IC50的抑制剂浓度。
2 结果与分析
2.1 pET32a-aCA2原核表达载体的构建
基于a-CA2的全长cDNA序列、pMD19-T及pET-32a多克隆位点的序列, 设计带酶切识别位点的引物HEP-F和HEP-R, 以海带配子体的cDNA为模板, 扩增到a-CA2的开放阅读框(ORF)序列, 连接至克隆质粒pMD19-T上以构建pMD19T-aCA2; 提取该质粒, 用BamHI和XhoI对其及表达质粒pET-32a分别进行双酶切反应, 连接目的片段以构建pET32a-aCA2。提取pET32a-aCA2, 经BamHI和XhoI的双酶切反应, 其产物经电泳检测, 只观察到目的基因大小(816 bp)和载体序列大小(5854 bp)的片段(图1泳道1); 目的基因的序列分析结果进一步表明, 已准确地将a-CA2插入至表达质粒pET-32a中。
2.2 ra-CA2的诱导表达、纯化和免疫印迹检测
将pET32a-aCA2转化大肠杆菌, 获得转基因细胞系。经放大培养并添加IPTG诱导培养后, 收集菌体, 反复冻融以破碎细胞, 提取分别得到上清液和沉淀中的蛋白, 经SDS-PAGE电泳, 发现上清液(图1泳道2)和沉淀(图1泳道3)中均出现目的蛋白的条带; 它的预测分子量大小为45.57 kD, 包含29.27 kD由目的基因编码的蛋白和15.3 kD由表达质粒pET-32a中His标签及多克隆位点碱基所编码的多肽。由于利用表达质粒pET-32a中的His标签融合表达目的蛋白, 因此, 可利用商业提供的抗聚His标签的抗体, 对转基因细胞系中的总蛋白进行Western免疫印迹。结果(图1泳道4)显示, 在目的蛋白大小处只出现单一条带的信号, 说明该处的重组蛋白中含有His标签; 印迹所对应的分子量大小约为45 kD, 与目的蛋白的预测分子量大小相符, 从而表明重组表达的就是目的基因2所编码的蛋白。

图1 a-CA2原核表达载体双酶切凝胶电泳图及重组a-CA2表达和纯化产物的SDS-PAGE与免疫印迹图谱
M1.DNA分子量标准; M2.预染蛋白质分子量标准; 泳道1. 重组表达质粒pET32a-aCA2的双酶切产物; 泳道2和3. 重组菌的上清液和沉淀部分; 泳道4. 重组菌的全菌蛋白; 泳道5-11. 经含5、10、50、100、150、200和250 mmol/L咪唑缓冲液洗脱的产物
M1.1 kb DNA Ladder Marker; M2.PageRulerTMPrestained Protein Ladder; Lane 1. Double enzyme digested products of the construct pET32a-aCA2; Lanes 2 and 3. supernatant and insoluble, respectively, fractions of the transformed bacteria; Lane 4. crude proteins of the transformed bacteria; Lanes from 5 through 11. the eluted products with a buffer solution containing 5, 10, 50, 100, 150, 200 and 250 mmol/L imidazole, respectively
利用Bio-ScaleTM Mini ProfinityTM IMAC Cartridges蛋白亲和层析纯化预装柱, 对自上清中提取的粗蛋白依次用含不同浓度咪唑的洗脱缓冲液来洗脱以纯化目的蛋白。其洗脱液经SDS-PAGE电泳和染色, 结果(图1泳道5-11)显示, 用含150 mmol/L咪唑的洗脱缓冲液洗脱下来的蛋白, 在目的蛋白大小处只显现一条带(图1泳道9)而无杂带。因此, 可以利用含150 mmol/L咪唑的洗脱缓冲液来纯化重组的a-CA2。
2.3 ra-CA1的诱导表达、纯化和免疫印迹检测
将YE等[18]已经建立并携带pET28a-aCA1表达载体的大肠杆菌, 按上述ra-CA2的方法进行诱导表达。全菌蛋白的电泳结果显示: 相对于未诱导表达的菌株(图2泳道1), 在约34 kD处出现一不同的条带(图2泳道2); 其大小与重组a-CA1大小(30.3 kD)及目的基因上游His标签和多克隆位点等碱基编码蛋白(2.2 kD)之和相近; 利用His标签抗体进行免疫印迹, 结果显示在目的蛋白大小处只出现一条印迹(图2泳道5); 这些结果均表明, 该条带即为目的蛋白条带。转基因菌株上清液及沉淀物的SDS凝胶电泳结果显示,a-CA1经诱导培养后主要表达在上清液中(图2泳道3)。按上述ra-CA2亲和层析的方法纯化ra-CA1; 不同浓度咪唑洗脱缓冲液的SDS凝胶电泳结果显示, 20 mmol/L咪唑的洗脱缓冲液有利于从上清液中纯化到ra-CA1(图2泳道9); 这样就可以利用含20 mmol/L咪唑的洗脱缓冲液来纯化重组的a-CA1。
2.4 ra-CA的CO2水合反应活性
利用上述经亲和层析纯化制备的ra-CA1和ra-CA2, 分别构建体外的CO2水合反应(即CO2+ H2O®HCO3–+H+)体系, 经电极法测定可知: 在不加ra-CA1的体系中, 需要约239 s的时间, pH才能自8.0下降到7.0; 但在加入ra-CA1的体系中, 只需要约84 s的时间, pH就下降到7.0; 从而表明ra-CA1具有加速CO2的水合反应能力。经计算可知, ra-CA1的水合反应比活力为1.52±0.120 U/mg蛋白(3次重复试验的平均值±标准差, 以下同, 图3)。同样, 检测结果表明, ra-CA2约需要140 s的时间, 使反应体系的pH下降1个单位; 经计算可知, ra-CA2的水合反应比活力为0.54±0.046 U/mg蛋白(图3), 极显著地低于ra-CA1的CO2水合酶活性(<0.01)。
2.5 ra-CA的酯酶水解活性
a-CA能将p-NPA水解成p-NP, 而后者在405 nm波长处具有特殊的吸收峰, 可用于p-NP的定量或定性分析。因此在a-CA酯酶活性检测之前, 需建立p-NP量与OD405之间的关系式。在预实验的基础上, 通过检测, 作者发现在0.05~6mmol/L的p-NP之间, OD405与p-NP的量呈现正比例的线性关系, 从而建立=0.015 9+0.017 9(2=0.980 7)。该方程式中的代表OD405,代表p-NP的浓度(mmol/L)。
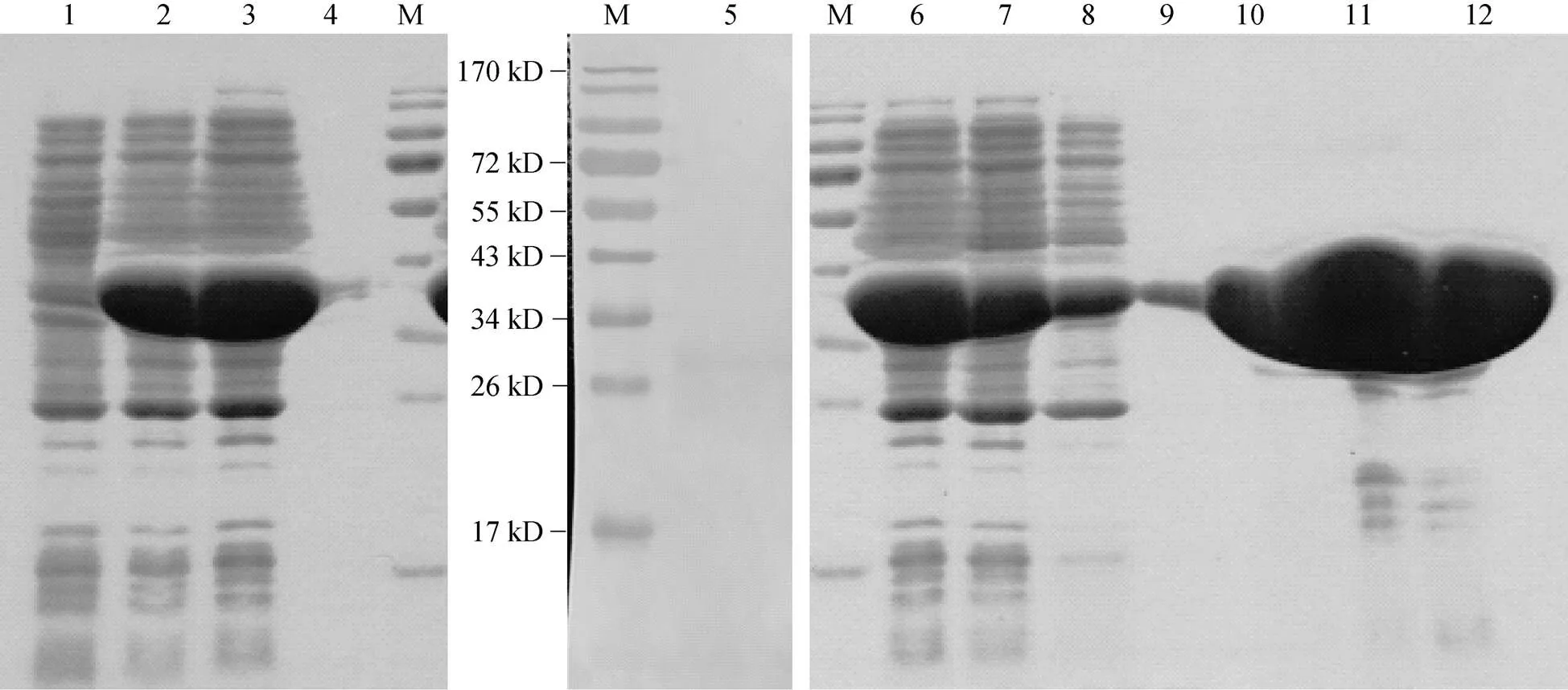
图2 ra-CA1表达和纯化产物的SDS-PAGE与免疫印迹图谱
M. 预染蛋白质分子量标准; 泳道1. 未经IPTG诱导培养的转基因菌株的全菌蛋白; 泳道2、5和6. 经IPTG诱导培养的转基因菌株的全菌蛋白; 泳道3和4. 重组菌株的上清液和沉淀部分; 泳道7. 流穿; 泳道8-12. 经含10、20、50、200和500 mmol/L咪唑缓冲液洗脱的产物
M. Prestained Protein Ladder; Lane 1: crude proteins expressed in the transgenic bacterium cultured without addition of IPTG; Lanes 2, 5 and 6. crude proteins expressed in the transgenic bacterium cultured with IPTG as an inducer; Lanes 3 and 4. soluble and insoluble fractions extracted from the transgenic bacterium after induced culture with addition of IPTG; Lane 7. Flow through; Lanes from 8 through 12. the eluted products with a buffer solution containing 10, 20, 50, 200 and 500 mmol/L imidazole, respectively

图3 ra-CA1和ra-CA2的CO2水合反应及p-NPA的酯酶水解活性
利用制备的ra-CA1和ra-CA2分别构建体外水解p-NPA的酯酶反应体系, 经分光光度计检测, 发现随着反应时间的延长, OD405值也会相应地增加, 说明加入的ra-CA能水解p-NPA, 使p-NPA逐渐水解从而生成p-NP。但在不添加重组蛋白的对照组中, 12 min时, OD405值就不再发生明显的变化, 表明此时这个反应体系几乎不产生新的p-NP。为此, 作者以12 min的反应时间来计算酶促反应的活性。
检测后经计算可知, ra-CA1的酯酶比活力为0.697±0.176 U/mg; ra-CA2的酯酶比活力为0.743±0.129 U/mg, 经统计分析, 二者差异不显著(>0.05)。
2.6 抑制剂AZ对ra-CA酯酶活性的影响
在上述建立的体外酯酶反应体系中添加不同浓度的抑制剂AZ来探究该抑制剂对ra-CA酯酶活性的影响, 结果表明当AZ的浓度增加到250mmol/L或500mmol/L, 反应体系中的OD405几乎不再发生显著变化, 说明此时两个重组a-CA的酯酶活性已接近完全被抑制(表1)。
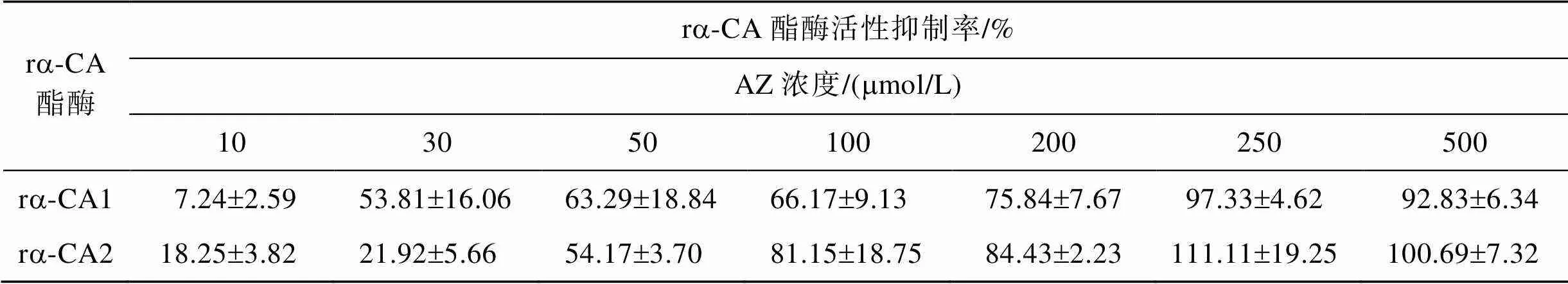
表1 不同浓度乙酰唑胺(AZ)对ra-CA酯酶活性的抑制率
利用SigmaPlot 4.0软件对表1的数据进行非线性回归, 从而计算出ra-CA1的IC50=30.2mmol/L, ra-CA2的IC50=53.6mmol/L。由此可以看出ra-CA1对AZ的敏感度明显高于ra-CA2。
3 讨论
本研究根据已报道的海带配子体a-CA1和a-CA2的cDNA序列[18, 19], 利用原核表达技术, 在大肠杆菌中异源表达了这两个a-CA的可溶性蛋白, 经亲和柱层析纯化并利用纯化的ra-CA构建了体外CO2水合反应的体系, 利用电极法检测了它们的水合反应活性, 这不仅从功能上鉴定了这两个基因, 也有助于进行两者的功能比较并分析它们可能的生物学作用。
本研究的结果指出, 海带ra-CA2的水合反应比活力为1.52 U/mg蛋白, 而ra-CA2的为0.54 U/mg蛋白(图3)。两者的水合反应比活力, 虽然明显低于衣藻周质b-CA(比活力为4.2 U/mg)[29]和三角褐指藻()类囊体腔q-CA(比活力为30.9 U/mg)[10], 但却高于自生长于南极冰中一种衣藻(sp. ICE-L)以及绿潮藻浒苔()经异源重组的a-CA(比活力分别为0.437 和0.267 U/mg)[30, 31]。至于酯酶活性, 海带ra- CA与南极冰中那种衣藻(sp. ICE-L) (0.319 U/mg[30])的结果相近。
值得指出的是, 本研究所检测的酶活性是携带His标签的融合蛋白, 而非海带配子体的天然a-CA。尽管His标签的分子量小, 对目标蛋白的酶活性及结构等的负面影响较小[32], 但越来越多的研究[33]表明,它的负面影响不容忽视。同时, 在ra-CA的纯化过程中, 作者使用了IMAC蛋白亲和层析纯化预装柱(即Ni柱); 在此过程中,a-CA的金属辅基Zn2+有可能被Ni柱中的氨三乙酸吸附[34]。另外, 人类a-CA的催化作用机理是目前研究最透彻的, 作者将海带的a-CA氨基酸序列与人类水合反应活性很高(a-CAII)、中等(a-CAI)及很低(a-CAIII)的3个a-CA[35]作比较, 发现, 海带的a-CA1和a-CA2均与人类水合反应活性很低的a-CAIII的氨基酸序列最接近, 一致性和相似性分别为27.57%和44.40%, 及28.52%和43.35%。这些都可能是导致海带ra-CA催化活性较低的原因。因此, 若进行海带a-CA的酶促反应动力学研究, 建议使用分离纯化的天然蛋白或将融合表达蛋白的标签利用蛋白酶除去。
岳国峰等[16]曾利用AZ处理海带雌配子体细胞, 发现培养液的pH与对照之间没有发生显著变化, 说明没有胞外CA参与无机碳的吸收; 但最近BI等[15]自海带配子体中检测到胞外CA的活性。据BI等[19]报道,a-CA2因位于配子体细胞的周质空间发挥作用, 因而属于胞外CA。本研究自重组的a-CA2中检测到酶活性, 不仅支持了海带配子体胞外CA具有生物学活性的观点[15], 也表明a-CA2应对海带配子体胞外CA的活性作出较大的贡献。鉴于衣藻()[2]、硅藻(,)[3]及高等植物[36]的细胞中都存在不同类型的胞外CA, 作者推测海带配子体细胞也可能存在着其他类型但目前尚未知的胞外CA, 它们的共同作用, 才能使配子体细胞的胞外CA活性达到33.92 U/g鲜质量[15]。
同样, 通过本研究还可以了解到,a-CA1应是海带配子体胞内CA的活性[15]的主要贡献者, 因为a-CA1位于配子体细胞的叶绿体中[18]; 但位于线粒体的g-CA[20]的贡献也不能被忽视。这样才能使海带配子体细胞胞内CA的活性达到36.83 U/g鲜质量[15]。但这些胞内、胞外CA与海带配子体细胞吸收和利用无机碳之间存在着什么关系, 有待进一步揭示。
[1] Cannon G C, Heinhorst S, Kerfeld C A. Carboxysomal carbonic anhydrases: Structure and role in microbial CO2fixation[J]. Biochimica et Biophysica Acta, 2010, 1804(2): 382-392.
[2] Moroney J V, Ma Y, Frey W D, et al. The carbonic anhydrase isoforms of: intracellular location, expression, and physiological roles[J]. Photosynth Res, 2011, 109(1/3): 133-149.
[3] Hopkinson B M, Dupont C L, Matsuda Y. The physiology and genetics of CO2concentrating mechanisms in model diatoms[J]. Current Opinion in Plant Biology, 2016, 31: 51-57.
[4] Badger M R, Price G D. The role of carbonic anhydrase in photosynthesis[J]. Annu Rev Plant Biol, 1994, 45(1): 369-392.
[5] Hewett-Emmett D, Tashian R E. Functional diversity, conservation, and convergence in the evolution of the α-, β-, andg-carbonic anhydrase gene families[J]. Molecular Phylogenetics and Evolution, 1996, 5(1): 50-77.
[6] Lee R B Y, Smith J A C, Rickaby R E M. Cloning, expression and characterization of thed-carbonic anhydrase of()[J]. Journal of Phycology, 2013, 49(1): 170-177.
[7] So A K C, Espie G S, Williams E B, et al. A novel evolutionary lineage of carbonic anhydrase (eclass) is a component of the carboxysome shell[J]. Journal of Bacteriology, 2004, 186(3): 623-630.
[8] Lane T W, Saito M A, George G N, et al. A cadmium enzyme from a marine diatom[J]. Nature, 2005, 435(7038): 42.
[9] Del Prete S, Vullo D, Fisher G M, et al. Discovery of a new family of carbonic anhydrases in the malaria pathogen–theh-carbonic anhydrases[J]. Bioorganic & Medicinal Chemistry Letters, 2014, 24(18): 4389-4396.
[10] Kikutani S, Nakajima K, Nagasato C, et al. Thylakoid luminalq-carbonic anhydrase critical for growth and photosynthesis in the marine diatom[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(35): 9828-9833.
[11] Jensen E L, Clement R, Kosta A, et al. A new widespread subclass of carbonic anhydrase in marine phytoplankton[J]. ISME Journal, 2019, 13(8): 2094- 2106.
[12] Ikemori M, Nishida K. Carbonic anhydrase in the marine alga[J]. Physiologia Plantarum, 1968, 21(2): 292-297.
[13] 毕燕会, 卫宁宁, 李佳莉, 等. 碳酸酐酶(CA)在大型海洋褐藻获取与利用无机碳过程中的作用[J]. 生命科学, 2019, 31(3): 296-309.
BI Yanhui, WEI Ningning, LI Jiali, et al.The role of carbonic anhydrase in inorganic carbon acquisition and utilization by brown seaweeds[J]. Chinese Bulletin of Life Sciences, 2019, 31(3): 296-309.
[14] Bi Y H, Li J L, Zhou Z G. Full-length mRNA sequencing inand identification of carbonic anhydrase genes[J]. Aquaculture and Fisheries, 2019, 4(2): 53-60.
[15] Bi Y H, LIANG C L, Li J L, et al. Effects of inorganic carbon concentration and pH on carbonic anhydrase activity of gametophytes of[J]. Aquaculture and Fisheries, 2021, 6(1): 51-55.
[16] 岳国峰, 王金霞, 王建飞, 等, 海带幼孢子体的光合碳利用[J]. 海洋与湖沼, 2001, 32(6): 647-652.
YUE Guofeng, WANG Jinxia, WANG Jianfei, et al. Inorganic carbon acquisition by juvenile sporophyte of()[J]. Oceanologia et Limnologia Sinica, 2001, 32(6): 647-652.
[17] 余贞, 毕燕会, 周志刚. 海带配子体碳酸酐酶(CA)基因的克隆及其特征分[J]. 水产学报, 2011, 35(9): 1343- 1353.
YU Zhen, BI Yanhui, ZHOU Zhigang. Cloning and characterization of carbonic anhydrase (CA) gene fromgametophytes[J]. Journal of Fisheries of China, 2011, 35(9): 1343-1353.
[18] YE R X, YU Z, SHI W W, et al. Characterization ofa- type carbonic anhydrase (CA) gene and subcellular localization ofa-CA in the gametophytes of[J]. Journal of Applied Phycology, 2014, 26(2): 881-890.
[19] Bi Y H, Qiao Y M, Wang Z, et al. Identification and characterization of a periplasmica-carbonic anhydrase (CA) in the gametophytes of(Phaeophyceae)[J]. Journal of Phycology, 2021, 57(1): 295-310.
[20] Bi Y H, Du A Y, Li J L, et al. Isolation and characterization of ag-carbonic anhydrase localized in the mitochondria of[J]. Chemosphere, 2021, 266: 129162.
[21] Pocker Y, Stone J T. The catalytic versatility of erythrocyte carbonic anhydrase. III. Kinetic studies of the enzyme-catalyzed hydrolysis of p-nitrophenyl acetate[J]. Biochemistry, 1967, 6(3): 668-678.
[22] 周志刚, 吴超元. 海带无性繁殖系的形成及孢子体诱导[J]. 生物工程学报, 1998, 14(1): 109-111.
ZHOU Zhigang, Wu Chaoyuan. Clone culture ofand induction of its sporophytes[J]. Chinese Journal of Biotechnology, 1998, 14(1): 109-111.
[23] Starr R C, Zeikus J A. UTEX-The culture collection of algae at the University of Texas at Austin 1993 list of cultures[J]. Journal of Phycology, 1993, 29(S2): 1-106.
[24] 陈晶, 王丽丽, 石微微, 等. 海带配子体中孢子形成相关蛋白(SRP)基因的克隆及其原核表达[J]. 水产学报, 2010, 34(8): 1165-1173.
Chen Jing, WANG Lili, SHI Weiwei, et al. Cloning of srp gene from the gametophytes ofand its expression in[J]. Journal of Fisheries of China, 2010, 34(8): 1165-1173.
[25] Bradford M M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254.
[26] Wilbur K M, Anderson N G. Electrometric and colorimetric determination of carbonic anhydrase[J]. Journal of Biological Chemistry, 1948, 176(1): 147- 154.
[27] Verpoorte J A, Mehta S, Edsall J T. Esterase activities of human carbonic anhydrases B and C[J]. Journal of Biological Chemistry, 1967, 242(18): 4221- 4229.
[28] Bhakta A, Bandyopadhyay M, Dasgupta S, et al. Effect of NaHS on carbonic anhydrase activity of human erythrocyte[J]. Asian Journal of Medical Sciences, 2016, 7(3): 23-27.
[29] Ynalvez R A, Xiao Y, Ward A S, et al. Identification and characterization of two closely relatedb- carbonic anhydrases from[J]. Physiologia Plantarum, 2008, 133(1): 15-26.
[30] Qu C, He Y, Zheng Z, et al. Cloning, expression analysis and enzyme activity assays of the α-carbonic anhydrase gene fromsp. ICE-L[J]. Molecular Biotechnology, 2018, 60(1): 21-30.
[31] Wang Y, Liu F, Wang M, et al. Characterization and transcriptional analysis of one carbonic anhydrase gene in the green-tide-forming algaa ()[J]. Phycological Research, 2020, 68(1): 90-97.
[32] Porath J. Immobilized metal ion affinity chromatography[J]. Protein Expression and Purification, 1992, 3(4): 263-281.
[33] Arnau J, Lauritzen C, Petersen G E, et al. Current strategies for the use of affinity tags and tag removal for the purification of recombinant proteins[J]. Protein Expression and Purification, 2006, 48(1): 1-13.
[34] Terpe K. Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems[J]. Applied Microbiology and Biotechnology, 2003, 60(5): 523-533.
[35] Supuran C T, Scozzafava A, Casini A. Carbonic anhydrase inhibitors[J]. Medicinal Research Reviews, 2003, 23(2): 146-189.
[36] DiMario R J, Clayton H, Mukherjee A, et al. Plant carbonic anhydrases: structures, locations, evolution, and physiological roles[J]. Molecular Plant, 2017, 10(1): 30-46.
Comparative analysis of enzyme activities of two recombinanta-carbonic anhydrases (a-CAs) of
WANG Zhen1, BI Yan-hui1, ZHOU Zhi-gang1, 2
(1. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources Conferred by Ministry of Education, Shanghai Ocean University, Shanghai 201306, China; 2. International Research Center for Marine Biosciences Conferred by Ministry of Science and Technology, Shanghai 201306, China)
In order to explore whether the two reported alpha carbonic anhydrases (a-CA1 anda-CA2) ofwere active, the soluble recombinant proteins of them expressed inwere obtained. After purification, the hydratase activity as well as esterase activity of the two recombinanta-CAs (ra-CA1 and ra-CA2) were detected. The results showed that the hydratase activity of ra-CA1 (1.52±0.120 U/mg) was almost three times higher than that of ra-CA2 (0.54±0.046 U/mg), indicating that ra-CA1exibited much higher catalytic activity for CO2hydration than ra-CA2. There was no significant difference between the esterase activities of ra-CA1 (0.697±0.176 U/g) and ra-CA2 (0.743±0.129 U/g), indicating that there was no significant difference between the two ra-CAs in catalyzing the conversion of p-nitrophenyl acetate (p-NPA) to p-nitrophenol (p-NP). The results confirmed that these twoa-CAs were functional proteins, and might participate in the process of inorganic carbon absorption and storage in. This study provided biochemical proofs for the CO2concentrating mechanism of this kelp.
;a-carbonic anhydrase (CA); procaryotic expression; hydration activity; esterase activity
Jan. 5, 2022
[National Natural Science Foundation of China, No. 41376136; The National Key R & D Program of China, No. 2018YFD0901500]
S968.31
A
1000-3096(2022)07-0061-09
10.11759/hykx20220105001
2022-01-05;
2022-02-23
国家自然科学基金项目(41376136); 国家重点研发计划项目(2018YFD0901500)
王震(1990—), 男, 山东菏泽人, 硕士研究生, 主要从事藻类生物技术研究, E-mail: 740352930@qq.com; 周志刚(1964—),通信作者, E-mail: zgzhou@shou.edu.cn
(本文编辑: 谭雪静)

