链状裸甲藻赤潮消亡过程及其与休眠包囊关系的初步研究
李光毅 ,刘保清 ,邱勇,黄龙展 ,陈竞武
( 1.泉州师范学院 海洋与食品学院 福建省海洋藻类活性物质制备与功能开发重点实验室/近海资源生物技术福建省高校重点实验室,福建 泉州 362131;2.国家海洋局厦门海洋环境监测中心站,福建 厦门 361008;3.泉州海洋环境监测预报中心,福建 泉州 362131)
1 引言
赤潮是由海水中某些浮游植物、原生动物或细菌在一定环境条件下,短时间内暴发性增殖或聚集而引起的一种水体变色的有害生态异常现象[1]。近年来,由于近岸海域污染不断加剧,水体富营养化程度日趋严重,赤潮发生的频率和危害程度明显上升,尤其是有毒甲藻赤潮有增多的趋势[2-3]。赤潮的发生是气象、水文、化学、物理和生物等因素耦合作用的结果,具体的发生机制仍未研究清楚[4-5]。
链状裸甲藻(Gymnodinium catenatum)隶属于甲藻门裸甲藻属,属于广温广盐种,主要分布在西班牙、日本、澳大利亚和美国等,同时也是我国常见的赤潮种之一,其包囊在我国沿海分布广泛[6-7]。链状裸甲藻可产生麻痹性贝毒(Paralytic Shelfish Poisoning, PSP),严重危害水产养殖业和人类健康。迄今为止,我国已多次发生链状裸甲藻赤潮,如2017年在福建漳州和泉州暴发了大规模链状裸甲藻赤潮,造成严重的PSP中毒事件和经济损失[8]。
泉州湾位于福建省东南部沿海,北起惠安县的崇武半岛,南至石狮市的祥芝角,湾口向东敞开,湾口中部有大、小坠岛横亘其间,属于开敞式海湾。泉州湾是晋江和洛阳江的入海口,两江带来大量有机物和营养盐,加上沿岸工业废水、生活污水和养殖废水的污染,致使泉州湾水体富营养化严重[9]。2018年6月中旬,泉州湾海域发生了一次小规模链状裸甲藻赤潮,本文根据此次链状裸甲藻赤潮消亡期间的浮游植物与环境资料,重点探讨了赤潮消亡期间监测海域的生态环境特征,同时对该海域的甲藻包囊进行调查,以期了解赤潮与休眠包囊的关系,也为赤潮的生态环境研究和海洋环境管理部门开展赤潮监测和预测提供科学依据。
2 材料与方法
2.1 调查时间与地点
本文在泉州湾赤潮发生海域设置4个调查站位,调查站位详见图1。在赤潮发生期间(2018年6月10−14日)进行连续监测(每日上午 9−10点采样1次),赤潮完全消失后(2018年7月4日)监测1次,合计进行6次海水水质和浮游植物调查。甲藻包囊的调查时间为2018年6月14日、2018年7月4日、2019年2月23日和2019年5月8日,调查站位同上。

图1 监测站位Fig.1 Monitoring stations
2.2 调查方法
浮游植物调查:用有机玻璃采水器采集表层水样1 L,用Lugol’s溶液固定,带回实验室,静置沉淀48 h后,用虹吸管吸去上清液,浓缩至10~100 mL(浓缩的最终体积视浮游植物细胞密度而定)。使用Olympus BX41显微镜进行种类鉴定和细胞计数,每个样品计数3遍,取其平均值。
海水水质调查:采用Cond3210型电导率仪和pH3210型酸度计现场测定各站位表层海水的水温、盐度和pH。采集表层海水,经处理后带回实验室进行溶解氧(Dissolved Oxygen, DO)浓度、化学需氧量(Chemical Oxygen Demand, COD)和营养盐浓度分析测定,水样的采集、现场处理和分析测定均按《海洋调查规范》(GB/T 12763-2007)[10]和《海洋监测规范》(GB 17378-2007)[11]中规定的方法进行。
甲藻包囊调查:用QNC7-1型抓斗式采泥器采集表层沉积物,每个站位采集3次,取3份沉积物样品的上表层(0~2 cm)充分混合,用塑封袋密封,放入4℃冰箱中避光保存,直至带回实验室进行分析。
包囊样品处理:取适量沉积物样品分成两份,一份(约5 g)置于70℃烘箱中烘24 h以上直至恒重,测定沉积物含水率;另一份(约5 g)用灭菌过滤海水稀释后超声波处理2 min,依次通过孔径为125 μm和20 μm尼龙筛网,此步骤重复多次,直至获得较为清澈的过滤液,收集20 μm尼龙筛网的沉积物样品,定容至10 mL,然后加入5%中性福尔马林固定。每份包囊样品重复观察3次,取其平均值。包囊密度以每克干重沉积物中的包囊数表示(cysts/g)。包囊鉴定主要参照文献[12-16]。
2.3 水质评价方法
使用富营养化指数(E)法评价海域的富营养化程度,计算公式为
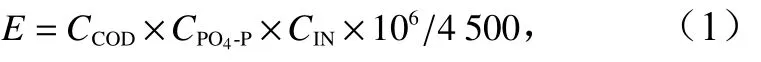
式中,CCOD为化学需氧量(单位:mg/L);CIN为无机氮浓度(单位:mg/L);CPO4-P为活性磷酸盐浓度(单位:mg/L)。当E<1时,水体为贫营养水平;当E≥1时,水体呈富营养化。E值越大,水体的富营养化程度越高。
2.4 数据处理与分析
采用Excel 2020软件,对原始数据进行处理;采用SPSS 19.0软件,分析各要素间的差异性和相关性;采用Origin 8.5软件进行绘图。
3 结果
3.1 赤潮演化过程
2018年6月10 −12日在泉州湾海域发生了小规模链状裸甲藻赤潮,水体呈褐色,面积约为2 km2。6月13日赤潮开始消退,水色开始恢复正常,6月14日赤潮完全消失。
链状裸甲藻有游泳单细胞和链状群体两种,该种一般为链状群体,大多数细胞链由2~16个细胞组成,最多可达到64个。单细胞和链状群体末端的细胞(细胞长为 34~41 μm,宽为 27~33 μm)倾向于锥形尖端,而链中的细胞(长为 23~33 μm,宽为 27~36 μm)向后扁平。细胞横沟较深,在细胞长度的1/5~1/3处呈左向位移,纵沟窄而深,延伸至上锥体和下锥体[17]。本次赤潮水样中,4~16个细胞链的链状裸甲藻占主导地位(图2b)。
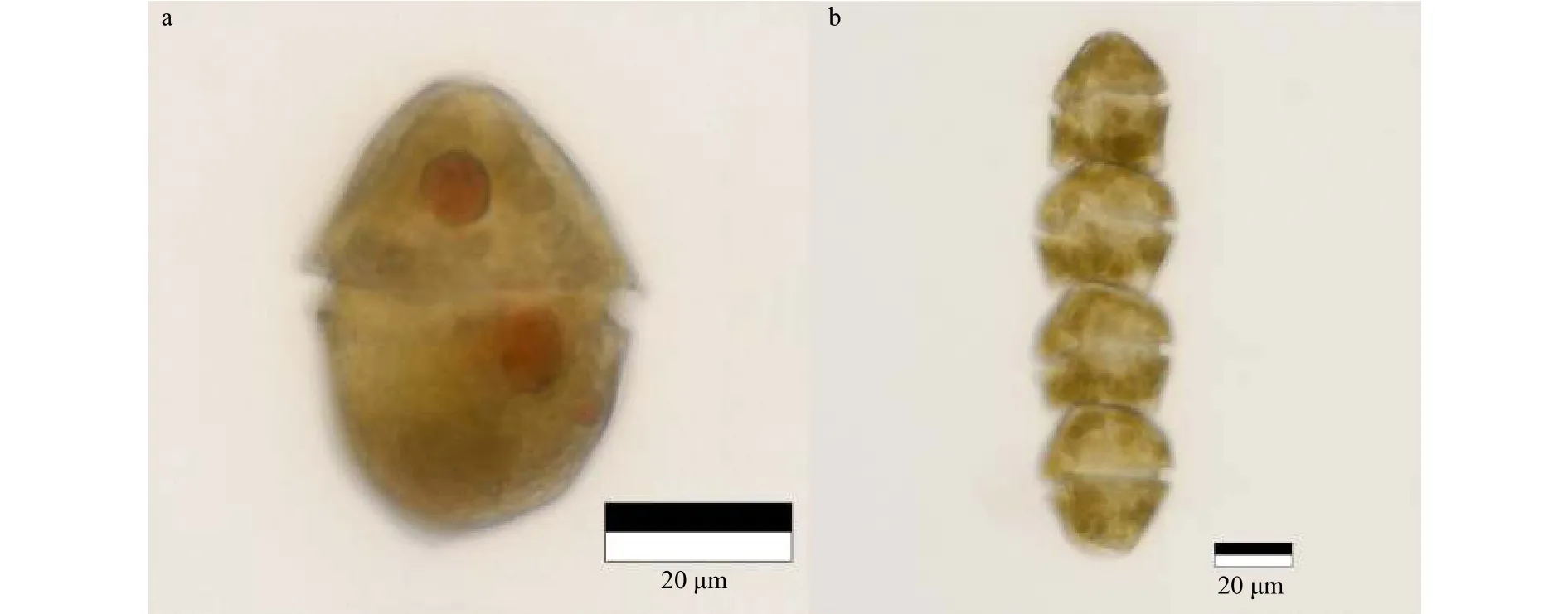
图2 链状裸甲藻单细胞(a)及链状群体(b)Fig.2 Gymnodinium catenatum monoplast (a) and catenoid colony (b)
3.2 赤潮发生期间海水环境因子状况
3.2.1 海水水化因子
根据国家海洋局崇武海洋环境监测站在泉州湾海域的历史监测资料表明,以往6月份监测海域水温变化范围为25.2~27.9℃,盐度变化范围为28.6~29.8。由图3可知,2018年6月赤潮发生期间,水温变化范围为 27.1~28.2℃,平均水温为(27.6±0.4)℃,盐度介于29.7~31.4之间,平均为30.8±0.8。在整个赤潮的消亡过程中,水温和盐度均发生了显著变化(p<0.05)。

图3 赤潮期间水温和盐度的变化Fig.3 Variations of temperature and salinity during red tide
由图4可知,赤潮发生期间,pH和DO浓度均发生显著变化(p<0.05)。pH 变化范围为 8.11~8.49,平均为8.30±0.13;DO浓度变化范围为6.66~14.17 mg/L,平均为(10.12±3.04)mg/L,在赤潮消亡前期,DO 的饱和度均在150%以上,最高值达到220%。pH和DO浓度的最高值均出现在6月12日,到6月14日达到最低值,赤潮消亡后期,pH和DO浓度急剧下降,并在7月4日恢复至正常水平。

图4 赤潮期间pH和DO浓度的变化Fig.4 Variations of pH and DO concentration during red tide
3.2.2 海水营养盐变化
监测期间,研究海域无机氮和活性磷酸盐浓度随着赤潮消亡的过程发生显著变化(p<0.05)。活性磷酸盐浓度在监测期间变化范围是未检出至0.045 4 mg/L,其中6月11日未检出,而6月12日出现最高值,高达0.045 4 mg/L,劣于第四类海水水质标准,但是富营养化指数E<1,表明监测海域未达到富营养化水平(图5)。

图5 赤潮期间活性磷酸盐(PO4-P)浓度的变化Fig.5 Variations of active phosphate (PO4-P) concentration during red tide
无机氮浓度在监测期间变化范围为0.050~0.281 mg/L(p<0.05),平均为(0.186±0.09)mg/L,均符合第二类海水水质标准,其中最高值出现在6月11日,最低值则出现在6月12日。通过对海水中无机氮组成进行分析,结果表明随着赤潮的消亡过程,海水中无机氮组成结构发生显著变化(p<0.05),、和的浓度变化范围分别为0.011~0.168 mg/L、0.025~0.054 mg/L和 0.002~0.226 mg/L,和分别在6月12日和6月11日占主要优势,其他时间均以为主(图6)。

图6 赤潮期间无机氮浓度的变化Fig.6 Variations of inorganic nitrogen concentration during red tide
3.3 浮游植物和甲藻包囊种类组成
监测期间采集的海水样品经鉴定,共有浮游植物3门48属100种,其中硅藻门种类最为丰富,共35属80种,占总种类数的80%,甲藻门12属19种,占19%,蓝藻门1属1种,占1%。硅藻门中角毛藻属种类数最多,共有13种,其次是根管藻属、圆筛藻属和斜纹藻属,分别有8种、7种和6种;甲藻门中原甲藻属、原多甲藻属和角藻属种类数较多;6月11日和12日在个别站位中检出了蓝藻门的汉氏束毛藻(Trichodesmium hildebrandtii)。本次调查共鉴定赤潮藻类58种,占总种类数的58%,其中硅藻门38种,鉴定出的19种甲藻和1种蓝藻均为赤潮藻类。
4个航次中共鉴定出甲藻包囊5大类37种和1种未定种,其中原多甲藻类包囊种类数最多,共有19种,占总种类数的50.0%;膝沟藻类包囊7种,占18.4%;裸甲藻类包囊5种,占13.2%;翼甲藻类和钙质类包囊分别为4种和2种,各占10.5%和5.3%。从甲藻的营养类型来看,以异养型甲藻包囊为主,共25种,自养型甲藻包囊则为12种,详见图7。
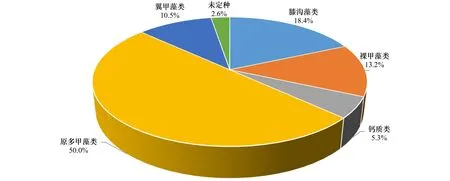
图7 泉州湾海域甲藻包囊种类组成Fig.7 Species composition of dinoflagellate cysts in the Quanzhou Bay
3.4 种类数
由图8可知,监测海域赤潮发生期间浮游植物种类数介于27~69种之间,其中6月12日最高,6月11日最低。在赤潮消亡前期(6月10−11日),甲藻门和硅藻门种类数较低,赤潮消亡中后期(6月12−14日),甲藻和硅藻种类数明显升高,6月12日甲藻和硅藻种类数均达到最高(17种和51种);7月4日则在监测海域鉴定出3种甲藻和35种硅藻。

图8 赤潮期间浮游植物种类数的变化Fig.8 Variations of phytoplankton species during red tide
3.5 细胞密度
监测结果显示(图9),6月10−12日链状裸甲藻在浮游植物群落中占绝对优势,细胞密度均在106cells/L以上,占到浮游植物细胞总数的80.4%~98.4%,6月10日细胞密度最高,达到(7.02±0.11)×106cells/L。由于链状裸甲藻在赤潮消亡前期数量极高,因此甲藻在赤潮消亡前期占绝对优势,其他甲藻仅锥状斯克里普藻(Scrippsiella trochoidea)细胞密度较高,介于8.67×103~1.69×104cells/L 之间,而夜光藻(Noctiluca scintillans)、海洋原甲藻(Prorocentrum micans)和塔玛亚历山大藻(Alexandrium tamarense)等甲藻密度较低,均在103cells/L以下。6月13−14日链状裸甲藻细胞密度急剧下降,仅占细胞总数的41.7%和11.9%,细胞密度最低仅为(5.10±0.42)×104cells/L,优势类群已经变为硅藻(比率为87.8%)。在赤潮完全消退20 d后,7月4日监测海域未发现链状裸甲藻。
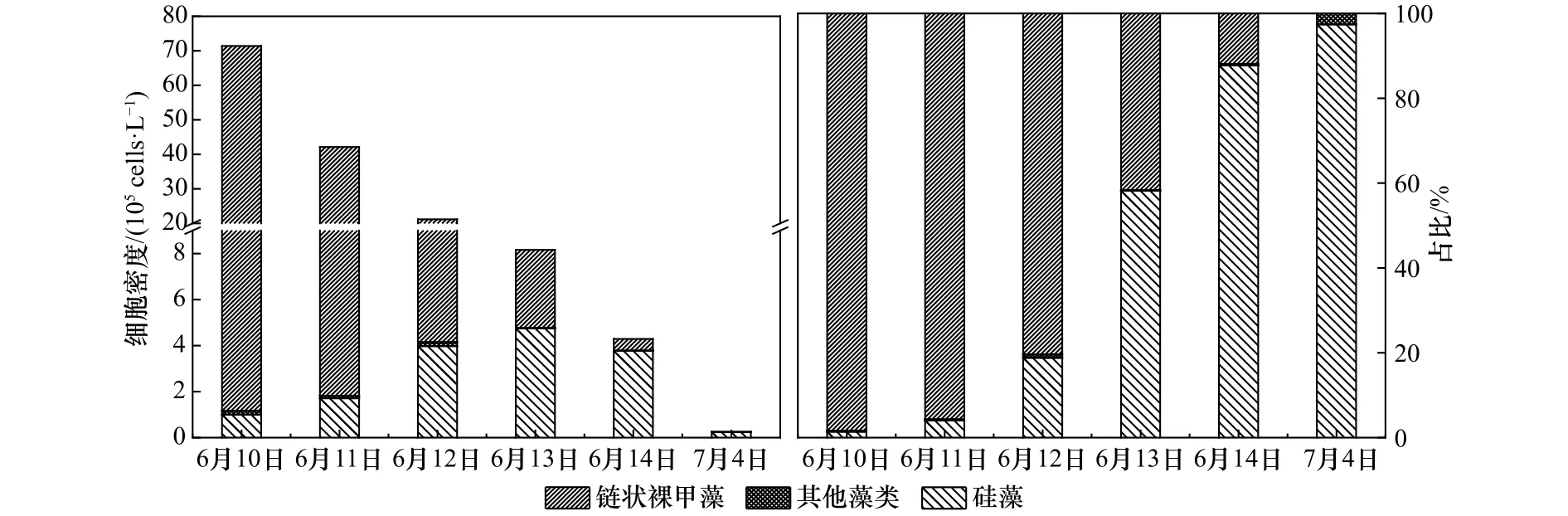
图9 赤潮期间浮游植物细胞密度及其所占比率的变化Fig.9 Variations of phytoplankton cell density and its proportion during red tide
在赤潮消亡后期(6 月 13−14 日),硅藻取代链状裸甲藻的优势地位,密度为(4.75±0.90)×105cells/L 和(3.77±0.24)×105cells/L,分 别 占 浮 游 植 物 总 数 的58.2%和87.8%。其中中肋骨条藻(Skeletonema costatum)和旋链角毛藻(Chaetoceros curvisetus)占主要优势,分别占硅藻细胞总数的43.6%~46.2% 和41.6%~44.4%。在赤潮消退之后(7月4日),硅藻为监测海域的绝对优势类群,密度为2.39×104cell/L,占浮游植物总密度的比率高达97.4%。
3.6 甲藻包囊种类数和丰度
监测海域4个航次甲藻包囊的种类数介于22~33种之间,平均为27种,其中2018年7月4日最高,2018年6月14日最低,且均以异养型甲藻包囊为主,其中又以原多甲藻类包囊占优势,每个航次均在14种以上;丰度上,2018年7月4日亦是最高,为(758±426) cysts/g,最低为 2019 年 2月 23日,为(460±192) cysts/g,全年平均为575 cysts/g。4个航次异养型包囊和自养型包囊丰度比(H∶A值)在1.98~7.69之间,平均为4.01。同样原多甲藻类包囊丰度在4个航次中均占主要优势,每个航次均占总丰度的50%以上,详见图10。

图10 泉州湾海域甲藻包囊种类数和丰度的变化Fig.10 Variations of species number and abundance of dinoflagellate cysts in the Quanzhou Bay
链状裸甲藻包囊在每个航次每个站位中均有发现(图11),丰度介于 19~(65±8)cysts/g 之间,平均为41 cysts/g,其中2018年6月14日最高,2019年5月8日最低,详见图12。在监测海域还发现其他有毒有害的甲藻包囊,如同样产麻痹性贝毒(PSP)的微小/相似亚历山大藻包囊复合体(Alexandrium minutum/affinecyst complex)和塔玛/链状亚历山大藻包囊复合体(Alexandrium tamarense/catenellacyst complex),产虾夷扇贝毒素(YTXs)的多边舌甲藻(Lingulodinium polyedra)、网状原角藻(Protoceratium reticulatum)和具刺膝沟藻(Gonyaulax spinifera)包囊,但丰度均不高,最高为多边舌甲藻包囊的17 cysts/g,最低为塔玛/链状亚历山大藻包囊复合体的6 cysts/g,且这些有毒有害甲藻包囊仅在个别航次有检出。
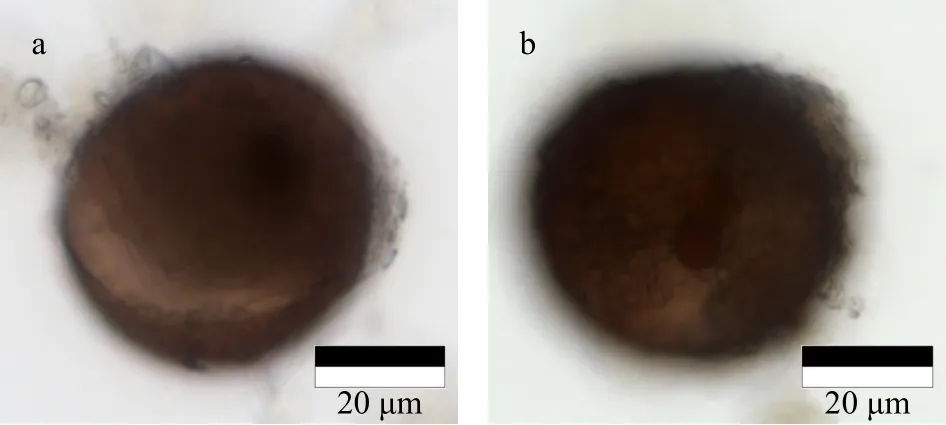
图11 链状裸甲藻空包囊(a)和活体包囊(b)Fig.11 Gymnodinium catenatum empty cysts(a)and live cysts(b)

图12 泉州湾海域链状裸甲藻包囊丰度Fig.12 Variations of abundance of Gymnodinium catenatum cysts in the Quanzhou Bay
4 讨论
4.1 链状裸甲藻赤潮消亡期间浮游植物群落变化
由于本次监测的时候,赤潮已经发生,因此未能获取赤潮发生前的浮游植物群落结构数据,但根据以往的调查资料[18-19]可知,泉州湾海域浮游植物的主要类群是硅藻,7月4日的浮游植物监测数据也证明了这一点。泉州湾的浮游植物类群主要为广布种和暖水种,如中肋骨条藻、旋链角毛藻、派格棍形藻(Nitzschia paradoxa)、尖刺拟菱形藻(Pseudo-nitzchia pungens)和洛氏角毛藻(Chaetoceros lorenzianus)等,也存在着少量的如长耳盒形藻(Biddulphia aurita)和弯菱形藻(Nitzschia sigma)等温带种。链状裸甲藻以前在泉州湾未有报道;中肋骨条藻在泉州湾则一直是优势种,在2006年的6−8月还发生过多次赤潮[19];旋链角毛藻在泉州湾的数量也较多,个别月份优势度较高。此次赤潮期间,浮游植物种类亦是以广布种和暖水种为主,其中链状裸甲藻、中肋骨条藻和旋链角毛藻优势度明显。
赤潮消亡期间,浮游植物种类数在前期较少,到了中后期甲藻和硅藻种类数均明显增加,而总细胞密度因链状裸甲藻数量的减少则是逐渐下降。赤潮消亡前期,监测海域链状裸甲藻数量极高,后期数量急剧下降,到了7月4日,甚至检测不到;而中肋骨条藻和旋链角毛藻则相反,赤潮消亡前期数量较少,均在105cells/L以下,到了中后期,密度急剧升高。链状裸甲藻和中肋骨条藻、旋链角毛藻高峰的交替出现,表明了赤潮生物之间存在着营养竞争和互相演替的过程,同时也证明了甲藻赤潮消亡的过程通常由硅藻群落取代甲藻群落的生态特征[20-21]。
4.2 赤潮暴发与环境因子的关系
对于赤潮生物而言,影响其生长的因素很多,其中良好的海况、适宜的温度和盐度等是其必不可少的条件[22]。根据国家海洋局崇武海洋环境监测站的观测资料显示,监测海域赤潮暴发期间,盛行东风,风力2~3级,海况较好,有利于赤潮生物的生长和繁殖,且赤潮生物因风向影响主要集中在靠近岸边的Q1和Q2站位。不同的赤潮生物都有其生长繁殖的最适温度,即使是同一物种,也存在着不同的生态类型[23]。链状裸甲藻是广温广盐种,本次链状裸甲藻赤潮在水温27.1~28.2℃之间暴发,2017年6月在深沪湾暴发的链状裸甲藻赤潮水温则是介于25.9~27.4℃之间[24],表明泉州沿海两次暴发赤潮的链状裸甲藻种群均属于暖水生态型,相反在塔斯马尼亚河口南部和西班牙发现的链状裸甲藻赤潮,那里的水温介于12~17℃之间,表明该区域的链状裸甲藻种群是冷水生态型[25-26],而在海州湾发现的链状裸甲藻赤潮,水温介于22.8~23.4℃之间,表明该种群可能属于中度生态型[27]。但来自台湾海峡的链状裸甲藻藻株生长最适温度为23℃,与赤潮发生时的温度并不一致[23]。在盐度方面,链状裸甲藻在盐度在23.9~32.8之间均可暴发赤潮[24,27],但在盐度为28时生长最好[6]。此次赤潮盐度介于29.7~31.4,且赤潮生物密度与盐度呈明显的负相关关系(p<0.01),同上述结论相符合。
赤潮在发展时期会吸收大量的CO2并释放出O2,致使海水pH和DO浓度增高;而当赤潮消亡时,死亡后的大量藻体会被微生物分解,消耗水体中的DO并释放CO2,致使水体中pH和DO浓度降低。此次赤潮消亡时并未出现低氧状况,这主要与消亡时监测海域的大风大浪有关。pH和DO浓度在整个赤潮消亡过程中呈明显的正相关关系,相关系数高达0.914。
水体富营养化是赤潮暴发的原因之一,营养盐对赤潮的发生起着基础性作用。监测海域虽然位于泉州湾湾口,水体交换较好,但仍受到晋江、洛阳江等入海河流的影响,还有周边面源污染排入,使该海域常年处于富营养化水平[9,28]。与2015年监测海域同时期的营养盐浓度进行对比[28],发现虽然2018年6月10日水体呈富营养化,但仍远低于2015年同时期的水平,同时随着赤潮的发展,无机氮浓度和活性磷酸盐浓度都有明显的下降,活性磷酸盐甚至未检出,而在赤潮消亡后期营养盐浓度逐渐恢复,但仍处于贫营养水平。张文[6]研究发现,低氮或低磷均不利于链状裸甲藻的生长;程军利等[27]指出,活性磷酸盐是控制海州湾链状裸甲藻消退的决定性因素。但此次链状裸甲藻赤潮并未发现同营养盐浓度有显著的相关关系,且活性磷酸盐浓度在6月12日突增,该原因还有待进一步研究。一般来说,海洋中的无机氮以为主,其他形式的无机氮为辅,7月4日监测海域浓度占无机氮浓度的70%也证明了这一点。赤潮消亡过程中,和浓度变化幅度较大,浓度一直维持在较低水平,变化幅度较小,这可能是因为和是藻类优先利用的氮源,最后才是[29]。
4.3 休眠包囊在赤潮生消过程中的作用
休眠包囊在赤潮生消过程中扮演着重要的角色。一方面,在赤潮消亡时期,大量休眠包囊的形成导致营养细胞数量的锐减,是赤潮消亡的原因之一;另一方面,这些休眠包囊沉积在海底,使赤潮生物度过恶劣环境,在环境好转时,这些包囊又可以萌发,从而向水体中提供营养细胞,促进赤潮的再次发生,被认为是赤潮的“种源”[13]。泉州湾海域链状裸甲藻赤潮消亡时,形成休眠包囊,沉积在当地海域的底泥中,这些包囊在赤潮消亡时采集的水样中也有发现。包囊数量随着时间呈逐渐下降趋势,在赤潮刚消亡时(6月 14日)丰度最高,达到(65±8)cysts/g,1年之后,丰度最低,为19 cysts/g,仅占最高丰度的30%。王朝晖[7]曾于2003年9月采集泉州湾3个站位的表层沉积物样品,发现泉州湾链状裸甲藻包囊丰度平均为7 cysts/g,远低于本次监测结果。而Bravo等[30]报道西班牙链状裸甲藻赤潮后,当地海域链状裸甲藻包囊的丰度迅速增加;在塔斯马尼亚南部也报告了高丰度的包囊,在那里链状裸甲藻赤潮很常见[31]。这些都证明了赤潮消亡时会形成大量的休眠包囊。但潘俊等[32]在调查南黄海包囊分布时,发现暴发链状裸甲藻赤潮的区域,1年之后检测到链状裸甲藻包囊数量较少;李光毅等[33]在研究湄洲湾甲藻包囊分布时也得出同样的结论,可见休眠包囊可能受到海流、潮汐和萌发等影响,经过一段时间后,数量会呈下降趋势。
甲藻包囊具有孢粉质壁,能长期保存在沉积物中,但需度过一段时间的强制性休眠期才能萌发。塔斯马尼亚南部和西班牙的链状裸甲藻包囊在黑暗的冰箱中可以存活1年,休眠期持续6 d到两周,且在4℃条件下仍然能萌发[17,26];Figueroa等[34]指出在缺氮或缺磷的环境下,链状裸甲藻包囊最终萌发率仍在57%以上;而Liu等[23]采集厦门湾的链状裸甲藻包囊进行萌发实验,发现该包囊在23℃环境下1 d内即可萌发,且在4℃条件下贮藏两年后萌发率仍有73%。泉州湾海域的链状裸甲藻包囊同厦门湾一样,均属于暖水生态型,且较多为没有萌发的活体包囊,萌发能力较强,在适宜的条件下,具有暴发赤潮的潜在性。
5 结论
2018年6 月中旬在泉州湾海域发生小规模链状裸甲藻赤潮,赤潮持续时间短,发生过程中共鉴定浮游植物3门48属100种,硅藻门种类最多;赤潮消亡期间群落结构发生变化,赤潮消亡前期链状裸甲藻占据绝对优势,后期硅藻(主要为中肋骨条藻和旋链角毛藻)代替链状裸甲藻成为优势种,且浮游植物种类数明显增加;此次赤潮在高温、高盐、富营养化的环境中暴发,但与营养盐没有呈现显著的相关关系,大风大浪是导致赤潮消亡的重要原因;在泉州湾海域共鉴定甲藻包囊5大类37种和1种未定种,全年平均丰度为574 cysts/g,异养型甲藻包囊种类数和丰度均占主要优势;休眠包囊在赤潮生消过程中起着重要作用,赤潮消亡时形成休眠包囊,包囊数量随着时间呈下降趋势,但仍有萌发的可能,具有重新暴发赤潮的潜在性,需要引起重视。
——泉州宋船

