克伦生葡萄内生菌Acremonium sclerotigenum的分离鉴定及致腐能力研究
李培谦,药震,冯宝珍,师守国
(运城学院 生命科学系,山西 运城,044000)
克伦生(Crison)是常见的鲜食无核葡萄品种,因其品质好,抗病性强,储藏期长等优点倍受农户青睐,然而在采后储藏过程中仍有腐烂病发生。植物内生菌在植物体内广泛存在,具有丰富的多样性[1-2],它们与植物长期共存,在植物生命过程中发挥着多种功能[3]。内生菌能够诱导寄主植物的抗性产生,目前人们已经证实菌根菌[4]、植物内生细菌[5]及线虫[6]通过激发寄主系统获得性抗性以增强对病原菌的防卫反应。比如Colletotrichumtropicale能诱导可可叶片内几百个防御基因表达,增强植物免疫力[7]。另一方面,内生菌也能够抑制寄主植物防御反应,侵染寄主植物,同时也为其他病原菌共同侵染提供条件[8-9]。内生菌还通过与病原菌直接相互作用的方式调节宿主植物病害的发生[3]。如内生菌可以通过过度寄生、竞争或抗菌来拮抗病原体。总之,目前的研究表明内生菌能够通过拮抗作用减弱植物病害发生,也能通过协助作用加重病害发生[3]。
葡萄内生菌包括真菌、细菌、放线菌,主要分布在根、茎、叶和藤条内,而果实内生菌报道很少。在树干、藤条、根部、叶片主要分离到细菌和放线菌[10]。葡萄内生菌以芽胞杆菌(Bacillusspp.)、假单胞菌(Pseudomonasspp.)、弯曲杆菌(Curtobacteriumspp.)、葡萄球菌(Staphylococcusspp.)和链霉菌(Streptomycesspp.)居多[10-11]。PANCHER等[12]对意大利北部112个葡萄园的葡萄茎秆内生真菌群落进行分析,发现链格孢(Alternariasp.)和黑附球菌(Epicoccumnigrum)分布最广。国内学者从赤霞珠分离到73个菌株,包括23个细菌,14个放线菌,36个真菌,其中从根部分离的内生菌最多,占比34%,而从果实分离的内生菌最少,占比12%[13]。GUARNACCIA等[14]对欧洲和以色列葡萄植株内生菌进行调查,分离鉴定了间作壳属(Diaporthe)的175个菌株,绝大多数为D.eres和D.ampelina,并且D.baccae,D.celeris,D.hispaniae和D.hungariae菌株对葡萄均具有强致病性。然而,鲜食葡萄储藏期内生菌的种类及致病性罕见报道。
本研究对储藏期鲜食克伦生葡萄内生菌进行分离鉴定,并测定其致腐能力,为葡萄采后病害防控提供理论依据和技术支持。
1 材料与方法
1.1 实验材料
1.1.1 培养基及样品
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):马铃薯200 g、葡萄糖20 g、琼脂20 g,蒸馏水定容至1 000 mL,121 ℃灭菌15 min。克伦生葡萄果实于2020年10~12月取自运城夏县葡萄冷库。
1.1.2 试剂及设备
2×TaqPCR MasterMix II PCR扩增试剂盒,天根生化科技(北京)有限公司;DNA Marker DL2000,宝日医生物技术(北京)有限公司;真菌基因组DNA提取试剂盒,艾德莱生物科技公司;引物ITS1/ITS4、NL1/NL4,生工生物工程(上海)股份有限公司;葡萄糖、NaCl、琼脂粉等常规试剂均为国产分析纯。
BMJ-250型培养箱,上海博迅医疗生物仪器股份有限公司;Olympus CX43显微镜,日本奥林巴斯公司;T100TMThermal Cycler PCR仪,美国伯乐公司。
1.2 实验方法
1.2.1 葡萄内生菌的分离鉴定
1.2.1.1 内生菌的分离纯化
选取健康的克伦生葡萄果实15 g,先在自来水下冲洗晾干,再用75%酒精充分浸泡5 min,无菌水冲洗3~5次,然后用5.4% 的NaClO溶液浸泡5 min,无菌水冲洗4~5次,最后于无菌吸水纸上晾干。置于无菌研钵内加10 mL无菌水研碎,取组织液100 μL均匀涂布在PDA平板上。将平板置于25 ℃培养箱中进行黑暗培养20 d,每天观察菌落的生长情况,根据菌落的颜色以及形态挑取单菌落,将菌株(K1~K13)进行纯化后保存,以供后续实验。
消毒可靠性检验采用漂洗液培养法和组织印记检查法。漂洗液培养:取最后一次漂洗液100 μL均匀涂在PDA平板上,按上述条件进行培养。组织印迹检查:葡萄晾干后,用无菌的镊子夹住葡萄,在PDA平板上滚动印记,置于相同条件下培养。在无菌操作和实验材料的严格消毒灭菌下,组织印记与漂洗液培养的培养基上无任何微生物生长。
1.2.1.2 形态学鉴定
内生菌株纯化后,观察其菌落特点,用显微镜观察菌丝及孢子形态并拍照。
1.2.1.3 基因组DNA提取及分子生物学鉴定
将菌株在PDA平板上培养10 d,用直径7 mm的打孔器打取菌饼,置于150 mL液体PDA中,摇瓶培养5 d,收集菌丝。液氮研磨后,采用真菌基因组DNA提取试剂盒提取总DNA。采用真菌通用引物进行PCR扩增,反应体系为:2×TaqMaster Mix 12.5 μL、DNA模板1 μL、上下游引物各1 μL,ddH2O补足至25 μL。反应程序为:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃终延伸10 min。转录间隔区ITS(internal transcribed spacer)序列扩增引物为ITS1和ITS4[15];核糖体28S rDNA D1/D2区序列引物为NL1(TGCGTTGATTACGTCCCTGC)和NL4(GGTCCGTGTT-TCAAGACGG)[16]。PCR产物经1%琼脂糖凝胶电泳进行初步检测后,送到杨凌天润奥科生物科技有限公司进行测序,并上传至美国国家生物信息中心(National Center for Biotechnology Information,NCBI)的GenBank。
1.2.1.4 进化树构建
测序结果在NCBI进行在线BLAST(Basic Local Alignment Search Tool)比对分析,并下载模式菌株序列用CLUTALX 1.83软件进行多重序列比对。使用MEGA-X 软件以邻接法(neighbor-joining methods,NJ)对ITS、28 S rDNA D1/D2区序列构建系统发生树,分析该菌与其他菌株的亲缘关系,以确定其分类地位[17-18]。
1.2.2 葡萄储藏期病原菌分离鉴定
将明显病变的克伦生葡萄果实用75%酒精处理1 min,然后用无菌水冲洗4~5次;用镊子取病健交界处置于PDA平板上,于25 ℃培养箱中进行黑暗培养2~3 d;待出现菌落后,再次转接PDA平板,然后将菌株保存。结合形态学和ITS序列进行鉴定,具体方法同上。
1.2.3 致腐能力测定
选取健康青提葡萄维多利亚、樱桃番茄千禧、苹果藤木一号果实,先用无菌水冲洗干净,再经75%酒精消毒,无菌水冲洗后晾干备用。用消毒打孔器在果实赤道处制造轻微伤口,深度约2 mm;用直径7 mm的打孔器取得菌饼,菌丝面贴于伤口。每个菌株处理6个果实,内生菌和致病菌均进行致病性测定。于25 ℃培养箱内培养,接种1 d后开始观察发病症状,记录症状。实验重复3次,对照组用无菌水处理。
1.2.4 对峙培养
将纯化的内生菌、腐烂病原菌在PDA平板上于25 ℃培养箱内培养7 d,用直径7 mm打孔器分别在菌落边缘打孔,然后将菌饼同时接种于新的PDA平板(间距2 cm),置于25 ℃培养箱内黑暗培养,检测内生菌对病原菌是否具有拮抗作用。
2 结果与分析
2.1 葡萄内生菌的分离纯化
在健康克伦生葡萄果实内共分离到20个真菌菌株,其中K1~K13菌落培养性状基本一致,菌株在25 ℃ PDA平板上生长缓慢,大约30 d能长满平板。在PDA培养基上菌落呈白色绒状,菌落表面平展,菌丝分生孢子单胞,透明,圆柱状,直或弯,表面光滑,尺寸为(3.0~5.0) μm×(0.7~1.8) μm。其形态特征与菌核枝顶孢(Acremoniumsclerotigenum)形态特征吻合(图1-a)。
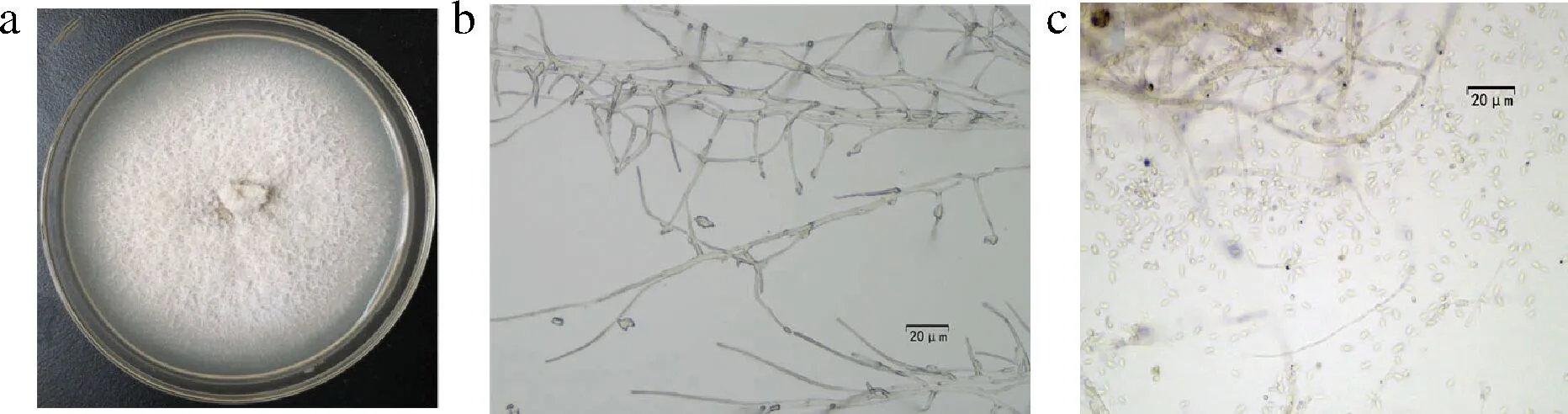
a-PDA上菌落生长特征;b-菌丝;c-分生孢子图1 葡萄内生菌形态特征Fig.1 Morphology of endophytes from grape
随机选取3个菌株K2、K7、K8提取基因组DNA,PCR扩增后测序,序列上传GenBank(ITS序列:MW64452~MW644524,28S rDNA D1/D2区序列:MW644777~MW644779)。经过NCBI在线BLAST分析后下载CBS模式菌株序列,利用Mega-X构建NJ系统进化树。如图2-a所示,ITS序列进化树分析显示,K2、K7、K8与A.sclerotigenum聚为一支;图2-b所示,28S rDNA D1/D2区序列分析显示K2、K7、K8与A.sclerotigenum聚为一支,结合形态学特点将K2、K7、K8鉴定为菌核枝顶孢(A.sclerotigenum)。
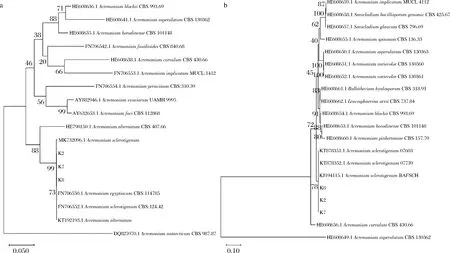
a-基于ITS序列构建NJ进化树;b-基于28 S rDNA D1/D2区序列构建NJ进化树图2 基于ITS序列和28S rDNA序列构建NJ树Fig.2 Neighbor joining tree constructed with sequences of the ribosomal internal transcribed spacer (ITS) regions and 28S rRNA gene
2.2 葡萄储藏期腐烂病菌分离鉴定
由病变克伦生果实上分离纯化得到菌株LK4和LK7,利用形态学和分子生物学进行鉴定。LK7菌落灰色至黑灰色,分生孢子梗丛生,不分枝或分支,直立,有分隔,分隔处缢缩,青灰色至灰色,顶端簇生分生孢子,顶端的产孢细胞膨大;分生孢子椭圆形或倒卵形至近圆形,表面光滑无凸起,无色,单胞,成堆时呈现淡黄色,其特征与灰葡萄孢(Botrytiscinerea)特征吻合(图3-b和图3-c)。LK4菌落初期正面为灰白色后渐变为暗色至青褐色;背面暗褐色至黑褐色。菌丝无色、无隔膜,分生孢子梗丛生,有分支,直立或弯曲;分生孢子深褐色,倒梨形、卵形或倒棍棒形,棕褐色,有3~8个横隔,1~4个纵隔,分隔处略隘缩,有柱状短喙,其形态特征符合链格孢(Alternariasp.)(图3-d和图3-e)。
将菌株LK7的ITS序列(GenBank no:MZ882168)在NCBI进行BLAST分析,发现其与B.cinerea同源性达99%,下载同源序列构建NJ进化树进一步证实为B.cinerea。将菌株LK4的ITS序列(GenBank no:MZ882167)在NCBI进行BLAST分析,发现与Alternariasp.同源性达99%,构建NJ进化树进一步证明该菌株为Alternariasp.。

a-病变克伦生果实;b-灰葡萄孢LK7菌落;c-菌株LK7菌丝及分生孢子;d-链格孢LK4菌落;e-菌株LK4菌丝及分生孢子图3 腐烂克伦生葡萄病原菌Fig.3 Pathogen from rot Crison fruits
2.3 致腐能力测定
将菌株K7分别接种于青提、番茄和苹果,并以无菌水、灰葡萄孢LK7作为参照。接种7 d后,无菌水处理组果实完好无损;灰葡萄孢LK7处理组果实完全腐烂,果实发病率100%(图4-b);而K7处理组,葡萄果实发病缓慢,发病区域仅局限于接种部位(图4-c),甚至放置20 d,处理果实发病部位仍然局限于接种区域(图4-d)。由此可见,K7对葡萄果实致腐性明显,致腐能力弱于灰葡萄孢。

a-无菌水接种7 d;b-灰葡萄孢LK7接种7 d;c-菌株K7接种7 d;d-菌株K7接种20 d图4 内生菌K7对葡萄的致腐作用Fig.4 Saprogenicity of endophyte K7 on grape
图5显示,内生菌K7对番茄具有明显致腐性,但致腐能力弱于灰葡萄孢。K7也能够引起苹果腐烂,致腐能力弱于灰葡萄孢(图6)。

a-灰葡萄孢LK7接种7 d;b-菌株K7接种7 d;c-无菌水处理图5 内生菌K7对番茄的致腐作用Fig.5 Saprogenicity of endophyte K7 on tomato
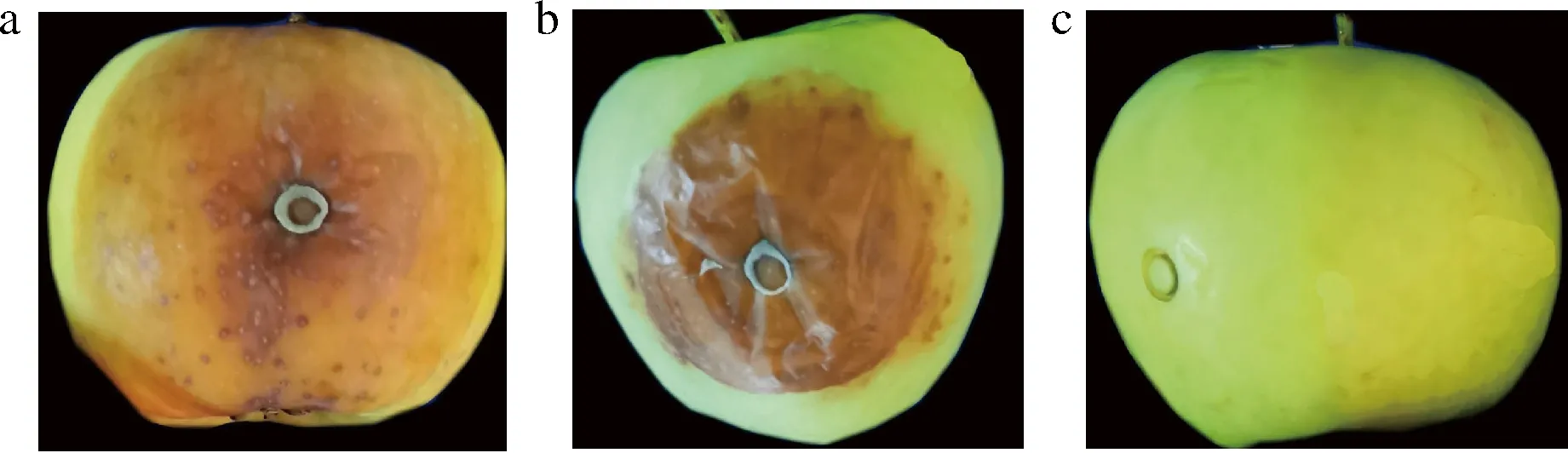
a-灰葡萄孢LK7接种7 d;b-菌株K7接种7 d;c-无菌水处理图6 内生菌K7对苹果致腐作用Fig.6 Saprogenicity of endophyte K7 on apple
2.4 内生菌与致病菌关系
为探讨内生菌与病原菌的相互作用,将内生菌K7与病原菌LK4、LK7对峙培养。如图7所示,内生菌K7生长缓慢,而病原菌LK4、LK7在PDA上生长迅速,占领了绝大部分的营养和空间,因此内生菌K7与病原菌LK4、LK7之间无拮抗作用,它们均能引起果实腐烂。
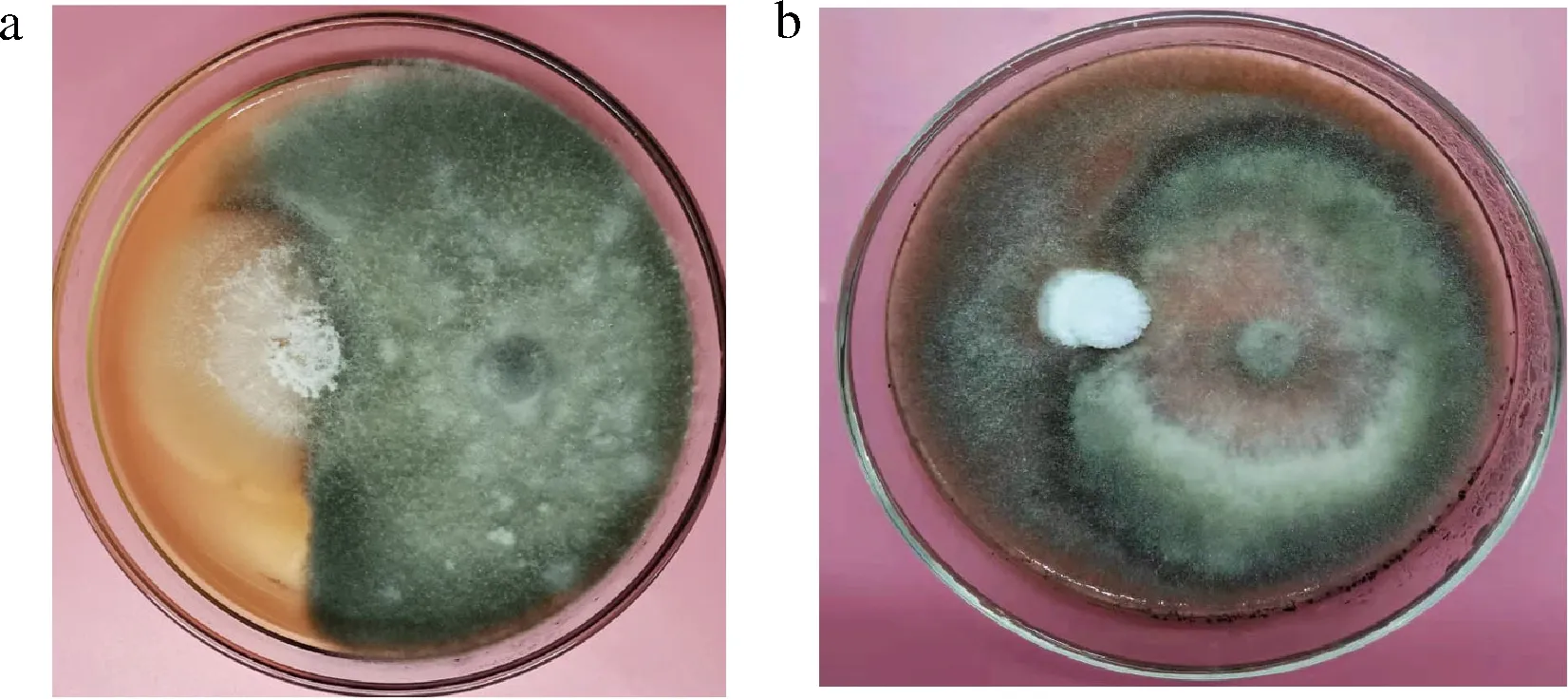
a-K7与灰葡萄孢LK4;b-K7与链格孢LK7图7 内生菌与病原菌对峙培养Fig.7 Endophytes and pathogens confrontation culture
3 结论与讨论
本研究结合形态学和分子生物学方法鉴定了克伦生葡萄果实内生菌A.sclerotigenum,证明了该菌能够引起葡萄、番茄和苹果腐烂;明确了储藏期克伦生葡萄致腐菌主要为灰葡萄孢(B.cinerea)和链格孢(Alternariasp.)。本研究首次报道了克伦生葡萄内生菌A.sclerotigenum,丰富了葡萄内生菌多样性,也为克伦生采后病害防治提供了重要理论依据。
Acremonium属种类繁多,大约有150个种,该属真菌大多在土壤中腐生或者寄生在植物、昆虫等生物体内,有些种类还能引起人类和哺乳动物疾病[19]。Acremonium属鉴定除了需要形态学特征,还需要结合ITS序列和28S序列等基因进行鉴定。PARK等[20]从土壤中分离到该属真菌,利用形态学及ITS序列分析鉴定为A.sclerotigenum。GIRALDO等[21]从西班牙土壤内分离到Acremonium属真菌,利用形态学特征,结合ITS和28S序列进行鉴定,鉴定了该属2个新种。BURRUANO等[22]从葡萄根、叶、芽、种子内分离到94株Acremonium属内生菌;LO+PICCOLO等[16]利用ITS和28S rDNA将这94个菌株进行鉴定,其中有68个为A.persicinum和26个为A.sclerotigenum[16]。本研究首次从克伦生葡萄果实中分离到了13株A.sclerotigenum菌株,其形态特征与前人[16,20-21]研究基本一致。
储藏期葡萄腐烂由黑曲霉、黑根霉、灰葡萄孢、白腐病菌、炭疽病菌、青霉菌、交链孢霉等病菌侵染引起,并且灰霉和交链孢霉在低温条件下具有较强的致病性,是低温贮运中的主要致腐菌[23]。本研究中,在储藏期克伦生葡萄果实上分离到的致腐烂菌主要为灰葡萄孢和链格孢,说明克伦生葡萄储藏期应该加强对这2种病原菌的防治。此外,笔者也发现内生菌K7能够引起果实腐烂,说明内生菌引起的植物病害值得深入研究。
目前植物内生菌焦点在于拮抗菌的报道,而内生菌A.sclerotigenumK1菌株对克伦生葡萄储藏期致病菌B.cinerea和Alternariasp.均无抑制作用。HUANG等[24]分析了葫芦科植物的1044株内生菌,发现有84株对葫芦科主要致病菌无拮抗活性。体外对峙培养内生菌的拮抗作用表现为营养竞争、抗生物质及重寄生。在PDA平板上A.sclerotigenumK7菌株生长速率远小于病原菌,对病原菌无抑制作用。Acremonium属真菌大多为土壤和植物腐生菌,有些种能够引起人类、动物疾病和植物病害[25]。前人对94株Acremonium属葡萄内生真菌进行分析,发现所有的A.persicinum菌株对葡萄霜霉菌(Plasmoparaviticola)游动孢子萌发具有不同程度的抑菌作用,而部分A.sclerotigenum菌株却对葡萄霜霉病菌无任何抑制作用[16]。A.sclerotigenum可能参与寄主生长过程,提高寄主对环境胁迫的抗性,这些需要进一步的试验验证。本文首次报道了储藏期克伦生葡萄内生菌A.sclerotigenum,明确了腐烂病菌的主要种类,为葡萄采后病害防治提供了理论基础和技术支持。

