肝细胞生长因子对低氧性肺动脉高压小鼠影响的初步研究
唐胡婷 母炜浩 向渝静 安永
(重庆医科大学附属儿童医院胸心外科/国家儿童健康与疾病临床医学研究中心/儿童发育疾病研究教育部重点实验室/儿科学重庆市重点实验室,重庆 400014)
肺动脉高压(pulmonary arterial hypertension,PAH)是一类以肺动脉渐进性闭塞导致肺血管阻力逐渐升高继而诱发右心室衰竭的一种恶性肺血管疾病,临床上因缺氧而引起的低氧性肺动脉高压(hypoxic pulmonary arterial hypertension,HPAH)最为常见[1]。目前治疗HPAH手段有限且效果不佳,因此研究新的治疗方法很有必要。现有研究表明在PAH动物模型中,PAH的进展程度与肝细胞生长因子(hepatocyte growth factor,HGF)体内浓度呈负相关,在该动物模型肺部所检测到的HGF激活物有所下降[2]。肺血管内皮细胞损伤是肺动脉高压形成的始动因素[3],因此修复受损的内皮细胞,可有效抑制PAH对肺血管的持续影响。已有研究发现在受损的血管内皮细胞周围,存在高表达的HGF及促血管生成的血管内皮祖细胞(endothelial progenitor cells,EPCs)[4]。本课题组前期实验已表明,移植高表达肝细胞生长因子受体(hepatocyte growth factor/mesenchymal-epithelial transition factor,HGF/c-Met)轴 的EPCs,可 使EPCs定向迁移至HPAH动物模型受损的肺血管处,改善肺血管重构,降低肺动脉压力[5]。由此猜测:直接提高体内HGF浓度后是否可直接治疗受损的肺血管内皮细胞,继而逆转PAH对机体循环系统的影响,以达到治疗PAH的目的。所以本研究采用提高HPAH小鼠体内HGF含量,与未有任何处理的HPAH小鼠进行比较分析,为HPAH的治疗方法提供新思路和依据。
1 材料与方法
1.1 实验动物及仪器试剂
清洁级雄性C57BL/6小鼠30只,体重12~16 g,购于重庆医科大学实验动物中心[合格证号:SYXK(渝):2012-0001]。
主要试剂及仪器:重组小鼠HGF(美国PEPROTECH公司),小动物超声仪(飞依诺科技有限公司,型号:VINNO 6 LAB),内皮素-1(endothelin-1,ET-1)ELISA检测试剂盒(南京森贝伽生物科技公司),一氧化氮(nitric oxide,NO)Griess试剂盒(上海碧云天生物技术有限公司),透射电镜(日本日立公司,型号:HT7700)。
1.2 模型建立与分组
将30只小鼠适应性喂养3 d后,依据随机数字表法分为正常组、HPAH组和HGF治疗组,每组10只。在实验进行的前4周,正常组小鼠(共10只)置于独立通气笼盒(individual ventilated cages,IVC)间正常饲养;其余2组(共20只)小鼠置于自制缺氧箱内,氧气浓度10%(体积分数),每天持续低氧8 h,每周更换水、垫料,给予充足的食物[6-7]。待成功建立HPAH小鼠模型后,给予HGF治疗组小鼠尾静脉注射重组小鼠HGF,剂量为1 mg/kg;同时正常组及HPAH组小鼠给予相同剂量的0.9%氯化钠溶液尾静脉注射。而后将3组小鼠置于IVC间正常饲养1周。实验进行到第5周时观测3组小鼠肺动脉压及血管重构情况。
1.3 PAH严重程度相关指标的检测
实验第5周时,称量各组小鼠体重(body weight,BW),将各组小鼠胸腹部脱毛后给予小鼠吸入异氟烷气体进行麻醉,动物心脏彩超检测小鼠右心室收缩压(right ventricular systolic pressure,RVSP)、三尖瓣峰值流速。
分离出小鼠心脏,剪去心耳,再沿室间隔剪下右心室,用滤纸吸去其水分,分别称量右心室(right ventricle,RV)、左 心 室(left ventricle,LV)+室间隔(interventricular septum,S)的质量,最后计算RV/BW比值和右心室肥厚指数(right ventricular hypertrophy index,RVHI)=RV/(LV+S)×100%。
1.4 透射电镜观察肺动脉超微结构
小鼠经10%水合氯醛(4 mL/kg)麻醉,固定于实验操作台上,用手术器械打开胸腔,充分暴露心脏后,分离出肺动脉。快速剪取肺动脉,放入2.5%戊二醛中固定,透射电镜观察肺动脉血管超微结构的改变。
1.5 血清NO及ET-1浓度的检测
实验第5周时,取小鼠眶动脉和眶静脉血,于室温下自然凝固30 min,3 000 r/min离心20 min,取上清液。依NO试剂盒及ET-1检测试剂盒说明书进行测定。
1.6 统计学分析
应用SPSS 23.0统计软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组RVHI及RV/BW比值的比较
各组RVHI及RV/BW比值的比较差异均有统计学意义(P<0.05)。HPAH组RVHI及RV/BW比值均显著高于正常组及HGF治疗组,而HGF治疗组RVHI及RV/BW比值均高于正常组(P<0.05)。见表1。
表1 各组RVHI及RV/BW比值的比较 (±s,n=10)
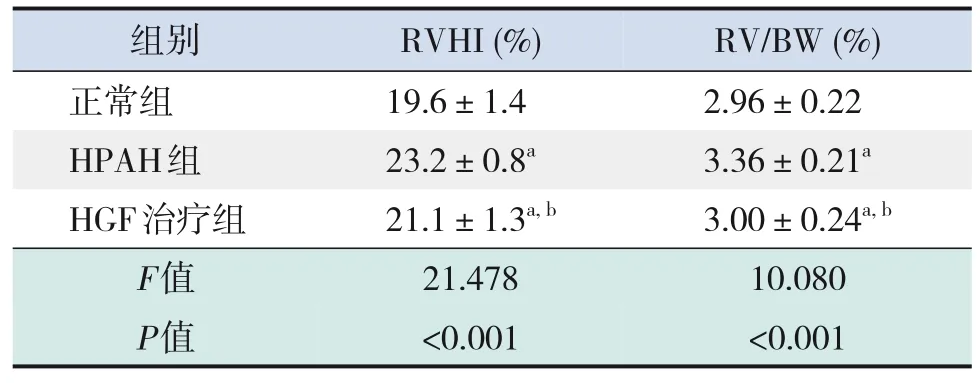
表1 各组RVHI及RV/BW比值的比较 (±s,n=10)
注:[RVHI]右心室肥厚指数;[RV/BW]右心室/体重。a示与正常组比较,P<0.05;b示与HPAH组比较,P<0.05。
组别正常组HPAH组HGF治疗组F值P值RVHI(%)19.6±1.4 23.2±0.8a 21.1±1.3a,b 21.478<0.001 RV/BW(%)2.96±0.22 3.36±0.21a 3.00±0.24a,b 10.080<0.001
2.2 各组血流动力学比较
HPAH可表现出肺动脉血流异常。心脏彩超结果显示各组三尖瓣峰值流速及RVSP比较差异均有统计学意义(P<0.05)。HPAH组及HGF治疗组三尖瓣峰值流速均大于正常组,而HGF治疗组三尖瓣峰值流速小于HPAH组(P<0.05)。HPAH组RVSP显著高于HGF治疗组和正常组,HGF治疗组RVSP高于正常组(P<0.05)。见表2。
表2 各组三尖瓣峰值流速及RVSP比较 (±s,n=10)

表2 各组三尖瓣峰值流速及RVSP比较 (±s,n=10)
注:[RVSP]右心室收缩压。a示与正常组比较,P<0.05;b示与HPAH组比较,P<0.05。
组别正常组HPAH组HGF治疗组F值P值三尖瓣峰值流速(cm/s)46.7±2.3 66.5±3.0a 51.0±1.5a,b 202.808<0.001 RVSP(mm Hg)20.5±1.2 26.6±1.2a 21.0±1.3a,b 75.467<0.001
2.3 各组肺动脉超微结构
透射电镜下可观察到正常组血管内皮细胞结构完整,动脉内膜及弹力膜结构正常,线粒体正常无肿胀。HPAH组可见内皮细胞被大量破坏,未见完整的内皮细胞,小动脉内膜及弹力膜排列紊乱,有断裂及缺失。HGF治疗组血管内皮细胞结构基本完整,动脉内膜及弹力膜结构基本正常,偶见有断裂,较正常组有轻微水肿现象。见图1。

图1 各组小鼠肺动脉超微结构(透射电镜,×5 000) 正常组与HGF治疗组内皮细胞结构完整,动脉内膜及弹力膜未见明显破坏;HPAH组肺动脉内膜结构被破坏,未见完整的内皮细胞。箭头所示为小鼠肺动脉内膜及弹力膜位置。
2.4 各组血清NO及ET-1水平的比较
通过Griess法测定各组小鼠血清中NO水平,结果显示HGF治疗组血清中NO水平高于正常组,而HPAH组血清中NO水平显著高于HGF治疗组与正常组(P<0.05)。ELISA法检测血清中ET-1水平,结果显示HPAH组血清中ET-1水平显著高于HGF治疗组与正常组,HGF治疗组血清中ET-1水平高于正常组(P<0.05)。见表3。
表3 各组血清NO及ET-1水平的比较 (±s,n=10)

表3 各组血清NO及ET-1水平的比较 (±s,n=10)
注:[NO]一氧化氮;[ET-1]内皮素-1。a示与正常组比较,P<0.05;b示与HPAH组比较,P<0.05。
组别正常组HPAH组HGF治疗组F值P值NO(μmol/L)50.7±1.8 69.4±2.0a 56.1±1.8a,b 267.733<0.001 ET-1(pg/mL)183.2±1.4 201.7±1.6a 186.9±3.3a,b 187.025<0.001
3 讨论
PAH是由于不同病因引起肺小动脉病变最终导致肺动脉压力升高的疾病,病理表现为肥厚远端肺血管重构、炎症和血栓形成等。而肺血管重构是肺动脉高压形成的始动因素,故研究血管重构发生的机制,是研究治疗PAH靶向药物的重点[3]。目前临床上常见的PAH患者多因肺部疾病或生活坏境等导致长期供氧不足,处于低氧状态下最终形成HPAH,由于其发生发展机制不明和在疾病发展过程中气短、右心衰等症状出现较晚,使得患者进行临床治疗时的病情已经进展到中晚期,导致该疾病治疗效果不佳[8],且现有治疗药物不能预防和逆转该疾病的发生发展。故为提高临床疗效,改善患者预后,研究新的靶向治疗药物具有重要意义。
目前有关PAH的治疗药物多数为血管活性物质[9-10],这类药物虽然可以在短时间内缓解PAH对心血管系统的损害,但未能修复受损的肺血管内皮细胞,故PAH的发生发展仍会持续。现有学者研究发现抑制血管内皮细胞的破坏,保证其完整性,可有效缓解炎症机制对血管内膜的损害,进而改善肺血管重构现象,治疗肺动脉高压疾病[11-12]。HGF是一种血管内皮细胞分泌的特异性分子,它可促进细胞增殖、迁移和新生血管形成[13]。结合本课题组前期实验,过表达HGF/c-Met轴的EPCs确实参与受损血管的修复[14-15]。为探讨HGF是否可直接参与修复受损血管进而达到治疗HPAH的目的,本研究通过使小鼠缺氧4周建立HPAH小鼠模型,此模型可用来评价治疗HPAH药物效果[7]。实验结果显示:HPAH组较正常组三尖瓣峰值流速、RVSP、RVHI、RV/BW均显著增加,表明本次实验构建HPAH动物模型成功。而后向已构建成功的HPAH小鼠体外注射HGF,以此达到提高小鼠体内HGF浓度的目的[16-17]。
本研究结果发现提高体内HGF浓度,透射电镜下可观察到内皮细胞结构完整,动脉内膜及弹力膜结构未见破坏,说明体内HGF浓度的升高有助于肺血管内皮细胞修复,保证肺血管内膜的完整性。HGF治疗组小鼠血清中NO及ET-1浓度较HPAH组降低,表明内皮细胞所分泌的收缩和舒张血管因子趋向于平衡状态,其分泌功能得到改善,肺血管的舒缩功能趋向于正常,其可能与HGF具有促进新生血管生成、抑制细胞凋亡、调节免疫失衡及抗炎等作用有关[18-19]。有研究表明,肺微血管内皮细胞与过表达HGF基因的间充质干细胞共同培养时,由于间充质干细胞旁分泌大量的HGF作用于肺微血管内皮细胞,使其通透性降低,细胞凋亡数量减少,细胞结构保持完整[20],本次实验结果与之相一致。其原因可能是HGF激活mTOR/STAT-3通路,增加紧密连接闭锁蛋白的表达和促进细胞增殖,降低内皮细胞通透性,从而保护内皮细胞[2,20-22]。且mTOR/STAT-3通路被证实可抑制肺组织细胞的凋亡、炎症及应激反应[23],促进新生血管的生成[24],进而抑制PAH所致的血管重构现象,这些均有利于修复受损的血管,结合本课题组前期实验,故推测HGF可能参与了肺血管的修复过程。本实验中,HGF治疗组三尖瓣峰值流速、RVSP、RVHI、RV/BW均较HPAH组有明显降低,其可能与HGF修复血管内皮细胞,保护动脉内膜及弹力膜结构完整,抑制血管重构现象[25],从而改善肺动脉高压小鼠的血流动力学有关。这些结果提示HGF可能为治疗HPAH提供新思路。目前HGF/c-Met轴也正逐渐成为研究治疗肿瘤、内分泌及心血管疾病的靶向药物的重点[26-28]。有研究表明通过抑制HGF/c-Met轴的促进新生血管生成、减弱细胞炎症、应激反应及减少细胞凋亡等作用,可有效治疗癌症[29],相反,是否可以选择促进其作用来治疗HPAH,以及其作用的信号通路有待进一步研究。
综上所述,本研究显示,体内高浓度的HGF,可修复受损血管内皮细胞恢复其功能,维护血管动脉内膜及弹力膜的完整性,改善血管重构现象,降低HPAH对循环系统的损害,为治疗HPAH提供一种新思路。
利益冲突声明:所有作者均声明不存在利益冲突。

