香猪CHD3基因3′-侧翼区264 bp结构变异的研究
黄月丽,冉雪琴,牛 熙,李 升,黄世会,王嘉福
(1.贵州大学农业生物工程研究院,山地植物资源保护与种质创新教育部重点实验室,贵阳 550025;2.贵州大学生命科学学院,贵阳 550025;3.贵州大学动物科学学院,高原山地动物遗传育种与繁殖教育部重点实验室,贵阳550025)
香猪属于原始的地方猪种,主要生长于中国西南部分山区,因其双月断奶的仔猪宰食无乳腥味、开膛后腹腔不臭,故被称为香猪[1]。香猪的体型矮小、短圆,在其面部形成“川”字或者菱形的褶皱纹路,普通香猪个体躯干皮肤平整,没有褶皱,在长期养殖过程中发现少量香猪躯干和四肢皮肤呈现明显且密布的褶皱,通过皱皮表型个体交配繁殖的仔猪中,仍然存在部分皱皮个体,说明该褶皱表型可以遗传[2]。皮肤是动物体的第一道屏障,具有保护、体温调节、免疫、代谢等多种生物学功能[3],所以正常健康的皮肤显得尤为重要。结构变异是指在基因组中存在>50 bp核苷酸序列的突变,包括缺失、易位、串联重复、插入和倒置[4]。在生物体中大部分结构变异会导致疾病的形成。沙皮犬全身呈现非常明显的皮肤褶皱,并且还会伴随周期性发热、透明质酸沉积等症状,经研究发现,在透明质酸合成酶2(hyaluronan synthase 2,HAS2)基因的上游存在一段核苷酸序列不稳定重复,该位点突变是导致沙皮犬出现上述现象的主要原因[5]。皱皮香猪皮肤上有大量凹凸起伏的褶皱,表皮层异常不均匀增生,皮肤中的胶原纤维和弹性纤维减少、断裂、排列杂乱,皮肤弹性降低,并且被毛稀疏,与人类皮肤老化现象相似;皱皮香猪皮肤排泄功能受阻,凹陷处皮肤容易被寄生虫和真菌感染,引起皮肤炎症,同时皱皮香猪皮下脂肪层变薄,个体生长缓慢,在屠宰时被毛除不尽[6-7]。
染色质调节域解旋酶DNA结合蛋白3(chromodomain-helicase-DNA-binding protein 3,CHD3)属于ATP依赖性染色质调节域解旋酶DNA结合蛋白(CHD)家族之一,该家族包括9个成员,分为3个亚家族,CHD3、CHD4、CHD5属于第二亚家族(CHDII)[8]。CHD3也被称为Mi-2α,在皮肌炎患者中作为自身抗原被发现,随着皮肌炎的恶化,往往也会有其他并发症出现,主要是增加典型皮疹伴坏死性肌炎和恶行肿瘤的风险[9-10]。已有研究表明,CHD3是核小体重塑与去乙酰化(nucleosome remodeling and deacetylation,NuRD)复合物的核心酶亚基[11],该复合物利用CHD蛋白ATP水解产生的能量行使功能,广泛参与调控基因转录、细胞周期、细胞发育等重要的生物学过程[12-13]。在生物体生长发育过程中,CHD3基因具有重要的作用,Snijders等[14]报道CHD3基因突变与智力残疾、大头畸形、语言障碍等综合征相关;CHD3基因的突变也会导致神经发育异常、关节松弛、面部粗糙等疾病[15];CHD3通过C-端与ETs相关分子(ETs related molecular, ERM)相互作用,调控早老素蛋白1(presenilin 1)的表达[16]。
前期研究发现,在具有全身性皱皮的香猪CHD3基因中,3′-侧翼区存在一段264 bp核苷酸插入/缺失结构变异[6],为了探究CHD3基因3′-侧翼区264 bp结构变异对基因表达的影响,本试验以普通香猪、皱皮香猪和大白猪为研究对象,采用生物信息学、实时荧光定量PCR、Western blotting等方法探究该结构变异的结构特征、遗传多样性以及对表达的影响,解析与香猪皱皮性状的关系。
1 材料与方法
1.1 样品
150头普通香猪(XP)和30头皱皮香猪(XPZ)皮肤组织均采自贵州大山地生态养殖有限责任公司猪场,147头大白猪(LW)的皮肤组织采自贵州毕节市顺丰养殖场。
1.2 主要试剂及仪器
血液/组织基因组DNA提取试剂盒、胶回收试剂盒、2×TaqPCR MasterMix、Trizol试剂、反转录试剂盒、质粒提取试剂盒、实时荧光定量PCR试剂盒、DL2000 DNA Marker均购自天根生化科技(北京)有限公司;pGEM-T Easy Vector购自普洛麦格(北京)生物技术有限公司;皮肤组织总蛋白提取试剂盒(SA-01-SK)购自莱恩生物科技有限公司;BCA蛋白浓度测定试剂盒(P0010S)、极超敏ECL化学发光试剂盒(P0018FS)、SDS-PAGE凝胶快速配制试剂盒(P0012AC)购自上海碧云天生物技术有限公司;Anti-CHD3抗体(ab134125)和辣根过氧化物酶(HRP)标记的山羊抗兔IgG(ab205718)均购自Abcam公司;内参Anti-GAPDH抗体(AF7021)购自Affinity Biosciences公司;电泳仪(DYY-6C)购自北京六一生物科技有限公司;荧光及化学发光成像系统(ChemiScope 6000)购自上海勤翔科学仪器有限公司;PCR扩增仪(T100)、定量PCR仪(CFX96)均购自Bio-Rad公司。
1.3 CHD3基因结构变异片段生物信息学分析
运用miRBase在线软件下载猪对应的miRNA数据库,用miRanda软件预测CHD3基因结构变异片段所能结合的miRNA,设置结合的临界分数(Score≥120)和自由能(Energy≤―20 kJ/mol),分数越大,自由能越小,miRNA与mRNA结合能力越强;通过在线数据库RBPsuite对结构变异区域的RNA结合蛋白(RBP)进行分析,分数范围0~1,当分数>0.5时表示结合能力较强;利用UCSC Genome Browser Gateway软件分析重复元件(TEs)。
1.4 引物设计与合成
根据GenBank中猪CHD3基因序列(登录号:NC_010454.4),运用Primer Premier 5.0软件设计扩增结构变异位点的特异性引物和检测mRNA表达量的实时荧光定量PCR引物,引物信息见表1。引物均由英潍捷(上海)贸易有限公司合成。
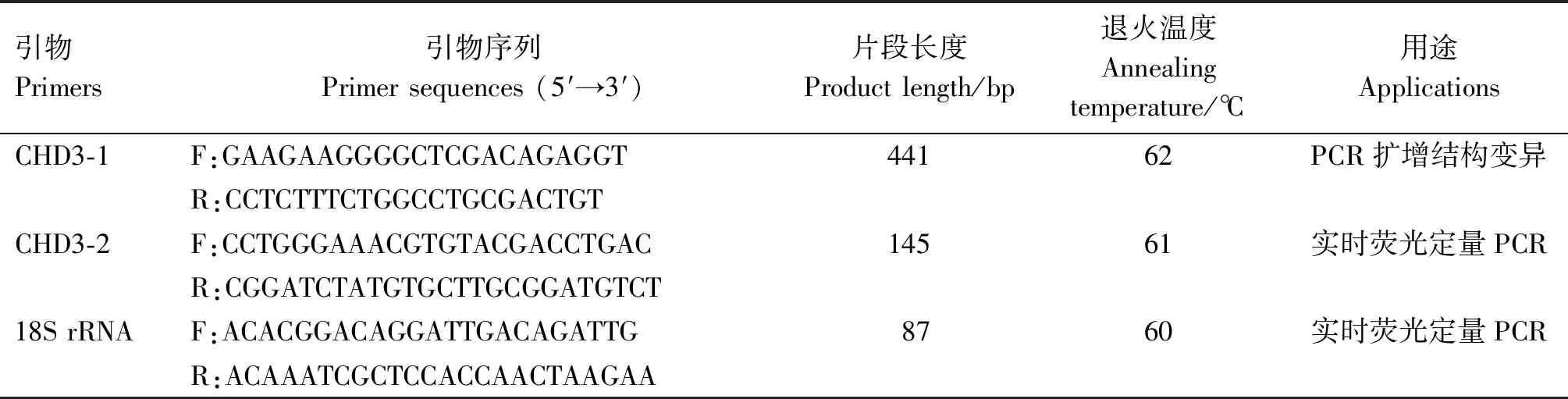
表1 引物信息
1.5 PCR扩增及基因分型
按照DNA提取试剂盒说明书提取所采集的普通香猪、皱皮香猪、大白猪皮肤组织的基因组DNA,用0.8%琼脂糖凝胶电泳检测基因组的完整性,检测合格的DNA分装后-20 ℃保存备用。
以皱皮香猪和普通香猪基因组DNA为PCR扩增模板,PCR扩增体系20 μL:2×TaqPCR MasterMix 10 μL,基因组DNA 1 μL,上、下游引物各0.2 μL,ddH2O 8.6 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸1 min,共36个循环;72 ℃延伸10 min;4 ℃保存。取适量PCR产物经2.0%琼脂糖凝胶电泳检测,胶回收后由北京擎科生物科技有限公司进行核苷酸序列测定。
1.6 CHD3基因结构变异群体分布频率检测
以3个猪群的基因组DNA为模板,采用PCR方法对每一个样品进行扩增,然后使用2.0%琼脂糖凝胶电泳检测,并记录CHD3基因结构变异在3个猪群体中的存在情况;用Excel 2019计算CHD3基因结构变异基因型频率和等位基因频率,用SPSS 22.0软件中的χ2检验分析CHD3基因结构变异是否处于Hardy-Weinberg平衡状态。
1.7 实时荧光定量PCR检测CHD3基因表达量
根据Trizol法分别提取香猪3种基因型皮肤总RNA,反转录合成cDNA,以18S rRNA为内参,采用实时荧光定量PCR检测CHD3基因表达量。PCR反应体系10 μL:cDNA 1 μL,上、下游引物(10 pmol/μL)各0.2 μL,2×SYBR Green Supper Mix 5 μL,ddH2O 3.6 μL。PCR反应条件:95 ℃预变性10 min;95 ℃变性15 s,61 ℃退火30 s,共40个循环。熔解曲线:从65 ℃升高到95 ℃,以0.5 ℃/5 s速率上升。采用2-ΔΔCt方法计算基因的相对表达量。
1.8 CHD3蛋白表达量检测
根据蛋白提取试剂盒说明分别提取香猪3种基因型皮肤总蛋白,按BCA蛋白浓度检测试剂盒说明测定蛋白浓度;进行SDS-PAGE,将蛋白带转移到PVDF膜上,封闭1 h,与Anti-CHD3(1∶4 000)、Anti-GAPDH(1∶4 000)在4 ℃孵育过夜,然后与HRP标记的山羊抗免IgG(1∶4 000)在常温孵育2 h,使用极超敏ECL化学发光试剂盒检测并拍照保存。
1.9 数据统计与分析
用ImageJ 1.8.0软件计算蛋白条带灰度值,用GraphPad Prism 8.0对实时荧光定量PCR和Western blotting结果进行单因素方差分析(One-Way ANOVA),Tukey法进行组间多重比较。结果用平均值±标准差表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 生物信息学分析
2.1.1CHD3基因结构变异区域miRNA结合位点分析 利用miRBase和miRanda软件预测miRNA的结合位点,结果显示在CHD3基因结构变异片段上,分数≥120,且自由能≤-20 kJ/mol的miRNA,共35个(表2)。

表2 CHD3基因结构变异区域miRNA结合位点

续表
2.1.2CHD3基因结构变异区域RBP结合位点分析 利用RBPsuite软件对RNA结合蛋白(RBP)进行分析,结果显示,当分数≥0.5,共有10个RBPs能结合到CHD3基因结构变异片段上,且锌指RNA结合域蛋白2(ZRANB2)和肉瘤融合蛋白(FUS)这2个RBPs在结构变异片段上分别有2个结合位点(表3)。
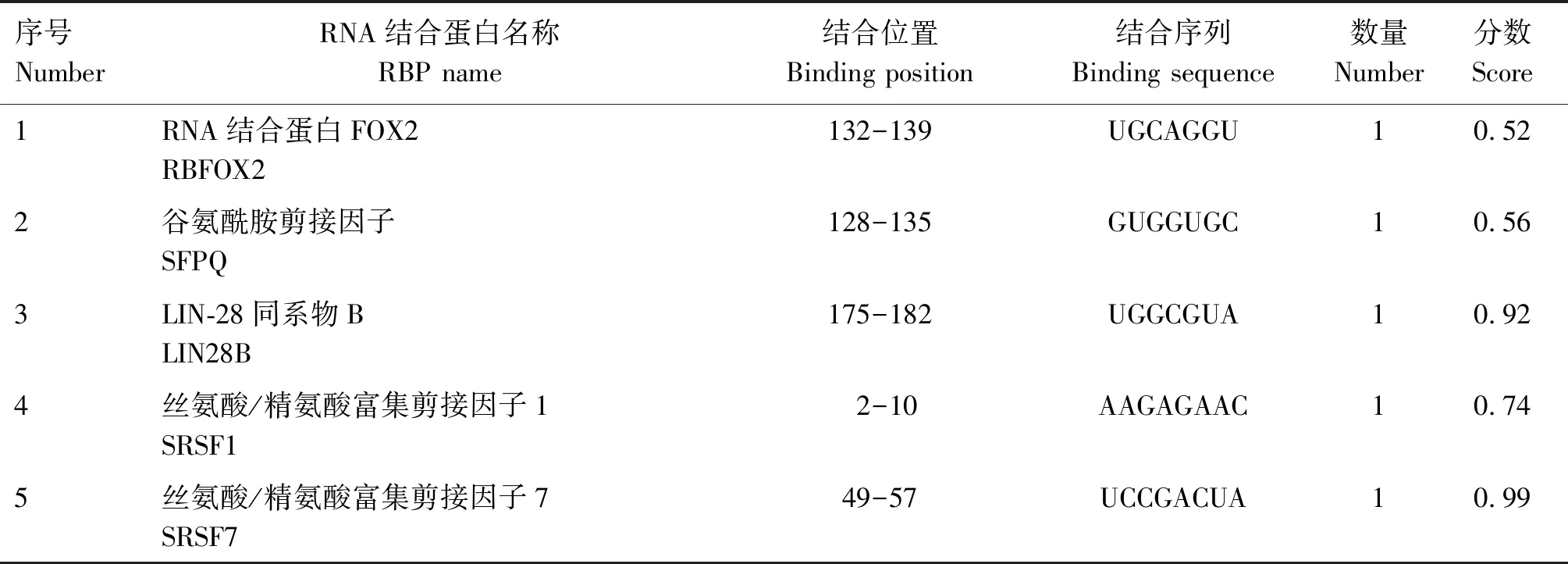
表3 CHD3基因结构变异区域RBP结合位点

续表
2.1.3CHD3基因结构变异片段的重复元件分析 利用UCSC Genome Browser Gateway软件对CHD3基因序列进行重复元件分析,结果显示,在CHD3基因结构变异区间存在1个254 bp的短散在元件(short interspersed element, SINE),属于tRNA家族,位于Chr12:53 115 742-53 115 995。
2.1.4CHD3基因结构变异分析 根据CHD3基因结构变异上的SINE元件位置和miRNA、RBP结合的位置,对其做了一个示意图(图1),从图1中可以清晰地看出扩增CHD3基因结构变异的上、下游引物位置、结构变异序列、SINE元件位置,同时还分别列举了3个miRNA和3个RBP在结构变异序列上的结合位置,miRNA依次是miR-7137-5p、miR-676-5p、miR-9806-5p,RBP依次是RBFOX2、FXR2、IGF2BP1;箭头所指是CHD3基因结构变异序列插入/缺失的位点(图1)。

①波浪下划线标出的是引物序列,灰色背景标出的是CHD3基因结构变异序列(染色体位置Chr12:53 115 726-53 115 989),直线加粗下划线标出的是SINE元件(染色体位置Chr12:53 115 742-53 115 995);直角矩形框内是列举的3个miRNAs结合位点,圆角矩形框内是列举的3个RBPs结合位点。②箭头所指为CHD3基因结构变异序列插入/缺失位点①Wavy underline is primer sequence, gray background is CHD3 gene structural variation sequence (chromosome position Chr12: 53 115 726-53 115 989), bold line underline is SINE element (chromosome position Chr12: 53 115 742-53 115 995); Three miRNA binding sites are listed in the rectangular box, and three RBP binding sites are listed in the rounded rectangular box. ②The arrow indicates the insertion/deletion site of structural variation sequence of CHD3 gene图1 CHD3基因结构变异分析示意图Fig.1 Schematic diagram of structural variation analysis of CHD3 gene
2.2 CHD3基因结构变异片段的检测
为了验证CHD3基因结构变异是否真实存在,以普通香猪和皱皮香猪基因组DNA为PCR扩增的模板,扩增出177和441 bp 2条条带(图2),将2条带分别胶回收并进行测序,测序结果与预期大小一致;将2个条带的DNA序列比对到猪的参考基因组(Scrofa11.1),结果显示与参考基因组序列相似性为99.5%。将大片段(441 bp)定义为I等位基因(插入型),将发生缺失结构变异的片段(177 bp)定义为D等位基因(缺失型)。
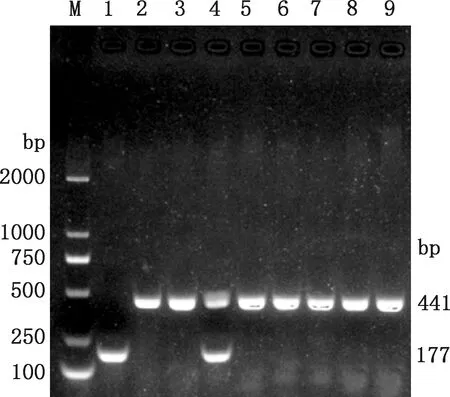
①1~5,皱皮香猪;6~9,普通香猪。②M,DL2000 DNA Marker;1,DD型;4,ID型;2、3、5~9,II型①1-5, Xiang pigs with wrinkle skin; 6-9, Ordinary Xiang pigs. ②M,DL2000 DNA Marker;1,DD genotype;4,ID genotype;2, 3, 5-9,II genotype图2 CHD3基因结构变异位点的PCR检测Fig.2 PCR detection of CHD3 gene structural variation sites
2.3 CHD3基因结构变异群体分布频率检测
利用PCR的方法检测CHD3基因的分布情况,在3个猪群体中都检测到了3种基因型(DD型、ID型、II型);皱皮香猪、普通香猪、大白猪的D等位基因频率分别是30.0%、6.7%、4.8%,皱皮香猪D等位基因频率极显著高于普通香猪、大白猪(P<0.01),普通香猪D等位基因频率显著高于大白猪(P<0.05)(表4)。
Hardy-Weinberg平衡检验结果显示,CHD3基因结构变异在皱皮香猪和普通香猪中处于Hardy-Weinberg平衡状态(P>0.05),在大白猪中处于Hardy-Weinberg不平衡状态(P<0.05)(表4)。
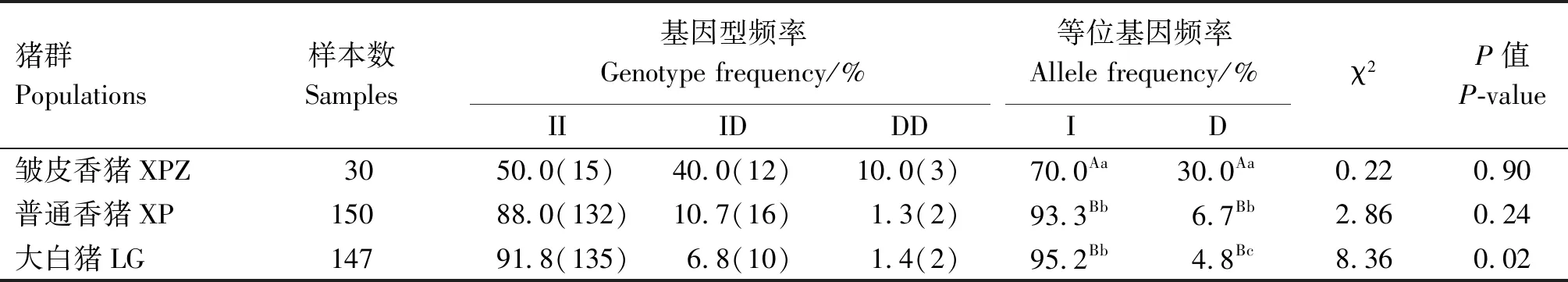
表4 猪群中CHD3基因结构变异的频率分布
2.4 CHD3基因的表达分析
实时荧光定量PCR检测香猪皮肤中CHD3基因mRNA表达量,结果显示DD基因型和ID基因型均极显著高于II基因型(P<0.01),DD基因型的mRNA表达量高于ID基因型,但是差异不显著(P>0.05)(图3)。

**,差异极显著(P<0.01);无*,差异不显著(P>0.05)。下同**,Extremely significant difference (P<0.01);No *,No significant difference (P>0.05). The same as below图3 不同基因型香猪CHD3基因相对表达量Fig.3 Relative expression of CHD3 gene in Xiang pigs of different genotypes
Western blotting检测香猪皮肤中CHD3蛋白表达量,结果显示DD基因型和ID基因型蛋白表达量均极显著高于II基因型(P<0.01),DD基因型蛋白表达量高于ID基因型,差异不显著(P>0.05)(图4)。
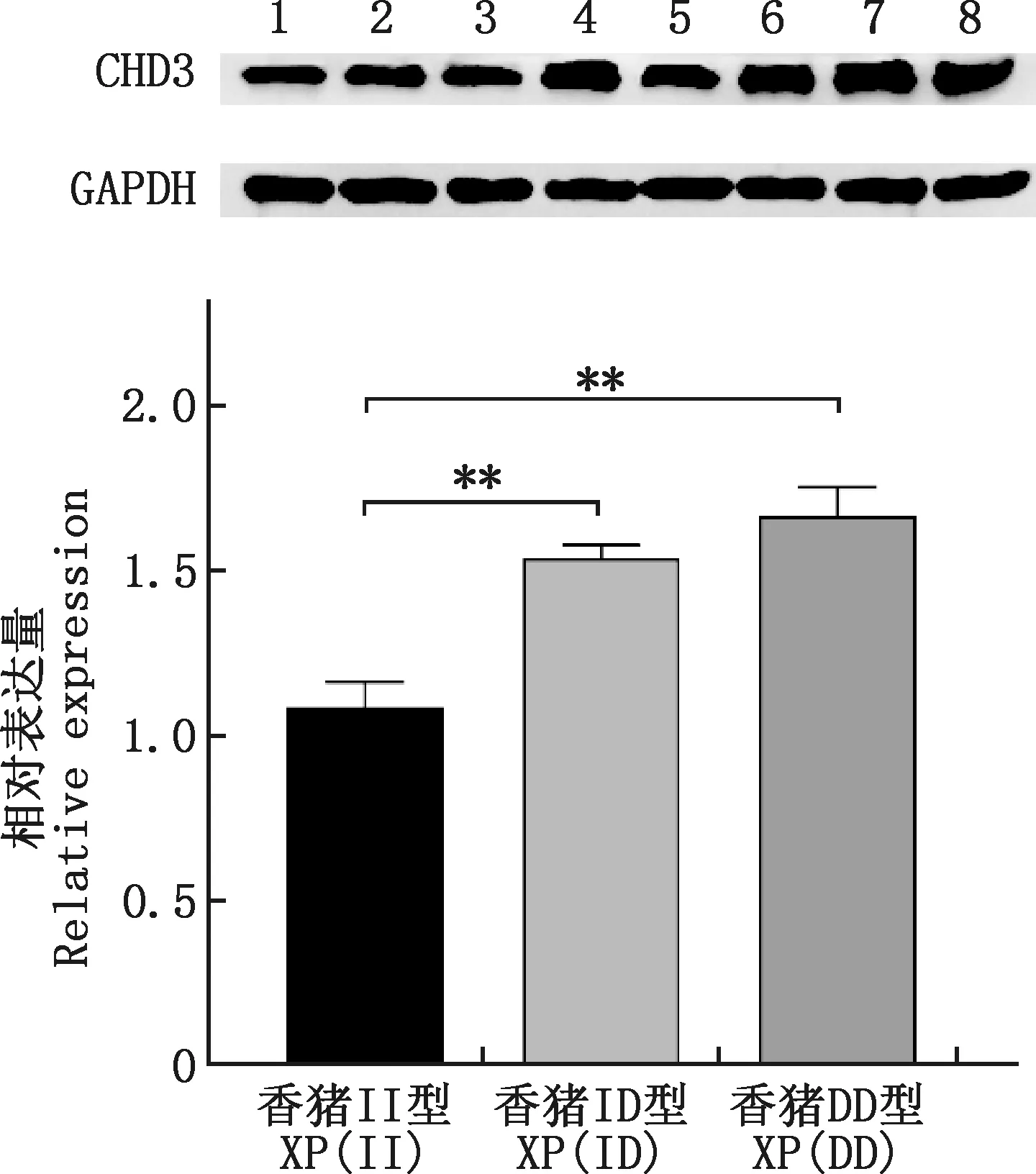
1~3,香猪II基因型;4、5,香猪ID基因型;6~8,香猪DD基因型1-3, Genotypes II of Xiang pigs; 4 and 5, Genotypes ID of Xiang pigs; 6-8, Genotypes DD of Xiang pigs图4 不同基因型香猪CHD3蛋白表达水平Fig.4 Expression of CHD3 protein in Xiang pigs of different genotypes
3 讨 论
CHD3蛋白是皮肌炎患者中的自身抗原,皮肌炎主要表现为皮肤损伤和肌肉无力。有研究证明,在皮肌炎患者中,基质金属蛋白酶(MMP)表达水平上调,细胞外基质(extracellular matrix,ECM)被大量降解[17],细胞外基质的主要成分包括胶原蛋白和弹性蛋白,它们的主要作用是维持皮肤、器官、组织的形状,使其不易变形,皮肤中ECM的减少是皱纹形成的重要原因[18]。研究发现,CHD4通过调控纤溶酶的活性,对ECM的水解产生影响[19],CHD3和CHD4的结构和氨基酸序列高度相似[20],推测具有相似的调控功能。核小体重塑和脱乙酰酶(NuRD)复合物是细胞中发现的主要染色质重塑复合物之一,它在调节基因转录、基因组完整性和细胞周期进程中起着重要作用,通过其对这些基本细胞过程的影响,越来越多的证据表明,这种大分子复合物活性的改变可导致发育缺陷、癌症和加速衰老[21-23]。NuRD含有多种组分,包括CHD3(或CHD4)以及HDAC1/2、MTA2/3和MBD2/3等多种阻遏因子,CHD3、CHD4是NuRD复合体的活性亚单位(核小体重塑和脱乙酰酶活性),这些蛋白质形成不同的CHD3和CHD4-NuRD复合物,它们不仅能抑制特定靶基因的基因转录,还可以激活特定靶基因的基因转录[20]。之前的研究表明,在香猪中CHD3基因的3′-侧翼区具有一段264 bp核苷酸插入/缺失结构变异[6]。为了证实猪群体中存在的这一结构变异,检测了2个猪品种3个群体中264 bp结构变异的基因型,包括普通香猪、皱皮香猪和大白猪。结果表明,CHD3基因的264 bp结构变异多态性在香猪和大白猪中普遍存在,并且在皱皮香猪、普通香猪、大白猪中的基因型频率不同。I等位基因频率为大白猪>普通香猪>皱皮香猪,而D等位基因频率是皱皮香猪>普通香猪>大白猪。CHD3基因3′-端264 bp结构变异在皱皮香猪和普通香猪中处于Hardy-Weinberg平衡状态,在大白猪中处于Hardy-Weinberg不平衡状态,表明这一结构变异在香猪群体中是随机变异,而大白猪中不是随机的,而是高度人工选择的结果。
生物信息学分析显示,CHD3基因264 bp插入/缺失结构变异位于该基因的3′-侧翼区(mRNA的3′-UTR),属于tRNA家族的SINE元件,该元件序列含有35个miRNAs结合位点、10个RBPs结合位点。SINE是由RNA聚合酶Ⅲ转录的真核非自主逆转录转座子[24],并可逆转录成DNA插入基因组中的新位点,约占哺乳动物基因组的10%,因此,它们在基因组的结构组织、生物过程的协调乃至物种的多样性和进化中发挥着关键作用[25]。SINE可以影响mRNA从细胞核的输出、mRNA翻译以及mRNA的衰变[26];当SINE在3′-UTR中存在时,它可以通过Staufen蛋白介导mRNA衰变,从而使mRNA降解[27],Staufen蛋白属于双链RNA结合蛋白家族,有2个同源蛋白,即Staufen1和Staufen2,Staufen2可以与mRNA的3′-UTR区结合,诱导mRNA降解[28]。miRNA是基因转录后表达调控的重要分子,通常与mRNA的3′-UTR区结合来抑制mRNA翻译或者促使mRNA降解[29]。本研究结果显示,CHD3基因中D等位基因的存在导致该基因表达增强,蛋白丰度增加,I等位基因的表达低于D等位基因,推测I等位基因由于SINE元件的存在,通过RNA结合蛋白调节CHD3基因的mRNA稳定性,诱导mRNA降解,而miRNA进一步抑制CHD3基因的mRNA翻译,从而导致含有SINE元件的CHD3基因的mRNA和蛋白表达均低于缺失SINE元件的CHD3基因。由于D等位基因缺失SINE元件,miRNA和RBP失去了对基因表达调控的功能,使CHD3基因表达上调。
在ATM介导的DNA损伤修复研究中发现,CHD3蛋白的一个亚型CHD3.1通过其C-端与KAP-1相互作用维持染色质压缩状态[30-31],阻碍DNA损伤修复,通过ATM依赖性KAP-1磷酸化后(pS824-KAP-1),消除了CHD3和KAP-1的相互作用,CHD3蛋白从染色质上释放,异染色质逐渐松弛,损伤修复才得以进行[32]。同时,在ATM-KAP-1信号通路介导的染色质修复过程中CHD3具有一定的阻碍作用[33]。在小鼠早衰模型研究中,当ATM-KAP-1信号通路异常,会导致小鼠胚胎成纤维细胞的衰老,加速小鼠的早衰[34-35]。由以上推测CHD3基因的异常表达可能会间接导致动物衰老。本研究发现,香猪皮肤组织中,CHD3基因和蛋白的表达量均为DD基因型>ID基因型>II基因型,表明该结构变异促使CHD3基因表达量上调,该基因的表达上调可能会导致NuRD功能或者ATM-KAP-1信号通路的异常,影响相关靶基因的乙酰化水平,阻碍损伤位点修复和染色质重塑,从而诱导细胞凋亡,加速细胞的衰老。同时等位基因频率结果显示,皱皮香猪中CHD3基因结构变异D等位基因频率极显著高于普通香猪和大白猪。由以上论述推测CHD3基因结构变异可能与香猪皱皮形成有关。
4 结 论
猪CHD3基因的3′-侧翼区264 bp插入/缺失结构变异在香猪和大白猪中呈现多态性,皱皮香猪的D等位基因频率大于普通香猪和大白猪,该结构变异属于tRNA家族的SINE元件,含35个miRNAs和10个RBPs结合位点,参与CHD3基因的表达调控,皱皮香猪CHD3基因中该元件的缺失,导致CHD3基因的异常表达和积累,可能是香猪皱皮形成的重要因素之一。

