红参多糖对1型糖尿病小鼠的降血糖作用研究
曲 孟, 张 露, 齐 欣, 崔承弼
(延边大学 农学院,吉林 延吉 133002)
糖尿病作为临床常见的慢性疾病之一,会引起一系列的并发症[1],在发达国家已成为危害人们健康的3大疾病之一[2]。我国糖尿病患者的数量位居世界第1[3],全球约有4.24亿人患病,预计到2030年将增加到5.52亿[4]。糖尿病可累及各年龄和种族的人,临床诊断靠症状和空腹或随机血糖 (有时需做葡萄糖耐量试验)判断,有3种主要类型——胰岛素依赖型(1型)、非胰岛素依赖性型(2型)和妊娠糖尿病。
1型糖尿病又称胰岛素依赖型糖尿病[5],而且大部分认为是2种因素彼此长时间作用的结果,这2种分别是遗传因素和环境因素。其发病特点有3种,在儿童和青少年时期发病频繁、发病急、必须要使用胰岛素[6]。长期使用不仅有依赖性,而且也具有不小的副作用,因此,依赖性低、安全性高、不良反应少的植物多糖和微生物多糖已成为许多糖尿病饮食治疗研究者的研究方向[7]。有研究表明[8],总胆固醇(TC)、甘油三酯(TG)和糖化血红蛋白(GHb)[9]指标的下降能显著改善糖尿病小鼠脂代谢紊乱。α-葡萄糖苷酶(α-GC)是一类通过带有α-糖苷键底物中的非还原端进行催化水解一种叫做α-葡萄糖基的酶的总称[10]。它起着很重要的作用,与糖尿病有着密切联系[11]。
红参为人参的根部蒸干所制[12]。红参中有许多活性成分,其中有一项很主要的成分那就是红参多糖,而且其在红参中所含有的成分较多[13]。最近几年,植物多糖越来越被人们看重,经药理研究表明[14],多糖具有较好的抗病毒、降血糖、抗肿瘤、免疫调节和抗炎等方面的生物活性[15-16],而且它的毒副作用相对较小[17]。红参多糖作为红参中主要成分之一[18],其生物活性也是多种多样的。
很多关于植物多糖降血糖的文献报道,随着药物中多糖浓度的增加或其他复合配方成分的添加,其降血糖效果也随之增加,而目前关于红参多糖的研究甚少,故该试验采用红参多糖对糖尿病小鼠进行治疗,研究对比不同剂量的红参多糖对患糖尿病小鼠的降血糖效果,以及对其糖耐量(OGTT)、GHb、TC、TG、α-GC、脏器系数等相关指标是否具有影响,目的在于探索红参多糖的降血糖作用,为治疗糖尿病提供参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
1) 材料:用5年生人工种植的人参制作红参,延边韩工坊健康制品有限公司。
2) 试剂:NaCl注射液(0.9%),于吉林康乃尔药业有限公司购入;柠檬酸、柠檬酸钠,AR级,于天津东华试剂厂购入;盐酸二甲双胍片,纯度以C2H22N5·HCL记0.5 g/片,于天方药业有限公司购入;链脲佐菌素(STZ),纯度≥98%(HPLC),于美国SIGMA公司购入;葡萄糖粉剂,购于广西梧州制药有限公司。
3) 试剂盒:糖化血红蛋白(GHb)试剂盒、总胆固醇(TC)试剂盒、α-葡萄糖苷酶(α-GC)活性检测试剂盒、甘油三酯(TG)试剂盒,于南京市建成生物研究所购入。
1.1.2 动物
雄性昆明小鼠40只,体重为18~20 g左右,在恒温温度大约为20~25 ℃、 相对湿度为(55±10)%的食品研究中心动物室内进行适应性喂养7 d,自由摄食和饮水,多笼饲养。 喂养所用的饲料、垫料等一些基础用品由延边大学实验动物中心提供。
1.1.3 仪器
水浴锅:OSB-2100-CE型,于东京理化器械株式会社购入;离心机:TG16A-WS型,于上海卢湘仪器有限公司购入;实验型冷冻干燥机:LyoQuest -55型,于西班牙Telstar集团购入;血糖仪:AG-605型,于天津市九安医疗公司购入;真空泵:DTC-22B型,于日本Uluac Kiko公司购入;落地式连续投料粉碎机:DF-35型,于温岭市林大机械有限公司购入;冷凝器:CCA-1111-CE型,于东京理化器械株式会社购入;涡旋混匀器:MS 3 basic型,于德国IKA集团购入;1次性无菌注射器:规格为1 mL,于上海金塔医用器材有限公司购入。
1.2 方法
1.2.1 红参的预处理、红参多糖的提取及测定
1) 预处理:将粉碎处理后的红参,过60目筛,进而得到红参粉末,随即进行称量。
2) 红参多糖的提取:利用热水浸提法[19],按照料液比1∶15(g∶mL),放置水浴锅中浸提,温度为100 ℃、浸提时间为4 h,取出静置冷却至室温后将滤液3 500 r/min离心10 min,将得到的上清液进行过滤,把得到的滤液蒸发浓缩,然后将制得的红参多糖浓缩液放入-80 ℃冰箱中进行冷冻,再进行冷冻干燥的操作,将冻干之后所得到的提取物粉末密封并储存,以备后续实验。
3) 葡萄糖标准曲线的绘制:采用105 ℃干燥至恒重的D-葡萄糖作为对照品,并精密的称取25 mg,然后加入适量水溶解D-葡萄糖,并将其定容到25 mL容量瓶中,然后翻转摇匀,就会得到葡萄糖储备液,浓度含量1 mg/mL。精密量取所得到的葡萄糖储备,分别量取6种含量的葡萄糖液置于25 mL容量瓶中,采用了0.3、0.6、0.9、1.2、1.5和1.8 mg这6种含量,用蒸馏水稀释到刻度,然后得到了不同浓度(12、24、36、48、60、72 μg/mL)的葡萄糖标准溶液。将各浓度的葡萄糖标准溶液都进行精密量取,各量取2 mL,然后加入1 mL的质量分数为5%的苯酚溶液,摇晃均匀之后立刻加入5 mL的浓硫酸,摇匀,在沸水浴中加热20 min进行显色反应,在最大吸收波长490 nm处测定吸光度,用蒸馏水做空白对照,制图,求得标准曲线及回归方程。
4) 苯酚-硫酸法测定红参多糖:用分析天平精密的称取人参多糖粉末纯品10 mg,放在10 mL容量瓶中用蒸馏水定容。量取红参多糖提取液约2.0 mL,称取配置好的5%苯酚溶液1 mL倒入其中,摇晃将两者混匀,快速的加入浓硫酸5 mL后涡旋至混合溶液澄清不浑浊,在沸水浴中进行加热显色反应持续20 min,然后将其静置在室内冷却至室温。在最大吸收波长490 nm处测定吸光度(OD值),用蒸馏水做空白对照,带入标准曲线求得浓度C[20]。
1.2.2 糖尿病小鼠模型的构建
1) 链脲佐菌素(STZ)配置:量取STZ分装在离心管中,采用1.5 mL规格的离心管,每管放12 mg的STZ,用锡纸将分装后的离心管包裹起来。 将按照比例配置好的柠檬酸和柠檬酸钠缓冲溶液(0.1 mol/L,pH值4.3~4.4) 溶解STZ, 配置成12 mg/mL注射液,将两者充分摇晃达到混匀的效果,在避光的条件下放置在冰浴储存,现配现用。
2) 小鼠造模:对小鼠适应性喂养7 d后,对所有的小鼠正常饮水禁食12 h,进食过夜,测量小鼠体重以及空腹血糖水平,依据体重进行一次性大剂量腹腔注射12 mg/mL的STZ(剂量为120 mg/kg·BW),建立1型糖尿病模型,将柠檬酸-柠檬酸钠缓冲溶液同时注射给空白组所有小鼠进行假性处理。每组需在30 min内完成注射,注射结束后1 h恢复各组小鼠的进食[21]。
在造模后的第4天将所有小鼠进行禁食,之后测量小鼠的体重和空腹血糖值,11.1 mmol/mL 是血糖限值,超过11.1 mmol/mL即为高血糖,所以造模成功就是指所测得的空腹血糖值高于11.1 mmol/mL。成功即为1型糖尿病小鼠,同时将血糖值低于11.1 mmoL/mL的造模未成功的小鼠剔除[22]。
1.2.3 糖尿病小鼠分组
小鼠造模成功后,将小鼠按体重随机分为6组,每组5只,每日按不同浓度灌胃给药1次,按照小鼠体重的变化适当调节药的剂量,空白组和阴性组不给药,灌胃给蒸馏水。在为期30 d的灌胃期间每天都要记录小鼠的体重、食物和水的摄入量。参考相关试验[23]后对红参多糖浓度的设置和小鼠每日允许摄入量进行设计(表1)。

表1 小鼠分组及灌胃剂量
1.2.4 动物实验流程
小鼠造模成功后,每天都要进行灌胃给药以及测量体重、摄食量和饮水量,每周需要定期进行空腹血糖的测量,4周后,最后1次测量小鼠的空腹血糖值,并且进行口服葡萄糖耐量试验,然后对小鼠进行眼球取血,将血液收集在1.5 mL的离心管中,放置在冰上,降低温度放置凝固,随即脱颈处死,解剖,取其肾、脾、肝、心脏用0.9%的NaCl溶液冲洗脏器表面并测湿重。将收集的血液进行离心处理,将离心所得到的血浆和血细胞分开保存留用之后进行各项指标的测定。
1.2.5 指标测定
1) 灌胃期间小鼠的饮水量、摄食量和体重的测定:在灌胃的30 d期间,每天连续不断测量小鼠的体重、摄食量、饮水量变化并记录。其中食物效价计算方法:
食物效价=小鼠体重增加量/小鼠摄食量
2) 小鼠空腹血糖的测定:对小鼠进行12 h的隔夜禁食之后,将各组小鼠的尾巴剪去末端一小段,用血糖仪蘸取血液进行取血,测量其空腹血糖值然后将血糖值细心记录,要求放弃尾端冒出的第1滴血,以第2滴血液所测得的血糖值为准。
3) 口服葡萄糖耐量的测定:最后1次灌胃后隔夜禁食12 h,经口按照剂量为2 g/kg·BW 1次性大剂量葡萄糖溶液灌胃后,每30 min测量1次血糖值持续观察2 h,并记录。
4) 脏器系数的测定:解剖小鼠取其肾、脾、肝、心脏并测湿重。其重量即为小鼠的脏器系数。
5) 生化指标的测定:将冰浴保存的血液和肝脏取出,按照试剂盒的使用方法进行操作,测定吸光值,求得TC、TG、GHb和α-GC含量。
1.3 统计学分析
2 结果与分析
2.1 红参水提多糖的提取率及纯度
红参粉末经水提后得到的红参多糖,提取率为41.24%。
吸光值(OD值)为0.445 7,带入葡萄糖标准曲线y=0.631 6 x+0.142 6得到红参多糖含量为47.99%。
2.2 红参多糖对小鼠基础指标的影响
试验期间通过对比各组观察发现,空白组所用垫料干燥,小鼠毛发健康,体重迅速增长,体重最重,显著高于注射STZ的各组小鼠(P<0.05);阴性组小鼠的摄食量和饮水量显著高于其他各组。所用物料严重浸湿,小鼠毛发枯黄粗糙,身材瘦小;各组状态随给药次数的增加而有所改善。
由表2可知,空白组小鼠体重最重,食物利用率最高,阴性组食物利用率最低,其余给药组随着灌胃给药次数的增加食物利用率逐渐提高。

表2 试验期间对各组小鼠体重及摄食饮水的影响(n=5)
2.3 红参多糖对小鼠血液指标的影响
2.3.1 对小鼠空腹血糖的影响
由图1可知,造模之前,各组小鼠空腹血糖无明显差异,造模成功后,未给药时,各组小鼠空腹血糖值均高于11.1 mol/L。灌胃给药后,阳性组和红参多糖高中低剂量组血糖值均有所下降,且随给药次数的增加血糖值逐渐降低,空白组血糖仍保持较低,阴性组血糖值逐渐升高。其中,红参多糖高剂量组对糖尿病小鼠的降血糖效果显著,与盐酸二甲双胍的降血糖效果相近,因为效果相近就可以证明红参多糖高剂量组对糖尿病小鼠的降血糖效果较好,说明对糖尿病小鼠降血糖可以起辅助的作用。
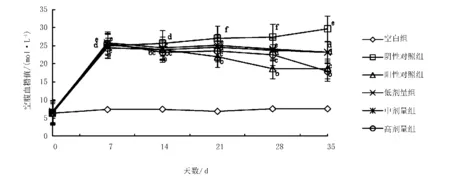
注:标有相同字母表示差异不显著(P>0.05),标有不同字母表示差异显著(P<0.05)。
2.3.2 对小鼠糖耐量的影响
由图2可知,在30~60 min各组小鼠血糖水平均迅速上升,阳性组和空白组在60 min时达到了峰值,60~90 min时,阴性组和红参多糖高中低剂量组持续缓慢上升,在90 min时达到峰值,60~120 min时,空白组和阳性组呈下降趋势,90~120 min时,红参多糖高中低剂量组下降趋势与阳性组呈下降趋势相似。由此得出红参多糖高剂量组对小鼠糖耐量的改善效果较好。

注:标有相同字母表示差异不显著(P>0.05),标有不同字母表示差异显著(P<0.05)。
2.3.3 对小鼠TC、TG、GHb、α-GC的影响
红参多糖对小鼠TC、TG、GHb和α-GC的影响见表3。空白组的TC、TG和GHb的含量最低,相反阴性组的最高。红参多糖低剂量组、中剂量组和高剂量组因给药的浓度依次上升,TC、TG和GHb的含量逐渐下降,红参多糖高剂量组和阳性对照组的TC、TG和GHb值均无显著性差异(P>0.05),但是红参多糖高剂量组与阴性对照组均具有显著性差异(P<0.05)。

表3 红参多糖对TC、TG、GHb及α-GC的影响
α-葡萄糖苷酶活性在空白组中最低,阴性组中最高,红参多糖低剂量组、中剂量组和高剂量组随着给药的浓度上升,α-葡萄糖苷酶活性逐渐下降,其中,给药组与阴性组均差异显著(P<0.05)。因此,不同浓度红参多糖在一定程度上能够抑制α-葡萄糖苷酶活性,从而达到降低血糖值的作用。
2.4 红参多糖对小鼠脏器系数的影响
红参多糖对小鼠脏器系数的影响见表4。红参多糖给药各组心脏脏器系数和脾脏脏器系数与阳性组均无显著性差异(P>0.05)。肝脏脏器和肾脏脏器系数均在造模后显著增加(P<0.05),由此得出,红参多糖对小鼠的心脏和脾脏影响不大。此外,阴性组的肾脏和肝脏系数明显最高,显著高于其他组(P<0.05),红参多糖高剂量组能够显著降低肾脏系数和肝脏系数(P<0.05),因此,红参多糖可有效缓解糖尿病小鼠的肝肾肿大现象,不同浓度剂量中,红参多糖高剂量组的效果最好。
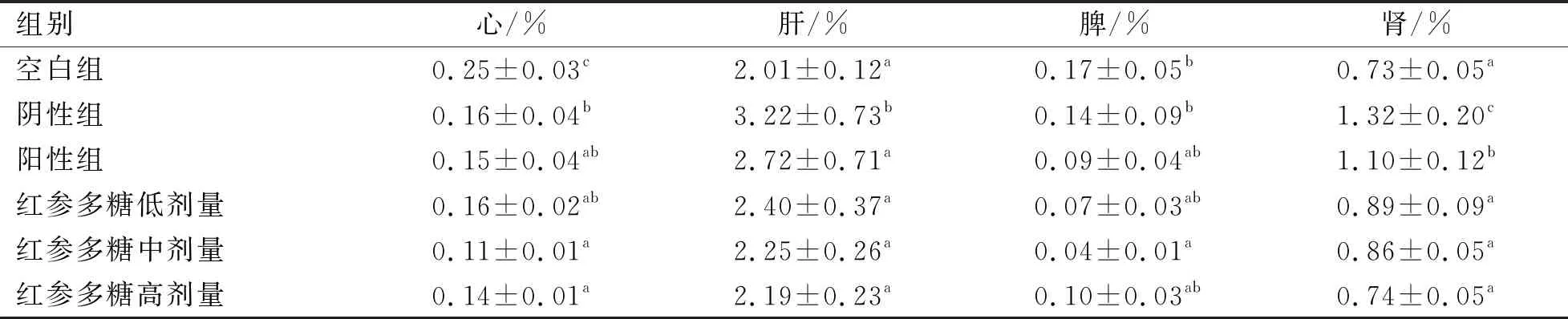
表4 对各组小鼠脏器系数的影响
3 讨论与结论
到目前为止,红参多糖的提取方法有很多,研究红参多糖提取方法的也有很多,比如常规法、超声波提取法[24]、微波萃取法等[25]。有研究比较了水提法、酸提法、碱提法对红参多糖的提取效果,结果表明酸碱对红糖存在破坏作用,还是水提法效果比较显著[26]。该试验采用的是水提法,以浸提温度100 ℃,浸提时间4 h,液料比15∶1(mL∶g)对红参粉末进行试验提取红参多糖。于雷等[23]研究了红参多糖降血糖血脂的作用,测定小鼠的血糖值和血脂4项,结果表明,红参多糖各剂量组与对照组相比,具有降血糖降血脂作用。该实验则更专注于对糖尿病小鼠的降血糖作用,通过测得空腹血糖值、TC、TG、GHb、α-葡萄糖苷酶活性、脏器系数以及观察垫料和小鼠毛发情况可以得出,红参多糖具有对糖尿病小鼠的降血糖作用;李瑞刚等[27]对红参和人参皂苷协同降血糖作用进行了研究,结果表明,协同给药时,人参皂苷Rb1降血糖和降血脂的作用会随着红参多糖剂量的增加而有所增强。该试验将目标单独放在了红参多糖的降血糖活性并得出随着红参多糖剂量的增加,降血糖作用也显著增强。
有研究验证肝肾系数降低表示对肝肾有保护作用[28],在该试验中脏器系数结果表明,红参多糖可有效缓解糖尿病小鼠的肝肾肿大现象,并对心脏和脾脏影响不大。空腹血糖值、TC、TG、GHb和α-葡萄糖苷酶活性均为验证降血糖作用的指标[29],α-葡萄糖苷酶是食物中碳水化合物水解的关键酶,其活性降低有利于减少碳水化合物转化为糖[30]。该试验结果显示上述指标均显著下降,并且随着红参多糖浓度的增加降血糖效果更为显著,证实了红参多糖具有降血糖作用,该结果与前人研究一致。综上所述,红参多糖具有降血糖的作用,但其具体的作用机制还需进一步探究。

