水飞蓟素治疗药物性肝损伤的“药效—靶标”作用网络分析*
郑世榜 邱 华 李永强 廖思娜 廖小莉
广西医科大学附属肿瘤医院,广西南宁市 530021
药物性肝损伤(Drug-induced liver injury,DILI)是药物、膳食补充剂和保健品引起常见的不良反应之一。研究表明,中国的药物性肝损伤的发生率达到每10万人口就有约24人发病,而抗肿瘤药物是引起DILI的第三大常见原因,占比8.34%[1]。临床上常因药物性肝损伤而导致抗肿瘤治疗时间延长或者抗肿瘤药物剂量降低,从而影响患者的治疗效果,是目前临床亟待解决的热点问题之一。
水飞蓟素是水飞蓟(归肝、胆经)的主要成分,是一种天然保肝的黄酮类化合物。它可通过抗氧化、抗炎、免疫调节、抗纤维化、刺激肝脏细胞再生等而发挥保肝作用[2]。中华医学会的药肝诊治指南对DILI的保肝推荐药物中水飞蓟素是一线推荐用药[3]。水飞蓟制剂肝病临床应用专家共识提出对药物性肝损伤,特别是毒蕈中毒所致肝损伤,首先推荐使用水飞蓟素治疗;使用水飞蓟素可预防或减少抗结核药物所致药物性肝损害[4]。
然而不同药物导致的肝损机制是不同的,且护肝药物的疗效也是不一样的,鉴于水飞蓟素具有多靶点的特点,为进一步更好指导临床用药,将采用网络药理学以及分子对接的方法来筛选并且探讨水飞蓟素抗药物性肝损伤主要的药效靶点,为DILI的精准治疗提供参考。
1 资料与方法
1.1 水飞蓟素靶点获取 利用TCMSP数据库获取水飞蓟素对应的靶点蛋白信息输入 Uniprot数据库,将目标蛋白转化为“智人”物种以及选择对应已验证的基因符号,从而进行靶点蛋白和基因匹对,获得作用靶点,在CTD数据库中以水飞蓟素为关键词,初筛水飞蓟素的作用靶点,将上述靶点合并且删除重复靶点后,获取水飞蓟素作用靶点。
1.2 DILI疾病基因获取及治疗靶点的筛选 运用GEO数据库下载芯片数据原始文件GSE54255,此芯片收集5例药物性肝损伤肝脏切片和5例正常对照肝脏切片的基因测序信息的样本,利用R语言软件中的limma 包分析差异基因,设置调整后的P<0.05和|log 2倍变化(FC)|>1为截断阈值。差异分析的结果使用ggplot2 软件包将绘制成火山图和热图。运用GeneCards数据库和OMIM数据库,以“Drug-induced liver injury”为检索词收集药物性肝损伤的靶点。将GEO数据库、GeneCards 和 OMIM 数据库的疾病基因合并,删除重复靶点后得到DILI疾病基因靶点。利用在线Venny2.1平台绘制药物靶点与疾病靶点的韦恩图,筛选出水飞蓟素抗药物性肝损伤的治疗靶点。
1.3 成分—靶点图的绘制和蛋白互作网络构建、核心药靶的筛选 将“1.2”项所得交集基因导入Cytoscape软件,进行药效成分—靶标网络的可视化,药物活性成分和作用靶点以“节点”表示,节点之间的相互作用以“边”表示,然后将交集基因输入 String 数据分析平台进行蛋白互作网络分析,选择物种为智人,选择互动得分≥0.9,删除游离的蛋白,获取水飞蓟素治疗药物性肝损伤的 PPI 网络数据,并将PPI数据保存为TSV格式,将TSV格式文件导入Cytoscape软件,绘制蛋白互作网络图;为进一步筛选出水飞蓟素抗DILI的核心基因,使用CytoNCA工具(Cytoscape插件)来分析靶基因的拓扑属性,采用度中心性(DC)、间中心性(BC)、接近中心性(CC)、特征向量中心性(EC)、局部边连通性(LAC) 和网络中心性(NC)六个参数来估计网络中节点的中心属性[5],节点参数量化值越高,表明节点在网络中重要性越大;在PPI网络中,采用上述六个参数大于中位数1倍进行两次筛选,获取水飞蓟素作用于DILI的核心靶点。
1.4 GO功能富集分析和 KEGG 通路富集分析 为进一步研究核心靶点功能及水飞蓟素在治疗DILI中的主要作用通路,利用R包clusterProfiler对“1.2”项中获得的治疗靶点进行 GO和 KEGG分析,设置P值和纠正后P值均<0.05进行可视化分析。
1.5 分子对接 从PubChem 数据库下载水飞蓟素和常用护肝药还原性谷胱甘肽的二维化合物结构,用Chemoffice软件整合成三维结构,并对三维结构进行最小结合能的优化,从PDB数据库中下载“1.3”项筛选出的degree值前5核心靶点的3D结构,运用 Pymol软件进行预处理,移除靶蛋白中的原有配体和水分子。使用Autodock对预处理后的靶蛋白添加氢原子,并将处理后的受体(靶标蛋白)和配体(水飞蓟素、还原性谷胱甘肽)文件保存为 PDBQT格式。设置Gridbox的坐标及大小,运行Autodock vina进行寻找柔性对接的最佳对接条件,记录受体与配体的对接位置,以此来评估靶蛋白与化合物的结合情况,最后使用 Pymol软件观察和分析靶蛋白和化合物的对接结果。
2 结果
2.1 DILI相关靶点筛选结果 根据筛选条件,对 GEO 芯片数据库的基因芯片进行分析获得1 706个差异表达基因,其中上调基因872个,下调基因834个,运用 R 语言软件绘制DILI相关芯片的差异表达基因的火山图和聚类图,见图1。GeneCards数据库设置相关系数≥10获得428个DILI相关基因,OMIM数据库获得35个疾病相关基因,去除数据库重复项后共获得2 108个DILI相关靶点。

a
2.2 水飞蓟素治疗肝损伤的潜在作用靶点预测结果 TCMSP以及CTD 数据库中获得水飞蓟素的靶点 270个,GEO、GeneCards 以及 OMIM 数据库中获得DILI的相关靶点2 108个,通过利用在线工具Venny2.1取交集后显示,水飞蓟素与DILI形成的药物—疾病交集靶基因有112个,见图2。
2.3 成分—靶标的网络以及靶标的获取 成分靶点网络图共由113个节点组成,包括药物节点(飞蓟素)1个(黄色),其余节点表示靶点,其中蓝色节点表示水飞蓟素对该基因相关蛋白有抑制作用,粉色节点表示存在双向作用,红色表示促进作用,绿色节点表示有一定的作用,但是作用方式未知,见图3(来源:CTD数据库)。在STRING数据库中获取药物与疾病靶点的 PPI的TSV格式文件,导入Cytoscape软件,得到潜在节点共 103个,边458条的PPI网络,见图4。利用插件 CytoNCA ,筛选条件为:BC、CC、DC、EC 、LAC 、NC参数均大于中位值,经过两个过滤筛选,最终得到9个核心靶点(按degree值从高到低),见表1。一般而言,高degree的蛋白更倾向于是关键蛋白。

图3 “成分—靶点”网络图

图4 蛋白互作(PPI)网络图

表1 核心靶点按degree值(DC)从高到低
2.4 GO功能富集分析 运用R包clusterProfiler进行对“2.2”项中筛选的交集基因进行GO功能富集分析后共获得条目2 479 条(其中生物过程2 335 个,分子功能 117个,细胞组成27个),生物过程(BP)主要涉及炎症应激、免疫反应、氧化应激等方面;分子功能(MF)主要涉及细胞因子受体、细胞因子活性等方面;细胞组成(CC)主要涉及分泌性颗粒状管腔、细胞质囊泡腔等方面。各类别位于前五的条目,见图5。
2.5 KEGG通路富集 运行R包clusterProfiler筛选得到165条信号通路(P<0.05),其中排名前 30的通路绘制气泡图,见图5。KEGG结果显示与药物性肝损伤密切相关的通路有:TNF信号通路、IL-17信号通路等。

a
2.6 分子对接 经过筛选最终选择将“2.3”项的degree值(DC值)前3的关键靶蛋白STAT3、TNF、RELA作为核心靶点,相应的化合物水飞蓟素和还原型谷胱甘肽作为小分子,回顾文献寻找活性中心后开展分子对接。分子对接亲和力<-5.0kJ/mol,这表明水飞蓟素与关键靶蛋白能稳定的结合,结合信息及参数见表2, 其中结合自由能最小,常见的药物性肝损伤的靶点TNF-α[6]的3D分子对接图,见图6。

表2 核心靶点—化合物的结合能(kcal/mol)
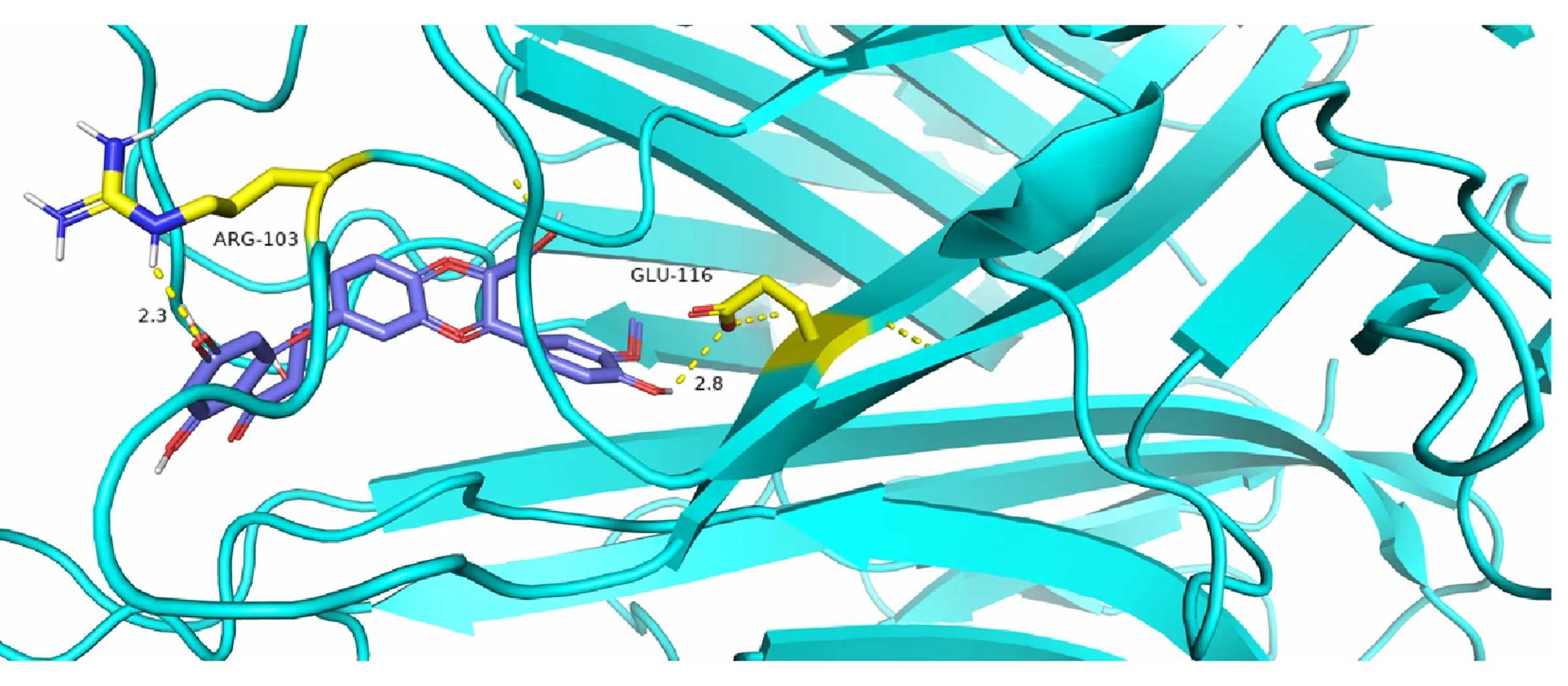
图6 水飞蓟素和核心靶点TNF的分子对接图
3 讨论
水飞蓟疏肝利胆、清热解毒,用于肝胆湿热和黄疸。水飞蓟素作为水飞蓟的主要成分,是临床上治疗药物性肝损伤的基础药物。目前水飞蓟素已成为国内多个权威肝病指南的推荐用药[3,7-9]。而在针对抗结核药物、毒蕈中毒引起的DILI治疗中, 水飞蓟素也成为我国专家共识的保肝用药一线推荐[4]。然而水飞蓟素抗药物性肝损伤的治疗主要基于临床经验,其作用分子机制仍未完全明确。因此筛选和识别水飞蓟素对DILI的治疗靶点具有重要意义,为临床的精准治疗提供参考。
网络分析筛选得到筛出最终核心靶点包括STAT3、TNF、RELA等药效靶标。STAT3是一种细胞质信号转录因子,在介导肝损伤的过程中起着至关重要的作用[10]。如图3所示,水飞蓟素可以下调STAT3的表达。大量的动物实验表明STAT3表达的下降可以保护小鼠免受多种药物诱导的肝毒性[11-13]。因而水飞蓟素或许是通过抑制STAT3的表达而发挥抗DILI作用。TNF-α是肿瘤坏死因子家族的成员,作为主要促炎的细胞因子,在肝脏的细胞凋亡、细胞增殖和免疫反应中起着关键作用。TNF-α在DILI进程中发挥加重肝损伤的作用[6],它能通过激活鞘氨醇激酶来激活PI3K/Akt通路,从而调节肝细胞凋亡[14]。最近的一项研究证实了水飞蓟素可能通过抑制TNF-α表达来减轻雷公藤内酯诱导的DILI[15],而图3所示,水飞蓟素调节TNF的表达是双向的,这提示水飞蓟素可通过精密调控TNF-α的浓度而发挥其抗DILI的作用。RELA是典型的NF-κB家族成员之一,用于调节控制炎症,细胞死亡和增殖基因的转录。RELA参与肝脏损伤炎症的调节[16]。研究表明RELA高表达水平在肝炎患者可以抗肝脏凋亡和减缓肝硬化程度,甚至可以降低死亡率[17-18],但对于DILI来说,研究报道抑制RELA的表达能减轻LPS诱导的小鼠急性肝损伤[19]。值得注意的是,在GEO数据库得出的差异基因中,肝损伤组RELA表达是上升的,而CTD数据库中提示水飞蓟素可以下调RELA,从而提示水飞蓟素可能通过下调RELA,从而改善药物性肝伤。
通路富集分析显示水飞蓟素主要作用于以TNF信号通路为主的炎症或氧化应激通路。TNF信号通路参与细胞损伤、免疫和炎症反应的调节,是控制肝稳态的细胞内通路[20]。TNF-α及其相关细胞因子在肝脏稳态中起关键作用,它们可以激活肝细胞的促凋亡(主要是半胱天冬酶)和抗凋亡(主要是NF-κB通路)[21]。药物可引起氧化还原变化,进而抑制TNF信号通路里面的抗调亡的生存途径如 NF-κB。研究表明,亚毒性剂量的乙酰氨基酚能对 NF-κB 进行抑制,从而使肝细胞对肿瘤坏死因子 (TNF) 的细胞毒性作用愈加敏感[22]。
最终笔者筛出的STAT3、TNF、RELA等靶基因基本富集在TNF信号通路中,为进一步验证水飞蓟素的药效靶点,采用分子对接的方法进行深入的探究,选取了排名degree值前3名的靶点与水飞蓟素和还原型谷胱进行对接,结果表明水飞蓟素与3个核心靶蛋白的结合能稳定结合,水飞蓟素的平均结合能高于还原型谷胱甘肽,尤其是与TNF-α的结合,达到了-10.4kcal/mol(图6、表2)。Wullaert A等研究发现TNF-α的激活是肝脏炎症发生的最早事件之一[23],提示水飞蓟素在DILI的炎症早期或许就能发挥出较强抗炎作用。
综上所述,本研究通过网络药理学以及分子对接的技术分析发现,水飞蓟素治疗DILI的核心药靶为 STAT3、TNF、RELA等靶点,主要是通过调控TNF信号通路为主的涉及炎症反应、氧化应激、细胞调亡的多条信号通路发挥抗药物性肝损伤的作用,并通过分子对接验证了药效靶点与水飞蓟素之间良好结合。然而本研究是基于现有文献中的数据来挖掘水飞蓟素抗药物性肝损伤的药效靶点,其结论仍需更多的研究进行验证。

