CT影像组学预测肾透明细胞癌病理分级:Meta分析
曹新玥,朱美霖,印隆林*,刘一铭,吴 颖
(1.四川省医学科学院·四川省人民医院放射科,四川 成都 610072;2.电子科技大学医学院,四川 成都 610054;3.西南医科大学附属医院放射科,四川 泸州 646000;4.川北医学院附属医院放射科,四川 南充 637000)
肾细胞癌病理分级可用于衡量其恶性程度并预测预后[1],而穿刺活检为有创检查,取材局限,且存在出血及种植转移等风险。影像组学可基于医学图像提取数据并加以分析,据以建立的模型能提高诊断效能及预测预后的准确性[2-4]。本研究以Meta分析观察基于CT影像组学预测肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)病理分级的价值。
1 资料与方法
1.1 文献检索 检索PubMed、Web of Science、EMbase及中国知网、中国生物医学文献服务系统和万方医学网自建库至2021年1月文献,英文检索词为“renal cell carcinoma”“radiomic”“texture analysis”“textural analysis”“Fuhrman”“ISUP”“grading”“histogram”,中文检索词为“影像组学” “肾癌”“纹理分析”“分级”。
1.2 文献纳入与排除标准 纳入标准:①CT影像组学预测ccRCC病理分级相关研究;②纳入患者均经病理确诊为ccRCC,组织病理学分级明确;③中文或英文文献;④可提取或通过重建得到2×2列联表;⑤存在重复研究时,选择其中样本量最大者。排除综述、会议摘要、书籍及评论性文章。
1.3 文献质量评价 由2名研究者独立评价文献质量及提取资料,发生分歧时请第3名研究者加入讨论并达成一致;若文献涉及多个相关影像组学模型,则选择诊断效能最高者进行评价。
以诊断准确性研究质量评价 (quality assessment of diagnostic accuracy studies-2, QUADAS-2)标准[5]为基础,根据研究内容和目的加以调整,删除其中“病例选择”中“是否避免采用病例-对照设计”问题,并于“待评价诊断实验”中添加了“是否采用多种检查设备和层厚”问题,判断纳入文献偏倚风险:若某领域均为“低风险”,则该领域偏倚风险为“低风险”;若某领域存在1~2个“不确定”,则该领域为“不确定”;若某领域存在2个以上“不确定”或 “高风险”,则该领域为“高风险”。
采用影像组学质量评分 (radiomics quality score, RQS)[6]于16个维度评价研究方法,得分范围为-8~36分。
1.4 统计学分析 采用Stata 16.0统计分析软件。计算Spearman相关系数r值及P值,判断是否存在阈值效益,r>0.5且P<0.05为存在阈值效益;若不存在阈值效益,则基于真阳性(true positive, TP)、假阳性(false positive, TP)、假阴性(false negative, FN)及真阴性(true negative, TN)数据,在双变量混合效应二元回归模型基础上计算合并敏感度(sensitivity, SEN)、合并特异度(specificity, SPE)、阳性似然比(positive likelihood ratio, PLR)、阴性似然比(negative likelihood ratio, NLR)及诊断比值比(diagnostic odds ratio, DOR)。绘制综合受试者工作特征(summary receiver operating characteristics, SROC)曲线,计算曲线下面积(area under the curve, AUC)。采用Cochran-Q方法和异质性指数(I2)评价文献异质性(检验水准α=0.05):I2<50%提示差异无统计学意义,直接行meta分析;I2≥50%为存在异质性,以meta回归分析或亚组分析等方法分析异质性来源;如异质性明显(I2>80%),则仅行描述性分析。绘制Deek漏斗图评估发表偏倚,P>0.05提示不存在发表偏倚。以敏感性分析验证meta分析结果的稳定性及可靠性。
2 结果
2.1 文献检索 初步检索获得349篇文献。经筛选后纳入16篇[7-22],其中英文文献10篇[11-17,20-22]、中文文献6篇[7-10,18-19],共2 489例患者、2 495个ccRCC病灶。见表1、2。
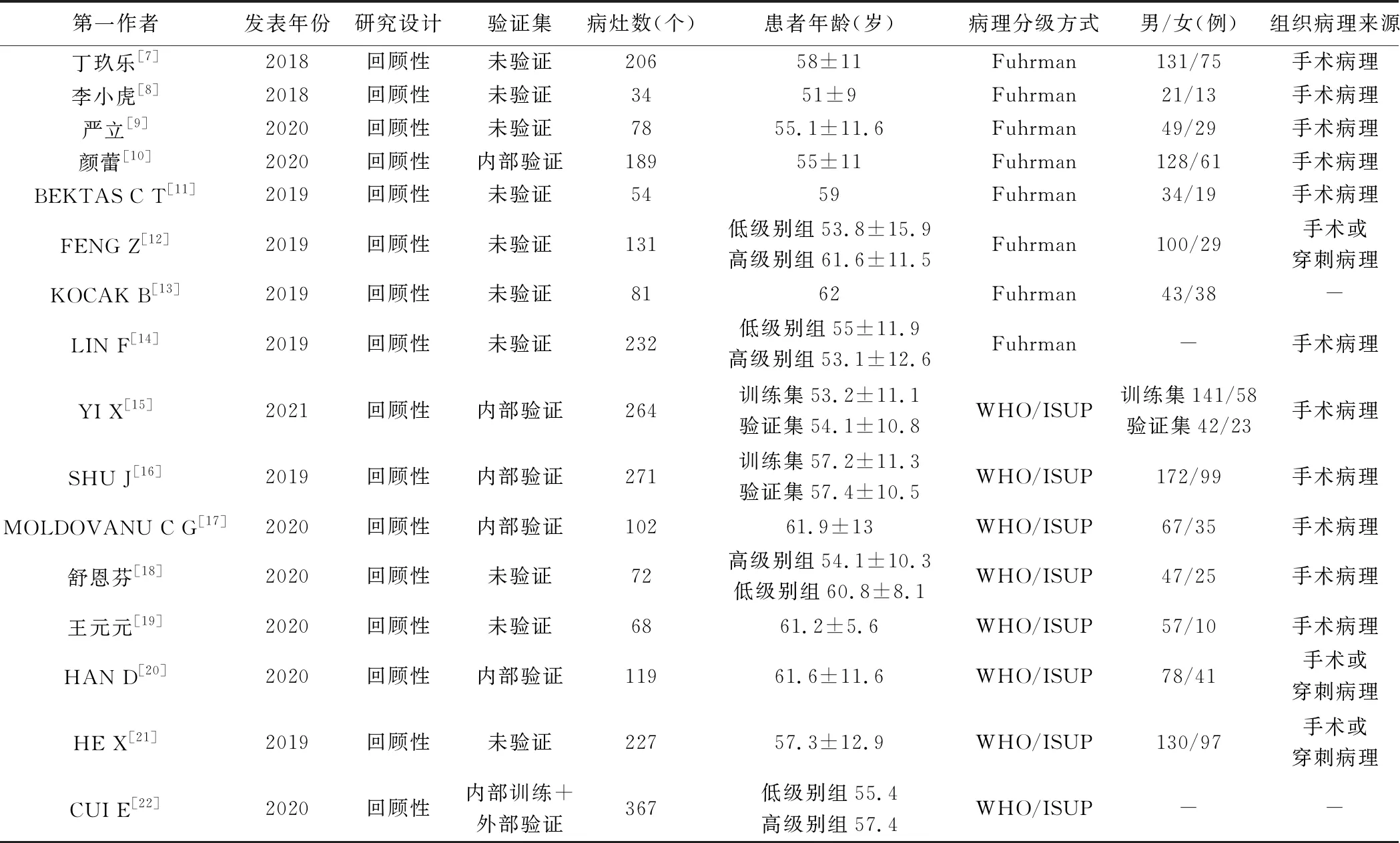
表1 16篇CT影像组学预测ccRCC病理分级文献基本特征
2.2 文献质量评价 基于文献与QUADAS-2评价问题的匹配程度进行的适用性评价结果显示,16篇纳入文献的适用性均良好(图1),RQS评分为0~16分,中位数为6.5分。
2.3 meta分析 CT影像组学预测ccRCC病理分级文献无明显阈值效益(r=0.12,P<0.01)而具有较高异质性(I2≥50%),其中ROI/VOI、病理分级方式(WHO/ISUP或Fuhrman)及是否采用ML为潜在异质性来源(图2及表3)。
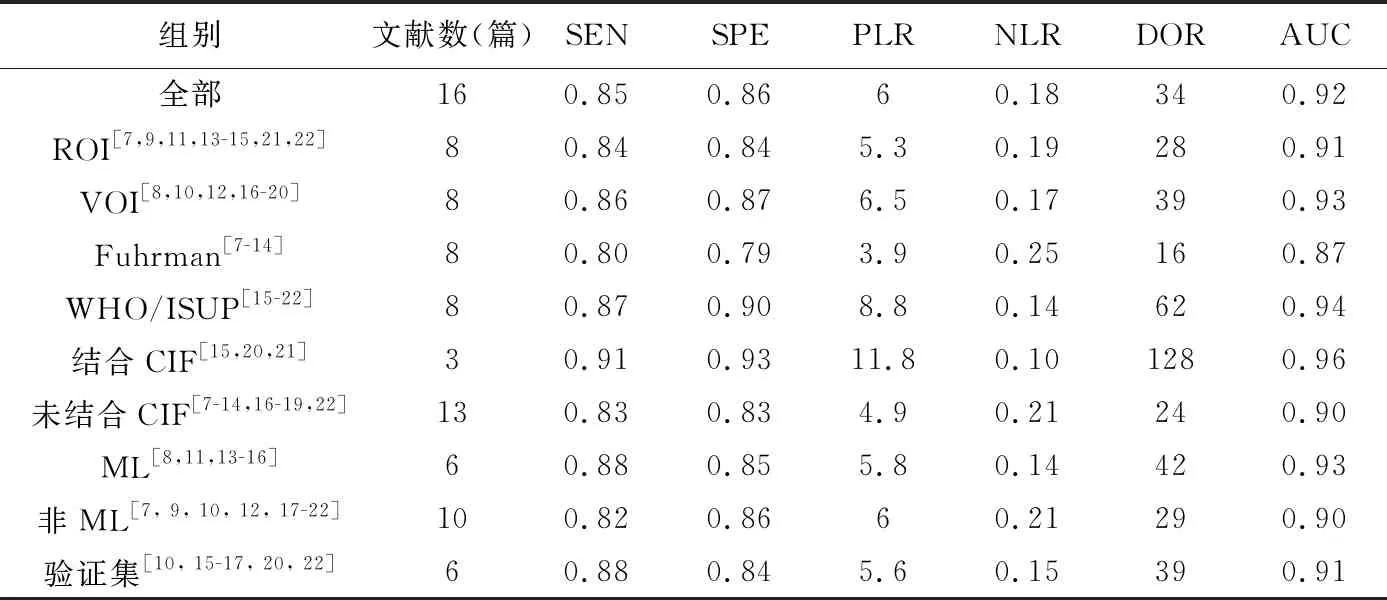
表3 CT影像组学预测ccRCC病理分级异质性来源分析结果
基于CT影像组学预测ccRCC病理分级的合并SEN为0.85[95%CI(0.80,0.89)],合并SPE为0.86[95%CI(0.81,0.90)],PLR为6.00[95%CI(4.30,8.30)],NLR为0.18[95%CI(0.13,0.24)],DOR为34.00[95%CI(20.00,57.00)]、AUC为0.92。见图3、4。
CT影像组学预测ccRCC病理分级文献无明显发表偏倚(P=0.87,图5)。敏感性分析结果显示本研究结果具有稳定性。
3 讨论
本研究结果显示,基于CT影像组学预测ccRCC病理分级效能较佳。
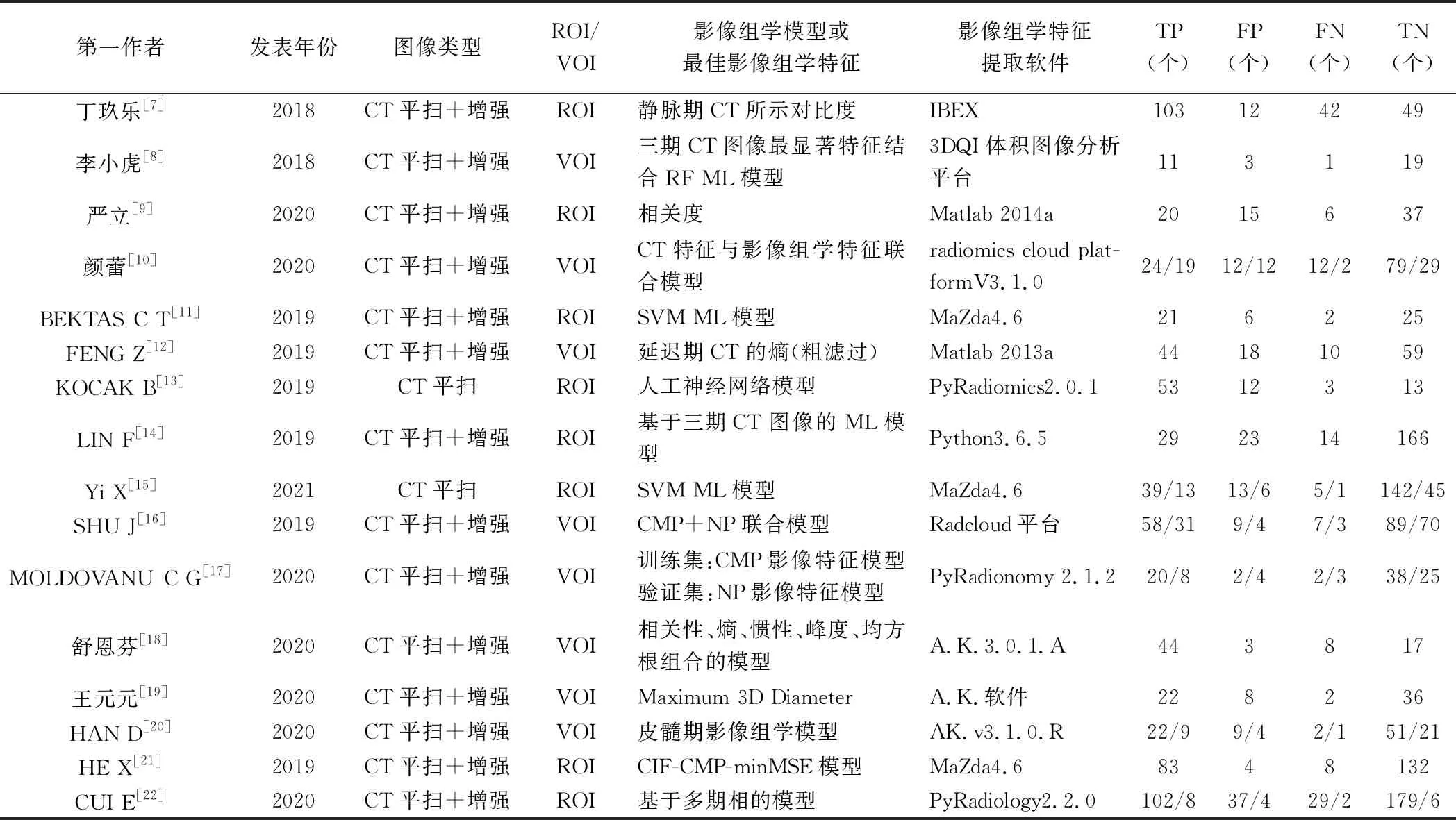
表2 16篇CT影像组学预测ccRCC病理分级文献的影像组学特征提取表
本研究纳入研究均为手动勾画ROI/VOI,其中部分由不同医师进行多次分割以减少偏倚,8篇则仅于单一层面分割ROI,可能低估肿瘤异质性[23]。既往研究[24]认为VOI包含较多病灶坏死成分,相比ROI更易出现绘制错误及混杂效应而影响结果。本研究发现VOI相关研究的AUC(0.93)略高于ROI(0.91),有待更多研究加以验证。
Fuhrman病理分级系统应用多年,但对多形性核定义不精确,重复性较差[25];WHO提议的新WHO/ISUP分级系统现已逐渐取而代之。本研究发现,以Fuhrman分级进行研究的AUC(0.87)低于WHO/ISUP(0.94,P<0.05),提示病理分级方式为异质性来源之一。本研究发现合并CIF模型的AUC(0.96)略高于未合并CIF模型(0.90),与既往针对非小细胞肺癌影像组学的meta分析[4]结论类似。有学者[8,14]认为多期相、多序列图像特征模型预测ccRCC病理分级的效能高于仅单序列。本研究结果显示,影像组学结合ML可提高诊断效能(AUC 0.90提高至0.93),有待进一步证实。
本组文献平均RQS质量较低,与既往关于乳腺癌、肾癌及前列腺的影像组学研究[3,26-27]结果基本一致,主要原因在于影像组学特征对图像采集参数具有依赖性[28-29],而目前影像组学研究多为单中心、小样本量回顾性研究,缺乏全面的图像采集数据,且难以实现标准化图像采集及重建;另外,多数影像组学研究未对模型进行独立验证,可致模型过拟合而使诊断效能虚高。
综上,CT影像组学预测ccRCC病理分级效能较佳。本研究主要局限:①纳入文献异质性较高;②仅纳入中、英文文献;③部分文献未提及病例选择标准及所用盲法;④多为单中心回顾性研究,且部分未设立验证集。

